APROVADO EM
29-04-2009
INFARMED
RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO
1. NOME DO MEDICAMENTO
Mysoline 250 mg comprimidos
2. COMPOSIÇÃO QUALITATIVA E QUANTITATIVA
Cada comprimido contém 250 mg de primidona.
Lista completa de excipientes, ver secção 6.1
3. FORMA FARMACÊUTICA
Comprimido.
Redondo, biconvexo, sem revestimento, branco ou quase branco, com ranhura num dos lados
e com um “M” de cada lado da ranhura.
O comprimido pode ser dividido em metades iguais.
4. INFORMAÇÕES CLÍNICAS
4.1 Indicações terapêuticas
Mysoline está indicado no tratamento do grande mal e da epilepsia psicomotora (lobo
temporal). É também muito eficaz no tratamento dos ataques focais e Jacksonianos, nos
espasmos mioclónicos e nos ataques acinéticos.
4.2 Posologia e modo de administração
O tratamento deve ser sempre planeado numa base individual. Em muitos casos será possível
utilizar Mysoline isolado mas, em alguns, será necessário associá-lo a outros
anticonvulsivantes.
Mysoline deve ser administrado com precaução em crianças, idosos, doentes debilitados ou
em doentes com insuficiência renal, hepática ou respiratória. Nestes casos pode ser necessária
uma redução da dose.
Mysoline é geralmente administrado duas vezes por dia. Deve iniciar-se o tratamento com
125 mg diários, ao deitar. Aumentar a dose diária em 125 mg, de três em três dias, até que o
doente esteja a tomar 500 mg por dia. Depois, e de três em três dias, aumentar a dose diária
em 250 mg para os adultos, ou 125 mg para as crianças com idade inferior a 9 anos - até se
conseguir o controlo da situação ou até se atingir a dose máxima tolerada. Esta pode ir até
1500 mg diários em adultos e 1000 mg diários em crianças.
APROVADO EM
29-04-2009
INFARMED
Doses médias diárias de manutenção:
Crianças até 2 anos
Crianças de 2-5 anos
Crianças de 6-9 anos
Adultos e crianças com mais de 9 anos
Comprimidos (250 mg)
1-2
2-3
3-4
3-6
Miligramas (mg)
250 - 500
500 - 750
750 - 1000
750 - 1500
A dose diária é geralmente fraccionada e administrada em duas doses iguais, uma de manhã e
outra à noite. Em certos casos pode ser aconselhável administrar uma dose maior na altura em
que os ataques forem mais frequentes. Por exemplo: 1) se os ataques forem nocturnos deve
administrar-se a dose completa, ou a maior parte, à noite; 2) se os ataques estiverem
associados a outra situação tal como a menstruação, é muitas vezes aconselhável um ligeiro
aumento da dose na devida altura.
Doentes medicados com outros anticonvulsivantes: sempre que não seja possível controlar
adequadamente os ataques com outros anticonvulsivantes ou se surgirem efeitos secundários,
pode utilizar-se Mysoline como adjuvante ou substituto do tratamento existente. Inicialmente,
deve-se, adicionar Mysoline ao tratamento anticonvulsivante em curso, pelo método da
introdução gradual anteriormente descrito. Quando se obtiver o efeito desejado e Mysoline
tiver sido administrado numa quantidade equivalente a, pelo menos, metade da dose
necessária, pode tentar-se a interrupção do tratamento anterior. Tal deve ser feito
gradualmente durante um período de duas semanas, durante o qual pode ser necessário
aumentar a posologia de Mysoline para manter o controlo. A interrupção do tratamento
anterior não deve ser demasiado rápida, pois existe o risco de ocorrer o estado epiléptico.
Contudo, nos casos em que o fenobarbital tenha constituído a base do tratamento anterior,
tanto a sua interrupção como a substituição por Mysoline deve ser mais rápida, de forma a
impedir que a sonolência excessiva interfira com o reconhecimento da dosagem mais
adequada de Mysoline.
4.3 Contra-indicações
Hipersensibilidade à substância activa, primidona, a qualquer dos excipientes de Mysoline ou
ao fenobarbital.
Mysoline não deve ser administrado a doentes com porfíria aguda intermitente.
4.4 Advertências e precauções especiais de utilização
Mysoline deve ser administrado com precaução e pode ser necessário reduzir a dose em
crianças, idosos, doentes debilitados ou em doentes com insuficiência renal, hepática ou
respiratória.
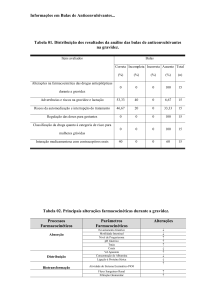
Mysoline poderá ter efeitos adversos sobre o feto, ver a secção 4.6 Gravidez e aleitamento
antes de considerar a sua toma durante a gravidez.
APROVADO EM
29-04-2009
INFARMED
A primidona é um potente depressor do SNC e é parcialmente metabolizada em fenobarbital.
Após administração prolongada existe uma tendência para o desenvolvimento de tolerância,
dependência e reacções de privação pela interrupção brusca do tratamento.
Foram notificados casos de ideação e comportamento suicida em doentes tratados com
medicamentos antiepilépticos, em várias indicações terapêuticas. Uma meta-análise de
ensaios aleatorizados de medicamentos antiepilépticos , contra placebo, mostrou também um
pequeno aumento do risco de ideação e comportamento suicida. Não é ainda conhecido o
mecanismo que explica este risco e os dados disponíveis não excluem a possibilidade de um
aumento do risco para a primidona.
Os doentes devem ser monitorizados quanto aos sinais de ideação e comportamento suicida,
devendo ser considerada a necessidade de tratamento adequado. Os doentes (e os prestadores
de cuidados aos doentes) devem ser aconselhados a contactar o médico assim que surjam
sinais de ideação e comportamento suicida.
4.5 Interacções medicamentosas e outras formas de interacção
Tanto a primidona como o seu principal metabolito, o fenobarbital, induzem a actividade
enzimática hepática, principalmente o sistema enzimático CYP 450 3A4. Isto pode provocar
alterações na farmacocinética de fármacos administrados simultaneamente. Os fármacos cujo
metabolismo possa ser aumentado e levar a uma diminuição da concentração plasmática e/ou
diminuição do tempo de semi-vida, devido a uma terapêutica concomitante são: androgéneos,
beta-antagonistas, carbamazepina, ciclosporina, clonazepam, cloranfenicol,
corticosteróides/glucocorticóides, ciclofosfamida, dicumarinas, digitoxina, doxiciclina,
etosuxamida, etoposido, felbamato, granissetrom, lamotrigina, losartan, metadona,
metronidazol, mianserina, montelacuste, nelfinavir, nimodipina, contraceptivos orais,
oxcarbazepina, fentoína, quinidina, rocurónio, valproato de sódio, tiagabina, teofilinas,
topiramato, antidepressores tricíclicos, vecurónio, varfarina e zonisamida.
Os seguintes fármacos inibem o sitema enzimático CYP 450 3A4 e podem originar um
aumento das concentrações plasmáticas da primidona e do seu metabolito fenobarbital,
quando administrados concomitantemente:
- Cloranfenicol,
- Felbamato,
- Nelfinavir,
- Metrodinazol,
- Valproato de sódio.
A erva de São João (hipericão, Hypericum perforatum) induz o sistema enzimático e pode
diminuir a concentração plasmática da primidona e do seu metabolito fenobarbital, e assim,
reduzir o efeito terapêutico.
O Mysoline inibe a glucuronidação do paracetamol e pode aumentar a hepatotoxicidade
deste.
A ligação da teofilina às proteínas pode afectar a ligação do fenobarbital e alterar os seus
níveis plasmáticos.
APROVADO EM
29-04-2009
INFARMED
A administração de Mysoline pode intensificar os efeitos de outros depressores do SNC, tais
como o álcool e os barbitúricos.
As interacções descritas em cima têm relevância clínica.
4.6 Gravidez e aleitamento
Gravidez
Todas as mulheres em idade fértil (com possibilidade de engravidar) deverão receber
aconselhamento médico especializado antes de iniciarem o tratamento, devido ao aumento do
risco de malformações congénitas.
O tratamento com medicamentos anti-epilépticos deverá ser reavaliado sempre que a mulher
pretenda engravidar.
O risco de malformações congénitas é 2 a 3 vezes maior nos descendentes de grávidas
medicadas com anti-epilépticos. As malformações mais frequentes são dos lábios e cavidade
oral, aparelho cardiovascular e tubo neural.
O tratamento com vários medicamentos anti-epilépticos (politerapia) poderá estar associado a
um maior risco de malformações congénitas relativamente ao tratamento com um único
medicamento (monoterapia). Sempre que possível deverá ser utilizado um regime de
medicamento único (monoterapia).
O tratamento com anti-epilépticos não deverá ser interrompido subitamente uma vez que
pode aumentar o risco de crises epilépticas com consequências graves para a mãe e/ou para o
feto.
Tem havido relatos de anormalidades congénitas, incluindo doença cardíaca congénita, fenda
palatina e condições associadas à carência materna de ácido fólico, em lactentes nascidos de
mães epilépticas tratadas com primidona. Esta informação deve ser tida em conta quando se
considerar a primidona ou tratamentos alternativos da epilepsia durante a gravidez.
Podem ocorrer sintomas de privação em recém-nascidos cujas mães receberam Mysoline
durante a gravidez.
A terapêutica anticonvulsivante prolongada pode estar associada a uma diminuição dos níveis
séricos de folatos. Como as necessidades em ácido fólico também aumentam durante a
gravidez, aconselha-se que as doentes em risco sejam regularmente observadas e também é
de considerar, embora seja controverso, um tratamento com ácido fólico e vitamina B12.
A terapêutica anticonvulsivante durante a gravidez tem sido ocasionalmente associada a
alterações da coagulação de recém-nascidos. Por este motivo, recomenda-se a administração
de vitamina K1 à mãe durante o último mês de gravidez e até ao parto. Na ausência de prétratamento devem ser administrados à mãe 10 mg de vitamina K1 na altura do parto e deve
ser imediatamente administrado 1 mg ao recém-nascido.
Aleitamento
Durante o aleitamento, o bebé deve ser monitorizado para controlo da sedação.
APROVADO EM
29-04-2009
INFARMED
4.7 Efeitos sobre a capacidade de conduzir e utilizar máquinas
Tal como acontece com a maioria dos outros anticonvulsivantes, os doentes que conduzem
veículos ou operam com máquinas deverão estar prevenidos para o facto de que poderá haver
uma redução no tempo de reacção.
4.8 Efeitos indesejáveis
Não existem dados clínicos actualizados sobre este produto que possam constituir uma base
de avaliação da frequência dos efeitos indesejáveis. Os efeitos indesejáveis mais frequentes
são a sonolência e a apatia e surgem, sobretudo no início de tratamento.
Os efeitos indesejáveis são apresentados por ordem decrescente de gravidade dentro de cada
classe de frequência.
Frequentes (>1/100)
Não frequentes
(1/100-1/1000)
Raros (<1/1000)
Perturbações gerais e
alterações no local de
administração
Sonolência
Doenças do sistema
nervoso
Apatia, ataxia, perturbações da visão,
nistagmo.
Doenças gastrointestinais
Náusea
Perturbações gerais e
alterações no local de
administração
Cefaleias, tonturas.
Doenças gastrointestinais
Vómitos
Afecções dos tecidos
cutâneos e subcutâneas
Reacções alérgicas que afectam
principalmente a pele. Podem incluir
erupção cutânea maculopapular,
morbifiliforme ou escarlatiniforme.
Doenças do sistema
nervoso
Alterações de personalidade, que podem
incluir reacções psicóticas.
Doenças do sangue e do
sistema linfático
Anemia megaloblástica, discrasia
sanguínea.
Afecções hepatobiliares
Aumento das enzimas hepáticas,
incluindo a gama-GT e a fosfatase
alcalina.
Afecções músculoArtralgia, osteomalacia. Tal como
esqueléticas e dos tecidos acontece com o fenobarbital, tem sido
conjuntivos
reportado contratura de Dupuytren.
APROVADO EM
29-04-2009
INFARMED
Afecções dos tecidos
cutâneos e subcutâneas
Reacções graves, tais como dermatite
esfoliativa, síndrome de StevensJohnson, necrólise epidérmica tóxica e
lúpus eritematoso
As perturbações da visão, cefaleias, tonturas, nistagmo, ataxia, vómitos e naúseas, são
geralmente passageiros mesmo quando pronunciados. Por vezes pode ocorrer uma reacção
idiossincrática envolvendo estes sintomas, numa forma aguda e grave, necessitando de
interrupção do tratamento.
Pode ser necessária a administração de suplementos de vitamina D durante uma terapêutica
prolongada com Mysoline, uma vez que o catabolismo da vitamina D pode estar aumentado.
Excepcionalmente e tal como acontece com a fenitoína e o fenobarbital, pode desenvolver-se
anemia megaloblástica que requer a interrupção do tratamento com primidona. Esta situação
pode ser controlada com ácido fólico e/ou vitamina B12.
4.9 Sobredosagem
A primidona é largamente metabolizada em fenobarbital e a sobredosagem pode induzir
vários graus de depressão do SNC que, dependendo da dose ingerida, podem incluir ataxia,
perda de consciência, depressão respiratória e coma.
Pode ocorrer cristalúria com a sobredosagem, o que pode constituir um meio de diagnóstico
útil em caso de suspeita de sobredosagem com primidona.
Dependendo da gravidade da intoxicação, a terapêutica deverá incluir aspiração gástrica,
administração de carvão activo, administração intravenosa de fluidos, diurese alcalina forçada
(para obter urina com um pH de 8,0) e outras medidas gerais de suporte. Em circunstâncias
de maior perigo de vida, a transfusão sanguínea (caso o doente seja hipotenso) ou
hemodiálise são medidas eficazes.
Não existe um antídoto específico.
5. PROPRIEDADES FARMACOLÓGICAS
5.1 Propriedades farmacodinâmicas
Grupo farmacoterapêutico: 2.6 - Sistema Nervoso Central. Antiepilépticos e
anticonvulsivantes
Código ATC: N03AA03
O efeito de Mysoline é devido às propriedades anticonvulsivantes dos três compostos activos,
nomeadamente a primidona e os seus dois principais metabolitos: o fenobarbital e a
feniletilmalonamida. Não se encontra ainda estabelecida qual a contribuição relativa de cada
um destes compostos para o efeito anticonvulsivante observado na prática clínica. Tal como
acontece com outros anticonvulsivantes, o mecanismo de acção de Mysoline não é bem
APROVADO EM
29-04-2009
INFARMED
conhecido embora seja provável que os efeitos sobre a membrana neuronal, particularmente
as alterações nos fluxos iónicos, desempenhem um papel fundamental.
Tal como outros anticonvulsivantes, Mysoline pode induzir as enzimas hepáticas.
Mysoline pode também afectar o metabolismo da vitamina D, o que pode constituir uma
predisposição para doenças ósseas.
5.2 Propriedades farmacocinéticas
Mysoline é rapidamente absorvido a partir do tracto gastrointestinal e o pico plasmático
atinge-se cerca de 3 horas após a ingestão. A distribuição da primidona engloba todos os
órgãos e tecidos: atravessa as barreiras hemato-encefálica e placentária e é excretada no leite
materno. A farmacocinética da primidona é complexa devido à sua biotransformação em dois
metabolitos, fenobarbital e feniletilmalonamida, que possuem acção anticonvulsivante e
propriedades farmacocinéticas complexas. A primidona possui uma semi-vida plasmática de
cerca de 10 horas, sendo consideravelmente inferior à dos seus principais metabolitos. Tanto
a primidona como a feniletilmalonamida possuem uma fraca ligação às proteínas plasmáticas,
enquanto cerca de metade de fenobarbital se liga às proteínas. Aproximadamente 40% do
fármaco é excretado na urina sem sofrer alterações.
5.3 Dados de segurança pré-clínica
A primidona é um fármaco com o qual existe uma vasta experiência clínica. Todas as
informações relevantes para o prescritor encontram-se descritas neste Resumo das
Características do Medicamento.
6. INFORMAÇÕES FARMACÊUTICAS
6.1 Lista dos excipientes
Povidona
Gelatina
Carmelose cálcica
Estearato de magnésio
Ácido esteárico
Água purificada
6.2 Incompatibilidades
Não aplicável.
6.3 Prazo de validade
5 anos.
APROVADO EM
29-04-2009
INFARMED
6.4 Precauções especiais de conservação
Não conservar acima de 30ºC.
Conservar na embalagem de origem para proteger da luz e humidade
Manter o recipiente bem fechado.
6.5 Natureza e conteúdo do recipiente
Frascos de polietileno de alta densidade (HDPE) com tampa de plástico, inviolável e com
fecho resistente à abertura por crianças, contendo 20 ou 60 comprimidos.
É possível que não sejam comercializadas todas as apresentações.
6.6 Precauções especiais de eliminação e manuseamento
Não existem requisitos especiais.
Os produtos não utilizados ou os resíduos devem ser eliminados de acordo com as exigências
locais.
7. TITULAR DA AUTORIZAÇÃO DE INTRODUÇÃO NO MERCADO
Laboratórios Azevedos – Indústria Farmacêutica, S.A.
Estrada Nacional 117-Km2
Alfragide
2614-503 Amadora
Telefone: 214725900
Fax: 21 4725990
E-mail: [email protected]
8. NÚMERO (S) DA AUTORIZAÇÃO DE INTRODUÇÃO NO MERCADO
Nº de registo: 8988816 - 20 comprimidos, 250 mg, frasco de HDPE com tampa de plástico,
inviolável e com fecho resistente à abertura por crianças.
Nº de registo: 8988824 - 60 comprimidos, 250 mg, frasco de HDPE com tampa plástico,
inviolável e com fecho resistente à abertura por crianças.
9. DATA DA PRIMEIRA AUTORIZAÇÃO/RENOVAÇÃO DA AUTORIZAÇÃO DE
INTRODUÇÃO NO MERCADO
Data de revisão: 06 Agosto 2001
Data da última renovação: 10 Dezembro 2007
10. DATA DE REVISÃO DO TEXTO