NOVO MÉTODO DE MENSURAR FIBRINOGÊNIO NO PLASMA DE CÃES
Andressa Aparecida Oggioni Pivari1, Gabriel Ricardo de Souza Lima1*, Kamila
Teixeira Pandolfi1, Ronaldo Eugênio de Oliveira1, Gabriela Porfirio-Passos2,
Lenir Cardoso Porfirio1.
1
Universidade Federal do Espírito Santo, Departamento de Medicina Veterinária
* [email protected]
2
Universidade Federal da Bahia, Doutoranda em Ciência Animal nos Trópicos.
[email protected]
1
O fibrinogênio (F) eleva-se mediante o estímulo de interleucinas e do fator de necrose tecidual
liberados no processo inflamatório. Com o objetivo de propor uma nova técnica para quantificação
desta proteína, propôs-se a técnica da diferença do plasma e soro e comparou-se os resultados com
a Técnica de Precipitação Térmica (técnica convencional). Para a nova técnica, utilizou-se o sangue
de 30 cães em tubos com e sem anticoagulante os quais foram centrifugados a 4000rpm por 10
minutos, e obteve-se o plasma e soro, respectivamente. Quantificou-se as proteínas de cada um em
refratômetro e considerou-se a diferença entre o plasma e soro, como o fibrinogênio da amostra,
expresso em mg.dL-1. Utilizando as mesmas amostras de sangue, comparou-se os resultados obtidos
com a técnica convencional, que envolve mais etapas como banho-maria e centrifugações e obtevese que correlação intraclasse dos valores médios do fibrinogênio pelas duas técnicas aplicadas para
cães foi de 0.4747, considerada uma replicabilidade de Média a Boa, sendo que a técnica proposta
mostrou-se eficiente e de mais rápida para execução do exame.
Palavras-chave: Refratometria, precipitação de proteína, plasma, soro.
Área do Conhecimento: Medicina Veterinária
Introdução
Na medicina veterinária o fibrinogênio plasmático é um importante parâmero para ser avaliado e
sua determinação é importante no diagnóstico de processos inflamatórios em cães, pois a
hiperfibrinogenemia é observada antes da leucocitose de origem inflamatória (VECINA et al., 2006).
O fibrinogênio eleva-se mediante o estímulo de interleucinas e do fator de necrose tecidual
liberados no processo inflamatório. Ele serve como substrato para a trombina, componente da
cascata de coagulação. A trombina age sobre o fibrinogênio no fluido tecidual e no plasma,
produzindo a fibrina, que é depositada nos tecidos inflamados, formando uma barreira contra a
disseminação da inflamação. O fibrinogênio é considerado uma das proteínas da fase aguda da
inflamação por ter aumento de sua produção pelo fígado em caso de inflamações e infecções
(SOUZA et al., 2006). Seu pico de produção ocorre entre o quinto e o sétimo dia do processo
inflamatório e esta hiperfibrinogenemia pode refletir a gravidade da inflamação Shalm et al. (1975), e
para Jain (1993), o pico de produção ocorre de seis a oito horas após lesão inicial, atingindo valores
máximos entre dois e cinco dias.
A interleucina-6 é principal regulador da resposta inflamatória, ocasionando o aumento da síntese
hepática das proteínas de fase aguda, como a proteína C reativa e fibrinogênio (VECINA, 2009).
Este trabalho tem como objetivo estimar o valor do fibrinogênio pela Técnica da Diferença da
Proteína Plasmática e Sérica, uma técnica mais simples em comparação à técnica clássica da
Técnica da Precipitação Térmica.
Metodologia
Esta pesquisa foi aprovada pelo Comitê de Ética para Uso de Animais da Universidade Federal do
Espirito Santo, com o número 47/2015.
Foram utilizados soro e plasma de 30 cães de diferentes raças, sexo, peso e estado clínico
atendidos do Hospital Veterinário onde foram obtidas as amostras de sangue em tubos sem e com
anticoagulante EDTA, a obtenção da amostra foi realizada pelo médico veterinário clínico e o
XX Encontro Latino Americano de Iniciação Científica, XVI Encontro Latino Americano de Pós-Graduação e VI
Encontro de Iniciação à Docência – Universidade do Vale do Paraíba.
1
material. foi levado ao Laboratório de Análises Clínicas nas mesmas dependências do Hospital
Veterinário do Centro de Ciências Agrárias e Engenharias CCAE-UFES.
Para a realização da Técnica de Precipitação Térmica foram usados seis tubos capilares (para
testes em triplicata para cada animal) e preenchimento até ¾ de sua capacidade e posteriormente
fechados em uma das extremidades. Estes foram centrifugados a 8000 rpm, por 5 minutos em
centrífuga de micro-hematócrito para separação do plasma. Após a centrifugação três dos capilares
foram quebrados e uma gota foi colocada no Refratômetro de Goldberg para mensuração da Proteína
Plasmática Total (PPT) e os outros três tubos capilares levados a banho-maria na temperatura de
56ºC a 58ºC, por três minutos. Este foram centrifugados novamente para a separação do fibrinogênio.
Desta forma obteve-se soro dos quais foram novamente dispensado uma gota no Refratômetro e
agora mensurada a Proteína Sérica (PS), pois o Soro é o Plasma sem Fibrinogênio. O Refratômetro
expressa o valor de proteína plasmática ou sérica em g.dL-1. Obtém-se o valor do fibrinogênio pela
diferença entre proteínas do plasma e proteínas do soro em g.dL-1, o resultado deve ser multiplicar
por 1000, pois o fibrinogênio é conhecido em mg.dL-1.
Utilizando o sangue dos mesmos animais da Técnica de Precipitação Térmica anterior, foi
realizada a Técnica da Diferença do Plasma e Soro Sanguíneo. Nesta técnica foi feita a coleta de
sangue dos animais em tubos com anticoagulante ácido etilenodiamino tetra-acético (EDTA) e outro
sem o anticoagulante aos quais foram centrifugados em centrífugas de tubos a 4000 rpm por 10
minutos e obteve-se plasma a partir do sangue no tubo com EDTA e soro no tubo sem presença de
anticoagulante respectivamente. Uma gota de cada tubo foi colocada no Refratômetro de Goldberg e
quantificada as proteínas de cada um (em triplicata). Considerou-se que a diferença entre proteínas
do plasma e proteína do soro como valor referente ao fibrinogênio da amostra, multiplicados por 1000
para serem expressos em mg.dL-1. Foi feito o teste estatístico com duas amostras relacionadas
correlação intraclasse (CI) com dados contínuos, utilizando o software BioEstat 5.0 (AYERES et al.
2007) para avaliar replicabilidade da amostra.
Resultados
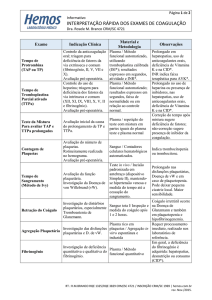
Os valores do fibrinogênio em todas as repetições nas duas técnicas estão descritos na Tabela 1.
O valor do fibrinogênio canino pela Técnica de Precipitação Térmica do fibrinogênio, no teste
estatístico de Correlação Intraclasse (CI) entre as repetições 1 e 2 foi igual a 0.4805 com IC 95%
limite inferior de 0,0852 e superior de 0,7451 indica que apresentaram Replicabilidade Média a Boa.
Entre 1 e 3 a CI igual a 0.3700 e IC 95% limite inferior de -0.0499 e superior de 0.6787, as repetições
2 e 3 e apresentaram IC de 0.3453 IC 95% limite inferior de -0.0780 e superior de 0.6631 significam
que a Replicabilidade é Ruim.
Quanto a Técnica da Diferença do Plasma e Soro Sanguíneo (Tab. 2) para determinar a
quantidade de fibrinogênio obteve-se na estatística de Correlação Intraclasse (IC) entre as repetições
4 e 5 valor de 0,7024 com IC 95% limite inferior de 0,3770 e superior de 0,8734. Entre as repetições 4
e 6 valor de 0,4211 com IC 95% limite inferior de -0,0264 e superior de 0,7280. As repetições 5 e 6
valor de 0,5788 com IC 95% limite inferior de 0,1832 e superior de 0,8131. Todas as repetições
indicam que apresentaram Replicabilidade Média a Boa entre as técnicas.
A correlação intercalasse dos valores médios do fibrinogênio pelas duas técnicas aplicadas para
cães foi de 0.4747 e apresentaram uma replicabilidade Média a Boa.
Acredita-se que a repetição pela Técnica da Diferença tenha apresentado melhor replicabilidade
porque não depende das pequenas variações de temperatura no Banho Maria (56 a 58 ªC)
recomendada por Schalm et al. (1975); Kaneko et al. (1997) e Jain (1993) e também porque muitas
vezes ocorre perda do pouco material contido no capilar ao colocar a gota do plasma ou plasma com
fibrinogênio precipitado no prisma do refratômetro, pois para que esta leitura seja feita deve-se
quebrar o capilar de micro-hematócrito para ter acesso ao conteúdo.
Os resultados do presente estudo estimulam a aprimorar os cuidados na execução desta técnica,
pois foi observada a redução do uso de equipamentos também, pois não houve necessidade de
utilizar Banho Maria, houve a substituição da centrifuga de micro-hematócrito pela centrífuga de tubo,
o que pode ser dispensável, visto que se pode aguardar a sedimentação do sangue total nos tubos
com anticoagulante ou aguardar a coagulação para obtenção do soro, nos tubos sem anticoagulante
o que é de extrema utilidade quando se trabalha a campo.
XX Encontro Latino Americano de Iniciação Científica, XVI Encontro Latino Americano de Pós-Graduação e VI
Encontro de Iniciação à Docência – Universidade do Vale do Paraíba.
2
Obteve-se na nova técnica proposta, evidente redução de tempo no fornecimento do resultado do
valor do fibrinogênio, pois foi muito mais rápido e este fato é de extrema importância na clínica
médica veterinária, mesmo que o procedimento padrão mais utilizado para quantificação do
fibrinogênio seja a técnica de Precipitação Térmica preconizada por Schalm et al. (1975) e
confirmado por Jain (1993). A técnica padrão envolve várias etapas como centrifugação, banho-maria
para desnaturação da proteína e nova centrifugação para a precipitação do fibrinogênio, com
consequente análise de proteínas totais do plasma e do soro pós precipitação, enquanto que com a
nova técnica proposta a análise é feita com menor quantidade de etapas e materiais, possibilitando
até mesmo que a técnica seja feita a campo, com um refratômetro clínico devidamente calibrado.
Como resultado, também se observou que as quantidades de fibrinogênio são mensuradas no
refratômetro, como descrito na metodologia, pelas duas técnicas comparadas neste trabalho e estão
sujeitas a variações que podem ser decorrentes de processos de mensuração inadequados, falhas
mecânicas ou falta de calibração adequada do aparelho, de variações devidas ao acaso ou mesmo
uma distração do examinador, visto que são aferidos os valores que equivalem a dois gramas entre
linhas, o que pode confundir o examinador. Percebe-se que para reduzir erros, deve-se promover a
padronização dos procedimentos técnicos adotados, como permitir só um examinador para as duas
técnicas.
Tabela 1. Valores das repetições do Fibrinogênio pela Técnica da Precipitação Térmica e pela
Diferença da Proteína do Plasma e do Soro para espécie canina.
Técnica da precipitação térmica (A)
Repetições
Técnica da diferença do plasma e soro (B)
Repetições
1
2
3
Média A
4
5
6
Média B
400
200
200
200
400
400
600
600
800
200
400
400
200
400
800
600
400
800
600
400
400
800
400
600
400
400
400
400
600
200
400
200
300
300
400
400
600
600
600
400
600
200
200
200
600
400
0
800
1000
400
200
400
400
600
200
400
600
200
600
200
200
200
400
0
200
600
800
600
1000
200
400
600
400
400
1000
200
400
1000
600
400
600
400
400
600
200
600
400
200
600
0
333
200
300
167
333
467
667
600
800
267
467
400
267
333
800
400
267
867
733
400
400
533
400
600
267
467
467
267
600
133
1600
200
600
200
0
400
200
200
800
600
800
800
400
400
1000
600
600
1000
1000
600
200
600
200
600
400
200
200
200
800
400
1400
200
500
300
200
400
200
400
600
400
400
600
400
400
1000
1000
400
800
1200
400
200
600
200
800
200
400
400
200
600
400
1400
200
400
200
0
400
400
400
1200
600
400
600
400
800
1400
800
600
800
1000
600
400
400
200
800
0
600
600
0
400
0
1467
200
500
233
67
400
267
333
867
533
533
667
400
533
1133
800
533
867
1067
533
267
533
200
733
200
400
400
133
600
267
XX Encontro Latino Americano de Iniciação Científica, XVI Encontro Latino Americano de Pós-Graduação e VI
Encontro de Iniciação à Docência – Universidade do Vale do Paraíba.
3
Discussão
Com a nova técnica proposta, mesmo que para Souza et al (2006) o método por precipitação por
calor seja rápido e de simples execução, espera-se que os exames feitos na clínica médica
veterinária para quantificação de fibrinogênio sejam mais rápido auxiliando no diagnóstico de doenças
comuns a rotina, como a piometra. Pois para Carvalho et al. (2008) as proteínas de fase aguda da
inflamação são parâmetros que devem ser utilizados na rotina clínica de cadelas com esta doença.
Entretanto, Vecina (2009) afirmou que a utilização do fibrinogênio como padrão de identificação de
um cão doente tem eficácia limitada, assim como outras proteínas de fase aguda, não sendo
parâmetro de importância para identificação de processos inflamatórios em cães, pois para o autor o
método por precipitação pelo calor utilizado como teste de triagem, apresenta resultados pouco
preciso.
Assim, com a execução da quantificação da proteína estudada no presente trabalho, espera-se
que os diagnósticos de algumas doenças dos animais de companhia sejam detectados mais
rapidamente, se comparada com a técnica convencional, pois para Meinerz et al. (2012), a dosagem
do fibrinogênio pode indicar presença de enfermidade antes das alterações observadas no
leucograma, o que passa a ser um exame precioso na detecção precoce de doenças, em animais,
tornando mais rápido o estabelecimento de adequada terapia, consequentemente melhorando o
prognóstico do paciente, auxiliando de forma rápida e precisa a tomada de decisão pelo médico
veterinário.
Este estudo concorda com Faria et al. (1999) quando reportaram que a dosagem do fibrinogênio
apresenta limitações com relação aos valores inferiores a 0,04g/l, mas propuseram outra técnica de
dosagem por precipitação com sulfato de amônio que demonstrou confiabilidade e eficiência,
permitindo quantificação inferior a 0,1g/dl que é o limite inferior da técnica de precipitação por
aquecimento.
A técnica de precipitação ou a nova técnica proposta da diferença do valor da proteína entre
plasma e soro são técnicas rápidas e mensuradas por refratometria, e Fornazari, et al. (2005)
relataram outra técnica para a dosagem do fibrinogênio, pelo método de Goodwin, em que esta
glicoproteína deve ser precipitada com sulfato de amônio, este precipitado passa a ser dissolvido com
hidróxido de sódio a 10% e dosado pelo reagente de biureto, com leitura em espectrofotômetro a 530
nm, e difere por ser mensurado por espectrofotometria, o que necessita de analisador bioquímico, ou
seja, de um laboratório.
As metodologias utilizadas no presente estudo, para a determinação do fibrinogênio ocorreu com
três repetições, uma das técnicas foi semelhante à descrita por Colla (2009) que após a leitura da
porcentagem de eritrócitos nos capilares do micro-hematócrio, foram determinadas as proteínas
plasmáticas totais (PPT) por meio da refratometria, onde um dos capilares era incubado em banhomaria a 56ºC por três minutos, mas sem repetições. Após nova centrifugação, foi realizada a leitura
das PPT, para assim, obter o valor de fibrinogênio e comparar com valores de rnormalidade descrito
por Schalm et al. (1970) que está compreendido entre 1 e 5g/l ou 100 a 500 mg/dL.
Para obtenção do fibrinogênio foi utilizado sangue com EDTA e a técnica utilizada foi a
precipitação do fibrinogênio Schalm et al. (1975); Jain, (1993); Kaneko et al. (1997) no presente
estudo, o valor médio de todos os animais foi de 440 mg/dL de fibrinogênio na técnica de
precipitação pelo calor, com valores mínimos e máximos de (0 a 1000mg/dL), enquanto que a média
da técnica pela diferença de plasma e soro foi de 522mg/dL com valores mínimos e máximos de (0 a
1600 mg/dL) e assemelham-se aos valores obtidos por Meinerz et al. (2012) que demonstraram em
34% (41/120) aumento dos índices de fibrinogênio, com valores variando de 500 a 1.800 mg/dL e
50% das amostras apresentaram hiperfibrinogenemia com normoleucometria, o que demonstra a
importância de solicitar a dosagem deste parâmetro, haja vista que a metade das amostras era de
animais com diagnóstico confirmado de diversas patologias, e para distinguir estas condições Schalm
(1970) e Silveira (1988) reportaram que a relação proteína plasmática total menos o fibrinogênio e
dividindo pelo fibrinogênio (PPT-F/F) obtém-se a relação (PP:F), que em casos de hiperfibrinogenimia
com valor da relação maior de 15, este aumento indica desidratação e quando a relação for menor
que 15 indica aumento absoluto do fibrinogênio relacionado a processo inflamatório.
No presente estudo não foi realizado distinção entre gêneros, mas Borges et al. (2011)
evidenciaram valores de 380 ± 22mg/dL para machos e 300 ± 17mg/dL para fêmeas, em animais
saudáveis, mas Jain (1993) reportou que o fibrinogênio é uma proteína de fase aguda, e aumentam
XX Encontro Latino Americano de Iniciação Científica, XVI Encontro Latino Americano de Pós-Graduação e VI
Encontro de Iniciação à Docência – Universidade do Vale do Paraíba.
4
nos casos de inflamações ou necrose tecidual. Fatores fisiológicos podem elevar temporariamente a
concentração de fibrinogênio plasmático e Thomas (2000) complementou que o fibrinogênio está na
classe das glicoproteínas e faz parte importante da hemostasia, porque é o substrato para a trombina
transformar o fibrinogênio em fibrina, durante o processo de coagulação.
Os valores obtidos para o fibrinogênio pelas duas técnicas corroboram com Bosco et al. (2012)
que obtiveram amplitude de 100 a 500 mg/dL em cães sadio. Observado que 68,75% dos cães com
elevada concentração de fibrinogênio plasmático (PPT/F < 10) tinham leucograma normal e que o
mecanismo que induz a hiperfibrinogemia antecede a ativação do metabolismo oxidativo dos
neutrófilos e as alterações leucocitárias.
O presente estudo mostrou que ocorre aumento do fibrinogênio, em ambas as técnicas, mas
Vecina (2009) reportou que são imprecisos e que os valores de fibrinogênio devem ser determinados
utilizando métodos automatizados, pois apenas 3,49% dos cães com hiperfibrinogenemia, não
apresentaram diferença significativa entre o grupo controle e o grupo de animais doentes.
Até o momento, não foram encontradas na literatura, informações referentes ao uso ou técnica da
diferença entre os valores das proteínas plasmáticas e séricas para a quantificação do fibrinogênio,
sendo assim, torna-se necessário mais estudos com esta relação e diferença entre os valores da
proteína plasmática e sérica, mesmo conhecendo-se a premissa de que “soro é o plasma sem
fibrinogênio”.
Conclusão
Concluiu-se que houve reprodutibilidade de média a boa para quantificar o fibrinogenio plasmático
pela Técnica da Diferença da Proteína Plasmática e Sérica em comparação com a Técnica
Convencional da Precipitação Térmica, sendo essa de mais rapida e simples execução, por envolver
menor número de etapas para sua confecção.
O presente estudo sugere que haja um número maior de animais separados por sexo, doentes e
saudáveis, contagem de leucócitos e animais anêmicos ou não, para que se possa comparar melhor
com a literatura as diferentes situações clínicas.
Referências
AYRES, M., AYRES JÚNIOR, M., AYRES, D.L. & SANTOS, A.A. BIOESTAT – Aplicações estatísticas
nas áreas das ciências bio-médicas. Ong Mamiraua. Belém, PA. 2007
BORGES, A.C.; JULIANO, R.S.; BARINI, A.C.; LOBO, J.R.; ABREU, U.G.P. de; SERENO, J.R.B.;
FIORAVANTI, M.C.S. Enzimas Séricas e Parâmetros Bioquímicos de Bovinos (Bos taurus) Sadios da
Raça Pantaneira. Dados eletrônicos. Corumbá: Embrapa Pantanal, 2011. 16 p. (Boletim de Pesquisa
e Desenvolvimento / Embrapa Pantanal. Disponível: http://www.cpap.embrapa.br/publicacoes/online/
BP106.pdf. Acesso: 20 jul 2016.
BOSCO, A.M.; COUTO, R.; PEREIRA, P.P.; ALMEIDA, B.F.M.; CIARLINI, P.C. Valor do teste de
redução do tetrazólio nitroazul (NBT) no diagnóstico de processos inflamatórios caninos. ARS Vet.,
Jaboticabal, SP, v. 28, n. 3, p. 161-168, 2012.
CARVALHO, C. C. D.; RÊGO, E. W.; QUEQUE, M.; SOARES, P. C. Avaliação da proteína C reativa,
fibrinogênio e leucograma em cadelas com e sem piometra. Med. Vet., Recife, v. 2, n. 2, p. 1-8, 2008.
COLLA, M.F. Valor da Haptoglobina no plasma comparado com a contagem de células somáticas do
leite no diagnóstico da mastite subclínica em vacas leiteiras, 2009. 66f. Dissertação (Mestrado em
Ciências Veterinárias) - Faculdade de Veterinária, Universidade Federal do Rio Grande do Sul, 2009.
FARIA, E.P.; MARQUES JR., A.P.; ALVES, G.E.S. Características celulares e bioquímicas do líquido
peritoneal de equinos submetidos à peritonite experimental. Arq. Bras. Med. Vet. Zootec., v. 51 n. 4,
Belo Horizonte, Ago. 1999.
XX Encontro Latino Americano de Iniciação Científica, XVI Encontro Latino Americano de Pós-Graduação e VI
Encontro de Iniciação à Docência – Universidade do Vale do Paraíba.
5
FORNAZARI, M.; SANNAZZARO, M.J.B; NOVO, N.F.; FRANÇA, H.H. Determinação do fibrinogênio
plasmático em indivíduos fumantes e não-fumantes do sexo masculino com idade superior a 21 anos
Rev. Soc. Bras. Clín. Méd., v. 3, n. 3, p. 61-66, maio-jun. 2005.
JAIN, N. C. The plasma proteins, dysproteinemias, and immune deficiencydisorders. In: JAIN, N. C.
Essentials of Veterinary Hematology. Philadelphia: Saunders, 1993. p. 349-380.
KANEKO, J.J. Bioquímica Clínica de Animais domésticos. Academic Press, 1997.
MEINERZ, A.R.M.; CLEFF, M.B.; CAMPÊLO, M.S.; BARCELLOS, L.E.K.; GIL, L.A.F. RIBEIRO,
C.L.G. Associação dos índices de fibrinogênio e contagem de leucócitos: auxilio de diagnóstico em
cães. Rev. Cient. Eletrônica Med. Vet., ano X, n.19, Jul 2012.
SCHALM, O.W. Plasma protein:fibrinogen ratios in routine clinical material from cats, dogs, horses,
and cattle-Part III. Miscellaneous: California Veterinarian, v. 6, n. 6, p. 9-10 ,1970. Disponível em:
https://www.cabdirect.org/cabdirect/abstract/19712200972. Acesso em 6 set. 2016.
SCHALM, O.W.; JAIN, N.C.; CARROLL, E.J. Veterinary Hematology. 3.ed. Philadelphia: Lea e
Febiger. 1975. 807p.
SILVEIRA, J.M. Patologia Clínica Veterinária. Teoria e Interpretação. Editora Guanabara: Rio de
Janeiro, 1988, 196 p.
SOUZA, M.V.; SOUZA, P.C.; RODRIGUES, B.L.; RIBEIRO JÚNIOR, J.I.; CORDEIRO, R.R.
Concentração do fibrinogênio no plasma sanguíneo de equinos da raça mangalarga marchador por
diferentes métodos. Rev. Ceres, v. 53, n. 307, p. 382-386, 2006.
THOMAS, J.S. Overview of plasma proteins. In: FELDMAN, B.F.; ZINKL, J.G.; JAIN, N.C. Schalm’s
Veterinary Hematology, 5 ed. Philadelphia: Wilkins, p.891-898, 2000.
VECINA, J. F.; PATRÍCIO, R. F.; CIARLINI, P. C. Importância do fibrinogênio plasmático na
identificação de processos inflamatórios de cães. Ciênc. vet. tróp., Recife-PE, v. 9, n. 1, p. 31-35,
2006.
VECINA, J.F. Avaliação dos marcadores da resposta inflamatória aguda em cães. 2009. 167f.
Dissertação (Mestrado em Ciências Médicas) -. Faculdade de Ciências Médicas da Universidade
Estadual de Campinas, 2009.
XX Encontro Latino Americano de Iniciação Científica, XVI Encontro Latino Americano de Pós-Graduação e VI
Encontro de Iniciação à Docência – Universidade do Vale do Paraíba.
6