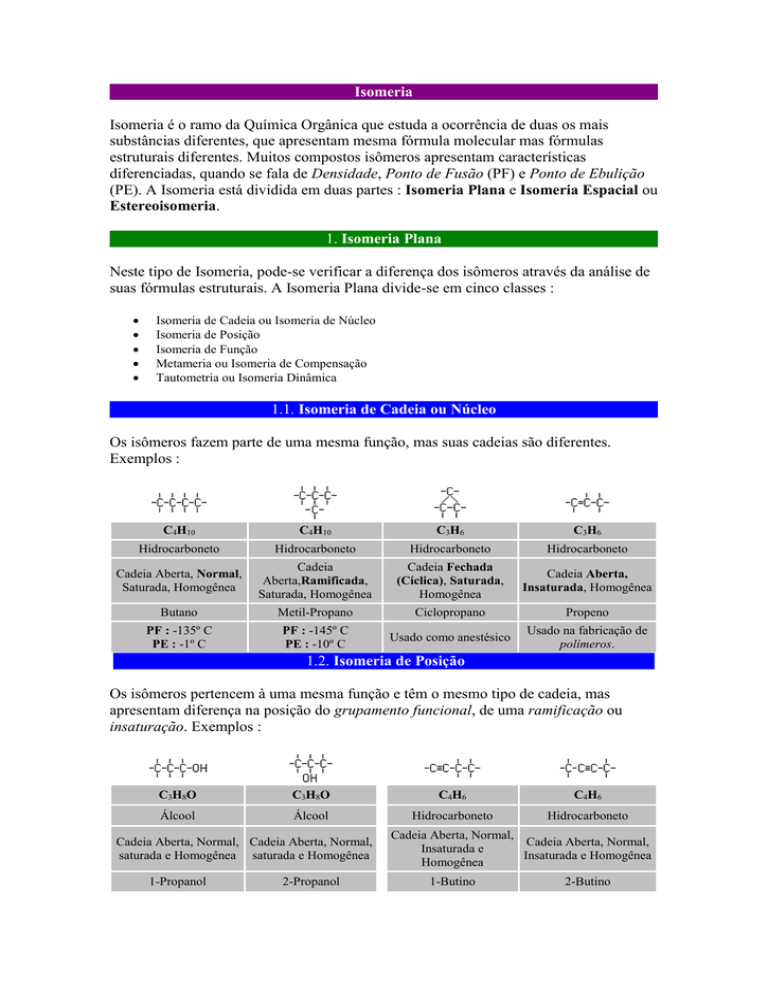
Isomeria
Isomeria é o ramo da Química Orgânica que estuda a ocorrência de duas os mais
substâncias diferentes, que apresentam mesma fórmula molecular mas fórmulas
estruturais diferentes. Muitos compostos isômeros apresentam características
diferenciadas, quando se fala de Densidade, Ponto de Fusão (PF) e Ponto de Ebulição
(PE). A Isomeria está dividida em duas partes : Isomeria Plana e Isomeria Espacial ou
Estereoisomeria.
1. Isomeria Plana
Neste tipo de Isomeria, pode-se verificar a diferença dos isômeros através da análise de
suas fórmulas estruturais. A Isomeria Plana divide-se em cinco classes :
Isomeria de Cadeia ou Isomeria de Núcleo
Isomeria de Posição
Isomeria de Função
Metameria ou Isomeria de Compensação
Tautometria ou Isomeria Dinâmica
1.1. Isomeria de Cadeia ou Núcleo
Os isômeros fazem parte de uma mesma função, mas suas cadeias são diferentes.
Exemplos :
C4H10
C4H10
C3H6
C3H6
Hidrocarboneto
Hidrocarboneto
Hidrocarboneto
Hidrocarboneto
Cadeia Aberta, Normal,
Saturada, Homogênea
Cadeia
Aberta,Ramificada,
Saturada, Homogênea
Cadeia Fechada
(Cíclica), Saturada,
Homogênea
Cadeia Aberta,
Insaturada, Homogênea
Butano
Metil-Propano
Ciclopropano
Propeno
PF : -135º C
PE : -1º C
PF : -145º C
PE : -10º C
Usado como anestésico
Usado na fabricação de
polímeros.
1.2. Isomeria de Posição
Os isômeros pertencem à uma mesma função e têm o mesmo tipo de cadeia, mas
apresentam diferença na posição do grupamento funcional, de uma ramificação ou
insaturação. Exemplos :
C3H8O
C3H8O
C4H6
C4H6
Álcool
Álcool
Hidrocarboneto
Hidrocarboneto
Cadeia Aberta, Normal, Cadeia Aberta, Normal,
saturada e Homogênea saturada e Homogênea
1-Propanol
2-Propanol
Cadeia Aberta, Normal,
Cadeia Aberta, Normal,
Insaturada e
Insaturada e Homogênea
Homogênea
1-Butino
2-Butino
O grupo funcional (OH) O grupo funcional (OH)
está no carbono 1
está no carbono 2
PF : -126º C
PE : 96º C
PF : -86º C
PE : 82,5º C
A ligação tripla está no
carbono 1
A ligação tripla está no
carbono 2
Reage com Sódio
metálico
Não reage com Sódio
metálico
1.2. Isomeria de Função
Isômeros de função são aqueles que possuem fórmula estrutural e cadeia idênticas, mas
pertencem à funções diferentes. Exemplos :
C3H6O
C 3H 6 O
C4H8O2
C4H8O2
C7H8O
C7H8O
Aldeído
Cetona
Ácido
Carboxílico
Éster
Fenol
Álcool
Propanal
Propanona
Ácido
Butanóico
Etanoato de
Etila
Orto-MetilHidróxiBenzeno
Álcool Benzílico
Utilizado
como
mordente na
indústria de
tinturaria
Solvente
Orgânico.
Vendido com o
nome
comercial de
Acetona.
Presente na
manteiga
rançosa
Essência
responsável
pelo sabor de
maçã.
Matéria prima
usada na
Álcool extraído
fabricação do
na resina de
desinfetante
certas árvores.
conhecido
como Creolina
1.3. Isomeria de Compensação ou Metameria
Os isômeros pertencem a uma mesma função e apresentam cadeias idênticas, mas
apresentam uma diferença na posição de um heteroátomo. A palavra metameria vem do
grego meta (mudança) + meros (parte). Exemplos :
C4H10O
C4H10O
C3H6O2
C3H6O2
Éter
Éter
Éster
Éster
Etóxi-Etano
Metóxi-propano
Metanoato de Etila
Etanoato de Metila
Utilizado como
anestésico comum
Utilizado em processos
industriais
Cadeia normal, aberta,
saturada e heterogênea
Cadeia normal, aberta,
saturada e heterogênea
O heteroátomo está entre O heteroátomo está entre
os carbonos 1 e 2
os carbonos 2 e 3
Cadeia normal, aberta,
saturada e heterogênea
Cadeia normal, aberta,
saturada e heterogênea
1.4. Isomeria Dinâmica ou Tautomeria
Os principais casos de tautomeria (que vem do grego tautos =
dois de si mesmo) envolvem os Enóis, que são Álcoois que
possuem a hidroxila (-OH) presa a um carbono insaturado. Os
Olha Lá !
As Cetonas não se
enóis se transformam em Aldeídos quando o carbono insaturado é
primário e em cetonas quando o carbono é secundário. Os
compostos originados a partir dos enóis apresentam tendência a
se transformar novamente nos enóis, fazendo com que o ciclo se
reinicie. Quando o Enol se transforma em Aldeído, dizemos que
houve um equilíbrio Aldo-enóico e quando o Enol se tranforma
em Cetona, houve um equilíbrio Ceto-enóico.Uma solução que
contém os dois tautômeros é chamada Solução Alelotrópica.
Exemplos :
Enol com Carbono
Primário
Etenol
Áldeído
Etanal
Enol com Carbono
Secundário
2-2-Butenol
transformam em
Aldeídos e vice-cersa. A
transformação só ocorre
entre Enol e Cetona ou
Enol e Aldeído. O Enol
que se trasnforma em
Cetona é diferente do
Enol que se transforma
em Aldeído.
Cetona
Butanona
Isomeria geométrica
3.1) Isomeria geométrica cis-trans A-B:
Analise as duas estruturas abaixo:
Se os carbonos estivessem ligados por uma ligação simples, poder-se-ia
interconverter uma estrutura na outra simplesmente girando essa ligação carbono-carbono.
Portanto, as duas estruturas seriam apenas conformações espaciais diferentes para uma
mesma molécula. No entanto, ao contrário de uma ligação simples, a dupla ligação não
permite esse giro entre os átomos ligados, pois a rotação impediria a sobreposição de
orbitais p e destruiria a ligação pi. Conclui-se então que as estruturas apresentadas são
moléculas diferentes. Esse fenômeno é chamado isomeria geométrica A-B, e ocorre
quando existe uma dupla ligação, sendo que nos carbonos estão ligados dois pares iguais de
grupos diferentes, como o exemplo acima.
As duas estruturas são isômeros geométricos, e recebem nomes ligeiramente
diferentes: a estrutura I é chamada Cis 1,2- dicloro eteno e a estrutura II é chamada Trans
1,2- dicloro eteno. O prefixo cis indica que os grupos iguais estão do mesmo lado no plano
que corta a dupla ligação. O prefixo trans indica que os grupos iguais estão em lados opostos
no plano que corta a dupla ligação. Os isômeros geométricos diferem entre si em algumas
propriedades químicas, especialmente quanto à velocidade das reações, mas diferem
principalmente nas propriedades físicas, tais como PF e PE, índices de refração, solubilidade,
densidade etc.
3.2) Isomeria geométrica cis-trans E-Z:
Um tipo especial de isomeria geométrica - a isomeria geométrica E-Z - ocorre
quando os carbonos de rotação impedida são ligados a dois grupos diferentes, podendo ser
os quatro grupos diferentes entre si. Nesse caso a referência é o número atômico (Z) dos
grupos ligados aos carbonos. Veja um exemplo:
No isômero cis, os grupos de maior Z (em vermelho) estão do mesmo lado do plano
da dupla ligação e no isômero trans, estão em lados opostos.
ISOMERIA GEOMÉTRICA EM COMPOSTOS CICLICOS BAERYANA.
É um tipo de isomeria CIS – TRANS que ocorre em compostos cíclicos em que dois carbonos
do anel estejam ligados a dois radicais diferentes.
PROPRIEDADES DOS ESTEREOISOMEROS GEOMETRICOS
De uma maneira geral os isômeros geométricos possuem propriedades químicas
semelhantes, já que pertencem a mesma função orgânica, e propriedades físicas diferentes,
devido à geometria molecular diferente dos isômeros, isto interfere principalmente na
polaridade e no volume da molécula, veja um quadro comparativo entre
os isômeros do 1,2 - dicloro - eteno.
1,2 Cis dicloroeteno
1,2 Trans dicloroeteno
-80°C
60°C
1,284g/mL
-50°C
PF
48°C
PE
1,265g/mL densidade
Os alcenos que apresentam o fenômeno da isomeria geométrica podem apresentar
diferenças em seus pequenos momentos de dipolo. Os isômeros trans geralmente
apresentam , por isso apresenta baixo ponto de ebulição .Já os isômeros cis revelam
um pequeno valor para aumentando seu ponto de ebulição. Isso porque os isômeros trans
possuem grupos iguais em posições opostas, gerando portanto, efeitos indutivos
equivalentes que se anulam, o que não ocorre com os isômeros cis.
EXERCÍCIOS
1-Faça as fórmulas espaciais e o nome IUPAC dos isomêros geométicos
possiveis para os compostos abaixo:
a) ácido Butenodioico.
b) 3 – Hexeno
c) 1 – Etil-3meil-ciclopropano
d)1,3-Ciclo-butanodiol
e) 3-Metil-2-penteno
f) 1-Cloro-propeno
2-Considere os compostos:
I. Buteno -2
II. Penteno -1
III. 1,2 - Dimetil Ciclopropano
IV. Ciclobutano
Em relação à possibilidade de isomeria cis-trans, pode-se afirmar que:
a) aparece apenas no composto I.
b) ocorre em todos.
c) ocorre somente nos compostos II e IV.
d) aparece somente nos compostos I e III.
e) só não ocorre no composto I.
3-Considere o composto 3,4-dimetil-3-hexeno.
a) Que tipo de isomeria ocorre nesse composto?
b) Escreva as fórmulas estruturais dos isômeros do item anterior,
identifique-os.