Sandra Doria Xavier
Associação temporal entre episódios de refluxo e eventos obstrutivos
respiratórios em pacientes com refluxo laringofaríngeo e síndrome da apneia
obstrutiva do sono
Tese apresentada ao Curso de Pós-Graduação
da Faculdade de Ciências Médicas da Santa
Casa de São Paulo para obtenção do título de
Doutora em Pesquisa em Cirurgia.
SÃO PAULO
2013
Sandra Doria Xavier
Associação temporal entre episódios de refluxo e eventos obstrutivos
respiratórios em pacientes com refluxo laringofaríngeo e síndrome da apneia
obstrutiva do sono
Tese apresentada ao Curso de Pós-Graduação da
Faculdade de Ciências Médicas da Santa Casa de
São Paulo para obtenção do título de Doutora em
Pesquisa em Cirurgia.
Área de concentração: Reinserção Social
Orientador: Prof. Dr. André Campos Duprat
Co-orientadora: Profa Dra. Claudia Alessandra Eckley
SÃO PAULO
2013
FICHA CATALOGRÁFICA
Preparada pela Biblioteca Central da
Faculdade de Ciências Médicas da Santa Casa de São Paulo
Xavier, Sandra Doria
Associação temporal entre episódios de refluxo e eventos obstrutivos
respiratórios em pacientes com Refluxo Laringofaríngeo e Síndrome
da Apneia Obstrutiva do Sono./ Sandra Doria Xavier. São Paulo, 2013.
Tese de Doutorado. Faculdade de Ciências Médicas da Santa
Casa de São Paulo – Curso de Pós-Graduação em Pesquisa em
Cirurgia.
Área de Concentração: Reinserção Social
Orientador: André Campos Duprat
Co-Orientadora: Cláudia Alessandra Eckley
1. Refluxo laringofaríngeo 2. Apneia do sono tipo
obstrutiva
BC-FCMSCSP/47-13
Dedico esta tese
Aos meus pais,
pessoas únicas a quem devo minha profissão
e a pessoa que sou hoje.
Ao meu esposo Fernando,
pela paciência durante este período de estudos,
pela motivação e por não ter me deixado desistir nunca.
Ao meu filho querido Luis Fernando,
por ter me aberto o caminho para a Medicina do Sono,
por ser tão especial nosso amor incondicional
Ao meu filho pequeninho Caio,
pela alegria de estar junto de nós,
pela sua chegada em minha vida.
Senhor, dai-me força para mudar o que pode ser mudado...
Resignação para aceitar o que não pode ser mudado...
E sabedoria para distinguir uma coisa da outra.
São Francisco de Assis
AGRADECIMENTOS
À Faculdade de Ciências Médicas da Santa Casa de São Paulo, onde me
formei e estou desde 1995, minha segunda casa;
À Irmandade da Santa Casa de Misericórdia de São Paulo, pela oportunidade
de trabalho desde 2010, no Departamento de Otorrinolaringologia;
Ao Dr. Ivo Bussoloti Filho, Chefe do Departamento de Otorrinolaringologia da
Santa Casa de São Paulo, por ter me incentivado a iniciar o Doutorado após sua
orientação no Mestrado, mesmo sabendo da minha mudança de linha de pesquisa;
Ao Dr. André Campos Duprat, Professor Instrutor da Faculdade de Ciências
Médicas da Santa Casa de São Paulo, orientador da minha tese, pelas críticas
sábias e pertinentes;
À
Dra.
Claudia
Alessandra
Eckley,
Médica
Segundo
Assistente
do
Departamento de Otorrinolaringologia da Santa Casa de São Paulo, co-orientadora
desta tese, que muito me ajudou em cada degrau, em cada etapa difícil superada,
sempre com uma palavra de otimismo, amiga acima de tudo;
Ao Dr. Carlos Kayoshi Takara e à Dra. Mônica Alcântara de Oliveira Santos,
Médicos Segundo Assistentes do Departamento de Otorrinolaringologia da Santa
Casa de São Paulo, por terem me ajudado a recrutar os pacientes da tese durante
nosso período de trabalho no Ambulatório de Especialidades Geraldo Burroul
(AEGB);
Ao Dr. Luiz Henrique de Souza Fontes, Médico Assistente do Grupo de
Esôfago e Motilidade Digestiva do Serviço de Gastroenterologia Clínica do Hospital
das Clínicas da Faculdade de Medicina da USP, meu imenso agradecimento por
toda sua vontade em ensinar, sua dedicação com os pacientes, sua prontidão para
solucionar problemas, enfim, por ter permitido o desenrolar desta tese;
Ao Dr. Tomás Navarro-Rodriguez, Médico Chefe do Laboratório para
Investigação em Motilidade Digestiva do Hospital das Clínicas da Faculdade de
Medicina da USP, por ter permitido a realização dos exames de pHimpedanciometria no seu serviço;
Ao Dr. Geraldo Lorenzi-Filho, Diretor do Laboratório do Sono do InCor, pela
oportunidade que me deu ao abrir as portas do Laboratório para a realização dos
exames de polissonografia, pela confiança e otimismo que sempre me passou
nesses anos, minha gratidão;
Ao Dr. Pedro Genta, pneumologista do InCor, pela incansável ajuda que me
deu para solucionar o mecanismo de funcionamento do sincronizador;
À Dra. Priscila Sardinha, otorrinolaringologista e fellow em Medicina do Sono no
InCor, por ter me enviado todos os exames de polissonografia pela internet no
período em que estava de licença maternidade. Isto permitiu que o andamento da
tese não fosse interrompido;
Ao acadêmico Júlio Patrocínio, pela grande ajuda no desenvolvimento das
formulas matemáticas no Excel e pela prontidão em tudo que lhe era requisitado;
Às acadêmicas Daniela Tridente, Patrícia Claro, Ana Carolina Dantas e Bárbara
Magalhães pela ajuda na seleção dos pacientes para a tese;
À minha amiga de infância Fernanda de Mello Malta, biomédica e
pesquisadora, que sempre me incentivou a seguir a carreira de pesquisa e me
ajudou a superar muitos obstáculos;
À Sra. Maria Zélia Cirino Vieira e Sra. Telma Vieira Arlindo, secretárias do
Departamento de Otorrinolaringologia da Santa Casa de São Paulo, pela constante
disposição em ajudar;
Ao Isildo Donizeti da Silva, Diretor da Uniscope, empresa responsável pela
importação e exportação de produtos da Sandhill Scientific para o Brasil, pela pronta
substituição do aparelho de pH-impedanciometria, pela rapidez deste empréstimo e
pela confiança;
À Erika Tiemi Fukunaga, Estatística da Faculdade de Ciências Médicas da
Santa Casa de São Paulo, pela análise estatística realizada neste estudo;
À Ana Paula Galvão Damasceno Carrare, Professora da Tecnologia da
Informação da Faculdade de Medicina da Santa Casa de São Paulo, pela
disponibilidade em me ajudar com a formatação da tese;
À CAPES, pela ajuda financeira durante todos esses anos;
À FAPESP, pela ajuda financeira para a aquisição de todas as sondas de pHimpedanciometria, bem como o equipamento de polissonografia.
ABREVIATURAS E SÍMBOLOS
CPAP...
pressão positiva contínua na via aérea (positive continuous airway pressure)
DP........
desvio-padrão
DRGE..
Doença do refluxo gastroesofágico
DVD.....
disco digital de vídeo
EDA.....
Endoscopia digestiva alta
EEI.......
Esfíncter esofagiano inferior
EES......
Esfíncter esofagiano superior
ESE......
Escala de Sonolência de Epworth
IAH.......
Índice de apneia e hipopneia
IMC.......
Índice de massa corpórea
InCor....
Instituto do Coração
Kgs.......
Quilogramas
n...........
número de pacientes
N1.........
fase 1 do sono NREM
N2.........
fase 2 do sono NREM
N3.........
fase 3 do sono NREM
NREM...
não REM
OR........
odds ratio
REM.....
movimento rápido dos olhos (rapid eyes movement)
RFS......
Reflux Finding Score
RGE......
refluxo gastroesofágico
RLF.......
refluxo laringofaríngeo
RSI........
Reflux Symptom Index
SAOS....
Síndrome da apneia obstrutiva do sono
TCLE..... Termo de consentimento livre e esclarecido
TV.........
Televisão
USP....... Universidade de São Paulo
VAS....... Vias aéreas superiores
SUMÁRIO
1 INTRODUÇÃO ......................................................................................................... 1
1.1 Revisão da Literatura ....................................................................................... 10
1.1.1 Refluxo Laringofaríngeo (RLF) e Doença do Refluxo Gastroesofágico
(DRGE) .............................................................................................................. 10
1.1.2 Síndrome da Apneia Obstrutiva do Sono (SAOS) ..................................... 17
1.1.3 Associação da SAOS com DRGE e RLF .................................................. 18
2 OBJETIVO ............................................................................................................. 23
3 CASUÍSTICA E MÉTODO ..................................................................................... 25
3.1 Casuística ........................................................................................................ 26
3.2 Método ............................................................................................................. 28
3.2.1 Leitura dos dados ...................................................................................... 28
3.2.2 pH-impedanciometria ................................................................................ 30
3.2.3 Diagnóstico da SAOS................................................................................ 33
3.2.3.1 Diagnóstico Clínico da SAOS ............................................................. 33
3.2.3.2 Diagnóstico Polissonográfico da SAOS .............................................. 34
3.2.4 Análise Estatística ..................................................................................... 35
4 RESULTADOS ....................................................................................................... 36
4.1 Caracterização da amostra .............................................................................. 37
4.2 Associação temporal entre refluxo e eventos obstrutivos respiratórios ........... 43
5 DISCUSSÃO .......................................................................................................... 50
6 CONCLUSÕES ...................................................................................................... 59
7 ANEXOS ................................................................................................................ 61
8 REFERÊNCIAS BIBLIOGRÁFICAS ...................................................................... 73
FONTES CONSULTADAS ....................................................................................... 85
RESUMO................................................................................................................... 86
ABSTRACT............................................................................................................... 87
APÊNDICE ................................................................................................................ 88
1 INTRODUÇÃO
2
Refluxo gastroesofágico (RGE) é definido como o retorno de conteúdo
gastroduodenal para o esôfago (Vakil et al, 2006), podendo ainda atingir órgãos
proximais do trato digestório e respiratório, como a faringe e a laringe (Koufman,
1991; Ylitalo et al, 2001; Koufman, 2002a; Koufman, 2002b; Gupta, Sataloff, 2009).
Pode ser considerado fisiológico, sem levar a sintomas clínicos ou patológicos, mas
ao provocar inflamação da mucosa esofágica será então chamado de Doença do
Refluxo Gastroesofágico (DRGE), cujos sintomas típicos são pirose e regurgitação
ácida (Kahrilas, Lee, 2005). Quando ocorre inflamação de segmentos da laringe e
faringe, passa a ser denominada manifestação extra ou supraesofágica da Doença
do Refluxo Gastroesofágico ou Refluxo Laringofaríngeo (RLF) (Koufman, 1991), que
tem como principais sintomas a tosse, globo faríngeo, pigarro, rouquidão, dor
torácica e asma (Jaspersen et al, 2003).
A lesão epitelial pelo material refluído é causada pela presença da pepsina,
que é a enzima proteolítica mais importante produzida no estômago (Johnston et al,
2006), sendo sua atividade máxima em pH dois.
As lesões teciduais causadas pelo refluxo podem ter como consequências:
erosões, ulcerações da mucosa, estenose péptica, assim como câncer de esôfago
(Lundell et al, 1999).
A DRGE é a doença mais prevalente do trato digestório na atualidade
(Moraes-Filho et al, 2002; Moraes-Filho et al, 2005; Nasi et al, 2006), atingindo de 20
a 40% da população geral (Jaspersen et al, 2003). No Brasil, em estudo
populacional empreendido em 22 metrópoles, entrevistando amostra populacional de
13.959 indivíduos, observou-se que 4,6% das pessoas entrevistadas apresentavam
pirose uma vez por semana e que 7,3% apresentavam tal queixa duas ou mais
vezes por semana. Em função desses dados, estima-se que a prevalência da
DRGE, no País, seja ao redor de 12% (Moraes-Filho et al, 2005).
A prevalência de manifestações do RLF em pacientes com DRGE é
extremamente alta (Dore et al, 2007). Estima-se que cinco a 20% da população
mundial tenham complicações supraesofágicas da DRGE (Richter, 1997; Altman et
al, 2005). O RLF é diagnosticado em aproximadamente 10% dos pacientes com
queixas otorrinolaringológicas e em pelo menos 50% dos pacientes com queixa de
alteração vocal (Koufman, 1991).
3
Lai et al (2008), utilizando exames objetivos como a pH-metria, encontraram
24% de RLF nos pacientes com DRGE. Um estudo prospectivo na Europa realizado
em 2003, envolvendo 6.215 pacientes com queimação retroesternal, constatou
32,8% de prevalência de sintomas extraesofágicos de refluxo (Jaspersen et al,
2003).
No entanto, é interessante notar como um grande número de pacientes com
RLF não tem esofagite ou outros sinais da DRGE (Nasi et al, 2001). Somente 17 a
25% dos pacientes com RLF apresentam esofagite erosiva à endoscopia digestiva
alta (EDA) (Koufman et al, 2002a). Isto pode ser explicado pelo fato de um evento de
refluxo considerado fisiológico para o esôfago pode causar dano à mucosa da laringe
e faringe, que não possui as mesmas barreiras de proteção esofágicas (físicas e
químicas) para suportar o contato com pH ácido, com enzimas proteolíticas gástricas
e sais biliares (Koufman, 1991; Fraser, 1994; Koufman, 2002a; Koufman et al, 2002b;
Ogut et al, 2005; Khan et al, 2006; Gupta, Sataloff, 2009). Certamente, os
mecanismos de proteção das mucosas gástrica e esofágica, inexistentes na mucosa
faríngea e laríngea, exercem um papel decisivo na capacidade destes órgãos de
suportar as agressões mecânicas e químicas a que são submetidos diariamente,
sendo vários destes mecanismos mediados pela saliva (Tobey, 1995; Marcinkiewicz et
al, 1998; Eckley et al, 2004). A saliva contém diversas substâncias orgânicas e
inorgânicas que contribuem para a proteção contra as agressões físicas e químicas e
para a manutenção da integridade da mucosa, não só da cavidade oral como também
do restante do trato digestório (Tobey, 1995; Marcinkiewicz et al, 1998), como o
bicarbonato, que promove neutralização ácida (Eckley et al, 2004). Sem saliva na
laringe há maior tempo de contato do material refluído na mucosa laríngea em
comparação com a mucosa esofágica, favorecendo o dano tecidual. Além disso, do
ponto de vista histológico, a mucosa laríngea tem, na maior parte de sua superfície,
epitélio respiratório (pseudoestratificado cilíndrico ciliado) enquanto o epitélio do
esôfago é pavimentoso não queratinizado, mais resistente à exposição ácida.
Assim, admite-se que o RLF possui fisiopatologia semelhante à da DRGE,
porém com mecanismos singulares (Groome et al, 2007; Qua et al, 2007; Lai et al,
2008), não sendo necessária a concomitância das duas doenças em todos os casos.
Além desta agressão direta à laringe pelo conteúdo refluído, admite-se que a
inflamação da mucosa esofágica possa promover estímulo indireto do nervo vago,
4
que induziria à tosse crônica, pigarro recorrente e laringoespasmo (agressões
igualmente lesivas à mucosa da laringe e da faringe) (Gupta, Sataloff, 2009;
Hobaika, Lorentz, 2009). Acredita-se que este reflexo vagal é um mecanismo
potente das manifestações extraesofágicas da DRGE (Mansfield, Stein, 1978), o
qual é desencadeado pela acidificação da porção distal do esôfago e por
microaspirações (Kalach et al, 2000).
Em relação ao diagnóstico das características físico-químicas do material
refluído, pesquisas mais recentes utilizando instrumentos diagnósticos, como a pHimpedanciometria (Sifrim et al, 2001), têm demonstrado que não só as secreções
líquidas e ácidas são as responsáveis pelo dano às mucosas esofágica, laríngea e
faríngea, mas também às secreções não ácidas e gasosas. Modelos experimentais
mostraram que o sinergismo entre secreções ácidas, pepsina e ácidos biliares pode
aumentar o potencial dano na mucosa esofágica.
Alguns estudos na literatura sugerem que o pH do refluxo, bem como a sua
forma física (líquida ou gasosa), sejam diferentes entre o DRGE e o RLF, sendo os
refluxos proximais mais gasosos e menos ácidos que os refluxos distais (Kawamura
et al, 2004; Oelschlager et al, 2006; Johnston et al, 2007). Emerenziani et al (2009)
encontraram que 30% dos eventos de refluxo ácido se tornam fracamente ácidos ao
longo do percurso pelo esôfago. Assim, necessita-se de exame objetivo mais
específico que a pH-metria para a detecção destes diferentes tipos de refluxo.
A pH-impedanciometria ou impedância intraluminal é um método de
monitorização prolongada intraesofágica que permite a detecção dos diferentes tipos
de refluxo, como refluxos líquidos, gasosos ou mistos e ainda o refluxo não ácido.
Os episódios de refluxo são mensurados através de mudanças na resistência de
corrente elétrica entre dois eletrodos colocados em um cateter no esôfago (Sifrim et
al, 2001). A combinação desta técnica com a pH-metria permite que seja feita a
distinção de refluxo ácido do refluxo não ácido (Sifrim et al, 2001).
A DRGE, bem como o RLF, têm como principais fatores de risco a obesidade,
o aumento da idade, estresse e fatores dietéticos (Moraes-Filho et al, 2005).
Outra doença com alta prevalência em indivíduos com perfil similar e que
também causa grande morbidade é a Síndrome da Apneia Obstrutiva do Sono
(SAOS).
5
A SAOS ocorre preferencialmente nos homens (três:um) entre a quarta e a
quinta décadas de vida (Olson et al, 1995), sendo caracterizada pela obstrução
recorrente, parcial (hipopneias) ou total (apneias), das vias aéreas superiores
durante o sono (AASM, 1999). Como consequência, podem ocorrer episódios de
hipóxia intermitente noturna e também fragmentação do sono e despertares
intermitentes, com graves consequências clínicas.
Sua fisiopatologia relaciona-se com o desequilíbrio entre as forças de
fechamento e abertura da faringe, sendo o tônus da musculatura dilatadora da
faringe importante na manutenção da patência da via aérea superior. No sono REM
(rapid eyes movement) – fase do sono que compõe aproximadamente 25% do
tempo total de sono – pode haver maior concentração de eventos obstrutivos
respiratórios (Eiseman et al, 2012). Os mesmos autores realizaram estudo
retrospectivo no qual foi feita análise de 300 exames de polissonografia e
encontraram, em 50% dos pacientes, duas vezes mais eventos obstrutivos
respiratórios durante a fase REM do que nas outras fases do sono (N1, N2 e N3),
devido à diminuição do tônus muscular característica desta fase.
A SAOS é fator de risco independente para hipertensão arterial sistêmica
(Young et al, 1997; Peppard et al, 2000b) e doenças cardiovasculares como
progressão da aterosclerose (Marin et al, 2005; Drager et al, 2007), infarto agudo do
miocárdio, arritmias (Gottlieb et al, 2010) e acidentes vasculares cerebrais (Redline
et al, 2010), com aumento da morbimortalidade por causa cardiovascular (Marin et
al, 2005; Drager et al, 2007). É considerada atualmente um problema de saúde
pública pelas consequências cardiovasculares (Lorenzi-Filho et al, 2010) e pelo
maior risco de acidentes de trânsito e de trabalho (Tregear et al, 2009). Nos Estados
Unidos, estimou-se que o custo anual do tratamento das consequências da SAOS
esteja em torno de US$ 3,4 bilhões e até 75-80% dos pacientes com SAOS
permanecem sem diagnóstico (Kapur et al, 1999).
Há algumas evidências na literatura que corroboram a hipótese de que haja
associação entre DRGE/RLF e Síndrome da Apneia Obstrutiva do Sono (SAOS). Um
estudo conduzido por Shepherd et al (2011) em 1116 pacientes com SAOS e 1999
pacientes-controles, mostrou uma maior prevalência de sintomas sugestivos de
DRGE nesta população (10,2% nos pacientes com SAOS e 5,5% nos controles),
independentemente de outros fatores de risco como idade e índice de massa
6
corpórea (IMC). Foi igualmente observado que os dois sintomas típicos da DRGE,
que são a queimação retroesternal e a regurgitação ácida, são relatados em mais de
60% dos pacientes com SAOS (Valipour et al, 2002; Kim et al, 2005), comparados
com 20% na população geral (Locke et al, 1997; Chiocca et al, 2005).
O impacto socioeconômico e na qualidade de vida dos pacientes com cada
uma destas doenças isoladamente é alto, não tendo sido estimado o potencial
agravamento causado pela concomitância de ambas (Kulig et al, 2003; Reimer,
2003). Cheung et al (2009) publicaram um estudo envolvendo 76 pacientes com RLF
e 73 controles e, através de questionários, concluíram que o RLF é fator
determinante na piora da qualidade de vida desta população e há indícios na
literatura de que o impacto seja até maior do que a DRGE propriamente dita (Carrau
et al, 2004). A SAOS, por sua vez, também determina piora na qualidade de vida,
uma vez que leva a sintomas diurnos como fadiga, sonolência excessiva, déficit de
atenção e pobre desempenho no trabalho (Veale et al, 2002).
As razões para associação entre DRGE/RLF e SAOS não estão
completamente estabelecidas.
O período de sono, mesmo sem eventos de apneia, é um momento muito
propício ao refluxo, no qual os mecanismos fisiológicos antirrefluxo estão reduzidos.
A lentidão no esvaziamento gástrico, diminuição na motilidade esofágica com maior
tempo de contato da acidez gástrica no esôfago, posição em decúbito supino,
diminuição da pressão do esfíncter esofagiano inferior (EEI) (Kahrilas et al, 1987),
diminuição da percepção do conteúdo ácido no esôfago, diminuição da produção de
saliva e diminuição das deglutições espontâneas corroboram para predispor o
indivíduo a ter episódios de refluxo enquanto dorme, favorecendo, em conjunto, a
lesão de mucosa (Orr et al, 1998; Orr et al, 2000; Orr et al, 2004; Fass et al, 2004;
Karkos et al, 2009; Fass, 2010). Poh et al (2010b) e Allen et al (2010) verificaram
que o estado de consciência por si só (sono X vigília) é mais importante do que a
posição do corpo (supino ou em decúbito) na determinação das diferenças entre os
episódios de refluxo diurno e noturno.
Ao analisar as possibilidades fisiopatológicas que podem explicar a
associação da SAOS e RLF, percebe-se que existem dois focos distintos, porém
inter-relacionados, que formam um verdadeiro círculo vicioso (Eskiizmir, Kezirian,
2009).
7
O primeiro deles está relacionado ao fato de que, durante os períodos de
apneia, há significativa diminuição da pressão intratorácica com aumento do
gradiente de pressão entre o tórax e o abdome, o que facilita o refluxo do conteúdo
gástrico para o esôfago (Demeter, Pap, 2004; Eskiizmir, Kezirian, 2009). Ademais,
a diminuição da pressão intratorácica leva à modificação da posição do diafragma,
que
traciona
o
ligamento
frenoesofágico
e,
consequentemente,
leva
ao
relaxamento parcial do EEI, facilitando mais uma vez o refluxo (Demeter, Pap,
2004). Segundo estes últimos autores, a longo prazo, esta constante modificação
na posição do diafragma pode destruir o ligamento frenoesofágico, levando à
insuficiência permanente do EEI e consequentemente, à DRGE. Não foram
encontrados na literatura estudos a fim de estabelecer se a mesma associação se
faz verdadeira para o RLF.
A segunda hipótese para explicar a associação entre SAOS e DRGE/RLF
seria a fragmentação do sono secundária ao aumento de despertares. Cada evento
de apneia levaria a despertares que, por sua vez, desencadearia relaxamento
transitório do EEI (Bernard et al, 1990; Kerr et al, 1992), facilitando o refluxo. A
associação dos despertares com eventos de refluxo já vem sendo descrita por vários
autores na literatura (Dent et al, 1980; Fass et al, 2001; Martinez et al, 2003; Orr et
al, 2008; Poh et al, 2010a), e nem sempre com concomitância temporal entre estes
episódios, ou seja, o refluxo não ocorre necessariamente no momento da apneia e
vice-versa.
Em contrapartida, o refluxo do conteúdo gástrico para a região da laringe e
faringe causa reação inflamatória local com edema ou até mesmo estenose, o que
leva à diminuição da luz faríngea e laríngea, propiciando ainda mais episódios de
colabamento da região, ou seja, apneias (Eskiizmir, Kezirian, 2009). Além da reação
inflamatória, o refluxo leva a déficits sensoriais nos receptores das mucosas faríngea e
laríngea, prejudicando a ativação reflexa dos músculos dilatadores da faringe. Assim,
o refluxo pode contribuir para a progressão da SAOS por mecanismos não só
inflamatórios locais, mas também por alterações neuromusculares (Eskiizmir, Kezirian,
2009). Segundo alguns autores, há um déficit sensorial nas regiões da orofaringe,
nasofaringe e laringe dos pacientes com SAOS (Kimoff et al, 2001; Nguyen et al,
2005) e, na opinião de outros autores, existe associação entre a intensidade da
inflamação laríngea e o déficit sensorial (Payne et al, 2006), e este, por sua vez, com
8
a gravidade da SAOS (Nguyen et al, 2005), corroborando para a hipótese de que o
RLF possa contribuir para a progressão da SAOS. Por outro lado, a lesão de
receptores faríngeos e déficit sensorial local em pacientes com SAOS pode ser
secundária aos próprios eventos de estreitamento e colabamento intermitente da
faringe pelas hipopneias e apneias (Lindman, Stal, 2002; Boyd et al, 2004).
Outro ponto relevante a ser comentado é sobre o reflexo entre a faringe e o
esfíncter esofagiano superior (EES), ou seja, o reflexo de aumento de tônus ante a
estimulação da faringe. Pacientes com RLF precisam do dobro de estímulo para
conseguirem o mesmo efeito no tônus, comparados a pacientes sem RLF (Ulualp et
al, 1998). Isto sugere que possa haver uma disfunção na parte aferente deste
reflexo, provavelmente nos receptores faríngeos (Phua et al, 2005). Estes receptores
podem estar danificados pela própria inflamação causada pelo RLF (Aviv et al, 2000)
ou também por pausas obstrutivas respiratórias (Lindman, Stal, 2002).
A associação entre SAOS e DRGE/ RLF também é vista em relação aos seus
respectivos tratamentos. Alguns estudos que utilizaram bloqueador de bomba de
prótons para o tratamento da DRGE mostraram que houve diminuição da
fragmentação do sono (Ing et al, 2000), diminuição dos roncos (Eryılmaz et al, 2012),
melhora no índice de apneia e hipopneia (IAH) (Senior et al, 2001; Bortolotti et al,
2006) e melhora na queixa de sonolência excessiva diurna vista pela Escala de
Sonolência de Epworth (Steward, 2004; Suurna et al, 2008; Eryılmaz et al, 2012).
Em contrapartida, o tratamento com CPAP (continuous positive airway pressure)
para SAOS diminui sintomas de DRGE (Kerr et al, 1992; Kerr et al, 1993; Ing et al,
2000; Konermann et al, 2002; Green et al, 2003; Tawk et al, 2006) e de RLF
(Eryılmaz et al, 2012). No entanto, o CPAP pode ajudar no tratamento da DRGE de
um modo direto, elevando a pressão intraesofágica e aumentando a constrição do
EEI, uma vez que os efeitos benéficos do CPAP na DRGE podem ser observados
não somente nos pacientes com SAOS, e sim ainda nos pacientes sem SAOS (Kerr
et al, 1992; Kerr et al, 1993; Ing et al, 2000).
Apesar de estar claro na literatura o aumento da prevalência da DRGE/RLF
nos pacientes com SAOS, não há estudos que demonstrem uma relação de causa e
efeito entre ambas as doenças. Uma das formas de se avaliar tal relação é estudar a
associação temporal entre eventos obstrutivos respiratórios, que ocorrem na SAOS,
e os episódios de refluxo, presentes na DRGE/RLF.
9
Todavia, há grande dificuldade em estabelecer o nexo causal entre
DRGE/RLF e SAOS, decorrente de alguns fatores. Ambas as doenças têm alta
prevalência: DRGE e RLF até 20% da população (Richter, 1997; Altman et al, 2005)
e SAOS em até 32,8% da população (Tufik et al, 2010). A obesidade é fator de risco
em ambas as doenças, presente em 16% da população (Peppard et al, 2000a;
Sarturi et al, 2010), e ainda pacientes com IMC acima de 40 kg/m2 têm maior
prevalência de comorbidades relacionadas à própria obesidade, como a SAOS e
DRGE (Hampel et al, 2005; Wang et al, 2008). Tanto RLF/DRGE como SAOS
atingem seu pico de incidência em indivíduos com mais de 40 anos de idade (Karkos
et al, 2009) e há dificuldade técnica em realizar os testes diagnósticos para estas
doenças de forma concomitante.
O estudo da associação temporal entre eventos obstrutivos respiratórios e os
episódios de refluxo permite a formulação de duas perguntas: Será que eventos
obstrutivos respiratórios podem precipitar um episódio de refluxo?, e ainda: Será que
um episódio de refluxo pode desencadear eventos obstrutivos respiratórios?
Sabendo da elevada prevalência na população geral do RLF, da DRGE e da
SAOS, bem como do impacto socioeconômico e morbimortalidade destas doenças
(Kulig et al, 2003; Reimer, Flemons, 2003), torna-se fundamental tentar estabelecer
uma
associação
temporal
entre
elas.
Para
tanto,
faz-se
necessário
o
desenvolvimento de pesquisas prospectivas com seleção rigorosa de pacientes e de
métodos diagnósticos a fim de minimizar potenciais vieses (falsos positivos) e falhas
diagnósticas (falsos negativos).
O melhor conhecimento destas possíveis relações poderá auxiliar no
diagnóstico e tratamento precoce da DRGE/RLF em pacientes com SAOS, evitando
o agravamento das manifestações clínicas destas doenças e minimizando seu forte
impacto socioeconômico.
10
1.1 Revisão da Literatura
1.1.1 Refluxo Laringofaríngeo (RLF) e Doença do Refluxo Gastroesofágico
(DRGE)
Koufman
(1991)
publicou
sua
experiência
sobre
as
manifestações
otorrinolaringológicas da DRGE obtidas com o estudo de 225 pacientes
diagnosticados através de videolaringoscopia e pH-metria esofágica de dois canais
de 24 horas. Encontrou refluxo no cateter proximal em 78% dos pacientes com
estenose laríngea, 71% dos pacientes com carcinoma laríngeo, 60% dos pacientes
com laringite posterior, 58% daqueles com sensação de globo faríngeo e 52% com
tosse
crônica.
Observou
que
a
maioria
dos
pacientes
que
procura
o
otorrinolaringologista não se queixa de pirose, e seus sintomas são causados pelo
refluxo do conteúdo gastrointestinal para a laringe e faringe. Assim sendo, conforme
o autor, este tipo de refluxo seria diferente do refluxo visto pelos gastroenterologistas
e seria melhor designado como Refluxo Laringofaríngeo (RLF). Os sintomas
clássicos do RLF são disfonia (presente em até 70% dos pacientes), pigarro, tosse
seca e sensação de globo faríngeo. Os achados laringoscópicos mais frequentes
foram edema e hiperemia de toda a laringe, mas principalmente das aritenoides e da
região interaritenoidea, que nos casos mais graves e crônicos passou a apresentar
espessamento do epitélio com paquidermia e metaplasia. Também demonstrou que
a acidez não é unicamente a responsável pelo dano tecidual na laringe, e sim a
pepsina, a qual ainda apresenta 70% de sua atividade em pH de 4,5 e 40% em pH
de cinco. Deste modo, elucidou que parece ser mais danosa ao epitélio laríngeo a
exposição mais prolongada de pepsina em pH não ácido do que a exposição mais
curta de pepsina em pH menores.
Smit et al (1998) fizeram um estudo das medidas do pH ao nível do EES de
20 voluntários normais a fim de determinar se existe refluxo ácido no esôfago
proximal em condições fisiológicas, e também propuseram uma técnica simples de
posicionamento
do
cateter
proximal
usando-se
o
nasofibrolaringoscópio
e
dispensando-se, assim, o uso de manometria. Foi feito exame de pH-metria
esofágica de 24 horas com dois canais, um na entrada do esôfago ao nível do
11
esfíncter superior do esôfago (encontraram um máximo de três episódios de curta
duração) e à noite, em posição supina, nenhum dos pacientes teve qualquer
episódio de refluxo ácido à garganta.
Eckley et al (1999) estudaram 20 pacientes adultos consecutivos com sintomas
e sinais laringoscópicos sugestivos de RLF através de pH-metria esofágica de dois
canais de 24 horas, com o objetivo de analisar a sensibilidade deste exame. O exame
de pH-metria esofágica foi positivo em 70% dos pacientes, sendo os casos negativos
daqueles pacientes com sintomas e sinais leves a moderados. Todos os pacientes
foram tratados clinicamente por um período mínimo de 12 semanas com inibidores de
bomba de prótons associados a pró-cinéticos, quando existiam sintomas digestivos
associados. Houve melhora clínica e laringoscópica em todos os pacientes, inclusive
nos seis pacientes que apresentavam exame de pH-metria normal. Os autores
concluíram que o diagnóstico do RLF é essencialmente clínico e que os resultados
negativos da pH-metria esofágica devem ser considerados com cautela.
Cianci et al (2000) citaram que os dois principais mecanismos reconhecidos
como potenciais causadores dos sintomas e alterações laríngeas secundários ao
refluxo gastresofágico são a estimulação de aferentes vagais no esôfago proximal e
distal, levando a um aumento na pressão do EES e ao contato direto da laringe com
o ácido, a pepsina e outras substâncias químicas nocivas refluídas. A pH-metria tem
sensibilidade de 27 a 78% nos pacientes com laringite por RGE. Os autores
estudaram três pacientes submetidos à gastrectomia parcial no passado através de
EDA e pH-metria esofágica de três canais (intragástrico, a cinco cm do EEI e cinco
cm abaixo do EES). Encontraram abundante refluxo biliar na cavidade gástrica
residual e refluxo com pH > quatro tanto no cateter gástrico quanto no do esôfago
distal. Concluíram que o refluxo com pH > quatro também pode gerar estímulo vagal
e laringite posterior e que deve ser estudado mais detalhadamente. Este foi o
primeiro relato na literatura de tal associação.
Nostrant, Rabine (2000) teceram uma análise crítica sobre as controvérsias
existentes até o momento quanto à associação causal entre DRGE e laringite
crônica. Estes autores citaram que existem controvérsias sobre os mecanismos
protetores mecânicos e reflexos da laringe e faringe, que incluiriam o esfíncter
esofagiano superior e a presença de refluxo esôfago-laríngeo e faríngeo. Estudos
destes mecanismos em pacientes com e sem sintomas e sinais de refluxo laríngeo
12
não mostraram associação direta efetiva dos sintomas com a doença. Quanto aos
exames diagnósticos, os autores ressaltaram que não existe nenhum exame isolado
capaz de firmar o diagnóstico de laringite de refluxo com certeza absoluta. Apenas
20% dos pacientes com laringite e refluxo proximal documentado têm alterações
endoscópicas (esofagite erosiva), e apenas outros 30 a 40% apresentam estudos
radiográficos contrastados anormais. A PH-metria esofágica com canal único distal
irá perder até 50% dos casos de refluxo proximal, e mesmo as pH-metrias com dois
ou três canais têm sensibilidade máxima de 50 a 75% e baixa reprodutibilidade, pois
os padrões de refluxo proximal variam muito.
Belafsky et al (2001) publicaram e validaram instrumento que documentou as
alterações anatômicas e a gravidade do RLF, o qual nomearam de Reflux Finding
Score (RFS) (Anexo 1). Trata-se de escala de gravidade clínica da doença, contendo
oito itens acerca dos achados endolaríngeos mais observados durante laringoscopia
de pacientes com RLF. A escala proposta varia de zero (sem achados anormais) até
26 (máxima alteração). Para validar o escore em questão, os autores avaliaram 40
pacientes consecutivos com diagnóstico clínico de RLF, confirmado por pH-metria
esofágica de 24 horas de duplo sensor. Os pacientes foram estudados antes do
tratamento com inibidor de bomba de prótons e após dois, quatro e seis meses do
início do tratamento. Todos os dados foram confrontados com 40 adultos voluntários
(grupo controle) pareados para idade e gênero, sem queixas vocais e sem histórico
de doença do refluxo. A média de RFS de entrada dos pacientes estudados foi de
11,5 (+ 5,2), valor que evoluiu para 9,3 após dois meses de tratamento, 7,3 em
quatro meses e 6,1 em seis meses (p<0,001). A média dos indivíduos do grupo
controle foi de 5,2 (intervalo de confiança entre 3,6 e 6,8). Assim, os autores
puderam afirmar com 95% de certeza que um indivíduo com RFS maior de sete
apresenta RLF.
Belafsky et al (2002) apresentaram e validaram um índice dos sintomas do
refluxo laringofaríngeo, o Reflux Symptom Index (RSI), como um instrumento para
documentar a gravidade dos sintomas do RLF – um questionário autoaplicado de
nove itens acerca dos sintomas relacionados ao RLF, que se encontra no Anexo 2
do presente estudo. Cada item indica uma pontuação, sendo que o valor de cada
item é somado para um escore final de pontos, retratando matematicamente a
intensidade dos sintomas referidos. No intuito de validar o questionário, os autores
13
realizaram um estudo prospectivo de seis meses em 25 pacientes com diagnóstico
confirmado por pH-metria esofágica de 24 horas de duplo sensor, aplicando o
questionário antes e depois do tratamento (inibidor de bomba de prótons duas vezes
ao dia e modificações comportamentais e de dieta). A média do RSI melhorou de
20,9 para 12,8 após o tratamento. Os autores indicaram então considerar valores de
RSI maiores de 13 como tendo 95% de confiabilidade de serem anormais.
Concluíram ser este instrumento de fácil reprodutibilidade para mensuração da
gravidade dos sintomas do RLF.
Koufman et al (2002a) publicaram o posicionamento da Academia Americana
de Otorrinolaringologia acerca do RLF, baseando-se em revisão de artigos e na
opinião do comitê organizador do estudo. O documento definiu o termo refluxo
gastroesofágico como sendo fluxo contrário do conteúdo do estômago para o
esôfago, evento que pode ser fisiológico, podendo ocorrer até 50 vezes ao dia. A
DRGE seria um termo clínico para descrever doença que ocorreria quando o número
de eventos de refluxo fosse excessivo, causando dano tissular (esofagite) e/ou
sintomas. O termo Refluxo Laringofaríngeo estaria se referindo ao fluxo contrário do
conteúdo gastroduodenal que atingiria a faringe e a laringe. Os autores então
apresentaram as diferenças entre a DRGE clássica e o RLF, registrando que
esofagite seria encontrada em cerca de 25% dos pacientes com RLF. Embora
alguns pacientes pudessem apresentar RLF e DRGE associados, na maior parte dos
casos haveria RLF isolado. Registraram ainda que os pacientes com RLF
apresentariam episódios de refluxo principalmente durante o dia e em pé, enquanto
na DRGE, isso ocorreria durante a noite e quando deitados.
Adhami et al (2004) relataram os resultados de sua pesquisa experimental em
17 cães sobre os efeitos da pepsina, dos ácidos biliares conjugados e não
conjugados, além da tripsina na mucosa laríngea em níveis variáveis do pH local.
Para tal, após anestesiarem os cães, causavam lesão na prega vocal direita, na
aritenoide e na região retrocricoídea, seguida de pincelamento com cada uma das
substâncias supracitadas em pH variável (um-dois, quatro-cinco, seis-sete), três
vezes por semana até completar 12 aplicações. O aspecto da mucosa laríngea foi
avaliado por laringoscopia rígida e as alterações macroscópicas graduadas
visualmente. No final do experimento, os cães foram sacrificados e suas laringes
foram examinadas histologicamente. A pepsina em pH um-dois causou mais
14
alterações visuais e histológicas do que em pH quatro-sete. Os ingredientes
duodenais causaram pouca ou nenhuma alteração histológica em qualquer pH, com
apenas discretas alterações visuais. Já a tripsina não causou qualquer alteração,
seja visual ou histológica na mucosa laríngea, em todos os valores de pH estudados.
As pregas vocais foram o local mais sensível aos químicos estudados. Os autores
concluíram que as alterações visuais encontradas na laringite por refluxo apenas
tem significado patológico nos episódios de refluxo ácido contendo pepsina.
Johnston et al (2004) demonstraram que a pepsina está presente no epitélio
laríngeo de pacientes com RLF e está ausente nos pacientes sem esta doença, e
ainda asseveraram que pacientes com RLF têm, no epitélio da laringe, menor
concentração da isoenzima anidrase carbônica, a qual é capaz de converter dióxido
de carbono em bicarbonato e assim neutralizar o conteúdo do ácido refluído.
Eckley et al (2004) estudaram a concentração salivar de fator de crescimento
epidérmico em 26 pacientes com RLF e em 20 controles. Observaram que pacientes
com RLF têm significativamente menor quantidade de fator de crescimento
epidérmico na saliva, importante na reparação tecidual das mucosas da laringe e da
faringe, dificultando sua regeneração diante de agressões como o refluxo.
Gill et al (2005) mostraram que o comportamento da enzima anidrase
carbônica é diferente nos epitélios do esôfago e da laringe, perante os eventos de
refluxo. No esôfago, parece haver aumento da concentração desta enzima em
pacientes com DRGE, favorecendo o bloqueio da acidez, enquanto isto não é
observado na totalidade da área da laringe: há aumento na comissura posterior, o
que não é visto na região das pregas vocais.
Mahieu, Smit (2006) apresentaram revisão sistemática sobre o diagnóstico e
tratamento do RLF, bem como sua experiência pessoal. Foram considerados apenas
estudos envolvendo adultos, com história e exame clínico compatíveis com RLF e
pesquisa de pH-metria esofágica de 24 horas de duplo sensor positiva. Os autores
citaram a baixa aceitação do diagnóstico por parte dos pacientes, porquanto, na falta
de sintomas clássicos da DRGE como regurgitação e queimação, haveria grande
dificuldade em se justificar o quadro clínico como sendo decorrente do RLF. Além
disso, admitiram haver grande controvérsia a respeito da doença, com estudos
questionando a relação entre os sinais e sintomas encontrados e a existência do
refluxo propriamente dito. A baixa especificidade e a sensibilidade da pH-metria
15
esofágica também foram abordadas, uma vez que apenas o refluxo ácido seria
detectável por este método. Assim, o diagnóstico deveria se basear em sintomas e
sinais específicos, na ausência de outra doença que os pudesse explicar, imputando
ao diagnóstico do RLF um caráter de exclusão. Concluíram que a despeito de ainda
existir grande controvérsia sobre a doença, não haveria evidência circunstancial
suficiente que negasse a relação entre o RLF e sintomas laríngeos e faríngeos.
Johnston et al (2007) realizaram estudo experimental in vitro para examinar o
efeito da pepsina em suas formas ativa e inativa na concentração de proteínas
protetoras da laringe, como a anidrase carbônica e Sep70. Os autores observaram
que a pepsina precisa estar ativa para conseguir depletar estas enzimas protetoras.
A pepsina teve sua atividade máxima em pH de dois e ficou inativa em pH maior que
6,5. Mesmo inativa em pH maior que 6,5, ela permaneceu estável até pH de oito e
pôde ser reativada quando o pH caiu. Concluíram que níveis de pepsina
permanecem detectáveis no epitélio laríngeo após um evento de refluxo.
Wise, Murray (2007), em um artigo de revisão de literatura, verificaram que o
uso combinado da impedância e da pH-metria demonstrou maior sensibilidade para
detectar todos os tipos de refluxo (ácido, não ácido, líquido, misto ou gasoso),
ajudando a determinar a sua localização, distribuição e composição.
Gupta, Sataloff (2009) realizaram estudo de revisão sistemática sobre artigos
abordando as manifestações supraesofágicas da DRGE, sabidamente o refluxo
laringofaríngeo. Pesquisas moleculares haviam comprovado o efeito nocivo da
exposição ácida da laringe, uma vez que mostraram que a pepsina na laringe
resultaria em depleção da anidrase carbônica e da proteína de estresse epitelial
Sep70, dois reconhecidos fatores protetores tissulares. Ademais, os estudos haviam
provado que a pepsina presente na laringe poderia ser reativada com novas quedas
do pH (ácido ou fracamente ácido). Citaram que a baixa sensibilidade dos exames
de monitorização prolongada do refluxo nos níveis esofágico e faríngeo tornaria a
associação de sistemas de escore de sintomas, como o RSI, e de sinais, como o
RFS, bastante confiável para diagnóstico do RLF. Sobre o uso da EDA, foi
encontrado que a presença de esofagite erosiva estaria presente em apenas 1020% dos casos de RLF, tornando este método diagnóstico de pobre valor quando
utilizado isoladamente.
16
Zerbib, Stoll (2010) observaram que a pH-metria de dois canais, que vinha
sendo considerada o método de escolha para o diagnóstico da DRGE e do RLF,
apesar de aparentemente poder suprir a necessidade de diagnóstico de refluxo nos
segmentos da laringe e da faringe, apresenta algumas sérias limitações como:
quedas de pH no sensor proximal sem episódios de refluxo distal (refluxo
esôfagoesofágico ou artefatos); controvérsias a respeito dos valores normais aceitos
no sensor proximal; inabilidade em detectar refluxo gasoso ou refluxo pouco ácido.
Moares-Filho et al (2010) definiram, em diretriz publicada para o diagnóstico e
tratamento da DRGE, que em pacientes com manifestações atípicas da DRGE, a
pH-metria de dois canais pouco contribui para o diagnóstico, não sendo indicada de
rotina nesses pacientes.
Lee et al (2010) estudaram 98 pacientes com sintomas sugestivos de RLF
usando pH-metria isolada e pH-impedanciometria, ou seja, associação da
impedanciometria à pH-metria de dois canais. Constataram que a sensibilidade
diagnóstica da pH-metria associada à impedanciometria é o dobro daquela da pHmetria isolada, e que pacientes com refluxo ácido tiveram mais episódios de refluxo
proximal do que aqueles com refluxo não ácido. Os autores concluíram que a pHimpedanciometria foi o melhor método para detectar e caracterizar os eventos de
refluxo em comparação com ambos os métodos separadamente (impedanciometria
e pH-metria).
Hoppo et al (2012) estudaram com pH-impedanciometria 40 pacientes
assintomáticos e 24 pacientes com RLF. Observaram que episódios de refluxo
proximais foram bastante raros na população assintomática. Deste modo, acreditam
que a presença de um único episódio de refluxo proximal deva ser considerada
anormal em pacientes com sintomas de RLF, independentemente de sinais ou
sintomas sugestivos de DRGE.
De Bortoli et al (2012) investigaram a prevalência de DRGE na sua forma
clássica em 41 pacientes com sintomas e achados laringoscópicos de RLF utilizando
RSI e RFS, respectivamente. Os autores confirmaram diagnóstico de DRGE pela
pH-impedanciometria em menos de 40% dos pacientes. Concluíram que a
sensibilidade dos exames de monitorização prolongada do esôfago é baixa para as
manifestações supraesofágicas da DRGE.
17
Prado et al (2013) traduziram para o português e fizeram adaptação cultural
do Reflux Finding Score, que passou a ser chamado de Escala de Achados
Videolaringoscópicos de Refluxo.
1.1.2 Síndrome da Apneia Obstrutiva do Sono (SAOS)
Johns (1991) desenvolveu um questionário que avalia a chance de o paciente
adormecer em oito situações cotidianas, chamado Escala de Sonolência de Epworth
(ESE) (Anexo 3). Sabendo que a sonolência excessiva diurna é uma consequência
bastante frequente da SAOS, o questionamento a respeito deste sintoma pode ser
utilizado na triagem desta doença. Pontuação acima de dez sugere diagnóstico de
sonolência diurna excessiva, que é definida como aumento da propensão para
dormir em circunstâncias nas quais o indivíduo afetado e outros consideram
inapropriadas. O diagnóstico de sonolência excessiva diurna em um indivíduo é
considerado de alto risco para SAOS.
Netzer et al (1999) validaram o questionário de Berlin, o qual contém
questões relativas a fatores de risco para a SAOS, tais como obesidade, hipertensão
arterial sistêmica, ronco, apneia testemunhada, sonolência excessiva diurna e
fadiga. É composto por dez questões divididas em três categorias. A primeira
categoria inclui questões sobre ronco; a segunda refere-se à fadiga diurna e/ou
sonolência ao dirigir; e a terceira refere-se à história de hipertensão arterial sistêmica
e obesidade. Cada categoria pode ser considerada positiva ou negativa, e quando
duas ou mais categorias forem positivas, o paciente é considerado de alto risco para
SAOS (Anexo 4). Sua sensibilidade é de 86%, com valor preditivo positivo de 89%
para identificar pacientes com SAOS.
Eikemann et al (2007) estudaram 21 pacientes entre 18 e 75 anos, os quais
realizaram polissonografia associada à medição da pressão de colabamento da
faringe. Os autores observaram enfraquecimento do reflexo desencadeado pela
pressão negativa na faringe para aumentar o tônus da musculatura dilatadora da
faringe em pessoas após 65 anos, mostrando não ser somente alteração anatômica
faríngea, mas também alteração funcional que acomete indivíduos mais idosos e os
predispõe ao desenvolvimento da SAOS.
18
Conrad et al (2007), em conjunto com a Academia Americana de Medicina do
Sono, definiram as regras para o diagnóstico da SAOS. A SAOS é definida quando o
IAH (índice de apneia e hipopneia – número de vezes em que ocorre diminuição ou
cessação do fluxo aéreo por hora de sono) é igual ou maior que cinco,
acompanhado por sonolência excessiva diurna ou por, pelo menos, duas das
seguintes características: ronco, despertares recorrentes, sono não reparador, fadiga
diurna ou comprometimento de memória ou da capacidade de concentração. A
presença de IAH ≥ 15 eventos/h, na ausência de sintomas relacionados com o sono,
também é suficiente para o diagnóstico da SAOS.
Dempsey et al (2010), em um estudo de revisão da literatura, relataram que a
obesidade relaciona-se com a SAOS não somente pelo simples fato de aumentar a
camada gordurosa ao redor da faringe e língua; nos indivíduos obesos, há
diminuição dos volumes pulmonares devido ao volume abdominal aumentado, e isto
acarreta menor tração da traqueia nas paredes da faringe. Com menor tração, há
menor tensão nas paredes laterais da faringe, favorecendo o estreitamento e o
colabamento da VAS.
Tufik et al (2010), em estudo epidemiológico na cidade de São Paulo, em uma
população de 1.042 pessoas, encontraram prevalência de SAOS em 32,8% dos
indivíduos estudados, sendo 9,6% das mulheres e 24,8% dos homens. A partir de
modelo de regressão linear, foram identificados fatores de risco independentes,
como sexo masculino (OR= 4,1) e obesidade (OR= 10,5).
Abrishami et al (2010) realizaram revisão sistemática da literatura a respeito
de diversos questionários de triagem para SAOS e chegaram à conclusão de que o
questionário de Berlin foi um dos questionários que apresentaram maior
sensibilidade e especificidade em predizer SAOS moderada a severa.
1.1.3 Associação da SAOS com DRGE e RLF
Tardif et al (1988) estudaram oito pacientes com SAOS, todos obesos, com
pH-metria de canal único distal concomitante com polissonografia, e não
encontraram associação temporal entre os eventos de apneia e RGE.
19
Kerr et al (1992) estudaram cinco pacientes com SAOS com queixas de
DRGE, com IMC variável, sem exclusão de tabagistas, etilistas ou outras possíveis
causas de laringite crônica, com pH-metria de canal único distal e polissonografia.
Não evidenciaram associação temporal direta de refluxo e apneia, mas houve
aumento dos despertares e movimentos do corpo precedendo os episódios de
refluxo. Embora não estatisticamente significante, observaram maior concentração
de hipopneias e apneias nos dez minutos precedendo os eventos de refluxo em
relação ao restante da noite. Assim, os autores concluíram que SAOS pode ser fator
predisponente para DRGE. Os segmentos da laringe e da faringe não foram
estudados.
Graf et al (1995) avaliaram 17 pacientes com SAOS divididos em dois grupos
(oito pacientes com SAOS leve e nove pacientes com SAOS grave), com IMC
variável, sem exclusão de tabagistas, etilistas ou outras possíveis causas de laringite
crônica, com polissonografia e pH-metria esofágica de dois canais concomitantes.
Não encontraram concomitância temporal entre os episódios de refluxo e apneia e
também não observaram associação entre maior gravidade da apneia e maior
número de eventos de refluxo.
Penzel et al (1999) estudaram 15 pacientes obesos com SAOS moderada e
grave, com polissonografia e pH-metria esofágica e com canal único distal
concomitantes. Foram encontrados 52 episódios de refluxo em oito pacientes
durante o registro, sendo 37 deles precedidos por evento obstrutivo respiratório.
Somente um evento de refluxo não teve despertar precedendo-o. Apesar deste
resultado, concluíram que não houve relação temporal entre episódios de refluxo e
apneia, uma vez que a média de IAH foi de 30,1 eventos por hora, ou seja, a minoria
dos eventos respiratórios levou a refluxo. Este trabalho, apesar de ter realizado os
exames de polissonografia e pH-metria concomitantes, não enfocou os segmentos
da laringe e da faringe, atendo-se ao segmento distal do esôfago.
Ing et al (2000) estudaram 63 pacientes com SAOS e 41 controles – todos
obesos – e realizaram polissonografia concomitante com pH-metria com canal único
distal. Foram encontrados significativamente mais episódios de refluxo distal nos
pacientes com SAOS do que nos controles. Na média, pacientes com SAOS
apresentaram mais de 100 episódios de refluxo distal durante oito horas de sono,
em comparação com 23 episódios nos pacientes sem SAOS. Além disso, 53,4% dos
20
episódios de refluxo distal foram temporalmente relacionados a eventos obstrutivos
respiratórios (apneia e hipopneia). No entanto, menos da metade (46,8%) de todas
as apneias e hipopneias e somente 43,8% dos despertares foram relacionados ao
refluxo distal. Assim, apesar de os autores terem evidenciado maior incidência de
episódios de refluxo distal nos pacientes com SAOS do que nos controles, não foi
possível encontrar associação temporal direta entre eventos obstrutivos respiratórios
e episódios de refluxo distal.
Morse et al (2004) estudaram 136 pacientes, sendo 101 deles com SAOS, nos
quais foram aplicados questionários para investigação de DRGE. Queixas de
queimação retroesternal e regurgitação ácida não foram diretamente correlacionadas
com a gravidade da SAOS. Afora isso, SAOS também não foi influenciada pela
gravidade da DRGE. Os autores concluíram que SAOS e DRGE, entre si, não
parecem ter relação de causalidade, mas sim que possuem fatores de risco em
comum.
Berg et al (2004) estudaram 14 pacientes obesos com SAOS, sem exclusão
de tabagistas, etilistas ou outras possíveis causas de laringite crônica, com
polissonografia, pH-metria esofágica de canal único distal e manometria esofágica
concomitantes. 81% dos eventos de refluxo distal foram relacionados a apneias e
76% foram relacionados à redução da pressão esofágica. Em contrapartida, 76%
das apneias não foram associadas a eventos de refluxo distal. Não houve
associação significante entre os episódios de queda de pH, pressão intraesofágica
(isto é, maior queda de pH, menor pressão esofágica) e IAH. Não encontraram
associação temporal ou de gravidade da SAOS com eventos de refluxo distal. Nesta
pesquisa, não foram estudados os segmentos da laringe e da faringe.
Oztürk et al (2004) analisaram 19 pacientes com SAOS grave, com IMC entre
27 a 31, utilizando exame de polissonografia concomitante à pH-metria esofágica de
dois canais. Setenta por cento dos episódios de refluxo distal tiveram relação
temporal com apneia ou hipopneia, sendo 41,5% precedendo e 58,5% sucedendo
evento respiratório. Não foi encontrado nenhum episódio de refluxo proximal nestes
pacientes.
Payne et al (2006) estudaram 34 pacientes, sendo 29 deles com SAOS,
utilizando um teste via endoscópica para determinar a sensibilidade da laringe e
ainda videolaringoscopia para determinar o RFS. Em 90% dos pacientes foram
21
encontrados sinais inflamatórios laríngeos e houve associação estatisticamente
significante entre grau de inflamação visto pelo RFS e IAH, entre RFS e déficit
sensorial e ainda entre déficit sensorial e IAH.
Suzuki et al (2010) realizaram estudo em pacientes com SAOS leve e
moderada associada ao RLF (n=12) ou à DRGE (n=16), e pacientes com SAOS
grave associada ao RLF (n=12) ou à DRGE (n=21). O IMC variava entre 27 e 37 e
utilizaram polissonografia concomitante com pH-metria esofágica de dois canais. Em
pacientes com SAOS grave, 99,9% e 100% dos eventos de refluxo nos grupos com
RLF e DRGE, respectivamente, foram associados a despertares secundários a
eventos respiratórios. Por outro lado, em pacientes com SAOS leve a moderada,
somente 26,5% e 66,9% dos eventos de refluxo nos grupos com RLF e DRGE,
respectivamente,
foram
associados
a
despertares
secundários
a
eventos
respiratórios, e 64% e 24,8% dos eventos de refluxo nos grupos com RLF e DRGE,
respectivamente, foram associados a despertares espontâneos. Nos pacientes com
SAOS leve a moderada com RLF associado, observou-se número signitivamente
alto de despertares espontâneos associados a episódios de refluxo.
Kuribayashi et al (2010a) estudaram nove pacientes com DRGE sem SAOS,
seis pacientes com SAOS sem DRGE, 11 pacientes com DRGE e SAOS, e 15
controles, nos quais foram realizadas manometria, polissonografia e pHimpedanciometria concomitantes. Não foi registrado nenhum evento de refluxo
proximal. O número de eventos de refluxo distal nos controles e nos outros grupos
não foi diferente. Não foi encontrada nenhuma concomitância temporal entre os
episódios de refluxo distal e os de apneia. Os autores verificaram que a pressão
intraesofágica diminui e a pressão nos esfíncteres superior e inferior do esôfago
aumenta progressivamente durante os eventos de apneia, sendo significativamente
maiores no final da apneia em comparação com o início dela. Assim, acreditam que,
apesar de por um lado existirem fatores precipitadores de refluxo durante um evento
de apneia, há também mecanismos compensatórios contra ele. No entanto, não
foram excluídos os tabagistas e etilistas, e em nenhum deles houve refluxo proximal
durante o exame.
Kuribayashi et al (2010b) publicaram estudo envolvendo oito pacientes com
SAOS e esofagite erosiva, nove pacientes com SAOS sem esofagite erosiva e oito
controles, tendo sido estudados com polissonografia, manometria e pH-metria de
22
dois canais. A gravidade da SAOS não foi diferente entre os dois grupos com SAOS
com e sem esofagite. Os episódios de refluxo noturno ocorreram por relaxamento
transitório do EEI e não por aumento de pressão intraesofágica. Durante um evento
de apneia foi observado aumento de pressão do EEI em concomitância com a
diminuição da pressão intraesofágica.
Xiao et al (2012) realizaram estudo com 37 pacientes com SAOS e 16
controles, nos quais foi realizada pH-impedanciometria em concomitância com
polissonografia, mas não foi estudada a associação temporal entre os eventos de
refluxo e apneia. Observaram que os pacientes com SAOS apresentaram de modo
significante mais eventos de refluxo ácido, sem diferença entre os refluxos não
ácidos e o número de episódios de RLF, o que não diferiu de modo significante entre
os grupos. No entanto, pela regressão linear, o IMC foi o único fator preditor de
SAOS nesse trabalho, podendo ser a justificativa para o grupo com SAOS ter tido
maior número de eventos de refluxo ácido.
2 OBJETIVO
24
O objetivo do atual estudo é determinar se existe associação temporal entre
os episódios de refluxo e os eventos obstrutivos respiratórios (hipopneia e apneia),
bem como a influência nessa associação: da idade, de sexo, IMC, sinais e sintomas
de refluxo laringofaríngeo e características físico-químicas do material refluído, em
pacientes com refluxo laringofaríngeo e síndrome da apneia obstrutiva do sono.
3 CASUÍSTICA E MÉTODO
26
3.1 Casuística
Foram selecionados 112 pacientes consecutivos no período de outubro de
2011 a agosto de 2012, com suspeita de SAOS e RLF, seguidos no Ambulatório de
Ronco e Apneia do Sono ou no Ambulatório de Laringe da Santa Casa de
Misericórdia de São Paulo. Foram admitidos todos os pacientes que se enquadraram
nos critérios de inclusão e exclusão, e que consentiram em participar do estudo
assinando o termo de consentimento livre e esclarecido (TCLE) após esclarecimento
sobre os objetivos, metodologia e riscos da atual pesquisa. O protocolo de estudo foi
aprovado pelo Comitê de Ética local.
Inicialmente, os pacientes foram submetidos à propedêutica otorrinolaringológica
geral, bem como verificação de peso e altura para posterior cálculo do IMC.
Para o diagnóstico de RLF, foram utilizados dois instrumentos validados para
tal fim, o RSI (questionário – Anexo 2), com valor superior a 13 e o RFS (baseado em
achados videolaringoscópicos – Anexo 1) com valor superior a sete, corroborado por
pH-impedanciometria com refluxo patológico proximal e/ou EDA com presença de
esofagite erosiva ou esôfago de Barrett (Mahieu, Smit, 2006; Gupta, Sataloff, 2009).
A avaliação da laringe e faringe foi feita através de laringoscopia com fibra
rígida de 10 m e 70º (Storz – Alemanha) acoplada a sistema de vídeo (câmera
Toshiba – Japão, gravador de DVD LG – Brasil) e monitor (LG – Brasil) para o
estabelecimento
do
Reflux
Finding
Score
(RFS).
Foi
utilizado
o
nasofibrofaringolaringoscópio flexível de 3,4 mm de diâmetro (Machida – Japão)
somente nos casos de aumento do reflexo nauseoso ou incapacidade de
visualização da laringe pelo método de laringoscopia com fibra rígida. Todos os
exames foram realizados no Departamento de Otorrinolaringologia da Santa Casa
de São Paulo, feitos e interpretados por um examinador cego, registrados e
armazenados em mídias de disco digital de vídeo (DVD).
Para o diagnóstico clínico da SAOS, foram aplicados dois questionários: a
Escala de Sonolência de Epworth e o Questionário de Berlin (Anexos 3 e 4).
Assim, os critérios gerais de inclusão foram:
27
a) Índice de massa corpórea ≤ 40 kg/m2. Para a determinação do IMC foram
medidos o peso corporal (em quilos) e a estatura (em metros) do paciente.
b) Idade ≥ 18 anos e < 70 anos.
c) Reflux Symptom Index (RSI) > 13 (Belafsky et al, 2002) e Reflux Finding
Score (RFS) > sete (Belafsky et al, 2001).
d) Questionário de Berlin positivo e Escala de Sonolência de Epworth maior
do que dez.
Foram considerados critérios de exclusão: tabagistas, etilistas, pacientes
expostos a químicos inalatórios abrasivos, com rinossinusite aguda ou crônica, com
lesões pré-neoplásicas ou neoplásicas da laringe, faringe e do restante do sistema
digestório (presentes ou previamente tratadas), bem como aqueles submetidos a
cirurgias destes órgãos.
O diagnóstico de rinossinusite aguda ou crônica foi baseado nos sintomas de
rinorreia, hiposmia, obstrução nasal e cefaleia associados aos achados de secreção
nasal espessa durante o exame de nasofibrolaringoscopia.
Todo paciente que estivesse fazendo uso de medicação antiácida ou de
qualquer medicação que tenha atuação no sistema digestório (pró-cinéticos, antiinflamatórios não hormonais e hormonais e alendronato de sódio) foi orientado a
interromper a medicação, pelo menos, por sete dias antes da data da
polissonografia com pH-impedanciometria. Foram excluídos todos os pacientes que
não conseguiram suspender as medicações supracitadas, bem como os pacientes
que estiveram em uso de medicações que facilitem o refluxo (betabloqueadores,
nitratos, bloqueador de canal de cálcio e anticolinérgicos) ou que não foram capazes
de tolerar o exame de polissonografia associado à pH-impedanciometria.
Em seguida, todos os pacientes foram submetidos à EDA sob sedação, no
Departamento de Endoscopia da Santa Casa de Misericórdia de São Paulo. Os
pacientes que apresentaram alterações endoscópicas esofágicas ou gástricas que
impossibilitassem a realização da monitorização esofágica prolongada foram
excluídos deste estudo. Para estabelecer a presença e gravidade de esofagite foi
utilizada a Classificação de Los Angeles (Lundell et al, 1999).
Foi considerado o diagnóstico de DRGE na sua forma clássica, com a
28
presença de refluxo ácido ou não ácido distal patológico visto no exame de pHimpedanciometria durante todo o período de exame (diurno e noturno), e/ou EDA
com sinal de esofagite erosiva ou esôfago de Barrett, de acordo com a classificação
de Los Angeles (Lundell et al, 1999).
Os pacientes assim incluídos foram então submetidos ao exame de
polissonografia de noite inteira, em concomitância com a pH-impedanciometria
esofágica.
Para a manutenção do paciente na pesquisa, houve a necessidade de
preencher alguns critérios nos exames de polissonografia e pH-impedanciometria:
a) Corroboração do diagnóstico de Refluxo Laringofaríngeo por exame
complementar: presença de refluxo ácido ou não ácido patológico, distal
ou proximal, detectado pelo exame de pH-impedanciometria e/ou
presença de esofagite erosiva ou esôfago de Barrett na EDA, de acordo
com a classificação de Los Angeles.
b) Presença de, pelo menos, um episódio de refluxo distal ou proximal visto
no exame de pH-impedanciometria durante o período de registro da
polissonografia.
c) Presença de IAH ≥ cinco no exame de polissonografia.
Para a sincronização dos eventos obstrutivos respiratórios e os eventos de
refluxo, foi utilizado um sincronizador (Time Sync – Sandhill Scientific) conectado
tanto ao equipamento de pH-impedanciometria quanto ao de polissonografia.
3.2 Método
3.2.1 Leitura dos dados
A partir do próprio programa do polissonígrafo Alice 5 (Phillips Respironics,
Murraysville, Pennsylvania, EUA), foram criadas tabelas nas quais foram listados
todos os eventos obstrutivos respiratórios com os respectivos horários em que
29
ocorreram. Sabendo dos horários dos episódios de refluxo noturno de cada um dos
pacientes, foram então criadas fórmulas matemáticas no programa Excel (Microsoft
Office) para se determinar o número dos episódios de apneia ou hipopneia que
precederam e sucederam cada episódio de refluxo. Foram analisados 15, 30 e 45
minutos antes e 15, 30 e 45 minutos após cada evento de refluxo, obtendo-se um
número absoluto de eventos obstrutivos respiratórios em cada faixa de tempo
estudada. A esse número absoluto foi feita multiplicação por quatro, dois e 0,75
respectivamente, para saber o número de eventos obstrutivos respiratórios por hora
de sono, ou seja, o IAH pré e pós cada episódio de refluxo. A partir desses dados, foi
calculado em porcentagem quanto houve de diminuição ou de aumento do IAH que
precedeu e que sucedeu cada episódio de refluxo em relação ao IAH referente à noite
inteira.
Em todos os pacientes foi feita a contagem dos eventos obstrutivos
respiratórios nos 15 minutos antecedendo e sucedendo cada episódio de refluxo, e
quando não houve sobreposição com outros eventos de refluxo, essa análise foi
estendida para 30 e 45 minutos.
Além disso, foi pesquisada a presença de despertares relacionados e não
relacionados a eventos obstrutivos respiratórios durante os 60 segundos que
precederam e sucederam cada evento de refluxo.
Uma vez feita a comparação entre o IAH referente à noite inteira e o IAH
obtido nos 15, 30 e 45 minutos que antecederam e sucederam o(s) episódio(s) de
refluxo, foram criados três grupos distintos:
Grupo I: pacientes cujo IAH referente aos períodos antecedendo o(s)
episódio(s) de refluxo foi maior que o IAH referente à noite inteira;
Grupo II: pacientes cujo IAH referente aos períodos sucedendo o(s)
episódio(s) de refluxo foi maior que o IAH referente à noite inteira;
Grupo III: pacientes cujo IAH referente aos períodos antecedendo e
sucedendo o(s) episódio(s) de refluxo foi menor ou igual ao IAH referente à noite
inteira.
Assim, os grupos I e II foram compostos por pacientes que apresentaram
alguma associação temporal entre eventos obstrutivos respiratórios e episódios de
refluxo, enquanto o grupo III foi composto por pacientes sem esta associação.
30
Foram excluídos todos os pacientes que tiveram somente episódios de
refluxo durante a fase REM do sono. Não foram excluídos os pacientes que os
tiveram e que também apresentaram outros episódios de refluxo em outras fases do
sono, e somente o refluxo ocorrido durante a fase REM não foi estudado. A
determinação de qual estágio do sono no qual o refluxo ocorreu foi baseada na fase
do sono que perdurou a maior parte do tempo durante o episódio de refluxo.
Pacientes em que tanto o IAH do período antecedendo como sucedendo
o(s) episódio(s) de refluxo foi maior do que o IAH referente à noite inteira foram
alocados no grupo I, exceto se o valor do IAH do período sucedendo o(s) episódio(s)
de refluxo foi maior que o dobro do IAH referente ao período antecedendo o(s)
episódio(s) de refluxo, sendo então alocados no grupo II.
3.2.2 pH-impedanciometria
A sonda de pH-impedanciometria utilizada foi a do modelo ComforTEC ZAIS62C26E, com 2,3 mm de diâmetro. Esta sonda possui dois sensores de pH em
antimônio (um proximal e um distal) e seis sensores de impedanciometria, sendo
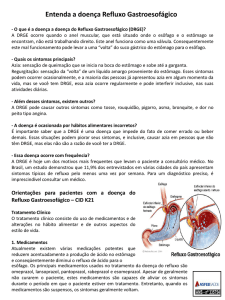
quatro distais e dois proximais (Fig. 1).
31
Figura 1: Sonda de ph-Impedanciometria
Refluxos proximais
Refluxos distais
Fonte: Modificado de Sandhill Scientific (2008).
Nota: Fig. 1: Sonda de pH-impedanciometria na qual é possível identificar os dois sensores de pH,
um distal localizado a cinco cm do EEI e outro proximal, localizado a 30 cm do EEI (setas maiores
escritas em vermelho) e seis sensores de impedanciometria, sendo quatro distais, localizados três,
cinco, sete e nove cm acima do EEI e dois proximais, localizados 15 e 17 cm acima do EEI, ou seja,
localizam-se no esôfago proximal (setas menores, escritas em branco).
A colocação da sonda de pH-impedanciometria foi feita no Serviço de
Gastroenterologia Clínica do Hospital das Clínicas da Faculdade de Medicina da
Universidade de São Paulo (USP) no período da manhã. O paciente permaneceu
com a sonda até a manhã do dia seguinte, sendo que durante o período noturno
dirigiu-se ao InCor para o exame de polissonografia. Imediatamente antes da
colocação desta sonda, foi realizada a manometria esofágica no mesmo setor, com
o objetivo único de identificar a posição do EES e do EEI.
O resultado do exame de pH-impedanciometria, como o próprio nome diz,
divide-se em dois grupos: o primeiro relacionado aos dados da pH-metria e o
segundo relacionado aos dados da impedanciometria.
32
pH-metria
Este, por sua vez, divide-se em pH-metria distal e proximal.
A pH-metria distal refere-se às informações obtidas pelo sensor distal de pH,
localizado no esôfago distal. Foi considerado refluxo distal ácido patológico se:
-
Score de DeMeester > 14,7 associado a: (a) porcentagem do tempo total
de exposição ácida no sensor distal de pH for > 4,5% ou (b) porcentagem
do tempo em posição ortostática com refluxo ácido > 8,4% ou (c)
porcentagem do tempo em posição supina com refluxo ácido > 3,5% ou
-
Porcentagem do tempo total de exposição ácida no sensor distal de pH for
> 4,5% (Jamielson et al, 1992).
O score de DeMeester (Fujiwara et al, 2005), por sua vez, é obtido a partir de
seis diferentes parâmetros: (1) Porcentagem do tempo total com pH < quatro; (2)
Porcentagem de tempo com pH < quatro com o paciente em pé; (3) Porcentagem de
tempo com pH < quatro com o paciente deitado; (4) Número total de episódios de
refluxo ácido; (5) Número total de episódios de refluxo ácido com duração maior que
cinco minutos; (6) Duração do episódio mais longo de refluxo ácido.
A pH-metria proximal refere-se às informações obtidas pelo sensor proximal
de pH, localizado na faringe. Considerou-se critério de positividade para refluxo
patológico proximal a presença de qualquer episódio de refluxo com pH menor ou
igual a cinco, independentemente de sua duração.
Impedanciometria
Foram considerados refluxos ácidos aqueles com pH menor que quatro,
refluxos não ácidos com pH igual ou superior a quatro, que englobam os refluxos
fracamente ácidos (pH entre quatro e sete) e os não ácidos propriamente ditos (pH
maior que sete). Refluxos serão considerados proximais quando o material refluído
alcançar o sensor de impedanciometria localizado a 15 cm do EEI.
Os valores de referência para cada um dos sensores de impedanciometria
podem ser vistos no Anexo 5, sendo que valores superiores aos descritos na tabela
33
foram considerados patológicos. Assim, pela análise da impedanciometria, foram
considerados refluxos proximais não ácidos patológicos quando houve > 12
episódios de refluxo/24 horas; refluxos distais não ácidos patológicos quando houve
> 33 episódios de refluxo/24 horas e refluxo distal ácido patológico quando houve >
50 episódios de refluxo/24 horas (Cho, 2010).
Refluxos líquidos caracterizam-se por queda na impedância de mais de 50%
do basal. Refluxos gasosos são definidos por rápido aumento (três kohms/segundos)
na impedância maior que 5.000 ohms, ocorrendo simultaneamente em, pelo menos,
dois segmentos esofágicos, na ausência de deglutição. Refluxos mistos (líquido e
gasoso) são definidos por um refluxo gasoso que ocorre imediatamente antes ou
durante um refluxo líquido. O tempo total de exposição ao conteúdo refluído (%) é
definido pela divisão do somatório de todos os tempos de clareamento do conteúdo
refluído de cada um dos episódios pelo tempo total de registro. O tempo de
clareamento do conteúdo refluído, por sua vez, é iniciado com a queda da
impedância para 50% da linha de base e seu retorno no sensor mais distal de
impedanciometria (Lee et al, 2010).
3.2.3 Diagnóstico da SAOS
3.2.3.1 Diagnóstico Clínico da SAOS
O diagnóstico clínico da SAOS foi feito a partir de dois questionários: o
questionário de Berlin e a Escala de Sonolência de Epworth. O questionário de
Berlin foi considerado positivo quando duas ou mais categorias foram positivas
(Netzer et al, 1999) e a Escala de Sonolência de Epworth, quando o somatório de
seus subitens foi maior que dez (Johns, 1991).
34
3.2.3.2 Diagnóstico Polissonográfico da SAOS
As polissonografias foram realizadas no Laboratório do Sono da Disciplina de
Pneumologia do Instituto do Coração (InCor) com o polissonígrafo Alice 5 (Phillips
Respironics, Murraysville, Pennsylvania, EUA). Foram feitas sob supervisão de um
técnico habilitado em polissonografia e consistiram no registro simultâneo de
algumas variáveis como: (1) Dados eletroencefalográficos; (2) Registro de tônus
muscular; (3) Registro de frequência cardíaca; (3) Registro de movimentação ocular;
(4) Registro de fluxo aéreo por cânula de pressão e termístor; (5) Registro de
movimentação torácica e abdominal; (6) Oximetria de pulso; (7) Posição do corpo;
(8) Registro de ronco (Kushida et al, 2005).
Todos os exames foram estagiados manualmente seguindo as regras propostas
por Rechtschaffen e Kales, com os acréscimos sugeridos pela Academia Americana de
Medicina do Sono, através de manual publicado em 2007 (Conrad et al, 2007).
Considerou-se evento de APNEIA quando houve diminuição do fluxo aéreo
nasal ≥ 90% do basal e com duração de ≥ dez segundos. Considerou-se obstrutiva
quando acompanhada por esforço respiratório contra uma faringe ocluída; e central,
quando não houve esforço respiratório associado à apneia.
Considerou-se evento de HIPOPNEIA quando houve diminuição do fluxo
aéreo nasal ≥ 30% do basal associado à queda ≥ 4% da saturação de oxigênio, com
duração de ≥ dez segundos.
O IAH foi calculado como número total de eventos respiratórios (apneias e
hipopneias) por hora de sono (eventos/h), e foi utilizado para estabelecer a
gravidade da SAOS.
Foi também calculado o IAH referente exclusivamente ao sono não REM
(NREM).
Considerou-se diagnóstico de SAOS a presença de cinco ou mais eventos de
apneia ou hipopneia por hora de sono. Em relação à gravidade, foi considerada
SAOS leve quando ocorreram cinco a 14,9 eventos de apneia ou hipopneia/h,
moderada quando ocorreram 15 a 29,9 eventos/h, e grave quando ocorreram 30 ou
mais eventos/h (AASM, 1999).
35
Foi feita análise estatística comparando-se os grupos I, II e III em relação às
variáveis de sexo, idade, IMC, RSI, RFS e características físico-químicas do material
refluído.
As
mesmas
comparações
foram
feitas
entre
os
pacientes
que
apresentavam Refluxo Laringofaríngeo exclusivo e aqueles que apresentaram
concomitância com a forma clássica da DRGE.
Em relação aos eventos de refluxo, foram estudados sua duração, pH (ácidos,
fracamente ácidos ou não ácidos), estado físico (líquidos, gasosos ou mistos) e
fases do sono em que ocorreram. Foram ainda estudados os 60 segundos que
precederam e sucederam cada episódio de refluxo em relação à presença de
despertar, seja ele relacionado ou não a evento respiratório.
3.2.4 Análise Estatística
Foi utilizado o software SPSS (Statistical Package for Social Sciences), versão
13.0 for Windows. Para análise descritiva, foram utilizadas as medidas-resumo (média,
mediana e desvio-padrão) para as variáveis quantitativas e calculadas as frequências
absolutas e relativas para as variáveis qualitativas. Além disso, utilizaram-se gráficos do
tipo boxplot para expressar os dados. Para análise estatística, foram utilizados os testes
de Kruskal-Wallis para as seguintes variáveis: idade, IMC, IAH, RSI e seus
subdomínios, RFS e seus subdomínios e a caracterização dos refluxos proximais e
distais. Como o tamanho da amostra foi pequeno, para o estudo da variável “sexo” foi
feita somente a análise descritiva. O teste de Mann-Whitney foi utilizado para a variável
“IMC”, além do Teste de Kruskal-Wallis. A significância estatística foi considerada para
valor de p < 0,05.
4 RESULTADOS
37
4.1 Caracterização da amostra
Dos 112 pacientes selecionados com suspeita de SAOS e RLF, 39 foram
excluídos por serem tabagistas, oito por serem etilistas, um por ter antecedente de
cirurgia no esôfago, oito pacientes com diagnóstico de rinossinusite aguda, cinco
pacientes por não terem conseguido suspender a medicação em uso que facilitava a
ocorrência de refluxo, e cinco por terem IMC acima de 40 kg/m2. Assim, 46 pacientes
foram submetidos ao exame de polissonografia em concomitância com a pHimpedanciometria. Dos 46 pacientes que realizaram ambos os exames, 19 pacientes
foram ainda excluídos do protocolo, pois três deles não apresentaram critérios
polissonográficos para o diagnóstico de SAOS, 14 deles não apresentaram nenhum
episódio de refluxo, seja ele proximal ou distal, durante o período de registro da
polissonografia, e dois por terem apresentado exclusivamente episódio de refluxo
durante o sono REM.
Assim, a amostra estudada foi de 27 pacientes, sendo 14 homens (51,9%) e
13 mulheres (48,1%), com idade variando entre 31 a 65 anos (média= 51,7 anos e
DP=9,3) e IMC entre 25 a 40 kg/m2 (média=32,4 kg/m2 e DP=4,3) (Quadro 1).
O Reflux Symptom Index (RSI) variou de 14 a 43 (média=25 e DP=6,7),
sendo que 12 (44,4%) pacientes queixavam-se de disfagia e 23 (85,2%) queixavamse de globo faríngeo. O Reflux Finding Score (RFS) variou de nove a 20
(média=14,2 e DP=2,5). Vinte e seis pacientes (96,3%) apresentaram pseudossulco,
25 (92,6%), obliteração ventricular, e 20 (74,1%), edema de pregas vocais. Todos os
pacientes apresentaram edema laríngeo difuso e hipertrofia de comissura posterior.
Nenhum paciente apresentou granuloma no processo vocal. A presença de muco
endolaríngeo espesso foi vista em 22 (81,5%) pacientes (Quadro 1).
QUADRO 1: Dados Gerais (n=27)
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
21
22
23
24
25
26
27
SEXO
IDADE
IMC
M
M
M
M
F
M
F
M
F
M
F
M
F
F
M
M
M
F
M
M
F
F
F
F
F
M
F
50
65
54
42
54
50
49
58
50
64
35
34
57
60
31
61
54
55
44
40
54
52
65
54
45
61
57
33
38,3
31,7
30,6
35
30,8
27,5
30,1
30,8
29,3
35
40
39,5
28,3
31,8
32,3
37,8
25
35,5
32,8
32,3
28
30,8
36,9
27
26
40
RSI
A
4
4
5
0
0
1
5
4
0
2
4
5
2
3
0
4
4
0
4
0
1
1
2
2
0
5
0
B
4
5
4
5
5
3
5
4
5
5
3
5
3
3
5
3
2
4
5
5
5
5
5
5
5
4
3
C
5
4
5
5
0
2
5
3
5
3
3
4
1
3
5
3
0
3
3
5
5
5
2
4
5
5
3
D
0
3
0
0
0
0
4
0
5
0
4
3
2
3
0
4
0
0
0
0
5
3
0
3
0
3
0
E
0
3
1
0
5
4
5
3
5
0
0
2
4
0
0
2
0
4
0
0
1
0
0
1
2
0
1
F’
5
4
0
5
5
3
5
0
5
3
5
4
5
2
5
2
0
3
4
5
5
0
0
2
2
0
3
RFS
G
0
3
0
0
5
3
5
4
5
0
5
2
4
3
3
2
0
5
4
0
0
0
0
2
0
5
4
H
0
2
4
5
5
3
4
0
5
5
3
4
3
4
5
2
5
3
0
5
5
5
5
5
0
5
4
I
4
0
1
3
0
2
5
4
5
0
3
5
5
4
3
0
4
5
0
2
5
4
0
3
5
1
3
TT
22
28
20
23
25
21
43
22
40
18
30
34
29
25
26
22
15
27
20
22
32
23
14
27
19
28
21
A’
2
2
2
2
2
2
2
2
0
2
2
2
2
2
2
2
2
2
2
2
2
2
2
2
2
2
2
B’
2
2
4
2
2
4
2
4
4
2
4
2
2
2
2
4
4
2
4
4
2
2
2
2
0
0
2
C’
2
2
2
0
2
2
2
2
2
2
2
0
0
2
2
2
4
2
2
0
0
2
2
2
4
2
2
D’
2
2
0
0
1
1
2
0
2
2
1
1
1
3
1
1
2
2
2
1
0
0
2
0
2
0
2
E’
2
3
2
2
3
3
2
3
3
2
1
2
3
3
2
3
3
2
3
2
2
2
3
3
3
3
2
F’’
3
3
2
2
3
3
2
3
3
2
2
2
3
3
3
3
3
2
3
2
3
3
3
3
2
3
2
G’
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
H’
0
2
2
2
2
2
2
2
2
2
2
2
0
0
2
2
2
2
2
2
0
2
2
2
2
0
2
TT’
13
16
14
10
15
17
14
16
16
14
14
11
11
15
14
17
20
14
18
13
9
13
16
14
15
10
14
Notas: A: rouquidão; B: pigarro; C: excesso de muco na garganta ou secreção escorrendo do nariz para a garganta; D: dificuldade de
engolir comida, líquido ou comprimido; E: tosse após comer ou após deitar-se; F’: dificuldades respiratórias ou engasgos; G: tosse
irritante; H: sensação de algo preso na garganta; I: dor no peito, indigestão, acidez estomacal subindo para a garganta; TT: total; A’:
pseudossulco; B’: obliteração ventricular; C’: eritema; D’: edema PPVV; E’: edema laríngeo difuso; F’’: hipertrofia da comissura posterior;
G’: granuloma; H’: muco; TT’: total; F: feminino; M: masculino.
39
Dos 27 pacientes, 17 deles preencheram o critério diagnóstico de DRGE na
sua forma clássica (pacientes 1,2,3,5,6,8,11,12,14,17,18,19,20,21,22,23,27), seja
pela presença de refluxo patológico distal no exame de pH-impedanciometria
(pacientes 2,5,6,14,19,22), ou pela presença de EDA com esofagite erosiva
(pacientes 3,11,12,17,18,23 e 27), ou ambas (pacientes 1,8,20,21) (Quadro 2).
Somente um paciente apresentou refluxo não ácido patológico distal (paciente
8) e dois pacientes apresentaram refluxo não ácido patológico proximal (pacientes 4
e 12) (Quadro 2).
Não houve nenhum paciente com diagnóstico de esôfago de Barrett na EDA.
QUADRO 2: Resultados da polissonografia, pH-impedanciometria e endoscopia digestiva alta
pH-impedanciometria
PSG
REFLUXO ÁCIDO PATOLÓGICO
IAH
PROXIMAL
IAH T
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
21
22
23
24
25
26
27
11,9
75,6
37,1
89,5
25,7
92,5
6,6
23,8
18,2
38,1
15,1
69,8
28,3
7,1
88,4
14,7
22,4
9,8
5,3
29,8
9,5
5,1
9
12,7
5,9
65,7
53,2
EDA
REFLUXO NÃO ÁCIDO
PATOLÓGICO
IAH
NREM
9
75,2
33,2
90,6
17,9
95,4
6,2
23,7
16,4
38
6,8
69,5
24,8
3,3
87,3
13,9
22,2
9
2,9
30,1
7,7
2,6
7,8
6,4
3,3
68
49,1
pH<4
pH<5
N
N
N
N
N
N
N
N
N
N
N
N
N
N
N
N
N
N
N
N
S
N
N
N
N
N
N
N
N
N
N
N
N
S
N
S
S
N
N
S
N
S
S
N
N
S
N
S
N
N
S
S
S
N
DeMeester
(VR<14,7)
14,9
15,7
6,9
2,9
15,7
15,7
0,8
11,4
2
11,9
4,3
3,7
2,2
43
5,1
3,6
7,1
1
31,5
22,3
30,4
12,8
1,1
7,1
1
1,2
3
DISTAL
TT
TTO
(VR<4,5%) (VR<8,4%)
5,2
8,8
5
7,2
2,1
2,8
0,7
1,1
0,4
0,1
2,1
1,7
0
0
3,4
6,1
0,5
0,8
3,1
3,5
1,1
0,5
0,7
1,2
0,4
0,5
14
18,2
1,6
2,7
1,3
2,1
2,4
4
0,2
0,3
5
0,9
4,6
1
10,4
9
5,7
0,2
0,1
18,3
2
3,1
0,1
0,2
0,2
0,4
0,9
1,4
TTS
(VR<3,5%)
0,2
1,1
0,9
0
3,6
3,8
0
0,9
0
2,7
1,9
0,1
0,3
7,5
0,1
0,1
0
0
14,4
9,3
0,6
0
0,5
0
0
0
0
PROXIMAL
DISTAL
N
N
N
S
N
N
N
N
N
N
N
S
N
N
N
N
N
N
N
N
N
N
N
N
N
N
N
N
N
N
N
N
N
N
S
N
N
N
N
N
N
N
N
N
N
N
N
N
N
N
N
N
N
N
ESOFAGITE
EROSIVA
S
N
S
N
N
N
N
S
N
N
S
S
N
N
N
N
S
S
N
S
S
N
S
N
N
N
S
Notas: IAH T: índice de apneia e hipopneia referente à noite inteira; IAH NREM: índice de apneia e hipopneia referente ao período de sono
NREM; VR: valor de referência; TT: porcentagem do tempo total com refluxo ácido; TTO: porcentagem do tempo em posição ortostática com
refluxo ácido; TTS: porcentagem do tempo em posição supina com refluxo ácido; N: não; S: sim; DRGE: doença do refluxo gastroesofágico; RLF:
refluxo laringofaríngeo; PSG: Polissonografia.
41
Não houve diferença estatisticamente significante entre os pacientes que
apresentaram Refluxo Laringofaríngeo exclusivo e aqueles que apresentaram
concomitância com a forma clássica da DRGE em relação às variáveis sexo, idade,
IMC, RSI e RFS e características físico-químicas do material refluído.
Em relação ao exame de polissonografia, o número total de eventos
obstrutivos respiratórios analisados nos 27 pacientes foi de 4.875. O IAH variou de
5,1 a 92,5 eventos/hora (média= 32,3, DP=28,9). Onze pacientes (40,7%)
apresentaram SAOS leve, sete (25,9%) pacientes foram diagnosticados com SAOS
moderada e nove (33,3%) pacientes com SAOS grave. O IAH do sono NREM variou
de 2,6 a 90,6 eventos/hora (média= 30,8, DP=30,3).
A Fig. 2 mostra um exemplo de exame de polissonografia, onde é possível
observar os eventos obstrutivos respiratórios.
FIGURA 2: Exame de polissonografia
Fonte: Laboratório do Sono do InCor.
Nota: Fig. 2: Foto de tela de computador com o exame de polissonografia, em que se veem
dois minutos de exame. É possível identificar dois eventos de apneia obstrutiva (AO) que estão
culminando em despertar (D), associados à dessaturação da oxihemoglobina (DESSAT).
42
Todos os 27 pacientes apresentaram, pelo menos, um episódio de refluxo
durante a polissonografia, sendo que dez deles (37%) apresentaram refluxo
proximal, que variou de um único episódio a três por paciente, com média de 0,6 (DP
+ 0,9 episódios), com duração média de 72,6 segundos (DP + 67,1 segundos).
Dezessete pacientes (63%) apresentaram exclusivamente refluxo distal durante o
registro polissonográfico, que variou de um a 18 episódios por paciente, com média
de 2,9 (DP + 3,6 episódios), com duração média de 32,5 segundos (DP + 41,3
segundos).
Foram 92 episódios de refluxo no total, com duração média de 42 segundos
(DP + 61 segundos), 77 (83,7%) distais e 15 (16,3%) proximais (Anexo 6). A minoria
foi de refluxos não ácidos (12%), sendo os refluxos ácidos (46%) e fracamente
ácidos (42%) os mais frequentes. 78% dos episódios de refluxo foram líquidos e o
restante foi misto (22%). Nenhum refluxo foi exclusivamente gasoso. Quanto à fase
do sono em que ocorreram, quase 50% dos episódios de refluxo ocorreram durante
a vigília (47,8%), seguidos dos estágios N2 (42,4%), N1 (5,4%) e N3 (4,4%). Quando
estudados os 60 segundos que precederam e sucederam cada episódio de refluxo
em relação à presença do despertar, na maioria dos episódios de refluxo o paciente
já estava em vigília (47,8%) e em 25% não houve despertar nesse período. Em
18,5% houve despertar relacionado ao evento respiratório nos 60 segundos que
precederam o refluxo, e em 20,7% houve despertar relacionado a evento respiratório
nos 60 segundos após o refluxo. Em 8,7% houve despertar sem relação com evento
respiratório nos 60 segundos que precederam o refluxo e em 6,2% houve despertar
sem relação com evento respiratório nos 60 segundos após o refluxo.
A Fig. 3 mostra um exemplo de refluxo não ácido visto no exame de pHimpedanciometria.
43
FIGURA 3: Traçado de exame de pH-impedanciometria com um exemplo de episódio de
refluxo não ácido distal e misto
Fonte: Laboratório para Investigação em Motilidade Digestiva do Hospital das Clínicas da Faculdade
de Medicina da USP.
Nota: Fig.3: Seta larga: valor de pH inferior a quatro, caracterizando refluxo não ácido. Setas finas:
aumento súbito na impedância seguida de queda, caracterizando refluxo misto. Esta mudança na
impedância só atinge os sensores distais, por isto é considerada como refluxo distal.
Dividindo os episódios de refluxo em dois grupos, proximais (n=15) e distais
(n=77), observa-se que no grupo de pacientes com refluxo proximal houve
predomínio dos refluxos ácidos (10/15, 67%), enquanto no grupo de pacientes com
refluxo distal houve predomínio dos não ácidos e fracamente ácidos (45/77, 58,4%).
Em ambos os grupos, os refluxos líquidos foram os mais frequentes. Foi na vigília
que ocorreu a maioria dos refluxos proximais (10/15, 67%), enquanto N2 foi o
estágio do sono em que ocorreu a maioria dos refluxos distais (35/77, 45,4%),
seguido da vigília (34/77, 44,2%) (Anexo 6).
4.2 Associação temporal entre refluxo e eventos obstrutivos respiratórios
Em todos os pacientes foi feita análise dos 15 minutos que precederam e
sucederam os episódios de refluxo, mas somente em 14 pacientes (pacientes
5,7,10,12,13,14,16,17,18,21,22,23,25,27) foi possível estender a análise para 30 e
44
45 minutos. Nos demais pacientes ocorreu sobreposição de eventos de refluxo
nessa faixa estendida de tempo, invalidando a análise.
Foram também feitas comparações entre o IAH do sono NREM e o IAH obtido
nos 15, 30 e 45 minutos que antecederam e sucederam o(s) episódio(s) de refluxo, e
não houve mudança na alocação dos pacientes nos três grupos; por isto, a
comparação foi feita com o IAH referente à noite inteira.
O Anexo 7 detalha todos os IAH de cada período de 15, 30 e 45 minutos que
antecederam e sucederam cada episódio de refluxo, em números absolutos.
Sete pacientes (25,9%, pacientes 14,15,16,20,23,24 e 25) apresentaram IAH
dos período(s) antecedendo o(s) episódio(s) de refluxo maior que o IAH referente à
noite inteira, caracterizando o GRUPO I (Quadro 3).
QUADRO 3: Pacientes cujo IAH referente aos períodos precedendo o(s) episódio(s) de
refluxo foi maior que o IAH da noite inteira (GRUPO I)
Pré-refluxo (média)
Paciente
IAH total
Pós-refluxo (média)
15 min*
30 min*
45 min*
15 min*
30 min*
45 min*
14
7,1
+12,7%
-43,7%
-62,0%
-100,0%
-71,8%
-81,7%
15
88,4
+24,4%
-
-
+27,8%
-
-
16
14,7
-45,6%
+42,9%
+27,2%
-100,0%
-93,2%
-81,6%
20
29,8
+38,6%
-
-
-46,3%
-
-
23
9
+122,2%
+344,4%
+240,0%
-100,0%
-100,0%
-85,6%
24
12,7
+41,7%
-
-
-37,0%
-
-
25
5,9
+171,2%
+205,1%
+103,4%
-100,0%
-100,0%
-100,0%
Notas: IAH: índice de apneia e hipopneia; min: minutos. *: Porcentagem de aumento (+) ou
diminuição (-) do IAH do período estudado em comparação com o IAH referente à noite inteira.
Quatro pacientes (14,8%, pacientes 12,13,21 e 27) apresentaram IAH dos
período(s) sucedendo o(s) episódio(s) de refluxo maior que o IAH referente à noite
inteira, os quais foram denominados de GRUPO II (Quadro 4).
45
QUADRO 4: Pacientes cujo IAH referente aos períodos sucedendo o(s) episódio(s) de
refluxo foi maior que o IAH da noite inteira (GRUPO II)
Pré-refluxo (média)
Pós-refluxo (média)
Paciente
IAH total
15 min*
30 min*
45 min*
15 min*
30 min*
45 min*
12
+69,8
-54,2%
-28,4%
-40,8%
+8,9%
-2,6%
-10,2%
13
+28,3
-1,1%
-43,5%
-62,5%
+27,2%
-1,1%
+13,1%
21
+9,5
-100,0%
-100,0%
-57,9%
+110,5%
+26,3%
+53,7%
27
+53,2
+20,3%
-39,8%
-60,0%
+88,0%
+24,1%
-4,9%
Notas: IAH: índice de apneia e hipopneia; min: minutos. *: Porcentagem de aumento (+) ou
diminuição (-) do IAH do período estudado em comparação com o IAH referente à noite inteira.
Dezesseis pacientes (59,3%, pacientes 1-11, 17-19, 22,26) apresentaram IAH
dos períodos antecedendo e sucedendo o(s) episódio(s) de refluxo, menor ou igual
ao IAH referente à noite inteira, chamados de GRUPO III (Quadro 5).
QUADRO 5: Pacientes cujo IAH referente aos períodos antecedendo e sucedendo o(s)
episódio(s) de refluxo foi menor que o IAH da noite inteira (GRUPO III)
Pré-refluxo (média)
Pós-refluxo (média)
Paciente
IAH total
15 min*
30 min*
45 min*
15 min*
30 min*
45 min*
1
11,9
-66,4%
-
-
-58,0%
-
-
2
75,6
-25,1%
-
-
-18,4%
-
-
3
37,1
-67,7%
-
-
-40,7%
-
-
4
89,5
-97,0%
-
-
-38,9%
-
-
5
25,7
-100,0%
-100,0%
-100,0%
-100,0%
-96,1%
-97,3%
6
92,5
-70,2%
-
-
-50,9%
-
-
7
6,6
-100,0%
-100,0%
-100,0%
-100,0%
-100,0%
-80,3%
8
23,8
-42,0%
-
-
-42,0%
-
-
9
18,2
-100,0%
-
-
-100,0%
-
-
10
38,1
-89,5%
-75,6%
-73,2%
-19,4%
-19,4%
-37,3%
11
15,1
-91,4%
-
-
-55,6%
-
-
17
22,4
-55,4%
-73,2%
-64,3%
-46,4%
-64,3%
-70,1%
18
9,8
-100,0%
-100,0%
-86,7%
-100,0%
-79,6%
-73,5%
19
5,3
-43,4%
-
-
-81,1%
-
-
22
5,1
-21,6%
-60,8%
-74,5%
-100,0%
-21,6%
-47,1%
26
65,7
-17,8%
-
-
-2,6%
-
-
Notas: IAH: índice de apneia e hipopneia; min: minutos. *: Porcentagem de aumento (+) ou
diminuição (-) do IAH do período estudado em comparação com o IAH referente à noite inteira.
Em dois pacientes (pacientes 15 e 27), tanto o IAH do período antecedendo
como aquele sucedendo o(s) episódio(s) de refluxo foram maiores do que o IAH
referente à noite inteira. O paciente 15 foi alocado no grupo I, pois o aumento
46
iniciou-se antes do(s) refluxo(s) e permaneceu semelhante após o(s) refluxo(s)
(27,8% e 24,4%), enquanto o paciente 27 foi alocado no grupo II, pois o IAH do
período que sucedeu o(s) episódio(s) de refluxo foi mais que o dobro do que o IAH
do período(s) que antecedeu o(s) episódio(s) de refluxo (88% e 20,3%,
respectivamente).
Exceto um paciente do grupo I (paciente 15), que apresentou refluxo proximal
noturno, todos os outros pacientes do grupo I apresentaram exclusivamente refluxo
distal noturno. Já quanto aos pacientes do grupo II, metade deles apresentou
refluxos proximais noturnos (pacientes 12 e 13) e metade, refluxos distais noturnos
(pacientes 21 e 27). No grupo III, nove pacientes (pacientes 2,3,5,7,9,11,17,18 e 26)
apresentaram exclusivamente refluxos distais noturnos, enquanto sete (pacientes
1,4,6,8,10, 19 e 22) apresentaram refluxo proximal noturno.
Em relação à distribuição dos pacientes com diagnóstico da DRGE na sua
forma clássica, confirmado em 17 pacientes, três pacientes pertenciam ao grupo I
(pacientes 14, 20 e 23), três pacientes faziam parte de grupo II (pacientes 12, 21 e
27) e 11 pertenciam ao grupo III (pacientes 1,2,3,5,6,8,11,17-19 e 22). Assim, a
maioria dos pacientes com diagnóstico de DRGE na sua forma clássica fazia parte
do grupo III, enquanto os pacientes com RLF exclusivo foram distribuídos de forma
mais homogênea entre os grupos I, II e III.
A caracterização de cada um dos grupos I, II e III pode ser vista nas Tabelas
1, 2 e 3.
A única diferença significativa encontrada entre os três grupos foi em relação
ao IMC, sendo o IMC mais elevado no grupo II em comparação com os outros dois
grupos (Teste Kruskal-Wallis e Teste de Mann-Whitney, p= 0,037).
TABELA 1: Médias, medianas e desvios-padrão das variáveis nos grupos I, II e III
Média
Grupo I
Grupo II
Grupo III
(n=7)
(n=4)
(n=16)
Mediana
DP
Média
Mediana
DP
Média
Mediana
p
DP
Idade (anos)
50,9
54
12,5
50,5
55,5
11,1
52,3
53
7,8
0,998*
IMC
31,4
31,8
3,2
37,9
39,7
3,8
31,5
30,8
3,9
0,037**
IAH
23,9
12,7
29,5
40,2
40,7
26,6
33,9
23,1
30,2
0,463*
RSI
22,1
22
4,5
29
30,5
5,7
25,3
23
7,5
0,220*
Disfagia
1,4
0
1,8
2,5
2,5
2,1
1,4
0
1,9
0,570*
Globo
3,7
5
2
4
4
0,8
3,4
4
1,93
0,864*
14,8
15
1,4
11,3
11
2,1
14,6
14
2,6
0,063*
-
-
-
-
-
-
1,9
2
0,5
0,709*
Obliteração ventricular
2,3
2
1,4
-
-
-
2,8
2
1,2
0,385*
Edema pregas vocais
1,4
1
1
1
1
0,8
1,2
1,5
0,9
0,772*
Edema difuso laríngeo
2,7
3
0,5
2,3
2
0,5
2,4
2,5
0,6
0,361*
Hipertrofia comissura posterior
2,7
3
0,5
2,5
2,5
0,6
2,6
3
0,5
0,784*
-
-
-
-
-
-
-
-
-
>0,999*
1,7
2
0,8
1
1
1,2
1,8
2
0,7
0,225*
RFS
Pseudossulco
Granuloma
Muco
Notas: IMC: índice de massa corpórea; IAH: índice de apneia e hipopneia; RSI: índice de sintomas de refluxo; RFS: Escala de Achados Videolaringoscópicos
de Refluxo; DP: desvio-padrão. *: Teste de Kruskal Wallis; **: Teste de Kruskal Wallis e teste de Mann-Whitney.
TABELA 2: Médias, medianas e desvios-padrão das variáveis nos grupos I, II e III – Referente aos refluxos distais
Média
Duração
Grupo I (n=7)
Mediana
DP
Grupo II (n=4)
Média Mediana
DP
Grupo III (n=16)
Média Mediana
DP
p
16,1
13
11,9
22,5
22,5
20,5
41,4
29
49,8
0,245*
1
1
1
0,5
0,5
0,7
1,6
1
2,9
0,840*
Fracamente ácidos
1,4
1
1,3
0,5
0,5
0,7
1,5
1
1,9
0,630*
Não ácidos
0,1
0
0,4
-
-
-
0,7
0
1,9
0,861*
Líquido
Ácidos
1,6
1
1,8
-
-
-
3,2
2
3,7
0,220*
Mistos
1
1
0,6
-
-
-
0,6
0
1,1
0,067*
Gasosos
-
-
-
-
-
-
-
-
-
>0,999*
V
0,9
1
0,9
0,5
0,5
0,7
1,8
1
2,9
0,501*
N1
0,1
0
0,4
-
-
-
0,2
0
0,4
0,769*
N2
1,6
1
1,9
0,5
0,5
0,7
1,5
1
2
0,846*
N3
-
-
-
-
-
-
0,3
0
0,5
0,252*
ER a (60’’)
0,6
0
1,1
0,5
0,5
0,7
0,7
0
1,4
0,836*
SER a (60’’)
0,3
0
0,8
-
-
-
0,3
0
0,8
0,860*
V a (60’’)
0,9
1
0,9
0,5
0,5
0,7
1,8
1
2,9
0,501*
O a (60’’)
0,9
0
1,2
-
-
-
1,1
1
1,4
0,424*
ER d (60’’)
0,7
0
1,1
0,5
0,5
0,7
0,7
0
1,2
0,929*
SER d (60’’)
0,6
0
1,5
-
-
-
0,1
0
0,3
0,733*
V d (60’’)
0,9
1
0,9
0,5
0,5
0,7
1,8
1
2,9
0,501*
O d (60’’)
0,4
0
0,5
-
-
-
1,3
1
1,9
0,308*
Notas: V: acordado; N1: estágio 1 do sono não REM; N2: estágio 2 do sono não REM; N3: estágio 3 do sono não REM; V a: acordado nos 60’’estudados
precedendo o episódio de refluxo; V d: acordado nos 60’’estudados sucedendo o episódio de refluxo; O a: não houve despertares nos 60’’estudados
precedendo o episódio de refluxo; O d: não houve despertares nos 60’’estudados sucedendo o episódio de refluxo; ER a: despertar associado a evento
respiratório nos 60’’estudados precedendo o episódio de refluxo; ER d: despertar associado a evento respiratório nos 60’’estudados sucedendo o episódio de
refluxo; SER a: despertar não associado a evento respiratório nos 60’’estudados precedendo o episódio de refluxo; SER d: despertar não associado a evento
respiratório nos 60’’estudados sucedendo o episódio de refluxo; DP: desvio-padrão; *: Teste de Kruskal Wallis.
TABELA 3: Médias, medianas e desvios-padrão das variáveis nos grupos I, II e III – Referente aos refluxos proximais
Grupo I (n=7)
Grupo II (n=4)
Média
Mediana
DP
Média
Duração
-
-
-
72
Ácidos
-
-
-
Fracamente ácidos
-
-
-
Não ácidos
-
-
Líquidos
-
Mistos
Mediana
Grupo III (n=16)
p
DP
Média
Mediana
DP
72
25,5
75,7
47
81,1
-
0,5
0,5
0,7
1,3
1
1,1
-
0,5
0,5
0,7
0,4
0
0,5
-
-
-
-
-
-
-
-
-
-
-
0,5
0,5
0,7
1,4
1
1,1
-
-
-
-
0,5
0,5
0,7
0,3
0
0,5
-
Gasosos
-
-
-
-
-
-
-
-
-
-
V
-
-
-
0,5
0,5
0,7
1,3
1
0,5
-
N1
-
-
-
-
-
-
0,1
0
0,4
-
N2
-
-
-
0,5
0,5
0,7
0,3
0
0,5
-
N3
-
-
-
-
-
-
-
-
-
-
ER a (60’’)
-
-
-
-
-
-
0,1
0
0,4
-
SER a (60’’)
-
-
-
-
-
-
0,3
0
0,5
-
V a (60’’)
-
-
-
0,5
0,5
0,7
1,3
1
0,5
-
O a (60’’)
-
-
-
0,5
0,5
0,7
-
-
-
-
ER d (60’’)
-
-
-
0,5
0,5
0,7
0,2
0
0,4
-
SER d (60’’)
-
-
-
-
-
-
0,2
0
0,4
-
V d (60’’)
-
-
-
0,5
0,5
0,7
1,3
1
0,5
-
O d (60’’)
-
-
-
-
-
-
0,2
0
0,4
-
Notas: V: acordado; N1: estágio 1 do sono não REM; N2: estágio 2 do sono não REM; N3: estágio 3 do sono não REM; V a: acordado nos 60’’estudados
precedendo o episódio de refluxo; V d: acordado nos 60’’estudados sucedendo o episódio de refluxo; O a: não houve despertares nos 60’’estudados
precedendo o episódio de refluxo; O d: não houve despertares nos 60’’estudados sucedendo o episódio de refluxo; ER a: despertar associado a evento
respiratório nos 60’’estudados precedendo o episódio de refluxo; ER d: despertar associado a evento respiratório nos 60’’estudados sucedendo o episódio de
refluxo; SER a: despertar não associado a evento respiratório nos 60’’estudados precedendo o episódio de refluxo; SER d: despertar não associado a evento
respiratório nos 60’’estudados sucedendo o episódio de refluxo; DP: desvio-padrão.
5 DISCUSSÃO
51
A relação temporal dos eventos de refluxo e eventos obstrutivos respiratórios
foi o enfoque principal deste estudo, com duas hipóteses principais, não excludentes
entre si: maior concentração de eventos obstrutivos respiratórios sucedendo
episódios de refluxo, e o inverso, ou seja, maior concentração de apneias e
hipopneias precedendo episódios de refluxo.
Assim, a primeira hipótese deste estudo foi verificar se o refluxo é um fator
que aumenta a frequência de hipopneias e apneias, ou melhor, se após um episódio
de refluxo ocorre maior concentração de eventos obstrutivos respiratórios. Isto se
apoia em duas teorias descritas na literatura (Nguyen et al, 2005; Payne et al, 2006;
Eskiizmir, Kezirian, 2009): o refluxo leva à inflamação na laringe com edema e
consequente estreitamento da luz, além de déficits sensoriais nos receptores das
mucosas faríngea e laríngea pelo material refluído.
No presente estudo, somente quatro pacientes (14,8%) apresentaram maior
concentração dos eventos obstrutivos respiratórios no período de até 45 minutos
após evento de refluxo, em comparação com o IAH referente à noite inteira. A
pequena casuística deste grupo dificultou estabelecer associações com as variáveis
demográficas.
No
entanto,
este
grupo
de
pacientes
apresentou
IMC
significativamente maior que o restante da população estudada, o que pode ter sido
fator colaborador para este resultado, uma vez que a obesidade é fator de risco
tanto para SAOS como para DRGE/RLF (Peppard, 2000a). Além disso, três dos
quatro pacientes deste grupo apresentaram refluxo patológico proximal à pHimpedanciometria, o que sugere associação não só com a obesidade, mas com
dano direto às mucosas da laringe e da faringe causado pelo material refluído.
Por outro lado, as alterações inflamatórias causadas pelo refluxo podem não
ser imediatas, a saber, possivelmente haja uma janela maior do que aquela utilizada
neste estudo (máxima de 45 minutos) para que as alterações inflamatórias causadas
pelo conteúdo gastroduodenal refluído se instalem. Pode ser que o efeito do refluxo
seja algo gradual que se reflita nas horas ou até dias subsequentes e, por isto, não
tenha sido possível estabelecer relação temporal neste estudo. Idealmente seria
interessante terem sido feitos cortes não somente em 15, 30 e 45 minutos
precedendo e sucedendo cada episódio de refluxo, mas sim cortes em uma, duas ou
três horas. No entanto, isto foi inviável, pois haveria sobreposição de eventos de
refluxo, o que prejudicaria a análise correta dos dados. Por outro lado, a inflamação
52
frequentemente encontrada na laringe dos pacientes com SAOS, bem como o déficit
sensorial podem ter sido causados não somente por refluxo. Os pacientes apneicos
podem ter apresentado reações inflamatórias na laringe pelo próprio trauma
intermitente mecânico, secundário à vibração causada pelo ronco, e ainda pela força
de sucção que ocorre com os eventos de hipopneias e apneias (Boyd et al, 2004).
Ademais, o próprio mecanismo de hipóxia e reoxigenação que ocorre a cada evento
obstrutivo de via aérea pode gerar radicais livres e stress oxidativo e,
consequentemente, inflamação laríngea (Boyd et al, 2004).
Exceto no estudo de Kerr et al (1992), em que os autores analisaram
episódios de refluxo dez minutos antes e após a ocorrência de cada um, não há na
literatura outros estudos nos quais se determine o período de estudo antecedendo e
sucedendo cada episódio de refluxo para a análise de eventos obstrutivos
respiratórios, e todos são baseados na concomitância dos eventos.
Como citado anteriormente, o objetivo aqui foi estudar esta associação de
uma forma linear ao longo do tempo, e não simplesmente a concomitância de
eventos, por isso determinaram-se aleatoriamente os períodos de 15, 30 e 45
minutos. Períodos maiores ainda seria interessante que fossem analisados, porém,
devido à sobreposição de episódios de refluxo não foi possível estudar períodos
mais prolongados. Mesmo tendo sido determinado o período máximo de estudo de
45 minutos, não foi possível analisar esse período em todos os pacientes pelo
mesmo motivo supracitado: sobreposição de episódios de refluxo.
A segunda hipótese deste estudo consiste na via contrária da supracitada:
episódios obstrutivos respiratórios levariam a eventos de refluxo, vale dizer, no
período anterior ao refluxo haveria maior concentração de apneia e hipopneia. Esta
teoria foi verificada por Kerr et al (1992) em cinco pacientes, nos quais foi
demonstrada uma associação temporal entre evento obstrutivo respiratório e refluxo,
porém sem significância estatística. Vários outros estudos também sugeriram tal
associação, sem conseguirem estabelecer uma temporalidade entre os eventos
(Tardif et al, 1988; Graf et al, 1995; Penzel et al, 1999; Ing et al, 2000; Berg et al,
2004; Kuribayashi et al, 2010a).
No atual estudo, sete pacientes (25,9% – grupo I) apresentaram maior
concentração de eventos obstrutivos respiratórios no período que precedeu o(s)
episódio(s) de refluxo, em comparação com o IAH referente à noite inteira. Foram
53
aplicados testes estatísticos e não foi encontrado nenhum fator diferenciador neste
grupo de pacientes em relação aos demais grupos.
Quase 60% dos pacientes estudados (59,3% – grupo III) não apresentaram
nenhuma associação temporal entre evento obstrutivo respiratório e episódio de
refluxo durante o período de monitorização (quer sucedendo, quer precedendo). Isto
pode ter sido consequência do estágio de sono no qual ocorreram os eventos de
refluxo: no presente estudo, a maior parte dos episódios de refluxo (47,8%) ocorreu
durante a vigília. Alguns estudos (Tardif et al, 1988; Penzel et al, 1999) também
encontraram maior prevalência dos episódios de refluxo durante a vigília, contudo
outro estudo observou maior número de episódios de refluxo no estágio N2 do sono
NREM (Oztürk et al, 2004). No presente estudo, a maioria dos refluxos proximais
ocorreu na vigília, enquanto a maioria dos refluxos distais ocorreu durante a fase N2
do sono NREM.
Este estudo é o único de que se tem conhecimento na literatura ocidental que
analisou de forma sistemática e detalhada o período de até 45 minutos antecedendo
e sucedendo os refluxos noturnos. Na revisão sistemática da literatura realizada por
Karkos et al (2009) não se mostrou nenhum estudo controlado ou meta-análise
sobre a possível associação temporal entre DRGE/RLF e SAOS. Todos os trabalhos
encontrados são baseados em baixo nível de evidência com estudos não
controlados e relatos de casos (Tardif et al, 1988; Kerr et al, 1992; Graf et al, 1995;
Penzel et al, 1999; Berg et al, 2004; Oztürk et al, 2004).
Apenas cinco trabalhos tentaram estabelecer uma associação temporal entre
SAOS e DRGE (Tardif et al, 1988; Kerr et al, 1992; Penzel et al, 1999; Ing et al,
2000; Berg et al, 2004) e quatro entre SAOS e RLF (Graf et al, 1995; Oztürk et al,
2004; Kuribayashi et al, 2010a; Suzuki et al, 2010). Estes estudos são baseados em
pequenas casuísticas e apresentam alguns vieses, como não exclusão de outras
causas de laringofaringite crônica (por exemplo, tabagismo e etilismo) (Kerr et al,
1992; Graf et al, 1995; Penzel et al, 1999; Ing et al, 2000; Berg et al, 2004; Oztürk et
al, 2004; Suzuki et al, 2010; Kuribayashi et al, 2010a), utilização de métodos
diferentes para o diagnóstico de RLF– pH-metria de dois canais (Graf et al, 1995;
Oztürk et al, 2004; Suzuki et al, 2010) ou pH-impedanciometria (Kuribayashi et al,
2010a), além de diferentes critérios para diagnóstico de SAOS (Graf et al, 1995;
Berg et al, 2004).
54
Neste estudo houve o cuidado de estabelecer critérios de exclusão bastante
rígidos, a fim de minimizar outras causas possíveis de laringite crônica, como o
etilismo e o tabagismo (Eckley et al, 2004). Além disso, foram utilizados em todos os
pacientes critérios consagrados na literatura para o diagnóstico tanto de SAOS
(Johns, 1991; AASM, 1999; Netzer et al, 1999; Kushida et al, 2005) como de DRGE
e RLF (Koufman, 1991; Eckley et al, 1999; Belafsky et al, 2001; Belafsky et al, 2002;
Mahieu, Smit, 2006; Wise, Murray, 2007; Zerbib, Stoll, 2010; Lee et al, 2010;
Moraes-Filho et al, 2010; Hoppo et al, 2012; De Bortoli et al, 2012). Daí explica-se o
porquê de se ter iniciado o trabalho com 112 pacientes em potencial e de se ter
conseguido incluir somente 27 deles no atual protocolo.
A maioria dos trabalhos em que se propôs o estudo da associação temporal
entre refluxo e apneia tem metodologia baseada na concomitância de eventos, sem
deixar explícito o tempo analisado antes e após cada evento de refluxo (Penzel et al,
1999; Ing et al, 2000; Berg et al, 2004; Oztürk et al, 2004). A concomitância dos
eventos de refluxo e apneia pode não significar relação de causa e efeito, mas
provavelmente estaria correlacionada à presença de laringoespasmo desencadeada
pelo refluxo (Hobaika, Lorentz, 2009).
Neste estudo, a minoria dos eventos obstrutivos respiratórios foi relacionada a
eventos de refluxo (4.875 eventos obstrutivos respiratórios e somente 92 episódios
de refluxo). Alguns artigos (Tardif et al, 1988; Graf et al, 1995; Penzel et al, 1999; Ing
et al, 2000; Berg et al, 2004; Oztürk et al, 2004) encontraram resultados
semelhantes, com a conclusão de que não houve associação temporal entre ambas
as doenças, DRGE/RLF e SAOS.
Se o refluxo para o esôfago fosse determinado exclusivamente pelo aumento
da diferença de pressão transdiafragmática secundária, a diminuição da pressão
intraesofágica que, por sua vez, é secundária ao evento de apneia/hipopneia, seria
esperado que a maior parte dos eventos obstrutivos respiratórios fosse seguida de
refluxo. Entretanto, no presente estudo, o achado foi de 53 vezes mais apneia e
hipopneia do que de refluxo. Isto reforça a hipótese defendida por Kuribayashi et al
(2010a) de que, a partir da análise do tônus dos esfíncteres superior e inferior do
esôfago durante episódios de apneia, verifica-se aumento do tônus em ambos os
esfíncteres, prevenindo o refluxo. Berg et al (2004) também observaram que não
houve associação direta entre diminuição da pressão intraesofágica secundária ao
55
evento de apneia e acidificação do esôfago por refluxo. Especula-se que possa ter
um valor-limite de diminuição de pressão intraesofágica que possa desencadear
refluxo (Oztürk et al, 2004), ou então doença de base no EEI/EES que permita a
ocorrência de refluxo (Berg et al, 2004). Não foi possível estabelecer tal inferência no
atual estudo, uma vez que não foram feitas mensurações manométricas
concomitantes à polissonografia.
No estudo de Kerr et al (1992), apesar de não terem observado relação
temporal clara entre refluxo e apneia, eles acreditam que os despertares
secundários aos eventos obstrutivos respiratórios possam desencadear refluxo por
intermédio da alteração de tônus do EEI. Os resultados do presente estudo não
corroboram esta hipótese, pois o número de eventos obstrutivos respiratórios (n=
4.875) e, consequentemente, de despertares é muito superior ao número de
episódios de refluxo (n= 92), concluindo-se mais uma vez que apenas a minoria dos
episódios de apneia e hipopneia foi sucedida por refluxo.
Outros pontos também merecem discussão neste estudo, que serão
abordados a seguir.
Os pacientes com IMC acima de 40 kg/m2 foram excluídos do estudo, pois é
sabido que pacientes com esses valores de IMC têm alta prevalência de
comorbidades associadas à própria obesidade, dentre elas a DRGE (Hampel et al,
2005; Wang et al, 2008), sendo considerados uma população à parte. Inicialmente,
foi pensado sobre a possível exclusão de pacientes com IMC acima de 30 kg/m2,
mas isto traria um viés à pesquisa, porque consequentemente se teria uma
população de pacientes talvez com SAOS mais leve, e não distribuídos de forma
homogênea de acordo com a gravidade da SAOS.
A exclusão dos episódios de refluxo que ocorreram no sono REM objetivou
evitar possível viés na contagem dos eventos obstrutivos respiratórios, pois o próprio
sono REM, por si só, pode levar a aumento das hipopneias e apneias, decorrente da
atonia muscular característica desta fase do sono (Eiseman et al, 2012). Novamente
para evitar outro possível viés, também se calculou o IAH do sono NREM, ou seja,
sem a fase REM do sono, que se comparou ao IAH referente à noite inteira. Como
os valores de IAH referente à noite inteira e IAH do sono NREM foram muito
semelhantes, não afetaram a alocação dos pacientes nos três grupos de estudo,
optando-se assim por usar o IAH referente à noite inteira para as comparações.
56
Pelo fato de que os sinais inflamatórios laríngeos e faríngeos sugestivos de
refluxo podem ser comuns a outras doenças ou processos irritativos exógenos, os
critérios de exclusão adotados foram extremamente rígidos. Tabagismo e etilismo,
por exemplo, causam processo inflamatório na mucosa respiratória, podendo
mimetizar as alterações encontradas no RLF. Dos 112 pacientes iniciais, 66
pacientes foram excluídos e, assim, somente 46 pacientes puderam ser submetidos
aos exames de polissonografia e pH-impedanciometria concomitantes. Acredita-se
que a inclusão de pacientes nos quais os achados laríngeos sugestivos de refluxo
não pudessem ser atribuídos a outras causas além do próprio refluxo permitiu que o
diagnóstico laringoscópico de RLF fosse bastante confiável, permanecendo apenas
duas causas possíveis da inflamação laríngea: o próprio refluxo e/ou a agressão
mecânica causada pelo ato de roncar.
Considera-se como valor de corte para diagnóstico de refluxo patológico
proximal a presença de qualquer episódio de queda do pH abaixo ou igual a cinco,
independentemente de sua duração. Koufman (1991) demonstrou que não é a
acidez unicamente responsável pelo dano tecidual na laringe e sim a pepsina, a qual
ainda apresenta 70% de sua atividade em pH de 4,5 e 40% em pH de cinco. Dois
estudos demonstraram que lesões decorrentes da exposição à pepsina no epitélio
esofágico podem ocorrer em pH < quatro, enquanto no epitélio laríngeo, em pH <
cinco (Johnston et al, 2007). Koufman (1991) ainda demonstrou que parece provocar
mais danos ao epitélio laríngeo a exposição mais prolongada de pepsina em pH não
ácido do que a exposição mais curta de pepsina em pH menores. No presente
estudo, se fosse utilizado o valor de corte de pH menor ou igual a quatro, haveria
somente um paciente (paciente 21) com diagnóstico de refluxo patológico proximal,
ao invés de 13 constatados. Desta forma, é possível perceber o incremento na
sensibilidade diagnóstica da pH-impedanciometria ao se adotar o valor de corte para
o sensor proximal em pH menor ou igual a cinco.
A pH-impedanciometria confirmou a presença de refluxo patológico distal em
10/27 (37%) pacientes e de refluxo patológico proximal em 13/27 (48%) pacientes. De
Bortoli et al (2012) confirmaram o diagnóstico de DRGE pela pH-impedanciometria em
menos de 40% dos pacientes com achados clínicos e laringoscópicos sugestivos de
RLF, achado este concordante com o encontrado no presente estudo (37%). A
sensibilidade diagnóstica dos exames de monitorização prolongada do esôfago, quer a
57
pH-metria de dois canais isolada ou a pH-impedanciometria, é sabidamente baixa
(Mahieu, Smit, 2006; Wise, Murray, 2007; De Bortoli et al, 2012), variando de 40 a 80%.
Alguns estudos na literatura sugerem que os refluxos proximais sejam menos
ácidos e mais gasosos que os refluxos distais (Kawamura et al, 2004; Oelschlager et
al, 2006; Johnston et al, 2007; De Bortoli et al, 2012). Já no presente estudo, não foi
observada preponderância dos refluxos não ácidos ou fracamente ácidos nos
refluxos proximais: a maioria dos refluxos proximais foi ácida (66,7%). Também não
foram observados refluxos gasosos no presente estudo nem nos refluxos proximais
nem nos distais, sendo os refluxos puramente líquidos os mais prevalentes em
ambos os grupos. Porém, alguns autores na literatura encontraram resultados
discrepantes em relação ao presente estudo, nos quais que os refluxos proximais
foram mais gasosos e menos ácidos que os refluxos distais (Kawamura et al, 2004;
Oelschlager et al, 2006; Johnston et al, 2007).
No período de registro noturno (pH-impedanciometria concomitante com
polissonografia) foi possível observar a predominância dos episódios de refluxos
distais em relação aos episódios de refluxo proximais no grupo I, sugerindo uma
tendência de que a concentração elevada de eventos obstrutivos respiratórios culmine
em refluxos do tipo distais, como foi sugerido por alguns autores como Penzel et al
(1999), Ing et al (2000), Berg et al (2004) e Oztürk et al (2004). Já nos grupos II e III,
os episódios de refluxo proximais e distais distribuíram-se de forma mais homogênea.
Não existe consenso na literatura entre a gravidade da SAOS e do RLF.
Somente Payne et al (2006) encontraram associação significativa entre a gravidade
dos sinais inflamatórios laríngeos visualizados por laringoscopia e a gravidade da
SAOS em 29 pacientes com SAOS. Mas outros autores (Tardif et al, 1988; Graf et al,
1995; Berg et al, 2004) não observaram tal achado. No presente estudo não foi
observada associação entre maior gravidade da SAOS com maiores valores nas
escalas de sintomas e sinais inflamatórios da laringe e da faringe (RSI e RFS) (Teste
de Kruskal Wallis, p= 0,525 e 0,815, respectivamente), tampouco nas associações
temporais.
Neste estudo pôde-se observar uma associação temporal entre episódios de
refluxo e eventos obstrutivos respiratórios em 40,7% dos pacientes, sendo que em
14,8% deles (Grupo II), os episódios de refluxo precederam o aumento da
concentração de eventos obstrutivos respiratórios, e em 25,9% deles (Grupo I), a
58
maior concentração de eventos obstrutivos respiratórios precedeu os episódios de
refluxo. No entanto, a pequena casuística destes grupos não permitiu identificar
eventuais fatores determinantes destas associações. Foi somente observado IMC
mais elevado nos pacientes cujos episódios de refluxo precederam a maior
concentração de eventos obstrutivos respiratórios (Grupo II).
Para concluir, estudos com populações maiores são necessários para melhor
conhecimento destas possíveis relações temporais a fim de auxiliar no diagnóstico e
tratamento precoce da DRGE/RLF em pacientes com SAOS, evitando-se o
agravamento das manifestações clínicas destas doenças e minimizando seu forte
impacto socioeconômico.
6 CONCLUSÕES
60
1) Houve associação temporal entre eventos obstrutivos respiratórios e
episódios de refluxo em 40,7% dos pacientes estudados, sendo:
-
14,8% com IAH sucedendo ao episódio de refluxo maior que o IAH
referente à noite inteira.
-
25,9% com IAH precedendo o episódio de refluxo maior que o IAH
referente à noite inteira.
2) O IMC foi estatisticamente maior no grupo II, no qual o IAH referente ao
período após o episódio de refluxo foi maior que o IAH referente à noite
inteira. Não houve diferença estatisticamente significante entre os grupos I,
II e III em relação às demais variáveis estudadas (sexo, idade, RSI, RFS e
características físico-químicas do material refluído).
7 ANEXOS
62
ANEXO 1
Reflux Finding Score (RFS)
Pseudosulco
2 pontos
Obliteração ventricular
Parcial – 2
Completa – 4
Eritema
Aritenóides apenas – 2
Difuso – 4
Edema PPVV
Leve – 1
Moderado – 2
Grave – 3
Polipóide – 4
Edema laríngeo difuso
Leve – 1
Moderado – 2
Grave – 3
Polipóide – 4
Hipertrofia de comissura posterior
Leve – 1
Moderado – 2
Grave – 3
Polipóide – 4
Granuloma
Presente – 2
Muco
Presente – 2
Fonte: Belafsky et al, 2001; Prado et al, 2013.
63
ANEXO 2
Reflux Symptom Index (RSI)
0= SEM QUEIXAS
5= QUEIXA GRAVE
No último mês, como foi afetado pelos seguintes problemas
Rouquidão
0
1
2
3
4
5
Pigarro
0
1
2
3
4
5
Excesso de muco na garganta ou secreção escorrendo do nariz
para a garganta
0
1
2
3
4
5
Dificuldade de engolir comida, líquido ou comprimido
0
1
2
3
4
5
Tosse após comer ou após deitar-se
0
1
2
3
4
5
Dificuldades respiratórias ou engasgos
0
1
2
3
4
5
Tosse irritante
0
1
2
3
4
5
Sensação de algo preso na garganta
0
1
2
3
4
5
Dor no peito, indigestão, acidez estomacal subindo para a
garganta
0
1
2
3
4
5
Fonte: Modificado de: Belafsky et al, 2002.
64
ANEXO 3
Escala de sonolência de Epworth
0: NENHUMA CHANCE / 1: PEQUENA CHANCE / 2: MODERADA CHANCE / 3: ALTA CHANCE
0
Sentado e lendo
Assistindo TV
Sentado, quieto em um lugar público, sem atividade
Como passageiro de um trem, carro ou ônibus, andando uma hora sem
parar
Deitado para descansar à tarde
Sentado e conversando com alguém
Sentado após almoço, sem ter bebido álcool
Se você estiver de carro, enquanto para alguns minutos no trânsito
intenso
Fonte: Johns, 1992.
1
2
3
65
ANEXO 4
Questionário de Berlin
Categoria 1
Categoria 2
1. Você ronca?
6. Quantas vezes você se sente cansado
( ) Sim
ou com fadiga depois de acordar?
( ) Não
( ) Praticamente todos os dias
( ) Não sei
( ) 3-4 vezes por semana
2. Seu ronco é:
( ) 1-2 vezes por semana
( ) Pouco mais alto que sua respiração?
( ) Nunca ou praticamente nunca
( )Tão mais alto que sua respiração?
7. Quando você está acordado você
( ) Mais alto do que falando?
se sente cansado, fadigado ou não
( ) Muito alto que pode ser ouvido nos
sente bem?
quartos próximos?
( ) Praticamente todos os dias
3. Com que frequência você ronca?
( ) 3-4 vezes por semana
( ) Praticamente todos os dias
( ) 1-2 vezes por semana
( ) 3-4 vezes por semana
( ) Nunca ou praticamente nunca
( ) 1-2 vezes por semana
8. Alguma vez você cochilou ou caiu
no sono enquanto dirigia?
( ) Nunca ou praticamente nunca
4. O seu ronco incomoda alguém?
( ) Sim
( ) Sim
( ) Não
( ) Não
5. Alguém notou que você para de
respirar enquanto dorme?
( ) Praticamente todos os dias
( )3-4 vezes por semana
( )1-2 vezes por semana
( ) Nunca ou praticamente nunca
Fonte: Netzer et al, 1999.
Categoria 3
9. Você tem pressão alta?
( ) Sim
( ) Não
( ) Não sei
IMC=
66
ANEXO 5
Valores de Referência do exame de impedanciometria
Número de episódios de refluxo nas 24 horas
Refluxos distais
Refluxos proximais
Refluxo ácido
<50
< 28
Refluxo não ácido
<33
< 12
Total dos refluxos
<73
< 31
Fonte: Cho, 2010.
67
ANEXO 6
Relação dos episódios de refluxo de cada paciente (n= 92)
FA
Estado
Físico
L
D
FA
L
W
V
V
00:00:18
D
FA
L
W
V
V
00:00:24
P
FA
L
W
V
V
00:00:21
D
NA
L
N2
ER
0
00:00:12
D
NA
L
N2
ER
0
00:00:11
D
NA
L
N3
0
0
00:00:06
D
NA
L
N1
0
0
00:04:13
D
NA
L
N2
ER
ER
00:01:12
D
NA
L
N2
0
0
00:00:43
D
NA
L
N2
0
0
00:00:57
D
A
L
N2
0
0
00:00:07
D
FA
M
N3
0
ER
00:00:51
P
FA
L
W
V
V
00:00:47
D
FA
L
W
V
V
00:00:04
D
A
M
N1
0
0
00:00:30
D
A
L
W
V
V
00:00:04
D
FA
L
W
V
V
00:00:25
D
FA
L
W
V
V
00:02:13
D
FA
L
W
V
V
00:04:11
D
FA
L
N2
ER
ER
00:00:10
D
A
L
N3
ER
ER
00:00:04
D
FA
L
N2
ER
ER
00:00:32
D
A
M
N2
ER
ER
00:00:14
D
A
M
W
V
V
00:00:22
D
A
M
W
V
V
00:00:07
P
A
L
W
V
V
00:05:45
D
A
L
W
V
V
00:00:34
D
A
L
W
V
V
00:00:15
D
A
L
W
V
V
00:00:10
D
A
M
W
V
V
00:00:22
P
A
M
W
V
V
00:02:48
D
A
L
W
V
V
00:00:37
D
A
L
W
V
V
00:00:14
D
A
L
N2
0
0
00:00:36
D
FA
L
W
V
V
00:00:11
D
FA
L
N2
0
0
00:03:56
D
FA
L
W
V
V
00:00:15
7
D
A
L
W
V
V
00:00:05
8
D
A
L
N3
0
0
00:00:23
D
A
L
N2
0
0
00:00:11
D
A
L
N2
SER
0
00:00:28
Paciente
1
2
3
4
5
6
Tipo de Refluxo
NOTURNO
D
pH
Estágio
do sono
W
Despertar
60’’ antes
V
Despertar
60’’ depois
V
Duração
00:02:13
68
ANEXO 6
Relação dos episódios de refluxo de cada paciente (n= 92) (continuação)
A
Estado
Físico
L
D
NA
L
N2
0
0
00:00:11
D
NA
L
N2
0
SER
00:00:38
D
NA
L
N2
SER
0
00:00:19
D
FA
L
W
V
V
00:00:21
P
A
L
W
V
V
00:00:37
P
FA
L
N1
ER
ER
00:00:04
P
A
L
N2
SER
SER
00:00:26
9
D
FA
L
N2
0
0
00:00:03
10
D
FA
L
W
V
V
00:00:01
P
A
L
W
V
V
00:00:35
D
FA
L
W
V
V
00:00:26
D
A
L
W
V
V
00:00:08
D
A
L
N2
SER
0
00:00:45
D
A
M
N2
0
0
00:02:33
P
A
M
W
V
V
00:00:54
13
P
FA
L
N2
0
ER
00:01:30
14
D
A
M
W
V
V
00:00:05
15
D
FA
M
N2
ER
ER
00:00:07
D
FA
M
N2
ER
ER
00:00:03
D
FA
L
N2
ER
ER
00:01:03
P
FA
M
N2
ER
ER
00:00:52
D
A
M
W
V
V
00:00:18
D
FA
L
W
V
V
00:00:50
Paciente
11
12
16
17
Tipo de Refluxo
NOTURNO
D
pH
Estágio
do sono
N1
Despertar
60’’ antes
SER
Despertar
60’’ depois
ER
Duração
00:00:18
D
A
L
N2
0
0
00:00:34
D
FA
M
W
V
V
00:00:21
18
D
A
L
W
V
V
00:00:14
19
P
A
L
W
V
V
00:01:25
P
A
L
W
V
V
00:02:44
P
A
L
N2
SER
0
00:00:22
D
FA
L
W
V
V
00:00:57
D
NA
L
N2
SER
SER
00:00:10
D
A
M
N2
0
0
00:00:34
D
A
L
N2
0
SER
00:00:12
D
A
L
N2
ER
ER
00:00:54
D
FA
L
N2
SER
SER
00:00:04
D
FA
L
N1
0
SER
00:00:36
21
D
A
L
W
V
V
00:00:37
22
P
A
M
W
V
V
00:00:41
23
D
FA
L
N2
0
0
00:00:11
20
69
ANEXO 6
Relação dos episódios de refluxo de cada paciente (n= 92) (continuação)
FA
Estado
Físico
M
D
FA
L
N2
0
ER
00:00:05
D
FA
L
N2
0
0
00:00:05
D
A
L
W
V
V
00:00:31
25
D
A
M
W
V
V
00:00:01
26
D
FA
M
W
V
V
00:00:13
D
FA
L
N2
ER
ER
00:00:43
D
FA
L
N2
ER
ER
00:00:22
D
FA
L
N2
ER
ER
00:00:37
D
FA
L
N2
ER
ER
00:00:08
Paciente
24
27
Tipo de Refluxo
NOTURNO
D
pH
Estágio
do sono
W
Despertar
60’’ antes
V
Despertar
60’’ depois
V
Duração
00:00:09
Nota: D: Distal; P: Proximal; A: Ácido; FA: Fracamente ácido; NA: Não ácido; L: Líquido; M: Misto; W: acordado;
N1: Estágio 1 do sono não REM; N2: Estágio 2 do sono não REM; N3: Estágio 3 do sono não REM; V: acordado
nos 60’’ estudados; O: não houve despertares; ER: houve despertar associado a evento respiratório; SER: Houve
despertar não associado a evento respiratório.
70
ANEXO 7
Número de eventos obstrutivos respiratórios por hora de sono referente aos períodos
precedendo e sucedendo cada episódio de refluxo
IAH Pré-refluxo
PACIENTE
1
2
3
4
5
6
IAH
TOTAL
11,9
75,6
37,1
89,5
25,7
92,5
6
7
6,6
IAH Pós-refluxo
REFLUXOS
15 min
30 min
45 min
15 min
30 min
45 min
1
4
-
-
4
-
-
2
8
-
-
0
-
-
3
4
-
-
0
-
-
4
0
-
-
16
-
-
1
48
-
-
44
-
-
2
56
-
-
52
-
-
3
4
-
-
60
-
-
4
76
-
-
80
-
-
5
84
-
-
72
-
-
6
68
-
-
56
-
-
7
60
-
-
68
-
-
1
16
-
-
16
-
-
2
8
-
-
28
-
-
1
0
-
-
0
-
-
2
0
-
-
32
-
-
3
8
-
-
132
-
-
1
0
0
0
0
0
0
2
0
0
0
0
2
1,3
1
0
-
-
0
-
-
2
0
-
-
84
-
-
3
88
-
-
88
-
-
4
92
-
-
84
-
-
5
84
-
-
76
-
-
6
76
-
-
24
-
-
7
32
-
-
0
-
-
8
12
-
-
0
-
-
9
0
-
-
36
-
-
10
0
-
-
80
-
-
11
56
-
-
72
-
-
12
16
-
-
4
-
-
13
0
-
-
20
-
-
14
0
-
-
36
-
-
15
0
-
-
44
-
-
16
0
-
-
44
-
-
17
0
-
-
68
-
-
18
8
-
-
44
-
-
19
0
-
-
24
-
-
20
88
-
-
80
-
-
1
0
0
0
0
1,3
71
ANEXO 7
Número de eventos obstrutivos respiratórios por hora de sono referente aos períodos
precedendo e sucedendo cada episódio de refluxo (continuação)
IAH Pré-refluxo
PACIENTE
8
IAH
TOTAL
23,8
IAH Pós-refluxo
REFLUXOS
15 min
30 min
45 min
15 min
30 min
45 min
1
44
-
-
0
-
-
2
4
-
-
4
-
-
3
12
-
-
12
-
-
4
8
-
-
0
-
-
5
16
-
-
24
-
-
6
24
-
-
20
-
-
7
12
-
-
40
-
-
8
20
-
-
4
-
-
9
12
-
-
40
-
-
10
0
-
-
4
-
-
11
0
-
-
4
-
-
9
18,2
1
0
-
-
0
-
-
10
38,1
1
0
0
0
32
38
30,6
2
12
24
26,6
36
32
22,6
3
0
4
4
24
22
18,6
1
0
-
-
0
-
-
2
0
-
-
4
-
-
3
4
-
-
16
-
-
11
15,1
12
69,8
1
32
50
41,3
76
68
62,7
13
28,3
1
28
16
10,6
36
28
32
14
7,1
1
8
4
2,7
0
2
1,3
15
88,4
1
112
-
-
128
-
-
2
120
-
-
124
-
-
3
116
-
-
100
-
-
4
92
-
-
100
-
-
1
4
2
1,3
0
2
5,3
2
12
40
36
0
0
0
1
4
2
1,3
24
16
13,3
2
16
10
14,6
0
0
0
16
17
14,7
22,4
18
9,8
1
0
0
1,3
0
2
2,6
19
5,3
1
8
-
-
0
-
-
2
0
-
-
0
-
-
3
0
-
-
4
-
-
4
4
-
-
0
-
-
72
ANEXO 7
Número de eventos obstrutivos respiratórios por hora de sono referente aos períodos
precedendo e sucedendo cada episódio de refluxo (continuação)
IAH Pré-refluxo
PACIENTE
20
IAH
TOTAL
29,8
IAH Pós-refluxo
REFLUXOS
15 min
30 min
45 min
15 min
30 min
45 min
1
16
-
-
72
-
-
2
44
-
-
0
-
-
3
48
-
-
0
-
-
4
80
-
-
20
-
-
5
48
-
-
4
-
-
6
12
-
-
0
-
-
21
9,5
1
0
0
4
20
12
14,6
22
5,1
1
4
2
1,3
0
4
2,7
23
9
1
20
40
30,6
0
0
1,3
24
12,7
1
0
-
-
0
-
-
2
48
-
-
28
-
-
3
24
-
-
4
-
-
4
0
-
-
0
-
-
25
5,9
1
16
18
12
0
0
0
26
65,7
1
56
-
-
56
-
-
2
64
-
-
68
-
-
3
48
-
-
68
-
-
4
48
-
-
64
-
-
1
64
32
21,3
100
66
50,6
27
53,2
Nota: IAH: Índice de apneia e hipopneia; min: minutos.
8 REFERÊNCIAS BIBLIOGRÁFICAS
74
AASM. American Academy of Sleep Medicine. Sleep-related breathing disorders
in adults: recommendations for syndrome definition and measurement techniques
in clinical research. The Report of an American Academy of Sleep Medicine Task
Force. Sleep. 1999;22(5):667-89.
Abrishami A, Khajehdehi A, Chung F. A systematic review of screening
questionnaires for obstructive sleep apnea. Can J Anaesth. 2010;57(5):423-38.
Adhami T, Goldblum JR, Richter JE, Vaezi MF. The role of gastric and duodenal
agents in laryngeal injury: an experimental canine model. Am J Gastroenterol.
2004;99(11):2098-106.
Allen L, Poh CH, Gasiorowska A, Malagon I, Navarro-Rodriguez T, Cui H, et al.
Increased oesophageal acid exposure at the beginning of the recumbent period is
primarily a recumbent-awake phenomenon. Aliment Pharmacol Ther.
2010;32(6):787-94.
Altman K, Stephens R, Lyttle C, Weiss K. Changing impact of gastroesophageal
reflux in medical and otolaryngology practice Laryngoscope. 2005;115(7):1145-53.
Aviv JE, Liu H, Parides M, Kaplan ST, Close LG. Laryngopharyngeal sensory
deficits in patients with laryngopharyngeal reflux and dysphagia. Ann Otol Rhinol
Laryngol. 2000;109(11):1000-6.
Belafsky PC, Postma GN, Koufman JA. The validity and reliability of the reflux
finding score (RFS). Laryngoscope. 2001;111(8):1313-7.
Belafsky PC, Postma GN, Koufman JA. Validity and reliability of the reflux
symptom index (RSI). J Voice. 2002;16(2):274-7.
Berg S, Hoffstein V, Gislason T. Acidification of distal esophagus and sleeprelated breathing disturbances. Chest. 2004;125(6):2101-6.
Bernard F, Dupont C, Viala P. Gastroesophageal reflux and upper airway
diseases. Clin Rev Allergy. 1990;8(4):403-25.
Bortolotti M, Gentilini L, Morselli C, Giovannini M. Obstructive sleep apnoea is
improved by a prolonged treatment of gastrooesophageal reflux with omeprazole.
Dig Liver Dis. 2006;38(2):78-81.
Boyd JH, Petrof BJ, Hamid Q, Fraser R, Kimoff RJ. Upper airway muscle
inflammation and denervation changes in obstructive sleep apnea. Am J Respir
Crit Care Med. 2004;170(5):541-6.
Carrau RL, Khidr A, Crawley JA, Hillson EM, Davis JK, Pashos CL. The impact of
laryngopharyngeal reflux on patient-reported quality of life. Laryngoscope.
2004;114(4):670-4.
Cheung TK, Lam PK, Wei WI, Wong WM, Ng ML, Gu Q, et al. Quality of life in
patients with laryngopharyngeal reflux. Digestion. 2009;79(1):52-7.
75
Chiocca JC, Olmos JA, Salis GB, Soifer LO, Higa R, Marcolongo M, et al.
Prevalence, clinical spectrum and atypical symptoms of gastro-oesophageal
reflux in Argentina: a nationwide population-based study. Aliment Pharmacol
Ther. 2005;22(4):331-42.
Cho YK. How to interpret esophageal impedance pH monitoring. J
Neurogastroenterol Motil. 2010;16(3):327-30.
Cianci R, Fedeli G, Cammarota G, Galli J, Agostino S, Di Girolamo S, et al. Is the
risk alkaline reflux a risk factor for laryngeal lesions? Am J Gastroenterol.
2000;95(9):2398.
Conrad I, S Ancoli-Israel, A Chesson. The American Academy of Sleep Medicine
manual for the scoring of the sleep and associated events: rules, terminology and
technical specifications. Westchester: IL: American Academy of Sleep Medicine;
2007.
De Bortoli N, Nacci A, Savarino E, Martinucci I, Bellini M, Fattori B. How many
cases of laryngopharyngeal reflux suspected by laryngoscopy are
gastroesophageal reflux disease-related? World J Gastroenterol.
2012;18(32):4363-70.
Demeter P, Pap A. The relationship between gastroesophageal reflux disease
and obstructive sleep apnea. J Gastroenterol. 2004;39(9):815-20.
Dempsey JA, Veasey SC, Morgan BJ, O'Donnell CP. Pathophysiology of sleep
apnea. Physiol Rev. 2010;90(1):47-112.
Dent J, Dodds W, Friedman R, Sekiguchi T, Hogan W, Arndorfer R, et al.
Mechanism of gastroesophageal reflux in recumbent asymptomatic human
subjects. J Clin Invest. 1980;65(2):256-67.
Dore M, Pedroni A, Pes G, Maragkoudakis E, Tadeu V, Pirina P, et al. Effect of
antisecretory therapy on atypical symptoms in gastroesophageal reflux disease.
Dig Dis Sci. 2007;52(2):463-8.
Drager LF, Bortolotto LA, Figueiredo AC, Krieger EM, Lorenzi GF. Effects of
continuous positive airway pressure on early signs of atherosclerosis in
obstructive sleep apnea. Am J Respir Crit Care Med. 2007;176(7):706-12.
Eckley C, Marinho V, Ruiz W, Costa H. O uso da pH-metria esofágica de dois
canais no diagnóstico da laringite crônica por refluxo gastroesofágico. Rev Bras
ORL. 1999;66(2):110-4.
Eckley CA, Michelsohn N, Rizzo LV, Tadokoro CE, Costa HO. Salivary epidermal
growth factor concentration in adults with reflux laryngitis. Otolaryngol Head Neck
Surg. 2004;131(4):401-6.
76
Eikermann M, Jordan AS, Chamberlin NL, Gautam S, Wellman A, Lo YL, et al.
The influence of aging on pharyngeal collapsibility during sleep. Chest.
2007;131(6):1702-9.
Eiseman NA, Westover MB, Ellenbogen JM, Bianchi MT. The impact of body
posture and sleep stages on sleep apnea severity in adults. J Clin Sleep Med.
2012;8(6):655-66.
Emerenziani S, Ribolsi M, Sifrim D, Blondeau K, Cicala M. Regional oesophageal
sensitivity to acid and weakly acidic reflux in patients with non-erosive reflux
disease. Neurogastroenterol Motil. 2009;21(3):253-8.
Eryılmaz A, Erişen L, Demir UL, Kasapoglu F, Ozmen OA, Ursavas A, et al.
Management of patients with coexisting obstructive sleep apnea and
laryngopharyngeal reflux disease. Eur Arch Otorhinolaryngol. 2012;269(12):2575-80.
Eskiizmir G, Kezirian E. Is there a vicious cycle between obstructive sleep apnea
and laryngopharyngeal reflux disease? Med Hypotheses. 2009;73(5):706-8.
Fass R, Fennerty M, Vakil N. Nonerosive reflux disease – current concepts and
dilemmas. Am J Gastroenterol. 2001;96(2):303-14.
Fass R, Achem S, Harding S, Mittal R, Quigley E. Review article: supraoesophageal manifestations of gastro-oesophageal reflux disease and the role of
night-time gastro-oesophageal reflux. Aliment Pharmacol Ther. 2004;20(Suppl
9):26-38.
Fass R. Effect of gastroesophageal reflux disease on sleep. J Gastroenterol
Hepatol. 2010;25 (Suppl 1):S41-4.
Fraser A. Review article: gastro-oesophageal reflux and laryngeal symptoms
Aliment Pharmacol Ther. 1994;8(3):265-72.
Fujiwara Y, Higuchi K, Watanabe Y, Shiba M, Watanabe T, Tominaga K, et al.
Prevalence of gastroesophageal reflux disease and gastroesophageal reflux
disease symptoms in Japan. J Gastroenterol Hepatol. 2005;20(1):26-9.
Gill GA, Johnston N, Buda A, Pignatelli M, Pearson J, Dettmar PW, et al.
Laryngeal epithelial defenses against laryngopharyngeal reflux: investigations of
E-cadherin, carbonic anhydrase isoenzyme III, and pepsin. Ann Otol Rhinol
Laryngol. 2005;114(12):913-21.
Gottlieb DJ, Yenokyan G, Newman AB, O'Connor GT, Punjabi NM, Quan SF, et
al. Prospective study of obstructive sleep apnea and incident coronary heart
disease and heart failure: the sleep heart health study. Circulation.
2010;122(4):352-60.
Graf K, Karaus M, Heinemann S, Körber S, Dorow P, Hampel K.
Gastroesophageal reflux in patients with sleep apnea syndrome. Z Gastroenterol.
1995;33(12):689-93.
77
Green B, Broughton W, O'Connor J. Marked improvement in nocturnal
gastroesophageal reflux in a large cohort of patients with obstructive sleep apnea
treated with continuous positive airway pressure. Arch Intern Med.
2003;163(1):41-5.
Groome M, Cotton J, Borland M, McLeod S, Johnston D, Dillon J. Prevalence of
laryngopharyngeal reflux in a population with gastroesophageal reflux.
Laryngoscope. 2007;117(8):1424-8.
Gupta R, Sataloff R. Laryngopharyngeal reflux: current concepts and questions.
Curr Opin Otolaryngol. Head Neck Surg. 2009;17(3):143-8.
Hampel H, Abraham NS, El-Serag HB. Meta-analysis: obesity and the risk for
gastroesophageal reflux disease and its complications. Ann Intern Med.
2005;143:199-211.
Hobaika AB, Lorentz MN. Laryngospasm. Rev Bras Anestesiol. 2009;59(4):487-95.
Hoppo T, Sanz AF, Nason KS, Carroll TL, Rosen C, Normolle DP, et al. How
much pharyngeal exposure is normal? Normative data for laryngopharyngeal
reflux events using hypopharyngeal multichannel intraluminal impedance (HMII). J
Gastrointest Surg. 2012;16(1):16-24.
Ing A, Ngu M, Breslin A. Obstructive sleep apnea and gastroesophageal reflux.
Am J Med. 2000;108(Suppl 4a):120-5S.
Jamielson JR, Stein HJ, DeMeester TR, Bonavina L, Schwizer W, Hinder RA, et al.
Ambulatory 24H Esophageal pH monitoring: normal values, optimal thresholds,
specificity, sensitivity and reproducibility. Am J Gastroenterol. 1992;87(9):1102-11.
Jaspersen D, Kulig M, Labenz J, Leodolter A, Lind T, Meyer-Sabellek W.
Prevalence of extra-oesophageal manifestations in gastro-oesophageal reflux
disease: an analysis based on the ProGERD Study. Aliment Pharmacol Ther.
2003;17(12):1515-20.
Johns, MW. A new method for measuring daytime sleepiness: the Epworth
sleepiness scale. Sleep. 1991;14(6):540-5.
Johnston N, Knight J, Dettmar PW, Lively MO, Koufman J. Pepsin and carbonic
anhydrase isoenzyme III as diagnostic markers for laryngopharyngeal reflux
disease. Laryngoscope. 2004;114(12):2129-34.
Johnston N, Dettmar PW, Lively MO, Postma GN, Belafsky PC, Birchall M, et al.
Effect of pepsin on laryngeal stress protein (Sep70, Sep53, and Hsp70) response:
role in laryngopharyngeal reflux disease. Ann Otol Rhinol Laryngol.
2006;115(1):47-58.
78
Johnston N, Dettmar PW, Bishwokarma B, Lively MO, Koufman JA.
Activity/stability of human pepsin: implications for reflux attributed laryngeal
disease. Laryngoscope. 2007;117(6):1036-9.
Kahrilas P, Dodds W, Dent J, Haeberle B, Hogan W, Arndorfer R. Effect of sleep,
spontaneous gastroesophageal reflux, and a meal on upper esophageal sphincter
pressure in normal human volunteers. Gastroenterology. 1987;92(2):466-71.
Kahrilas PJ, Lee TJ. Pathophysiology of gastroesophageal reflux disease. Thorac
Surg Clin. 2005;15(3):323-33.
Kalach N, Gumpert L, Contencin P, Dupont C. Dual-probe pH monitoring for the
assessment of gastroesophageal reflux in the course of chronic hoarseness in
children. Turk J Pediatr. 2000;42(3):186-91.
Kapur V, Blough DK, Sandblom RE, Hert R, de Maine JB, Sullivan SD, et al. The
medical cost of undiagnosed sleep apnea. Sleep. 1999;22(6):749-55.
Karkos P, Leong S, Benton J, Sastry A, Assimakopoulos D, Issing W. Reflux and
sleeping disorders: a systematic review. J Laryngol Otol. 2009;123(4):372-4.
Kawamura O, Aslam M, Rittmann T, Hofmann C, Shaker R. Physical and pH
properties of gastroesophagopharyngeal refluxate: a 24-hour simultaneous
ambulatory impedance and pH monitoring study. Am J Gastroenterol.
2004;99(6):1000-10.
Kerr P, Shoenut J, Millar T, Buckle P, Kryger M. Nasal CPAP reduces
gastroesophageal reflux in obstructive sleep apnea syndrome. Chest.
1992;101(6):1539-44.
Kerr P, Shoenut J, Steens R, Millar T, Micflikier A, Kryger M. Nasal continuous
positive airway pressure. A new treatment for nocturnal gastroesophageal reflux?
J Clin Gastroenterol. 1993;17(4):276-80.
Khan A, Hashmi S, Elahi F, Tariq M, Ingrams D. Laryngopharyngeal reflux: A
literature review. Surgeon. 2006;4(4):221-5.
Kim H, Vorona R, Winn M, Doviak M, Johnson D, Ware J. Symptoms of gastrooesophageal reflux disease and the severity of obstructive sleep apnoea
syndrome are not related in sleep disorders center patients. Aliment Pharmacol
Ther. 2005;21(9):1127-33.
Kimoff RJ, Sforza E, Champagne V, Ofiara L, Gendron D. Upper airway sensation
in snoring and obstructive sleep apnea. Am J Respir Crit Care Med.
2001;164(2):250-5.
Konermann M, Radü H, Teschler H, Rawert B, Heimbucher J, Sanner B.
Interaction of sleep disturbances and gastroesophageal reflux in chronic
laryngitis. Am J Otolaryngol. 2002;23(1):20-6.
79
Koufman J. The otolaryngologic manifestations of gastroesophageal reflux disease
(GERD): a clinical investigation of 225 patients using ambulatory 24-hour pH
monitoring and an experimental investigation of the role of acid and pepsin in the
development of laryngeal injury. Laryngoscope. 1991;101(4 Pt 2 Suppl 53):1-78.
Koufman, J. Laryngopharyngeal reflux 2002: a new paradigm of airway disease.
Ear Nose Throat J. 2002a;81(9 Suppl 2):2-6.
Koufman J. Laryngopharyngeal reflux is different from classic gastroesophageal
reflux disease. Ear Nose Throat J. 2002b;81(9 Suppl 2):7-9.
Koufman J, Aviv J, Casiano R, Shaw G. Laryngopharyngeal reflux: position
statement of the committee on speech, voice, and swallowing disorders of the
American Academy of Otolaryngology-Head and Neck Surgery. Otolaryngol Head
Neck Surg. 2002a;127(1):32-5.
Koufman J, Belafsky P, Bach K, Daniel E, Postma G. Prevalence of esophagitis in
patients with pH-documented laryngopharyngeal reflux. Laryngoscope.
2002b;112(9):1606-9.
Kulig M, Leodolter A, Vieth M, Schulte E, Jaspersen D, Labenz J, et al. Quality of
life in relation to symptoms in patients with gastro-oesophageal reflux disease –
an analysis based on the ProGERD initiative. Aliment Pharmacol Ther.
2003;18(8):767-76.
Kuribayashi S, Massey BT, Hafeezullah M, Perera L, Hussaini SQ, Tatro L. Upper
esophageal sphincter and gastroesophageal junction pressure changes act to
prevent gastroesophageal and esophagopharyngeal reflux during apneic
episodes in patients with obstructive sleep apnea. Chest. 2010a;137(4):769-76.
Kuribayashi S, Kusano M, Kawamura O, Shimoyama Y, Maeda M, Hisada T, et
al. Mechanism of gastroesophageal reflux in patients with obstructive sleep apnea
syndrome. Neurogastroenterol Motil. 2010b;22(6):611-72.
Kushida C, Littner M, Morgenthaler T, Alessi C, Bailey D, Coleman JJ, et al.
Practice parameters for the indications for polysomnography and related
procedures: an update for 2005. Sleep. 2005;28(4):499-521.
Lai Y, Wang P, Lin J. Laryngopharyngeal reflux in patients with reflux esophagitis.
World J Gastroenterol. 2008;14(28):4523-8.
Lee B, Kim G, Ryu D, Kim D, Cheong J, Lee D, et al. Combined Dual Channel
Impedance/pH-metry in Patients With Suspected Laryngopharyngeal Reflux. J
Neurogastroenterol Motil. 2010;16(2):157-65.
Lindman R, Stal PS. Abnormal palatopharyngeal muscle morphology in sleepdisordered breathing. J Neurol Sci. 2002;195(1):11-23.
80
Locke G, Talley N, Fett S, Zinsmeister A, Melton L. Prevalence and clinical
spectrum of gastroesophageal reflux: a population-based study in Olmsted
County, Minnesota. Gastroenterology. 1997;112(5):1448-56.
Lorenzi-Filho G, Genta PR, Pedrosa RP, Drager LF, Martinez D. Cardiovascular
consequences of obstructive sleep apnea syndrome. J Bras Pneumol.
2010;36(Suppl 2):38-42.
Lundell LRJ, Dent JR, Bennett AL, Blum D, Armstrong JP, Galmiche F, et al.
Endoscopic assessment of oesophagitis: clinical and functional correlates and
further validation of the Los Angeles classification. Gut. 1999;45(2):172-80.
Mahieu HF, Smit CF. Diagnosis and management of laryngopharyngeal reflux
disease. Curr Opin Otolaryngol Head Neck Surg. 2006;14(3):133-7.
Mansfield L, Stein M. Gastroesophageal reflux and asthma: a possible reflex
mechanism. Ann Allergy. 1978;41(4):224-6.
Marcinkiewicz M, Grabowska SZ, Czyzewska E. Role of epidermal growth factor
(EGF) in oesophageal mucosal integrity. Curr Med Res Opin. 1998;14(3):145-53.
Marin JM, Carrizo SJ, Vicente E, Agusti AG. Long-term cardiovascular outcomes
in men with obstructive sleep apnoea-hypopnoea with or without treatment with
continuous positive airway pressure: an observational study. Lancet.
2005;365(9464):1046-53.
Martinez S, Malagon I, Garewal H, Cui H, Fass R. Non-erosive reflux disease
(NERD) – acid reflux and symptom patterns. Aliment Pharmacol Ther.
2003;17(4):537-45.
Moraes-Filho J, Cecconello I, Gama-Rodrigues J, Castro L, Henry M, Meneghelli
U, et al. Brazilian consensus on gastroesophageal reflux disease: proposals for
assessment, classification, and management. Am J Gastroenterol.
2002;97(2):241-8.
Moraes-Filho J, Chinzon D, Eisig J, Hashimoto C, Zaterka S. Prevalence of
heartburn and gastroesophageal reflux disease in the urban Brazilian population.
Arq Gastroenterol. 2005;42(2):122-7.
Moraes-Filho J, Navarro-Rodriguez T, Barbuti R, Eisig J, Chinzon D, Bernardo W,
et al. Guidelines for the diagnosis and management of gastroesophageal reflux
disease: an evidence-based consensus. Arq Gastroenterol. 2010;47(1):99-115.
Morse C, Quan S, Mays M, Green C, Stephen G, Fass R. Is there a relationship
between obstructive sleep apnea and gastroesophageal reflux disease? Clin
Gastroenterol Hepatol. 2004;2(9):761-8.
Nasi A, Moraes-Filho J, Zilberstein B, Cecconello I, Gama-Rodrigues JJ, Pinotti
HW. Gastroesophageal reflux disease: clinical, endoscopic, and intraluminal
esophageal pH monitoring evaluation. Dis Esophagus. 2001;14(1):41-9.
81
Nasi A, Moraes-Filho J, Cecconello I. Gastroesophageal reflux disease: an
overview. Arq Gastroenterol. 2006;43(4):334-41.
Netzer NC, Stoohs RA, Netzer CM, Clark K, Strohl KP. Using the Berlin
Questionnaire to identify patients at risk for the sleep apnea syndrome. Ann
Intern Med. 1999;131(7):485-91.
Nguyen AT, Jobin V, Payne R, Beauregard J, Naor N, Kimoff RJ. Laryngeal and
velopharyngeal sensory impairment in obstructive sleep apnea. Sleep.
2005;28(5):585-93.
Nostrant TT, Rabine JC. Diagnosis and management of supra-esophageal
complications of reflux disease. Curr Gastroenterol Rep. 2000;2(3):210-6.
Oelschlager BK, Quiroga E, Isch JA, Cuenca-Abente F. Gastroesophageal and
pharyngeal reflux detection using impedance and 24-hour pH monitoring in
asymptomatic subjects: defining the normal environment. J Gastrointest Surg.
2006;10(1):54-62.
Ogut F, Midilli R, Oder G, Engin E, Karci B, Kabasakal Y. Laryngeal findings and
voice quality in Sjögren's syndrome. Auris Nasus Larynx. 2005;32(4):375-80.
Olson L, King M, Hensley M, Saunders N. A community study of snoring and
sleep-disordered breathing Health outcomes. Am J Respir Crit Care Med.
1995;152(2):717-20.
Orr W, Johnson L. Responses to different levels of esophageal acidification
during waking and sleep. Dig Dis Sci. 1998;43(2):241-5.
Orr W, Elsenbruch S, Harnish M, Johnson L. Proximal migration of esophageal
acid perfusions during waking and sleep. Am J Gastroenterol. 2000;95(1):37-42.
Orr W, Heading R, Johnson L, Kryger M. Review article: sleep and its relationship
to gastro-oesophageal reflux. Aliment Pharmacol Ther. 2004;20 (Suppl 9):39-46.
Orr W, Goodrich S, Fernström P, Hasselgren G. Occurrence of nighttime
gastroesophageal reflux in disturbed and normal sleepers. Clin Gastroenterol
Hepatol. 2008;6(10):1099-104.
Oztürk O, Oztürk L, Ozdogan A, Oktem F, Pelin Z. Variables affecting the
occurrence of gastroesophageal reflux in obstructive sleep apnea patients. Eur
Arch Otorhinolaryngol. 2004;261(4):229-32.
Payne R, Kost K, Frenkiel S, Zeitouni A, Sejean G, Sweet R, et al. Laryngeal
inflammation assessed using the reflux finding score in obstructive sleep apnea.
Otolaryngol Head Neck Surg. 2006;134(5):836-42.
Penzel T, Becker H, Brandenburg U, Labunski T, Pankow W, Peter J. Arousal in
patients with gastro-oesophageal reflux and sleep apnoea. Eur Respir J.
1999;14(6):1266-70.
82
Peppard PE, Young T, Palta M, Dempsey J, Skatrud J. Longitudinal study of
moderate weight change and sleep-disordered breathing. JAMA.
2000a;284(23):3015-21.
Peppard PE, Young T, Palta M, Skatrud J. Prospective study of the association
between sleep-disordered breathing and hypertension. N Engl J Med.
2000b;342(19):1378-84.
Phua SY, McGarvey LP, Ngu MC, Ing AJ. Patients with gastro-oesophageal reflux
disease and cough have impaired laryngopharyngeal mechanosensitivity. Thorax.
2005;60(6):488-91.
Poh CH, Allen L, Gasiorowska A, Navarro-Rodriguez T, Quan S, Malagon I, et al.
Conscious Awakenings Are Commonly Associated With Acid Reflux Events in
Patients With Gastroesophageal Reflux Disease. Clin Gastroenterol Hepatol.
2010a;8(10):851-7.
Poh CH, Allen L, Gasiorowska A, Navarro-Rodriguez T, Mizyed I, Powers J.
Reassessment of the principal characteristics of gastroesophageal reflux during
the recumbent period using integrated actigraphy-acquired information. Am J
Gastroenterol. 2010b;105(5):1024-31.
Prado AG, Saliture TBS, Siqueira A, Eckley CA. Tradução e adaptação cultural
do Reflux Finding Score para o Português Brasileiro. Rev Bras Otorrinolaringol.
2013;79(1);47-53.
Qua C, Wong C, Gopala K, Goh K. Gastro-oesophageal reflux disease in chronic
laryngitis: prevalence and response to acid-suppressive therapy. Aliment
Pharmacol Ther. 2007;25(3):287-95.
Redline S, Yenokyan G, Gottlieb GJ, Shahar E, O'Connor GT, Resnick HE, et al.
Obstructive sleep apnea-hypopnea and incident stroke: the sleep heart health
study. Am J Respir Crit Care Med. 2010;182(2):269-77.
Reimer M, Flemons W. Quality of life in sleep disorders. Sleep Med Rev.
2003;7(4):335-49.
Richter J. Extraesophageal presentations of gastroesophageal reflux disease.
Semin Gastrointest Dis. 1997;8(2):75-89.
Sarturi JB, das Neves J, Peres KG. Obesity in adults: a population based study in
a small town in South of Brazil, 2005. Cien Saude Colet. 2010;15(1):105-13.
Senior B, Khan M, Schwimmer C, Rosenthal L, Benninger M. Gastroesophageal
reflux and obstructive sleep apnea. Laryngoscope. 2001;111(12):2144-6.
Shepherd KL, James AL, Musk AW, Hunter ML, Hillman DR, Eastwood PR.
Gastro-oesophageal reflux symptoms are related to the presence and severity of
obstructive sleep apnoea. J Sleep Res. 2011;20(1 Pt 2):241-9.
83
Sifrim D, Holloway R, Silny J, Xin Z, Tack J, Lerut A, et al. Acid, nonacid, and gas
reflux in patients with gastroesophageal reflux disease during ambulatory 24-hour
pH-impedance recordings Gastroenterology. 2001;120(7):1588-98.
Smit CF, Tan J, Devriese PP, Mathus-Vliegen LM, Brandsen M, Schouwenburg
PF. Ambulatory pH measurements at the upper esophageal sphincter.
Laryngoscope. 1998;108(2):299-302.
Steward D. Pantoprazole for sleepiness associated with acid reflux and
obstructive sleep disordered breathing. Laryngoscope. 2004;114(9):1525-8.
Suurna MV, Welge J, Surdulescu V, Kushner J, Steward DL. Randomized
placebo-controlled trial of pantoprazole for daytime sleepiness in GERD and
obstructive sleep disordered breathing. Otolaryngol Head Neck Surg.
2008;139(2):286-90.
Suzuki M, Saigusa H, Kurogi R, Yamamoto T, Ishiguro T, Yohsizawa T, et al.
Arousals in obstructive sleep apnea patients with laryngopharyngeal and
gastroesophageal reflux. Sleep Med. 2010;11(4):356-60.
Tardif C, Denis P, Verdure-Poussin A, Hidden F, Pasquis P, Samson-Dollfus D.
Gastroesophageal reflux during sleep in obese patients. Neurophysiol Clin.
1988;18(4):323-32.
Tawk M, Goodrich S, Kinasewitz G, Orr W. The effect of 1 week of continuous
positive airway pressure treatment in obstructive sleep apnea patients with
concomitant gastroesophageal reflux. Chest. 2006;130(4):1003-8.
Tobey NA. How does the esophageal epithelium maintain its integrity? Digestion.
1995;56(Suppl 1):45-50.
Tregear S, Reston J, Schoelles K, Phillips B. Obstructive sleep apnea and risk of
motor vehicle crash: systematic review and meta-analysis. J Clin Sleep Med.
2009;5(6):573-81.
Tufik S, Santos-Silva R, Taddei J, Bittencourt L. Obstructive sleep apnea
syndrome in the Sao Paulo Epidemiologic Sleep Study. Sleep Med.
2010;11(5):441-6.
Ulualp S, Toohill R, Kern M, Shaker R. Pharyngo-UES contractile reflex in
patients with posterior laryngitis. Laryngoscope. 1998;108(9):1354-7.
Vakil N, van Zanten S, Kahrilas P, Dent J, Jones R, GCGroup. The Montreal
definition and classification of gastroesophageal reflux disease: a global
evidence-based consensus. Am J Gastroenterol. 2006;101(8):1900-20.
Valipour A, Makker H, Hardy R, Emegbo S, Toma T, Spiro S. Symptomatic
gastroesophageal reflux in subjects with a breathing sleep disorder. Chest.
2002;121(6):1748-53.
84
Veale D, Poussin G, Benes F, Pepin JL, Levy P. Identification of quality of life
concerns of patients with obstructive sleep apnoea at the time of initiation of
continuous positive airway pressure: a discourse analysis. Qual Life Res.
2002;11(4):389-99.
Wang Y, Beydoun MA, Liang L, Caballero B, Kumanyika SK. Will all Americans
become overweight or obese? Estimating the progression and cost of the US
obesity epidemic. Obesity. 2008;16:2323-30.
Wise J, Murray J. Utilising multichannel intraluminal impedance for diagnosing
GERD: a review. Dis Esophagus. 2007;20(2):83-8.
Xiao YL, Liu FQ, Li J, Lv JT, Lin JK, Wen WP, et al. Gastroesophageal and
laryngopharyngeal reflux profiles in patients with obstructive sleep
apnea/hypopnea syndrome as determined by combined multichannel intraluminal
impedance-pH monitoring. Neurogastroenterol Motil. 2012;24(6):258-65.
Ylitalo R, Lindestad P, Ramel S. Symptoms, laryngeal findings, and 24-hour pH
monitoring in patients with suspected gastroesophago-pharyngeal reflux.
Laryngoscope. 2001;11(10):1735-41.
Young T, Peppard P, Palta M, Hla KM, Finn L, Morgan B, et al. Population-based
study of sleep-disordered breathing as a risk factor for hypertension. Arch Intern
Med. 1997;157(15):1746-52.
Zerbib F, Stoll D. Management of laryngopharyngeal reflux: an unmet medical
need. Neurogastroenterol Motil. 2010;22(2):109-12.
85
FONTES CONSULTADAS
Rechtschaffen A, Kales A. A manual of standardized terminology, techniques and
scoring system for sleep stages of human subjects. Washington DC, Public Health
Service Government Printing Office. 1968.
Faculdade de Ciências Médicas da Santa Casa de São Paulo. Comissão de PósGraduação. Normalização para apresentação de dissertações e teses. [online].
São
Paulo:
Comissão
de
Pós-Graduação;
2004.
Disponível
em:
http://www.fcmscsp.edu.br/posgraduacao/arquivos/File/normastese_2004.pdf.
86
Xavier, SD. Associação temporal entre episódios de refluxo e eventos obstrutivos
respiratórios em pacientes com refluxo laringofaríngeo e síndrome da apneia
obstrutiva do sono. Tese (Doutorado). São Paulo: Faculdade de Ciências Médicas
da Santa Casa de São Paulo; 2013.
RESUMO
Introdução: A hipótese de haver uma associação entre Doença do Refluxo
Gastroesofágico (DRGE) e Refluxo Laringofaríngeo (RLF) com a Síndrome da
Apneia Obstrutiva do Sono (SAOS) vem sendo estudada nos últimos anos. Não se
sabe ainda se estas doenças simplesmente compartilham alguns fatores de risco em
comum, como a obesidade e o aumento da idade, ou se existe relação causa-efeito
entre elas. A investigação diagnóstica concomitante do RLF e SAOS com pHimpedanciometria e polissonografia, respectivamente, permite determinar se ocorre
associação temporal entre ambas as doenças. Objetivo: Determinar se existe
associação temporal entre episódios de refluxo e eventos obstrutivos respiratórios
em pacientes com RLF e SAOS. Casuística e Método: Vinte e sete adultos com
diagnóstico clínico de RLF foram submetidos à polissonografia concomitante com
pH-impedanciometria, após endoscopia digestiva alta. Para o diagnóstico de RLF
foram utilizados dois instrumentos validados para tal fim, o Reflux Symptom Index
(RSI) e o Reflux Finding Score (RFS), sendo que RSI > 13 e RFS > 7 foram
considerados como positivos para RLF. Foi determinado o número dos episódios de
apneia ou hipopneia que precederam e sucederam cada episódio de refluxo, tendo
sido analisados 15, 30 e 45 minutos antes e depois do refluxo, e comparados com o
índice de apneia e hipopneia (IAH) referente à noite inteira de estudo. Resultados:
Dos 27 pacientes, 14 eram homens (51,9%) e 13 eram mulheres (48,1%), com
idades variando entre 31 e 65 anos (média= 51,7 anos e DP=9,3) e IMC entre 25 e
40 kg/m2 (média=32,4 kg/m2 e DP=4,3). Os pacientes foram divididos em 3 grupos,
de acordo com a presença de associação temporal entre episódios de refluxo e
eventos obstrutivos respiratórios: Grupo I (25,9%) – IAH antecedendo o refluxo maior
que o IAH referente à noite inteira; Grupo II (14,8%)- IAH sucedendo o refluxo maior
que o IAH referente à noite inteira, e Grupo III (59,3%)– IAH antecedendo ou
sucedendo o episódio de refluxo menor ou igual ao IAH referente à noite inteira. Não
houve diferença estatisticamente significante entre os três grupos quanto às
variáveis idade, sexo, gravidade dos sinais e sintomas de RLF, presença ou
ausência da forma clássica de DRGE e características físico-químicas do material
refluído, exceto o IMC, que foi significativamente maior no grupo II. Discussão:
Tanto a DRGE e o RLF, quanto a SAOS são doenças com alta prevalência na
população e causam grande morbidade. Daí a importância de se compreender as
possíveis associações de causa e efeito entre estas doenças. O refluxo pode
predispor à ocorrência de evento de apneia por aumentar o processo inflamatório
nos segmentos da laringe e da faringe. No presente estudo, 14,8% dos pacientes
apresentaram tal associação temporal, sendo que o único fator diferenciador foi o
fato de serem mais obesos. Ademais, episódios de apneia podem levar ao refluxo
por aumentar o gradiente de pressão intratorácica e os despertares, vistos em 25,9%
dos pacientes da atual casuística. Os achados deste estudo sugerem a necessidade
de pesquisas com casuísticas maiores cuidadosamente desenhadas para se melhor
compreender as associações entre episódios de refluxo e apneia. Conclusão: Neste
estudo pôde-se observar uma associação temporal entre episódios de refluxo e
eventos obstrutivos respiratórios em 40,7% dos pacientes com RLF e SAOS.
87
Xavier SD. Temporal association between reflux episodes and obstructive respiratory
events in patients with Laryngopharyngeal Reflux and Obstructive Sleep Apnea.
Tese (Doutorado). São Paulo: Faculdade de Ciências Médicas da Santa Casa de
São Paulo; 2013.
ABSTRACT
Introduction: Recent literature has explored the possibility of a association between
Gastroesophageal Reflux Disease (GERD), Laryngopharyngeal Reflux (LPR) and
Obstructive Sleep Apnea (OSA). It is, however, unclear if these diseases simply
share the same risk factors (i.e. obesity and age) or if there is a cause-effect relation
between them. Diagnostic investigation using concomitant pH-impedance monitoring
and polisomnography allows assessment of a possible temporal association.
Objective: To determine if there is a temporal association between reflux and
obstructive respiratory events in patients with LPR and SAOS. Patients and
Methods: Twenty seven adults with clinically diagnosed LPR underwent concomitant
pH-impedance testing and polisomnography, after an upper digestive endoscopy.
The diagnosis of LPR was established using two validated instruments, the Reflux
Symptom Index (RSI) and the Reflux Finding Score (RFS), where a RSI > 13 and a
RFS > 7 were considered positive for LPR. The number of obstructive respiratory
events (apnea or hypopnea) that occurred 15, 30, and 45 minutes before and after
each reflux episode were recorded and compared to the apnea hypopnea index
(AHI) of the full night. Results: Twenty-seven patients were enrolled in the study, 14
males and 13 females, with a mean age of 51.7 years (ranging from 31 to 65 years),
and a mean body mass index (BMI) of 32.4 kg/m2 (ranging from 25 to 40 kg/m2).
Patients were sub-divided in 3 groups according to the presence of significant
temporal association between reflux and respiratory events: Group I – 25.9% of
patients presented a greater AHI before the reflux episodes when compared to the
total AHI; Group II – 14.8% of patients presented a greater AHI after the reflux events
when compared to the total AHI; and Group III- 59.3% of patients presented AHI
before or after the reflux episodes lesser or the same when compared to the total
AHI. No statistically significant difference was found for demographic or reflux related
variables, such as gender, age, RFS and RSI scores, physical-chemical
characteristics of the refluxate, or association with classical GERD. The only
statistically significant variable was BMI, which was found to be significantly higher in
patients from Group II. Discussion: Both GERD and LPR, as well as OSA are highly
prevalent diseases that cause great morbidity. Understanding the physiopathology
and possible associations between these diseases is important for diagnosis and
management. Two theories are proposed to explain the association. The first one
states that the inflammatory process caused by the refluxate at the
laryngopharyngeal segment influences reduction in upper airway patency. This was
observed in 14.8% of patients in the current series, which presented significantly
higher BMI. The other theory believes that apnea increases intrathoracic pressure
gradientes and awakenings, which facilitate reflux. This was observed in 25.9% of
our patients. Future studies with larger series and rigid design are necessary to better
clarify the factors leading to the temporal associations found between reflux and
respiratory events. Conclusion: A temporal association between reflux and
obstructive respiratory events was found in 40.7% of patients with
Laryngopharyngeal Reflux and Obstructive Sleep Apnea.
APÊNDICE
89
90
Termo de consentimento livre e esclarecido
Eu, Sandra Doria Xavier, portadora do RG 23620187-6, CPF: 269094748-05,
CRM 101577, pesquisadora e pós-graduanda da Faculdade de Ciências Médicas da
Santa Casa de São Paulo residente na cidade de São Paulo – SP, cujo telefone de
contato é (11) 99972-0009, vou desenvolver uma pesquisa cujo título é “Associação
temporal entre episódios de refluxo e eventos obstrutivos respiratórios em
pacientes com refluxo laringofaríngeo e síndrome da apneia obstrutiva do
sono”.
As apneias são paradas da respiração durante o sono causadas por um
fechamento momentâneo da garganta. A cada parada, cai o oxigênio que chega ao
organismo, podendo levar a sérias consequências, como pressão alta, infarto e
derrames. O refluxo, que é a subida do ácido do estômago para a garganta, está
muito associado à apneia. O refluxo pode piorar a apneia por inflamar a região da
garganta e, ao mesmo tempo, a apneia pode piorar o refluxo por facilitar a subida do
ácido.
O objetivo deste estudo é entender melhor a associação destas duas doenças
para conseguir tratar ambas de forma mais adequada.
Sua participação nesta pesquisa é voluntária e constará de algumas etapas.
Primeiramente, será necessário o preenchimento alguns questionários, que dizem
respeito às suas queixas de ronco, apneia e refluxo na garganta. Em seguida será
feito um exame do nariz e da garganta, chamado laringoscopia, no qual se introduz
um aparelho de fibra óptica ou por via nasal ou pela própria boca, ligado a uma
câmera. Este exame será realizado por mim, no Departamento de
Otorrinolaringologia da Santa Casa de São Paulo. Este exame consegue ver todas
as estruturas da laringe, a fim de se pesquisarem possíveis alterações das pregas
vocais e da mucosa da laringe. Este exame será feito com anestesia local em spray
e dura poucos minutos, sendo levemente incômodo e com risco de complicação não
mensurável de tão pequeno.
Para fazer o diagnóstico do refluxo, será feita uma série de exames. O
primeiro é a endoscopia digestiva alta, que será feita na Santa Casa pela equipe de
endoscopia, que é especializada no procedimento e o realiza diariamente. Para
fazer este exame, o paciente precisa ficar sem comer (jejum) por 8 horas. Consiste
na passagem de um tubo de fibra óptica pela boca para a visualização do esôfago,
estômago e início do intestino e é feita dormindo, depois de receber uma medicação
(sedação) na veia. Depois de acordar, o paciente vai com seu acompanhante para
casa, no mesmo dia. Esta etapa apresenta um desconforto mínimo, pois a sedação
ajuda o paciente a realizar o exame sem maiores dificuldades, e o risco de
complicação é baixo, permitindo que ele seja realizado em qualquer idade.
Outro exame que será feito será a manometria esofágica, que será feita no
serviço de Gastroenterologia do Hospital das Clínicas de São Paulo, que é
especializado no procedimento e o realiza diariamente. Apesar de ser feito pela
equipe da cirurgia, não é uma cirurgia, mas sim um exame muito parecido com a
endoscopia, em que é colocada uma sonda (canudinho) por dentro do nariz até o
esôfago (tubo que liga a garganta ao estômago). O exame é feito com o paciente
acordado para que possa ser testada a capacidade de engolir volumes diferentes de
água. Este exame dura poucos minutos e tem o objetivo de localizar onde estão as
91
aberturas do estômago para o esôfago e do esôfago para a garganta, além de
estudar se a movimentação do esôfago está adequada. O exame causa pequeno
desconforto durante a passagem da sonda, o qual desaparece imediatamente após
sua retirada.
Em seguida será feito o exame de pH-impedanciometria, também no Hospital
das Clínicas de São Paulo. Neste, outra sonda será passada pelo nariz e será
engolida para ficar no esôfago de um dia para outro, para saber se há refluxo e qual
o tipo (ácido, não ácido, líquido ou gasoso). O exame de pH-impedanciometria
também é indolor e pode causar incômodo por necessitar que a sonda fique dentro
do nariz e esôfago durante 24 horas. Com a sonda colocada, o paciente poderá
comer normalmente. Raramente a passagem da sonda pode causar sangramento no
nariz, que é rapidamente controlado.
Como temos o objetivo de relacionar as apneias noturnas e o refluxo, o
paciente passará a noite no InCor (Laboratório do Sono – Instituto do Coração), para
que seja feito um exame de monitorização do sono, do ronco e das apneias em
conjunto com a pH-impedanciometria. Este exame chama-se polissonografia e
consiste na colocação de fios grudados no couro cabeludo, no queixo, ao redor dos
olhos e fios para eletrocardiograma que irão monitorar se a pessoa está acordada ou
dormindo e se há apneia ou alteração dos batimentos do coração. O exame de
polissonografia não causa dor, apenas incômodo mínimo pelos fios presos ao corpo
com fita adesiva. No início da manhã, quando terminar a polissonografia, será
retirada a sonda da pH-impedanciometria e o paciente poderá ir para casa.
Sua participação não trará qualquer benefício direto, mas proporcionará um
melhor conhecimento a respeito da relação entre refluxo e apneia.
Não existe outra forma de obter dados com relação ao procedimento em
questão e que possa ser mais vantajosa. Informo que o paciente tem a garantia de
acesso, em qualquer etapa do estudo, sobre qualquer esclarecimento de eventuais
dúvidas. Se tiver alguma consideração ou dúvida sobre a ética da pesquisa, entre
em contato com o Comitê de Ética em Pesquisa (CEP) da Santa Casa de
Misericórdia de São Paulo – SP. Também é garantida a liberdade da retirada de
consentimento a qualquer momento e deixar de participar do estudo, sem qualquer
prejuízo.
Garanto que as informações obtidas serão analisadas em conjunto com
outros pacientes, não sendo divulgada a identificação de nenhum dos participantes.
O paciente tem o direito de ser mantido atualizado sobre os resultados parciais das
pesquisas, e caso seja solicitado, darei todas as informações que solicitar. Não
existirão despesas ou compensações pessoais para o participante em qualquer fase
do estudo, incluindo exames e consultas. Também não há compensação financeira
relacionada à sua participação. Se existir qualquer despesa adicional, ela será
absorvida pelo orçamento da pesquisa. Eu me comprometo a utilizar os dados
coletados somente para pesquisa e os resultados serão veiculados através de
artigos científicos, em revistas especializadas e/ou em encontros científicos e
congressos, sem nunca tornar possível a sua identificação. Abaixo está o
consentimento livre e esclarecido para ser assinado caso não tenha ficado qualquer
dúvida.
Acredito ter sido suficientemente informado a respeito das informações que li
ou que foram lidas para mim, descrevendo o trabalho “Associação temporal entre
92
episódios de refluxo e eventos obstrutivos respiratórios em pacientes com
refluxo laringofaríngeo e síndrome da apneia obstrutiva do sono”. Eu discuti
com a médica Dra. Sandra Doria Xavier sobre minha decisão em participar deste
estudo. Ficaram claros para mim quais são os propósitos do estudo, os
procedimentos a serem realizados, seus desconfortos e riscos, as garantias de
confidencialidade e de esclarecimentos permanentes. Ficou claro também que
minha participação é isenta de despesas e que tenho a garantia de acesso aos
resultados e de esclarecer minhas dúvidas a qualquer tempo. Concordo
voluntariamente em participar deste estudo e poderei retirar meu consentimento a
qualquer momento, antes ou durante o estudo, sem penalidade ou prejuízo ou perda
de qualquer benefício que eu possa ter adquirido.
Data:
_________________________________________________
Assinatura do paciente ou responsável legal
_________________________________________________
Assinatura da pesquisadora – Dra Sandra Doria Xavier CRM 101577
93
Classificação de Los Angeles: Classificação endoscópica de esofagite erosiva
Grau
Achado
A
Uma ou mais erosões menores do que 5 mm
B
Uma ou mais erosões maiores do que 5 mm em sua maior extensão, não
contínuas entre os ápices de duas pregas esofágicas
C
Erosões contínuas (ou convergentes) entre os ápices de pelo menos
duas pregas, envolvendo menos de 75% do órgão
D
Erosões ocupando pelo menos 75% da circunferência do órgão
Fonte: Lundell et al., 1999.