PROGRAMA DE PÓS-GRADUAÇÃO EM HEPATOLOGIA
UNIVERSIDADE FEDERAL DE CIÊNCIAS DA SAÚDE DE PORTO ALEGRE
PERFIL LIPÍDICO DE PACIENTES CIRRÓTICOS E SUA CORRELAÇÃO COM OS
ESCORES PROGNÓSTICOS
Lílian Bassani
Orientador: Prof. Dr.Cláudio Augusto Marroni
2011
PROGRAMA DE PÓS-GRADUAÇÃO EM HEPATOLOGIA
UNIVERSIDADE FEDERAL DE CIÊNCIAS DA SAÚDE DE PORTO ALEGRE
PERFIL LIPÍDICO DE PACIENTES CIRRÓTICOS E SUA CORRELAÇÃO COM OS
ESCORES PROGNÓSTICOS
Lílian Bassani
Orientador: Prof. Dr.Cláudio Augusto Marroni
Dissertação
submetida ao Programa de Pós-
Graduação em Hepatologia da Universidade Federal
de Ciências da Saúde de Porto Alegre como
requisito para obtenção do grau de Mestre.
2011
Catalogação da Publicação
B317p Bassani, Lilian
Perfil lipídico de pacientes cirróticos: correlação com
marcadores de prognóstico child-pugh, meld, variáveis
bioquímicas e os genótipos do vírus da hepatite C / Lilian
Bassani. – Porto Alegre, 2011.
56 f.: il.; graf.; tab.
Dissertação (mestrado) -- Universidade Federal de
Ciências da Saúde de Porto Alegre, Programa de PósGraduação em Hepatologia, 2011.
“Orientador: Prof. Dr. Cláudio Augusto Marroni”.
1. Cirrose. 2. HCV. 3. Álcool. 4. Lipoproteínas. 5. Escore
prognósticos. I. Marroni, Cláudio Augusto. II. Título.
CDD 616.362 4
CDU 616.36-004
AGRADECIMENTOS
A conclusão deste trabalho seria impossível sem a colaboração de algumas pessoas e
instituições que, de diversas formas, deram sua contribuição em diferentes etapas. Sobre os
seguintes, manifesto um agradecimento especial:
Deus, por tudo.
Ao professor Dr. Cláudio Augusto Marroni, que orientou o desenvolvimento deste
trabalho, por me oferecer essa importante oportunidade de crescimento profissional. Sempre
dedicado e empenhado, mesmo com tantas outras obrigações e afazeres.
Aos meus pais, Idevar A. Bassani e Maris Stela V. Bassani, por tudo que sou,
exemplo, confiança, apoio e carinho em todas as horas. Mãe, muito obrigada pelas orações
para que eu concluísse, com sucesso, mais esta etapa da minha vida.
Aos meus irmãos, em especial minha irmã Raquel Bassani, amiga e companheira, sem
a qual, literalmente, a conclusão deste mestrado não aconteceria.
Às amigas do grupo de pesquisa, Sabrina Fernandes, Flávia Feijó, Maria Eugênia
Deutrich, Stéfani Schneider, Mariane Bertotto e Danielle Harter, pela ajuda e companhia nesta
longa caminhada.
À amiga Deise Felix, pelos anos de amizade.
Ao amigo Rafael Loch, pelo apoio e incentivo, ao longo destes dois anos.
Ao amigo Thiago M. Delabary, pelo auxílio na finalização do texto.
Às secretárias da Pós Graduação, em especial, Luciane Spencer, por ser tão paciente,
colaboradora e eficiente nas questões práticas relacionadas a este mestrado.
À Professora Maria Terezinha Antunes, pela confiança no meu trabalho desde o
primeiro dia em que me tornei REUNI. Obrigada pela oportunidade de conhecer, de perto, as
entrelinhas da docência. Graças a isso, hoje, tenho certeza de que ser Professora é o que me
proporciona maior realização profissional.
A todos os médicos e residentes que atendem ou atenderam no ambulatório de
Gastroenterologia do Complexo Hospitalar Santa Casa, pela paciência e humildade no
momento das discussões dos casos.
Aos colegas das disciplinas obrigatórias, que pacientemente respeitaram as dúvidas,
muitas vezes, superficiais para eles, uma vez que são médicos, mas fundamentais para mim.
Às secretárias da Pró-Reitoria, pela atenção nestes dois anos.
À estatística Ceres Oliveira, pela paciência com a explicação das análises.
Aos Professores do Curso de Pós-Graduação em Medicina-Hepatologia e da
Universidade Federal de Ciências da Saúde de Porto Alegre, pelos conhecimentos e vivências
transmitidos.
Ao chefe do Serviço de Gastroenterologia, Dr. Ângelo Mattos.
À UFCSPA, pela maneira carinhosa e acolhedora com que me recebeu.
Ao Complexo Hospitalar Santa Casa de Porto Alegre, pelos prontuários utilizados na
realização desta pesquisa.
SUMÁRIO
1 REFERENCIAL TEÓRICO_________________________________________
12
1.1 Cirrose__________________________________________________________
12
1.2 Vírus da Hepatite C_______________________________________________
13
1.3 Álcool___________________________________________________________
15
1.4 Metabolismo Lipídico_____________________________________________
16
1.4.1 Lipídeos________________________________________________________
16
1.4.2 Lipoproteínas____________________________________________________
17
1.4.3 Metabolismo das Lipoproteínas e do Colesterol_________________________
18
1.5 Alterações no Metabolismo Lipídico de Pacientes Cirrótico______________
19
1.5.1 Hipóteses Para Redução Do Perfil Lipídico No Paciente Cirrótico__________
20
2 JUSTIFICATIVA__________________________________________________
25
3 OBJETIVOS______________________________________________________
26
3.1 Objetivo Geral____________________________________________________
26
3.2 Objetivos Específicos_______________________________________________
26
4 REFERÊNCIAS BIBLIOGRÁFICAS ( Referencial Teórico)______________
27
5 ARTIGO A SER PUBLICADO_______________________________________
34
6. ANEXO__________________________________________________________
52
LISTA DE ABREVIATURAS
Alb
albumina
ACAT
acil coa:colesterol aciltransferase
ADH
ácool desidrogenase
AG
ácidos graxos
ALDH
aldeído desidrogenase
ALT
alanina amino-transferase
Apo
apoproteína
Apo A-I
apoproteína A-I
Apo B
apoproteína B
Apo B-100
apoproteína B-100
Apo E
apoproteína E
AST
aspartato amino-transferase
BT
bilirrubina total
CE
colesterol esterificado
CHC
carcinoma hepatocelular
Col
colesterol
Cr
creatinina
CT
colesterol total
DHA
doença hepática alcóolica
HDL
lipoproteína de alta densidade
HIV
vírus da imunodeficiência humana
IDL
lipoproteína de densidade intermediária
IL6
interleucina tipo 6
LCAT
lecitina colesterol aciltransferase
LDL
lipoproteína de baixa densidade
LPL
lipase lipoprotéica
MELD
Model for End-stage Liver Disease
MEOS
sistema microssômico de oxidação do etanol
MTP
proteína microssomal transferidora de triglicerídeos
NADH/NAD
nicotinamida adenina dinucleotídio hidreto
Qm
quilomícrons
Qr
quilomícrons remanescentes
RAAS
renina angiotensina aldosterona
RNI
relação normalizada internacional
TG
triglicerídeos
TNF-α
fator de necrose tumoral alfa
VLDL
lipoproteína de muito baixa densidade
VHB
vírus da hepatite B
VHC
vírus da hepatite C
LISTA DE FIGURAS
Figura 1– Lipoproteínas plasmáticas: tamanho e densidade aproximados.
17
Figura 2 – Síntese hepática de colesterol.
21
Figura 3 - Redução dos níveis séricos de colesterol.
22
Figura 4 – Possíveis mecanismos responsáveis pela redução sérica de VLDL.
23
Figura A (Apêndice) – Caracterização da amostra estudada.
53
LISTA DE TABELAS
Tabela 1 (Artigo) – Caracterização da amostra, dados clínicos e demográficos.
41
Tabela 2 (Artigo) – Associação entre Child-Pugh, perfil lipídico e variáveis
42
bioquímicas.
Tabela 3 (Artigo) – Coeficiente de correlação de Pearson (R) entre o perfil
43
lipídico e os testes de função hepática e renal.
Tabela 4 (Artigo) - Medidas descritivas (média + desvio padrão) das análises
43
bioquímicas que avaliaram perfil lipídico, função renal, função hepática,
glicemia e o teste de comparação entre as etiologias da cirrose.
Tabela 5 (Artigo) - Medidas descritivas (média + desvio padrão) das análises
bioquímicas que avaliaram perfil lipídico, função renal, função hepática,
glicemia e o teste de comparação das variáveis entre os genótipos.
44
RESUMO
Introdução: O fígado exerce papel fundamental no metabolismo lipídico. Um grande número das
apolipoproteínas plasmáticas, lipídeos endógenos e lipoproteínas são sintetizadas pelos hepatócitos.
Em condições fisiológicas, o fígado garante a homeostase do metabolismo lipídico e das
lipoproteínas. Entretanto, na presença de cirrose, esse equilíbrio pode estar comprometido. Estudos
apontam que pacientes com cirrose apresentam alterações no metabolismo lipídico, especialmente
hipocolesterolemia. Já foi constatado que as concentrações de Colesterol Total (CT) e de
lipoproteínas diminuem com a progressão da doença e se correlacionam com os critérios de
prognóstico Child-Pugh e MELD e com os genótipos do Vírus da Hepatite C (VHC). Objetivos:
Avaliar o perfil lipídico (CT, Lipoproteína de Muito Baixa Densidade – VLDL-, Lipoproteína de
Baixa Densidade – LDL-, Lipoproteína de Alta Densidade- HDL – ,Triglicerídeos – TG ) de pacientes
com cirrose, de diferentes etiologias, e correlacionar, com os critérios de prognóstico Child-Pugh e
MELD, marcadores bioquímicos e os genótipos do VHC. Pacientes e métodos: Foram revisados os
prontuários de pacientes cirróticos em acompanhamento ambulatorial no Complexo Hospitalar Santa
Casa de Porto Alegre, RS, Brasil, no período de fevereiro a dezembro de 2010. Resultados: Foram
analisados 314 pacientes, destes, 153 preencheram os critérios de inclusão. Com relação à etiologia,
VHC estava presente em 53,6% (82), álcool 32,7% (50) e álcool/ VHC 13,7% (21). Sexo masculino
foi o mais prevalente (62,1%) e a média de idade foi de 59,3 ± 9,4 anos, sendo que a faixa etária
prevalente foi de 50-59 anos (37,3%), seguida pela faixa de 60-69 anos (32,7%). Dos pacientes com
VHC, o genótipo 3 foi prevalente com 50,5% seguido pelo genótipo 1 (47,6%). Quanto à classificação
Child-Pugh, 46,4% (71) tinham classificação A, 31,4% (48) classificação B, e 22,2% (34) tinham
classificação C. Com relação ao MELD, 64,7% (99) apresentaram valores <15, 24,2% (37) entre 1519 e 11,1% (17) ≥ 20. Observou-se que houve associação direta estatisticamente significativa
(p<0,05) entre perfil lipídico, albumina e sódio. Associação positiva também foi observada entre as
plaquetas e o perfil lipídico, exceto com o HDL. Associação inversa estatisticamente significativa
entre o perfil lipídico e as variáveis Bilirrubina Total, Relação Normalizada Internacional (RNI) e os
escores Child-Pugh e MELD. Em relação à Aspartato Amino-Transferase (AST), houve associação
inversa estatisticamente significativa com CT e LDL. Não houve diferença significativa (p>0,05)
entre os genótipos e as alterações no perfil lipídico, entretanto, o genótipo 3 apresentou os menores
níveis séricos de CT, LDL, TG, Creatinina e Plaquetas. Conclusão: A redução nos níveis séricos de
CT, LDL, HDL está relacionada com a gravidade da doença hepática, podendo ser utilizada como
indicador da função hepática.
Palavras-chave: Cirrose, HCV, álcool, lipoproteínas, escores prognósticos.
ABSTRACT
Introduction: The liver plays an essential role in the lipid metabolism. A large number of plasma
apolipoproteins, endogenous lipids and lipoproteins are synthesized by hepatocytes. Under
physiological conditions, the liver ensures the homeostasis of the lipid metabolism and of the
lipoproteins. In the presence of cirrhosis; however, this balance may be compromised. Studies
show that patients with cirrhosis develop alterations in the lipid metabolism, especially
hypocholesterolemia. It has already been found that concentrations of total cholesterol (TC) and
lipoproteins decrease with the disease progression and correlate with the Child-Pugh and MELD
prognostic criteria and with the genotypes of Hepatitis C Virus (HCV) as well. Objectives: To
evaluate the lipid profile ( TC, Very Low Density Lipoprotein – VLDL-, Low Density
Lipoprotein – LDL -, High-Density Lipoprotein – HDL -, Triglycerides – TG- ) in patients with
cirrhosis of different etiologies, and correlate them with the Child-Pugh and MELD prognostic
criteria, the biochemical markers and the genotypes of HCV. Patients and methods: We
reviewed the medical charts of outpatients with cirrhosis at a Hospital (Complexo Hospitalar
Santa Casa) in Porto Alegre, Brazil, period from February to December 2010. Results: We
analyzed 314 patients, of whom 153 met the inclusion criteria. Regarding etiology, HCV was
found in 53.6% (82), alcohol 32.7% (50) and alcohol / HCV 13.7% (21).Male sex was prevalent
(62.1%) and the average age was 59.3 ± 9.4 years old, and the prevalent age group was 50-59
(37.3%), followed by those aged 60-69 (32.7%).From the patients with HCV, genotype 3 was
prevalent with 50.5% followed by genotype 1 (47.6%). Regarding the Child-Pugh classification,
46.4% (71) were rated A, 31.4% (48) were rated B, and 22.2% (34) were rated C. Concerning
MELD, 64.7% (99) showed values <15, 24.2% (37) between 15-19 and 11.1% (17) ≥ 20. It was
found that there was a statistically significant (p <0.05) direct association between lipid profile,
albumin and sodium. It was also noted a positive association between platelets and lipid profile,
exception made to HDL. It was found a statistically significant inverse association between lipid
profile and variable Total Bilirubin, International Normalized Ratio (INR) - and the scores of
Child-Pugh and MELD. In relation to Aspartate Transaminase (AST), there was a statistically
significant inverse association with TC and LDL. There was no significant difference (p> 0.05)
between genotypes and changes in lipid profile, however, genotype 3 showed lower serum levels
of TC, LDL, TG, creatinine and platelets. Conclusion: The reduction in serum levels of TC,
LDL, and HDL is related to the severity of liver disease and may be used as an indicator of liver
function.
Key words: Cirrhosis, HCV, alcohol, lipoproteins, Prognostic score
12
1 REFERENCIAL TEÓRICO
1.1 Cirrose
A cirrose, caracterizada pela substituição difusa da estrutura hepática normal por
nódulos de estrutura anormal circundados por fibrose, é o estádio final comum de uma série
de processos patológicos hepáticos de diversas causas37 sendo que a infecção crônica pelo
vírus da hepatite B (VHB), o vírus da hepatite C (VHC) e o consumo do álcool são os agentes
etiológicos mais prevalentes. Cirrose por álcool e VHC são as causas mais comuns no mundo
ocidental, enquanto que VHB prevalece em muitas partes da Ásia e África61,70,71.
Apesar de haver muitas pesquisas em relação ao desenvolvimento da fibrose hepática,
o entendimento de sua etiopatogênese continua controverso. Vários estudos têm demonstrado
que a célula-chave na produção da fibrose no fígado é a célula estrelada de Ito, situada no
espaço de Disse29. Essa é uma célula armazenadora de gordura e vitamina A que, sob a ação
de citocinas fibrogênicas, diferencia-se em miofibroblasto e fibroblasto, engajando-se na ativa
síntese dos elementos da matriz (colágenos, elastina, proteoglicanos e proteínas de
constituição)87.
As principais consequências clínicas da cirrose são insuficiência hepática, hipertensão
portal (aumento da resistência intra-hepática) e o desenvolvimento de carcinoma hepatocelular
(CHC). As alterações circulatórias, geralmente verificadas em casos de cirrose (vasodilatação
esplâncnica, vasoconstrição extra-esplâncnica, hipoperfusão dos rins, retenção de água e sal,
aumento do débito cardíaco), estão intimamente relacionadas com as alterações hepáticas e
vasculares decorrentes da hipertensão portal23,86.
Considerada uma das principais causas de doença hepática, a cirrose é responsável por
aproximadamente 1,1% das mortes anuais42. Em 2001, foi considerada a 14ª causa de morte
no mundo e, acredita-se que até 2020, alcançará a 12ª posição entre as causas de óbito48,55.
A cirrose apresenta-se sob a forma compensada ou descompensada, sendo que a
mortalidade aumenta drasticamente quando os pacientes descompensam. A taxa anual de
mortalidade dos pacientes compensados, geralmente assintomáticos, varia de 1 a 3,4%, já nos
descompensados (presença de sangramento visceral, ascite, encefalopatia e síndrome hépatorenal) é de 20 a 57%17.
13
No Brasil, no ano de 2007, 1,75% dos registros de óbitos foram em decorrência de
doença Hepática (doença alcoólica – 0,85% e cirrose – 0,90%)21. No Rio Grande do Sul, em
2006, o percentual de óbitos foi de 1,6% (N= 1193)19. Na Região Metropolitana de Porto
Alegre, no ano de 2006, 435 pessoas vieram a falecer em decorrência de doença alcoólica e
cirrose20.
O prognóstico da cirrose depende da etiologia, da gravidade da hepatopatia, da
presença de doenças associadas e outras complicações. Várias pesquisas têm sido feitas com o
intuito de encontrar o melhor instrumento, não invasivo e de fácil utilização, para avaliar o
grau de comprometimento hepático, bem como o prognóstico dos pacientes24. Dentre os mais
utilizados estão os escores Child-Pugh e MELD (The Model for End Stage Liver Disease)35. O
escore Child-Pugh inclui três variáveis contínuas (tempo de protrombina, bilirrubina total e
albumina) e duas quantitativas (ascite e encefalopatia hepática). Uma pontuação 1,2 ou 3 foi
atribuída às variáveis, a fim de definir três grupos de pacientes com doenças de gravidade
crescente, identificadas pelas letras A, B e C. O grupo A é formado por pacientes com escore
(soma dos pontos) entre 5 e 6, o B entre 7 e 9 e o C entre 10 e 159. Estudo realizado com 177
pacientes cirróticos, para avaliar a validade prognóstica do escore Child-Pugh, concluiu que a
taxa de sobrevida de um ano é de 100 % para pacientes Child A, 80% para B e 45% para C39.
O escore MELD resulta num valor numérico obtido através de uma fórmula logarítmica em
que as variáveis são os níveis séricos de creatinina e bilirrubina e o valor do RNI (Relação
Normalizada Internacional)88. É utilizado, atualmente, como um dos preditores de mortalidade
em pacientes cirróticos, particularmente nos três primeiros meses, além de ser um marcador
de prioridade para pacientes em lista de transplante hepático7,8,16.
1.2 Vírus da Hepatite C
A infecção pelo VHC é, atualmente, uma das principais causas de doença hepática
crônica no mundo74. Os dados disponíveis sugerem que a prevalência mundial da infecção
pelo VHC é de cerca de 2,2-3,0%, ou seja, 130 – 170 milhões de indivíduos infectados65,74.
Estima-se que, anualmente, surjam, em âmbito mundial, de 3 a 4 milhões de novos casos12.
No Brasil, ainda não existem estudos capazes de estabelecer sua real prevalência,
estima-se que 1% a 2% da população em geral esteja infectada com o Vírus C26,68. Dados do
Ministério da Saúde51 contabilizam 93.238 casos confirmados de hepatite C no Brasil, entre
14
1996 e 2006, com prevalência de distribuição de 52,5% na Região Sudeste, 31,9% na Região
Sul, 6,5% na Região Centro-Oeste, 6,2% na Região Nordeste e 2,9% na Região Norte. A
distribuição dos casos de hepatite C, segundo a faixa etária, apresenta uma concentração de
casos em adultos com idade entre 40 a 59 anos. Essa distribuição pode ser explicada pela
característica clínica da doença, que praticamente tem curso assintomático e padrão de
evolução longo63.
Estudos sugerem que de 3 a 25% dos pacientes cronicamente infectados irão
desenvolver cirrose num período de 20 anos34,59, e uma proporção significativa (0,2 a 2,5%)
vai desenvolver hepatocarcinoma36,43.
O VHC pertence à família Flaviviridae, gênero Hepacivirus. São consideradas
populações de risco acrescido à infecção pelo VHC por via parenteral: indivíduos que
receberam transfusão de sangue e/ou hemoderivados antes de 1993; usuários de drogas
injetáveis, inaláveis ou pipadas que compartilham os equipamentos de uso; pessoas com
tatuagem, piercings ou que apresentem outras formas de exposição percutânea. A transmissão
sexual é pouco frequente (menos de 1% em parceiros estáveis), no entanto, a coexistência do
Vírus da Imunodeficiência Humana (HIV) constitui-se um importante facilitador dessa
transmissão. A transmissão vertical é rara quando comparada a do Vírus da Hepatite B52.
A alta taxa de cronificação da hepatite C decorre da habilidade do vírus em apresentar
mutações ante a pressão do sistema imunológico. Tais mutações explicam a grande
diversidade genética do vírus, resultando em variantes distintas imunologicamente
(genótipos, subtipos e quasispecies)80.
A análise filogenética das sequências genômicas permitiu a caracterização de seis tipos
de VHC, identificados por números arábicos (1, 2, 3, 4, 5, 6) e subtipos identificados por
letras minúsculas do alfabeto (a,b,c...), ambos por ordem de descoberta. Dentro de um mesmo
genótipo e subtipos, ocorrem ainda variações do VHC denominadas quasispecies78.
Com relação à distribuição geográfica mundial dos genótipos do VHC, nota-se que os
tipos 1a, 1b, 2a, 2b, e 3a são encontrados no Brasil, Europa Ocidental e Estados Unidos,
enquanto 1b, 2a e 2b são frequentemente encontrados no Japão e Taiwan. O tipo 3 é
prevalente na Ásia27.
Dentro do território Nacional, um estudo multicêntrico analisou a distribuição
geográfica dos genótipos e observou que a distribuição foi estatisticamente diferente entre as
regiões brasileiras. O genótipo 1 foi o mais frequente em todas as regiões (Norte-74,1% ;
Nordeste- 66,7%, Sudeste-66,4%, Centro-Oeste- 57,0% e Sul-51,7%). O genótipo 2
15
prevaleceu na região Centro-Oeste (11,4%), diminuindo nas regiões Sul (5,1%), Sudeste
(4,7%), Nordeste (3,0%) e Norte (1,2%). Com relação ao genótipo 3, a maior prevalência foi
na região Sul (43,2%), seguida pelo Centro-Oeste (31,6%), Nordeste (30,4%), Sudeste
(28,4%) e Norte (24,7%) . Os genótipos 4 e 5 foram detectados somente na região Sudeste10.
Na Região Sul (Rio Grande do Sul e Santa Catarina) os dados de uma pesquisa
realizada no período de 2001 a 2003, com 627 hepatopatas crônicos por VHC , demostrou a
presença de 3 genótipos (1,2,3), sendo a maior prevalência o HCV tipo 1 (53,9%), seguido
pelo 3 ( 40,7%) e tipo 2 ( 5,4%)76.
O VHC afeta principalmente o fígado, mas diversos tecidos podem estar envolvidos,
resultando num amplo espectro de manifestações extra-hepáticas, entre elas alterações no
metabolismo lipídico32 e Diabetes Mellitus Tipo 2 (DM2)85
1.3 Álcool
O consumo excessivo de bebidas alcoólicas representa um grave problema à saúde
pública mundial, fato que tem despertado interesse de vários pesquisadores. A ingestão
abusiva de álcool é uma das causas mais frequentes de cirrose nos países desenvolvidos66,79.
Estudo realizado em 16 Países Europeus, durante 25 anos (1970-2006), evidenciou a
associação entre o consumo de álcool e os índices de mortalidade por cirrose3. No Brasil, os
dados publicados no Io Levantamento Nacional sobre padrões de consumo de álcool na
população brasileira45 constataram que a faixa etária entre 18-24 anos apresentou o maior
percentual de dependência (15%), seguida pelas faixas 24-34 anos (9%), 35-44 anos (7%), 4559 anos (7%) e 60 ou mais (3%)45.
A Doença Hepática Alcoólica (DHA), ou seja, hepatopatia induzida pelo etanol e/ou
seus metabólitos, pode ser dividida em três formas: esteatose, hepatite alcoólica e cirrose. Tais
formas representam etapas evolutivas de um mesmo processo patogênico. Em fase inicial, o
aspecto histológico característico é a esteatose (deposição excessiva de gorduras nas células
hepáticas), depois predominam a necrose e a inflamação, com surgimento de fibrose,
caracterizando a hepatite alcoólica. Com a progressão da fibrose, há a modificação da
arquitetura normal do fígado, com formação nodular (cirrose), e com posterior
desenvolvimento de hipertensão portal e insuficiência hepática22.
16
A hepatotoxicidade do etanol está intimamente relacionada com o seu metabolismo,
que ocorre, principalmente, no fígado. A metabolização ocorre com o auxílio das enzimas
álcool desidrogenase (ADH), aldeído desidrogenase (ALDH), sistema microssômico de
oxidação do etanol (MEOS). A oxidação do etanol ocorre em duas fases: na primeira, ele é
transformado em aldeído acético (substância vasoativa mais tóxica que o próprio etanol); na
segunda, o aldeído acético é transformado em acetato. Em consequência da oxidação do
etanol, ocorrem importantes modificações bioquímicas, especialmente o aumento da relação
nicotinamida adenina dinucleotídio hidreto (NADH/NAD), além da formação de aldeído
acético, proliferação microssômica, entre outras que integram o conjunto de mecanismos
responsáveis pela lesão hepática50.
É difícil definir formalmente “um limiar tóxico” de consumo de álcool sobre o fígado
2,50
. As mulheres são mais suscetíveis à lesão hepática alcoólica, quando comparadas aos
homens. A maior suscetibilidade deve-se principalmente à reduzida atividade da ADH
gástrica, o que leva a uma diminuição do metabolismo gástrico do etanol com posterior
sobrecarga hepática1.
1.4 Metabolismo Lipídico
1.4.1 Lipídeos
Os lipídeos são elementos químicos fundamentais para a formação de todas as células
do organismo humano, para secreção de vitaminas, bile, hormônios esteróides e para a
produção e armazenamento de energia69.
Os lipídeos são biomoléculas que se caracterizam por serem insolúveis em água e
solúveis em solventes orgânicos. Quimicamente, são compostos que produzem ácidos graxos
pela hidrólise ou alcoóis complexos, que podem se combinar com ácidos graxos formando
ésteres. Os principais lipídeos de importância clínica são:
- Ácidos graxos (AG) - além de fornecerem energia, são importantes componentes
estruturais dos lipídeos. Podem ser obtidos através da dieta (via exógena) ou produzidos pelo
próprio organismo (via endógena), em um processo chamado de lipogênese69.
- Triglicerídeos (TG) - apresentam um papel essencialmente energético, para uso
imediato ou posterior armazenamento. São obtidos da dieta ou produzidos pelo organismo a
partir da esterificação do glicerol com três moléculas de ácidos graxos5.
17
- Fosfolipídeos - conferem função estrutural na dupla camada que constitui as
membranas celulares e na superfície das partículas de lipoproteínas84.
- Colesterol (Col) – esteróide característico dos tecidos animais, desempenha várias
funções essenciais, entre elas: componente estrutural de todas as membranas celulares;
precursor de ácidos biliares, de hormônios esteróides e da vitamina D. A maior parte de sua
biossíntese ocorre nos hepatócitos13.
1.4.2 Lipoproteínas
As lipoproteínas são macromoléculas constituídas de uma fração lipídica
(triglicerídeos, fosfolipídeos, colesterol livre e esterificado) e outra protéica, as apoproteínas
(Apo). Elas têm como função manter os lipídeos em solução (principalmente os triglicerídeos
e os ésteres de colesterol) durante o transporte entre os tecidos. Elas diferem na composição
lipídica e protéica, no tamanho, na densidade e no sítio de origem14. Figura 1.
As partículas de lipoproteínas plasmáticas incluem Quilomícrons (Qm), Lipoproteína
de Densidade Muito Baixa (VLDL), Lipoproteína de Densidade Baixa (LDL) e as
Lipoproteínas de Alta Densidade (HDL)6.
Figura 1. Lipoproteínas plasmáticas: tamanho e densidade aproximados.
VLDL= Lipoproteína de muito baixa densidade; LDL= Lipoproteína de baixa densidade; HDL= Lipoproteína de alta
densidade. (Adaptada de: bChampe 2009 )
18
1.4.3 Metabolismo das Lipoproteínas e Colesterol
Os Qm são os responsáveis pelo transporte da gordura exógena (proveniente da dieta),
levando-a do intestino para o fígado. Ao saírem dos enterócitos e entrarem na circulação
plasmática, entram em contato com outras lipoproteínas, principalmente a HDL (sintetizada
pelo fígado). Paralelo a isso, vão perdendo triglicerídeos e tornando-se cada vez menores,
passando a ser denominado Quilomícrons remanescentes (Qr). Os Qr são reconhecidos pelos
receptores da apoproteína E (Apo E) e endocitados nos hepatócitos, onde tanto o colesterol
como as frações protéicas restantes são metabolizadas, finalizando o metabolismo exógeno
das gorduras e dando origem a VLDL84.
O metabolismo endógeno dos lipídeos inicia com a produção de VLDL. A VLDL
(lipoproteína formada no hepatócito, a partir de ácidos graxos provenientes da circulação, ou
da própria síntese hepática, ou ainda oriundos da hidrólise dos Qr ), é a principal responsável
pelo transporte endógeno das gorduras, ou seja, leva os lipídeos sintetizados no fígado aos
tecidos periféricos, onde são degradados pela lipase lipoprotéica (LPL)69.
À medida que os TG são removidos das VLDLs, estas recebem colesterol estereficado
das HDL. Esse processo é executado pela proteína transferidora de ésteres de colesterol. As
VLDLs, quando perdem 21% do seu conteúdo de TG, passam a ser denominadas de IDL
(Lipoproteína de Densidade Intermediária) ou VLDL remanescentes. Uma parte será captada
pelos receptores hepáticos e outra parte continuará no plasma, sofrendo catabolismo e
transformando-se em LDL. Nesse catabolismo adicional, as LDL recebem colesterol
esterificado contido nas HDL em troca de TG, ficando dessa forma com menor teor de TG e
maior teor de colesterol esterificado. A LDL sofre, então, endocitose mediada por receptores,
e seus componentes são degradados nos lisossomos14. A endocitose da LDL é a principal
forma de transporte e entrega do colesterol para os tecidos periféricos84.
Em paralelo às etapas anteriores, ocorre o metabolismo do HDL. Vários mecanismos
estão envolvidos na sua síntese e secreção. O primeiro é a síntese pelo fígado e pelo intestino
como uma molécula relativamente pequena, cuja superfície, semelhante a outras lipoproteínas,
contém fosfolipídeos, colesterol livre e uma variedade de apoproteínas, sendo predominante a
apoproteína AI (Apo AI)47. Um segundo método para geração de HDL é o brotamento de
apoproteínas a partir de Qm e VLDL, quando elas são digeridas pela lípase lipoproteica. Um
terceiro método para geração de HDL é a Apo A I livre que pode ser desprendida de outras
19
lipoproteínas e membranas celulares para formar uma partícula semelhante à HDL nascente
dentro da circulação44.
A principal função da HDL é transportar o excesso de colesterol obtido nos tecidos
periféricos para o fígado e trocar proteínas e lipídeos com Qm e VLDLs. Além disso, a HDL
obtém o colesterol de outras lipoproteínas e de membranas celulares e o converte em ésteres
de colesterol pela ação da enzima lecitina colesterol aciltransferase (LCAT)28.
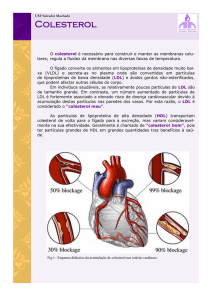
Colesterol
Além do colesterol exógeno absorvido através do trato gastrointestinal, o organismo
humano também é capaz de sintetizar, aproximadamente, 500 mg de colesterol/dia. A maior
parte da sua biossíntese ocorre nos hepatócitos, em uma das três formas: ésteres de colesterol,
colesterol biliar ou ácidos biliares. A produção de ésteres de colesterol no fígado é catalisada
pela acil coA:colesterol aciltransferase (ACAT). Após a esterificação, uma parte do colesterol
é transferida pela ação da proteína microssomal, transferidora de triglicerídeos (MTP), para o
núcleo central da VLDL, para que seja transportada para os tecidos77.
1.5 Alterações no Metabolismo Lipídico do Paciente Cirrótico
O fígado é considerado o sítio principal do metabolismo lipídico. Os hepatócitos
contribuem com ambos os ciclos, exógeno e endógeno, além de fazer parte do transporte dos
lipídeos através do plasma. Em um organismo saudável, um equilíbrio complexo é mantido
entre a biossíntese, a utilização e o transporte do colesterol e das lipoproteínas, no entanto, na
presença de cirrose, essa homeostase é rompida, gerando um desequilíbrio nesse sistema41.
Quadros de dislipidemias, observados na cirrose, diferem daqueles encontrados na
maioria das outras causas de dislipidemias secundárias, porque as lipoproteínas circulantes
estão não somente em quantidades anormais, mas também apresentam composição,
mobilidade eletrosférica e aparência alteradas49.
Estudos apontam que pacientes com cirrose apresentam alterações no metabolismo
lipídico,
especialmente
hipocolesterolemia
e
hipobetalipoproteinemia25,56,82.
Autores
demonstram que tais modificações evoluem com a progressão da hepatopatia e podem ser
20
utilizadas como um fator de prognóstico da descompensação da doença33,41,62. D’Arienzo et
al.18 avaliaram o papel prognóstico da hipocolesterolemia em 34 pacientes com cirrose
avançada por VHC. Como resultado final, observaram que todos os pacientes que
apresentavam nível sérico de colesterol < 100 mg/dL morreram dentro de 17 meses, enquanto
que 75% daqueles com nível de colesterol > 100 mg /dL sobreviveram pelo menos 2 anos.
Zauner e col.89 analisaram os fatores relacionados à mortalidade de 196 pacientes cirróticos
que exigiam tratamento intensivo. Eles constataram que o nível sérico de colesterol associouse, de forma independente, à mortalidade intra-hospitalar, juntamente com os níveis de
bilirrubina total, creatinina e lactato. A pesquisa realizada com 99 pacientes cirróticos em lista
de transplante hepático encontrou redução significativa no tempo de sobrevivência dos
pacientes que apresentaram hipoalbuminemia (albumina <2,5 g/dL), hipocolesterolemia
(Colesterol Total < 100 mg/dL) e hiponatremia (Sódio < 130 mEq/L)72.
Ghadir et al.30, através de um estudo transversal, verificaram que os pacientes
cirróticos – de diferentes etiologias – apresentaram redução no perfil lipídico quando
comparados com o grupo controle. Logo, essa redução estava associada, significativamente, à
progressão da cirrose. No entanto, o mecanismo exato responsável pela alteração lipídica nos
pacientes cirróticos por álcool ou vírus C ainda não foi elucidado, conquanto haja algumas
hipóteses que estão sendo exploradas na tentativa de justificar tal modificação.
1.5.1 Hipóteses para Redução do Perfil Lipídico no Paciente Cirrótico
A) Relação entre a redução do perfil lipídico e a etiologia da hepatopatia
Embora a alteração no metabolismo lipídico possa ser encontrada em hepatopatias
crônicas de diferentes etiologias30, a relação entre VHC e o metabolismo lipídico parece ser
mais específica. A associação entre VHC, lipoproteínas e esteatose tem sido descrita por
alguns autores15,54,73.
Acredita-se que o VHC possa influenciar a composição bioquímica das lipoproteínas
e, em alguns casos, até mesmo modificar o metabolismo lipídico56. Pacientes com infecção
crônica por VHC apresentam redução dos níveis de Colesterol Total (CT), LDL e HDL
quando comparados com controles não infectados. Sendo que os pacientes com genótipo 3
apresentam maior incidência de esteatose e redução mais pronunciada dos lipídeos58,75.
21
A presença da associação de esteatose em pacientes com hepatite crônica pelo VHC
tem ampla variabilidade na literatura. Quando analisada pela ótica crônica do VHC, a
prevalência da associação com esteatose pode variar na dependência de fatores virais como o
genótipo, tratamento antiviral prévio e graduação da fibrose11,67.
No mecanismo viral induzido, a patogênese está diretamente associada ao efeito
citopático do VHC genótipo 3. A proteína do core do VHC genótipo 3 induz a transcrição de
genes envolvidos no metabolismo lipídico, interferindo na formação e liberação de
apoproteína B (Apo B)46. Ela interfere também na função da MTP, localizada no retículo
endoplasmático dos hepatócitos, impedindo a formação e liberação de VLDL53,58.
Embora a esteatose, de moderada a acentuada, seja um sinal morfológico sugestivo de
infecção pelo genótipo 3 do VHC, sua presença não é necessariamente obrigatória na
cirrose67.
B) Redução dos níveis séricos de colesterol
A biossíntese e o transporte de colesterol são regulados pelos controles: (1) atividade
da enzima HMG-CoA-redutase (3-hidroxi-3-metilglutaril coenzima A redutase), (2) taxa de
síntese de receptor de LDL e (3) taxa de esterificação de colesterol pela ACAT ( Figura 2).
Figura 2. Síntese hepática de colesterol.
HMG-CoA-redutase
SÍNTESE
COLESTEROL
ACAT
CE
VLDL
Tecidos extra-hepáticos
ACAT (Acil CoA:colesterol Aciltrasnferase) ; CE ( Colesterol Esterificado); VLDL ( Lipoproteína de Densidade
Muito Baixa)
22
Na doença hepática crônica, acredita-se que a diminuição na síntese hepática ou
bloqueio parcial no processo de esterificação, em decorrência da redução na produção de
ACAT (figura 3), possam justificar a diminuição dos níveis intracelulares de colesterol e,
posteriormente, também os níveis séricos de CT41,57.
Figura 3. Redução dos níveis séricos de colesterol.
SÍNTESE
COLESTEROL
ACAT
CE
Colesterol para tecidos extra-hepáticos
ACAT (Acil CoA:coleserol Aciltransferase) CE (Colesterol Esterificado) .
C) Redução dos níveis séricos de VLDL e LDL
Estudos mostraram que a redução da VLDL está relacionada com a deficiência da
MTP60 e a inibição da síntese do colesterol (em decorrência da deficiência de ACAT),
necessário para a formação da lipoproteína41.
A deficiência da MTP, além de prejudicar a síntese de VLDL, acarreta a diminuição
dos níveis séricos de LDL, em decorrência da deficiência de Apo B (principal apoproteína da
LDL)62. Para montagem de VLDL é necessária a presença de Apo B-100, pois a MTP liga-se
a essa apoproteína77 (Figura 5).
23
Figura 4 – Possíveis mecanismos responsáveis pela redução sérica de VLDL e LDL.
MTP
Carregamento Apo B e TG
VLDL
LDL
ApoB (Apolipoproteína B-100); CE (Colesterol Esterificado); LDL (Lipoproteína de Densidade Baixa); MTP
(Proteína Microssomal Transferidora de Triglicerídeos);TG (Triglicerídeos); VLDL ( Lipoproteína de Densidade
Muito Baixa)
D) Redução dos níveis séricos de HDL
A patogênese do baixo nível de HDL em paciente com cirrose provavelmente tenha
natureza multifatorial. Acredita-se que o declínio nos níveis séricos da lipoproteína possa ser
atribuído à diminuição na síntese de Apo AI33.
A Apo AI, principal lipoproteína da HDL, é sintetizada e secretada pelo fígado. Como
outras proteínas sintetizadas pelos hepatócitos, as concentrações de Apo AI decaem
significativamente com a progressão da cirrose82. Certos autores constatam que níveis
circulantes de Apo AI reduzem com a progressão da fibrose hepática em decorrência do álcool
ou do vírus C e diminuem ainda mais com o aparecimento da cirrose 38,64.
Além da diminuição da Apo AI, estudos mostram que os baixos níveis de HDL estão
relacionados a um estado inflamatório mais pronunciado e à descompensação hemodinâmica,
comum em pacientes cirróticos com sepse severa15,31,83.
24
Tsai et al.82 realizaram um estudo que demonstrou que os baixos níveis de Apo AI e de
HDL estão associados a altos níveis de citocinas inflamatórias – fator de necrose tumoral alfa
(TNF-α) e interleucina seis (IL-6) –, ao aumento na atividade do sistema renina-angiotensinaaldosterona (RAAS), a múltiplas disfunções orgânicas e a alta mortalidade em pacientes
cirróticos com sepse grave. Dados recolhidos sugerem que o aumento da produção de
citocinas durante a infecção e inflamação pode ser responsável pela redução das
concentrações de lipídios. O TNF-α e a IL-6 podem inibir dose-dependente a síntese de
apolipoproteínas nas linhas celulares hepáticas81.
Bories e Campillo4 estudaram 30 pacientes cirróticos desnutridos, em ambiente
hospitalar, durante 30 dias e verificaram que a intervenção dietética (40 kcal/dia)
proporcionou aumento nos níveis de Apo AI e HDL.
25
JUSTIFICATIVA
Cirrose é considerada uma das principais doenças hepáticas do mundo, apresentando
considerável morbidade e mortalidade.
Os instrumentos utilizados na avaliação do prognóstico da cirrose auxiliam a
verificação da progressão da hepatopatia e contribuem para a escolha da melhor terapia,
visando, com isso, a redução da morbidade e da mortalidade.
A busca constante por marcadores que auxiliem, direta ou indiretamente, o
estadiamento da doença, a avaliação do prognóstico e a escolha do melhor tratamento são
objetivos a serem alcançados.
De fácil acesso, baixo custo e rapidez na obtenção dos resultados, a inclusão de
marcadores lipídicos, como rotina para pacientes cirróticos, deve ser incentivada uma vez que
poderá contribuir na verificação da progressão da doença e do prognóstico dos hepatopatas
crônicos.
26
OBJETIVOS
Objetivo Geral
•
Avaliar o perfil lipídico de pacientes cirróticos em decorrência do VHC e/ou álcool.
Objetivos Específicos
•
Avaliar o perfil lipídico de pacientes cirróticos e verificar sua possível associação com
a etiologia da hepatopatia e os genótipos do VHC.
•
Verificar a associação entre Child-Pugh, perfil lipídico (CT, VLDL, LDL, HDL, TG) e
os parâmetros bioquímicos (Albumina, Bilirrubina Total, Creatinina, Plaquetas,
Relação Normalizada Internacional e Sódio)
•
Correlacionar o perfil lipídico de pacientes cirróticos em decorrência do VHC e/ou
álcool com os escores de prognóstico Child-Pugh, MELD e com os parâmetros
bioquímicos.
27
REFERÊNCIAS BIBLIOGRÁFICAS ( Referencial Teórico)
1.Baraona E, Abittan CS, Dohmen K, Moretti M, Pozzato G, Chayes ZW, Schaefer C, Lieber
CS. Gender Differences in Pharmacokinetics of Alcohol. Alcohol Clin Exp Res. 2001;25:50207.
2.Becker U, Deis A, Sorensen TI, Gronbaek M, Borch-Johnsen K, Muller CF, Schnohr P,
Jensen G. Prediction of risk of liver disease by alcohol intake, sex, and age: a prospective
population study. Hepatology. 1996;23:1025-29.
3.Bentzen J, Smith V. Alcohol consumption and liver cirrhosis mortality: New evidence from
a panel data analysis for sixteen European countries. Journal of Wine Economics. 2010;5:128.
4.Bories PN, Campillo B. One-month regular oral nutrition in alcoholic cirrhotic patients.
Changes of nutritional status, hepatic function and serum lipid pattern. Br J Nutr. 1994;
72:937-46.
5.aBotham KM, Mayes PA. Lipídios com significado fisiológico. In: Murray RK, Granner
DK, Rodwell V. Harper: biquímica ilustrada. São Paulo: McGraw-Hill, 2007. p.115-24.
6.bBotham KM, Mayes PA. Metabolismo dos acilgliceróis e esfingolipídios. In: Murray RK,
Granner DK, Rodwell V. Harper: biquímica ilustrada. São Paulo: McGraw-Hill. 2007. p.199206.
7.Boursier J, Cesbron E, Tropet AL, Pilette C. Comparison and Improvement of MELD and
Child-Pugh Score Accuracies for the Prediction of 6-month Mortality in Cirrhotic Patients. J
Clin Gastroenterol. 2009;43:580-85.
8.Brandao A, Fuchs SC, Gleisner AL, Marroni C, Zanotelli ML, Cantisani G. Model for the
end-stage liver disease and death prediction in a cohort of Brazilian patients on the waiting list
for liver transplantation. ClinTransplant. 2008;22:651-56.
9.Brandão A, Marroni C. Modelos prognósticos de sobrevida. In: Mattos AA, Dantas-Correa
EB, editores. Tratado de Hepatologia. Rio de Janeiro: Rubio; 2010. p.867-876.
10.Campiotto S, Pinho JR, Carrilho FJ, Da Silva LC, Souto FJ, Spinelli V, Pereira LM,
Coelho HS, Silva AO, Fonseca JC, Rosa H, Lacet CM, Bernardini AP. Geographic
distribution of hepatitis C virus genotypes in Brazil. Braz J Med Biol Res. 2005;38:41-49.
11.Castéra L, Hézode C, Roudot-Thoraval F, Bastie A, Zafrani ES, Pawlotsky JM, Dhumeaux
D. Worsening of steatosis is an independent factor of fibrosis progression in untreated patients
with chronic hepatitis C and paired liver biopsies. Gut. 2003;52:288-92.
12.Cenci M, Massi M, Alderisio M, Soccio G, Recchia O. Prevalence of hepatitis C virus
(HCV) genotypes and increase of type 4 in central Italy: an update and report of a new
method of HCV genotyping. Anticancer Res. 2007;27:1219-22.
28
13.aChampe PC, Harvey RA, Ferrier R. Metabolismo dos Lipídeos Complexos. Biquímica
ilustrada. Porto Alegre: Artmed; 2009. p.201-18.
14.bChampe PC, Harvey RA, Ferrier R. Colesterol e Metabolismo dos Esteróis. Biquímica
ilustrada. Porto Alegre: Artmed; 2009. p.219-44.
15.Chien JY, Jerng JS, Yu CJ, Yang PC. Low serum level of highdensity lipoprotein
cholesterol is a poor prognostic factor for severe sepsis. Crit Care Med. 2005;33:1688-93.
16.Cholongitas E, Marelli L, Shusang V, Senzolo M, Rolles K, Patch D, Burroughs AK. A
systematic review of the performance of the model for end-stage liver disease (MELD) in the
setting of liver transplantation. Liver Transpl. 2006;12:1049-61.
17.D’Amico G, Garcia-Tsao G, Pagliaro L. Natural history and prognostic indicators of
survival in cirrhosis: a systematic review of 118 studies. J Hepatol. 2006;44:217-31.
18.D'Arienzo A, Manguso F, Scaglione G, Vicinanza G, Bennato R, Mazzacca G. Prognostic
value of progressive decrease in serum cholesterol survival in Child-Pugh C viral cirrhosis.
Scand J Gastroenterol. 1998;33:1213-18.
19.aDATASUS. Estatísticas de Saúde: Mortalidade no Rio Grande do
http://www.saude.rs.gov.br/wsa/portal/index.jsp?menu=organograma&cod=746; 2006.
Sul.
20.bDATASUS. Óbitos por causas, sexo e idade de residentes na região metropolitana de
Porto Alegre. http://www.saude.rs.gov.br/dados/1227005999990Publicacao%20SIM%20%202006.pdf; 2007
21.DATASUS. Informações de Saúde: Mortalidade no Brasil. Doenças do Aparelho
Digestivo. http://tabnet.datasus.gov.br; 2007.
22.Day CP. Treatment of alcoholic liver disease. Liver Transplantation. 2007; 13:S69-S75.
23.Desmet VJ, Roskams T. Cirrhosis reversal: a duel between dogma and myth. J Hepatol.
2004;40:860-67.
24.Durand F, Valla D. Assessment of the prognosis of cirrhosis: Child-Pugh versus MELD. J
Hepatol. 2005;42:S100-07.
25.Fabris C, Federico E, Soardo G, Falleti E, Piristi M. Blood lipids of patients with chronic
hepatitis: differences related to viral etiology. Clin Chimica Acta. 1997; 261:159-65.
26.Focaccia R, da Conceição OJ, Sette H Jr, Sabino E, Bassit L, Nitrini DR, Lomar AV,
Lorenço R, Vieira De Souza F, Kiffer CR, Santos EB, Gonzales MP, Sáez-Alquézar A, Riscal
JR, Fischer D. Prevalence of viral hepatitis in the general population of the municipality of
São Paulo, measured by a serologic survey of a stratified, randomized and residence-based
population. Braz J Infect Dis. 1998; 2:269-84.
27.Forns X, Costa J. HCV virological assessment. J Hepatol. 2006;44:S35-S39.
29
28.Forti N, Diament J. Lipoproteínas de Alta Densidade: Aspectos Metabólicos, Clínicos,
Epidemiológicos e de Intervenção Terapêutica. Atualização para os clínicos. Arq Bras
Cardiol. 2006;87:672-79.
29.Geerts A. History, heterogeneity, developmental biology, and functions of quiescent
hepatic stellate cells. Semin Liver Dis. 2001;21:311-36.
30.Ghadir MR, Riahin AA , Havaspour A , Nooranipour M , Habibinejad AA .The
Relationship between Lipid Profile and Severity of Liver Damage in Cirrhotic Patients. Hepat
Mon. 2010;10:285-88.
31.Gordon BR, Parker TS, Levine DM, Saal SD, Wang JC, Sloan BJ, et al. Relationship of
hypolipidemia to cytokine concentrations and outcomes in critically ill surgical patients. Crit
Care Med. 2001;29:1563-68.
32.Grigorescu M, Radu C, Crisan D, Grigorescu MD, Serban A, Neculoiu D, Rusu M,
Acalovschi M. Metabolic Syndrome, Insulin Resistence and Apionectin Level in Patients
with Chronic Hepatitis C. J Gastrointestin Liver Dis. 2008;17 :147-54.
33.Habib A, Mihas AA, Abou–Assi SG, Williams LM, Gavis E , Pandak WM, Heuman DM.
High-Density Lipoprotein Cholesterol as an Indicator of Liver Function and Prognosis in
Noncholestatic Cirrhotics. Clin Gastroenterol Hepatol. 2005;3:286–91.
34.Hoofnagle JH. Hepatitis C: the clinical spectrum of disease. Hepatology. 1997;26:S15–
S20.
35.Huo TI, Wu JC, Lin HC, Lee FY, Hou MC, Lee PC, Chang FY, Lee SD.. Evaluation of the
increase in model for end-stage liver disease (DeltaMELD) score over time as a prognostic
predictor in patients with advanced cirrhosis: risk factor analysis and comparison with initial
MELD and Child-Turcotte-Pugh score. J Hepatol. 2005;42:826-32.
36.Hutin Y, Kitler ME, Dore GJ, Perz JF, Armstrong GL, Dusheiko G, et al. The Global
Burden of Hepatitis C Working Group. Global burden of disease (GBD) for hepatitis C. J Clin
Pharmacol. 2004; 44:20–29.
37.Iida VH, Silva TJA, Silva ASF, Silva LFF, Alves VAF. Cirrose hepática: aspectos
morfológicos relacionados às suas possíveis complicações. Um estudo centrado em
necropsias. J. Bras. Patol. Med. Lab. 2005;41:29-36.
38.Imbert-Bismut F, Ratziu V, Pieroni L,Charlotte F, Benhamou Y, Poynard T. Biochemical
markers of liver fibrosis in patients with hepatitis C virus infection: a prospective study.
Lancet. 2001;357:1069-75.
39.Infante-Rivard C, Esnaola S, Villeneuve JP. Clinical and statistical validity of conventional
prognostic factors in predicting short-term survival among cirrhotics. Hepatology.
1987;7:660-64.
40.Ishibashi H, Nakamura M, Komori A, Migita K, Shimoda S. Liver architecture, cell
function, and disease. Semin Immunopathol. 2009;31:399-409.
30
41.Jiang M, Liu F, Xiong WJ, Zhong L, Xu W, Xu F, Liu YB. Combined MELD and blood
lipid level in evaluating the prognosis of decompensated cirrhosis. World J Gastroenterol.
2010;16:1397-01.
42.Kerr WC, Fillmore KM, Marvy P. Beverage-specific alcohol consumption and cirrhosis
mortality in a group of English-speaking beer-drinking countries. Addiction. 2000;95:339-46.
43.Kew M. Hepatitis C virus and hepatocellular carcinoma in developing and developed
countries. Viral Hepat Rev. 1998;4:259–69.
44.Lima ES, Couto RD. Estrutura, metabolismo e funções fisiológicas da lipoproteína de alta
densidade. J Bras Patol Med Lab. 2006;42:169-78.
45.LNPCAPB. I Levantamento nacional sobre os padrões de consumo de álcool na população
brasileira. Laranjeira R, Pinsky I, Zaleski M, Caetano R. Brasília: Secretaria Nacional
Antidrogas,
2007.
Disponível
em:
http://www.obid.senad.gov.br/portais/OBID/conteudo/index.php?id_conteudo=11325&rastro
=PESQUISAS+E+ESTAT%C3%8DSTICAS%2FEstat%C3%ADsticas/Popula%C3%A7%C3
%A3o+geral+brasileira#pad_con_alc. Acesso: fevereiro 2011.
46.Lonardo A, Loria P, Adinolfi LE, Carulli N, Ruggiero G . Hepatitis C and steatosis: a
reappraisal. J Viral Hepat. 2006;13:73-80.
47.Lund-Katz S, Liu L, Thuahnai ST, Phillips MC. High Density Lipoprotein Structure. Front
Biosci. 2003;8:1044-54.
48.Mathers C, Lopez AD. The burden of disease and mortality by condition: data, methods,
and results for 2001. In: Lopez A, Mathers C, Ezzati M, et al. Global burden of disease and
risk factors. Washington (DC): Oxford University Press and World Bank; 2006, p.45-93.
49.Miller JP. Dyslipoproteinaemia of liver disease. Baillieres Clin Endocrinol Metab.
1990;4:807-32.
50.Mincis M. Hepatite Alcoólica. In: Mattos AA, Dantas-Correa EB, editores. Tratado de
Hepatologia. Rio de Janeiro: Rubio; 2010. p.357-69.
51.Ministério da Saúde. Casos confirmados de hepatite C. Brasil, Grandes Regiões e
Unidades
Federadas.
1996-2006.
http://portal.saude.gov.br/portal/arquivos/pdf/casos_hepatite_c.pdf, 2007.
52.Ministério da Saúde. Secretaria de Vigilância em Saúde. Departamento de Vigilância
Epidemiológica. Hepatites virais: o Brasil está atento / Ministério da Saúde, Secretaria de
Vigilância em Saúde, Departamento de Vigilância Epidemiológica. Brasília-Brasil :
Ministério da Saúde, 2008.
53.Mirandola S, Realdon S, Iqbal J, Gerotto M, Dal Pero F, Bortoletto G, Marcolongo M,
Vario A, Datz C, Hussain MM, Alberti A. Liver microsomal triglyceride transfer protein is
involved in hepatitis C liver steatosis. Gastroenterology. 2006;130:1661-69.
31
54.Monazahian M, Kippenberger S, Müller A, Seitz H, Böhme I, Grethe S, Thomssen R.
Binding of human lipoproteins (low, very low, high density lipoproteins to recombinant
envelope proteins of hepatitis C virus. Med Microbiol Immunol. 2000;188:177-84.
55.Murray C, Lopez A. Alternative projections of mortality and disability by cause 19902020: Global Burden of Disease Study. Lancet 1997; 349:1498-504.
56.Napolitano M, Giuliani A, Alonzi T, Mancone C, D'Offizi G, Tripodi M, Bravo E. Very
low density lipoprotein and low density lipoprotein isolated from patients with hepatitis C
infection induce altered cellular lipid metabolism. J. Med. Virol. 2007;79:254-58.
57.Nashaat EH. Comparative study of serum lipid profile between chronic hepatitis C
Egyptian patients and normal controls and the effect of viral eradication on lipids profile.
Report and Opinion. 2010; 2:14-20.
58.Negro, F. Abnormalities of lipid metabolism in hepatitis C virus infection. Gut. 2010;
59:1279-87.
59.NIH: NIH Consensus Statement on Management of Hepatitis C: 2002. NIH Consens State
Sci Statements. 2002;19:1-46.
60.Perlemuter G, Sabile A, Letteron P, Vona G, Topilcol A , ChrétienY et al. Hepatitis C
vírus core protein inhibits microsomal triglyceride transfer protein activity and very low
density lipoprotein secretion: A model of viral-related steatosis. FASEB J. 2002;16:185-94.
61.Perz JF, Armstrong GL, Farrington LA, Hutin YJ, Bell BP. The contributions of hepatitis
B virus and hepatitis C virus infections to cirrhosis and primary liver cancer worldwide. J
Hepatol. 2006;45:529-38.
62.Petit JM, Benichou M, Duvillard L, Jooste V, Bour JB, Minello A, et al. Hepatitis C virusassociated hypobetalipoproteinemia is correlated with plasma viral load, steatosis, and liver
fibrosis. Am J Gastroenterol. 2003;98:1150-4.
63.PNHV
Programa
Nacional
de
Hepatites
Virais.
http://portal.saude.gov.br/portal/saude/Gestor/visualizar_texto.cfm?idtxt=27220. Acesso: fev
2011.
64.Poynard T, Abella A, Pignon JP, Naveau S, Leluc R, Chaput JC. Apolipoprotein AI and
alcoholic liver disease. Hepatology. 1986;6:1391–95.
65.Poynard T, Yuen MF, Ratiziu V, Lai CL. Viral hepatitis C. Lancet. 2003;362:2095-100.
66.Reuben A. Alcohol and the liver. Curr Opin Gastroenterol. 2008;24:328-38.
67.Rubbia-Brandt L, Fabris P, Paganin S, Leandro G, Male PJ, Giostra E, Carlotto A, Bozzola
L, Smedile A, Negro F. Steatosis affects chronic hepatitis C progression in a genotype specific
way. Gut. 2004;53:406-12.
32
68.SBH. Relatório do Grupo de Estudo da Sociedade Brasileira de Hepatologia.
Epidemiologia da infecção pelo vírus da hepatite C no Brasil. GED. 1999;18:53-58.
69.Scartezini M, Picheth G, Salgado W, Ihara SSM, Pinto LESA, Torres KP, Martinez TLR.
Metabolismo dos lipídeos e lipoproteínas. In: Martinez TLR. Manual de condutas clínicas em
dislipidemias. Rio de Janeiro: Medline, 2003. p.21-33.
70.Schuppan D, Afdhal NH. Liver Cirrhosis. Lancet. 2009; 371:838–51.
71.Seeff LB, Hoofnagle JH. Epidemiology of hepatocellular carcinoma in areas of low
hepatitis B and hepatitis C endemicity. Oncogene. 2006;25:3771–7.
72.Selcuk H, Uruc I, Temel MA, Ocal S, Huddam B, Korkmaz M, Unal H, Kanbay M, Savas
N, Gur G, Yilmaz U, Haberal M. Factors Prognostic of Survival in Patients Awaiting Liver
Transplantation for End-Stage Liver Disease. Dig Dis Sci. 2007;52:3217–223.
73.Serfaty L, Andreani T, Giral P, Carbonell N, Chazouillères O, Poupon R. Hepatitis C virus
induced hypobetalipoproteinemia: a possible mechanism for steatosis in chronic hepatitis C. J
Hepatol. 2001;34:428-34.
74.Shepard CW, Finelli L, Alter MJ. Global epidemiology of hepatitis C virus infection.
Lancet Infect Dis. 2005;5:558-67.
75.Siagris D, Christofidou M, Theocharis GJ, Pagoni N, Papadimitriou C, Lekkou A,
Thomopoulos K, Starakis I, Tsamandas AC, Labropoulou-Karatza C. Serum lipid pattern in
chronic hepatitis C: histological and virological correlations. J. Viral Hepat. 2006;13:56–61.
76.Silva CM, Costi C, Krug LP, Ramos AB, Grandi T, Gandolfi VL, Menezes ME, Ocampos
M, Niel C, Rossetti ML. High proportion of hepatitis C virus genotypes 1 and 3 in a large
cohort of patients from Southern Brazil. Mem Inst Oswaldo Cruz. 2007;102:867-70.
77.Smith C, Marks AD, Lieberman M. Síntese de Ácidos Graxos, Triacilgliceróis e dos
Principais Lipídeos de Membrana. In: Smith C, Marks AD; Lieberman M. Bioquímica
Médica Básica de Marks: uma abordagem clínica. Porto Alegre: Artmed, 2007. p.594-618.
78.Simmonds P, Bukh J, Combet C, Deléage G, Enomoto N, Feinstone S, Halfon P,
Inchauspé G, Kuiken C, Maertens G, Mizokami M, Murphy DG, Okamoto H, Pawlotsky JM,
Penin F, Sablon E, Shin-I T, Stuyver LJ, Thiel HJ, Viazov S, Weiner AJ, Widell A.
Consensus proposals for a unified system of nomenclature of hepatitis C virus genotypes.
Hepatology. 2005;42:962-73.
79.Sougioultzis S, Dalakas E, Hayes PC, Plevris JN. Alcoholic Hepatatis: From Pathogenesis
to Treatment. Curr Med Res Opin. 2005;21:1337-46.
80.Strauss E. Hepatite C. Rev. Soc. Bras. Med. Trop. 2001;34:69-82.
33
81.Tietge UJ, Maugeais C, Lund-Katz S, Grass D, deBeer FC, Rader DJ. Human secretory
phospholipase A2 mediates decreased plasma levels of HDL cholesterol and apoA-I in
response to inflammation in human apoA-I transgenic mice. Arterioscler Thromb Vasc Biol.
2002;22:1213-18.
82.Tsai MH, Peng YS, Chen YC, Lien JM, Tian YC, Fang JT, Weng HH, Chen PC, Yang
CW, Wu CS. Low serum concentration of apolipoprotein A-I is an indicator of poor prognosis
in cirrhotic patients with severe sepsis. J Hepatol. 2009;50:906-15.
83.Van Leeuwen HJ, Heezius EC, Dallinga GM, van Strijp JA, Verhoef J, van Kessel KP.
Lipoprotein metabolism in patients with severe sepsis. Crit Care Med. 2003;31:1359-66.
84.Wadi MT, Fonseca PTR, Duarte AG, Medeiros F, Araújo LS. Dislipidemia. In: Duarte AC,
Faillace GBD, Wadi MT, Pinheiro RL. Síndrome Metabólica-Semiologia, Bioquímica e
Prescrição Nutricional. Rio de Janeiro:Axcel; 2005. p 138-175.
85.Wlazlo N, Sauerwein HP, Schoon EJ, Stehouwer CD, Bravenboer B. Diabetes mellitus and
cirrhosis of the liver: a prognostically unfavourable combination. Ned Tijdschr Geneeskd.
2011;155:A2213.
86.Wanless IR, Nakashima E, Sherman M. Regression of human cirrhosis. Morphologic
features and the genesis of incomplete septal cirrhosis. Arch Pathol Lab Med. 2000;124:1599–
607.
87.Wells RG. Cellular sources of extracellular matrix in hepatic fibrosis. Clin liver Dis.
2008;12:759-68.
88.Wiesner R, Edwards E, Freeman R, Harper A, Kim R, Kamath P, et al. Model for endstage liver disease (MELD) and allocation of donor livers. Gastroenterology. 2003; 124:91-96.
89.Zauner C, Schneeweiss B, Schneider B, Madl C, Klos H, Kranz A, Ratheiser K, Kramer L,
Lenz K. Short-term prognosis in critically ill patients with liver cirrhosis: an evaluation of a
new scoring system. Eur J Gastroenterol Hepatol. 2000;12:517-22.
34
ARTIGO A SER PUBLICADO
ARQUIVOS BRASILEIROS DE GASTROENTEROLOGIA
PERFIL LIPÍDICO DE PACIENTES CIRRÓTICOS E SUA CORRELAÇÃO COM OS
ESCORES PROGNÓSTICOS
Lílian Bassani1, Sabrina Alves Fernandes1, Flávia Nunes1, Maria Eugênia Deutrich Aydos1,
Raquel Bassani2, Cláudio Augusto Marroni1
1
Programa de Pós-Graduação em Medicina: Hepatologia, UFCSPA, Porto Alegre.
2
Fisioterapia – IPA, Porto Alegre.
RESUMO
Introdução: O fígado exerce papel fundamental no metabolismo lipídico. Em condições
fisiológicas, os hepatócitos garantem a homeostase desse processo, entretanto, na presença de
cirrose, esse equilíbrio pode estar comprometido. Estudos apontam que pacientes com cirrose
apresentam
alterações
no
metabolismo
lipídico,
especialmente
hipocolesterolemia.
Objetivos: Avaliar o perfil lipídico (Colesterol Total – CT -, Lipoproteína de Muito Baixa
Densidade – VLDL-, Lipoproteína de Baixa Densidade – LDL-, Lipoproteína de Alta
Densidade- HDL – ,Triglicerídeos – TG ) de pacientes com cirrose, de diferentes etiologias, e
correlacionar, com os critérios de prognóstico Child-Pugh e MELD, marcadores bioquímicos
e os genótipos do VHC. Pacientes e métodos: Foram revisados os prontuários de pacientes
cirróticos em acompanhamento ambulatorial no Complexo Hospitalar Santa Casa de Porto
Alegre, RS, Brasil, no período de fevereiro a dezembro de 2010. Resultados: Foram
35
analisados 153 pacientes, destes, 53,6% (82) tinham cirrose por VHC, 32,7% (50) tinham
cirrose de etiologia alcoólica e 13,7% (21) tinham cirrose por álcool e VHC; 62,1% (95) eram
do sexo masculino e a média de idade foi de 59,3 ± 9,4 anos, sendo que a faixa etária
prevalente foi de 50-59 anos (37,3%), seguida pela faixa de 60-69 anos (32,7%). Dos
pacientes com VHC, o genótipo 3 foi prevalente com 50,5%, seguido pelo genótipo 1
(47,6%). Quanto à classificação Child-Pugh, 71 (46,4%) tinham classificação A,31,4% (48)
classificação B e 22,2%(34) tinham classificação C. Com relação ao MELD, 64,7%(99)
apresentaram valores <15,24,2% (37) entre 15-19 e 11,1% (17) ≥ 20. Houve associação
direta estatisticamente significativa entre perfil lipídico, albumina e sódio. Associação
positiva também foi observada entre as plaquetas e o perfil lipídico, exceto com o HDL.
Associação inversa estatisticamente significativa entre o perfil lipídico e variáveis Bilirrubina
Total, Relação Normatizada Internacional (RNI) e os escores Child-Pugh e MELD. Em
relação à Aspartato Amino-Transferase (AST), houve associação inversa estatisticamente
significativa com CT e LDL. Não houve diferença significativa (p>0,05) entre os genótipos e
as alterações no perfil lipídico. Conclusão: A redução nos níveis séricos de CT, LDL, HDL
está relacionada com a gravidade da doença hepática, portanto, pode ser utilizada como
indicador da função hepática ou de prognóstico.
Palavras-chave: Cirrose, HCV, álcool, lipoproteínas, escores prognósticos.
36
INTRODUÇÃO
O fígado exerce um papel fundamental no desempenho do metabolismo lipídico. Os
hepatócitos são considerados sítio principal para síntese do colesterol e das lipoproteínas. No
organismo saudável, um equilíbrio complexo é mantido entre a biossíntese, a utilização e o
transporte do colesterol e das lipoproteínas, no entanto, na presença de cirrose, essa
homeostase é desregulada, gerando um desequilíbrio nesse sistema11.
Estudos apontam que pacientes com cirrose apresentam alterações no metabolismo
lipídico, especialmente hipocolesterolemia e hipobetalipoproteinemia6,10,21. Tais modificações
evoluem com a progressão da hepatopatia e podem ser utilizadas como um indicador de
prognóstico para descompensação da doença26,35. Estudo realizado11 com 198 pacientes
cirróticos descompensados, verificou que a redução do perfil lipídico, está associada com a
progressão da hepatopatia (MELD > 21). Considerado um marcador independente de mau
prognóstico, a diminuição dos níveis séricos de HDL está associada com a maior
probabilidade de transplante hepático, no prazo de 12 meses, e com o aumento da mortalidade
de pacientes cirróticos13 ;
Em virtude dos dados expostos, fica clara a importância da identificação do perfil
lipídico de pacientes cirróticos, uma vez que se observa uma íntima relação entre as alterações
nas frações lipídicas e a piora do prognóstico. Além disso, tal conhecimento amplia as
alternativas intervencionistas na prática de tratamentos clínicos.
O objetivo deste estudo foi determinar o perfil lipídico de pacientes com cirrose, em
decorrência do álcool e/ou vírus da hepatite C (VHC), e correlacionar com marcadores de
prognóstico Child-Pugh e MELD, variáveis bioquímicas e o genótipo do VHC, a fim de
verificar se as modificações lipídicas podem ser utilizadas como uma ferramenta indicativa de
prognóstico.
37
METODOLOGIA
Estudo retrospectivo, transversal, realizado através da revisão dos prontuários médicos
de 314 pacientes em acompanhamento no ambulatório de Gastroenterologia do Complexo
Hospitalar Santa Casa de Porto Alegre, Porto Alegre, RS, Brasil, no período fevereiro a
dezembro de 2010, acerca do qual seguem as considerações:
Os pacientes incluídos, independente da raça ou do sexo, eram adultos (> 18 anos),
portadores de cirrose (com diagnóstico comprovado através de exames clínicos, histológicos
ou de imagem) em decorrência do álcool, VHC ou álcool e VHC.
Os pacientes excluídos apresentaram outras disfunções hepática (hepatite crônica por
vírus B, cirrose biliar primária, hepatite auto-imune, hepatite medicamentosa, esteatose
hepática, carcinoma hepatocelular, doença de Wilson), com doenças auto-imunes (lúpus
eritematoso sistêmico, artrite reumatóide, síndrome de Sjögren), com anticorpos contra o vírus
da imunodeficiência (HIV), com Insuficiência renal prévia e com doenças que pudessem
interferir no metabolismo lipídico (dislipidemia primária, fibrose cística). A ausência de
informações clínicas ou laboratoriais também foi critério de exclusão.
O projeto de pesquisa foi aprovado pelo Comitê de Ética em Pesquisa da Universidade
Federal de Ciências da Saúde de Porto Alegre (UFCSPA), protocolo no 1021/10.
A revisão dos prontuários médicos analisou os dados clínicos, epidemiológicos,
laboratoriais e anatomopatológicos dos pacientes, conforme discriminado abaixo:
Descrição da população de estudo: nome, gênero (masculino e feminino), idade (data de
nascimento).
Aspetos da Doença hepática:
Etiologia da cirrose (álcool, VHC, álcool e VHC);
Nos casos por VHC, foi observado o genótipo (1, 2, 3);
A Classificação da cirrose seguiu os critérios Child-Puhg (A,B,C) e Escore MELD
(Considerando como referência a mesma data da avaliação bioquímica).
38
Avaliação bioquímica:
Os marcadores bioquímicos avaliados foram: Albumina (Alb), Bilirrubina Total (BT),
Colesterol Total (CT), Creatinina (Cr), Lipoproteína de Alta Densidade (HDL),Lipoproteína
de Densidade Baixa (LDL), Plaquetas, Relação Normalizada Internacional ( RNI), Sódio
(Na), Triglicerídeos (TG) e Lipoproteína de Muito Baixa Densidade (VLDL).
Para efeito do presente estudo, todas as avaliações bioquímicas foram coletadas no
mesmo local (Laboratório Central do Complexo Hospitalar Santa Casa de Porto Alegre, RS,
Brasil) e mesmo período, diferindo, no máximo, em 30 dias.
ANÁLISE ESTATÍSTICA
A análise dos dados foi realizada utilizando o software SPSS (Statistical Package for
the Social Sciences) versão 17.0.
As variáveis quantitativas foram descritas através de média e desvio padrão
(distribuição simétrica) ou mediana e amplitude interquartílica (distribuição assimétrica). As
variáveis categóricas foram descritas através de frequências absolutas e relativas.
Para comparar médias, o teste t-Student ou Análise de Variância (ANOVA) one-way
com post-hoc de Tukey foram utilizados. Em caso de assimétrica, foram aplicados os testes de
Mann-Whitney e Kruskal-Wallis, respectivamente. Para avaliar a associação entre as variáveis
categóricas, foi aplicado o teste qui-quadrado de Pearson, com complementação pelo teste dos
resíduos ajustados.
Para avaliar a associação entre as variáveis quantitativas, os coeficientes de correlação
de Pearson (distribuição simétrica) ou Spearman (distribuição assimétrica) foram aplicados.
O nível de significância estatística considerado foi de 5% (p ≤ 0,05).
39
RESULTADOS
Foram revisados 314 prontuários médicos de pacientes em acompanhamento no
ambulatório de Gastroenterologia do Complexo Hospitalar Santa Casa de Porto Alegre, RS,
Brasil. Destes, 153 preencheram todos os critérios de inclusão.
A principal causa de exclusão foi insuficiência de dados (ausência de genótipo e/ou da
análise bioquímica referente ao perfil lipídico), correspondendo a 52,17% (N=84). A segunda
causa mais frequente foi decorrente de disfunção hepática causada por outras patologias
(hepatite auto-imune, cirrose criptogênica, esteatose, carcinoma hepato-celular e VHB),
correspondendo a 38,50% (N=62). Os demais 9,30% (N=15) foram excluídos por
apresentarem outras doenças gastrointestinais (doença de Crohn, retocolite ulcerativa).
Avaliação geral da casuística
A casuística foi composta por 153 pacientes com diagnóstico de cirrose por álcool,
VHC ou álcool e VHC. Em relação à caracterização da amostra, os dados estão descritos na
Tabela 1.
Dos 153 pacientes cirróticos avaliados, 82 (53,6%) tinham cirrose por VHC, 50
(32,7%) tinham cirrose de etiologia alcoólica e 21 (13,7%) tinham cirrose por álcool e VHC;
95 (62,1%) eram do sexo masculino e a média de idade foi de 59,3 ± 9,4 anos, sendo que a
faixa etária prevalente foi de 50-59 anos (37,3%), seguida pela faixa de 60-69 anos (32,7%).
Dos pacientes com VHC, 52 (50,5%) apresentaram genótipo 3, 49 (47,6%) genótipo 1 e 2
(1,9%) genótipo 2.. Quanto à classificação Child-Pugh, 71 (46,4%) tinham classificação A, 48
(31,4%) classificação B e 34 (22,2%) tinham classificação C. Com relação ao MELD, 99
(64,7%) apresentaram valores <15, 37 (24,2%) entre 15-19 e 17 ( 11,1%) ≥ 20.
A associação entre o critério de prognóstico Child-Pugh, o perfil lipídico ( CT, VLDL,
LDL, HDL, TG)
e as variáveis bioquímicas ( Alb, BT, Cr, Plaquetas, RNI, Na), está
demonstrada na Tabela 2.
Os níveis séricos de CT e albumina reduziram com a progressão do Child-Pugh. Os
valores VLDL foram maiores para os pacientes Child-Pugh A (≥16 mg/dL) e menores para
Child-Pugh C (<16 mg/dL). Quanto ao LDL e TG, o Child-Pugh C associou-se a níveis
40
séricos mais baixos (<70 mg/dL), ao passo que o Child-Pugh A associou-se a níveis séricos
mais elevados (≥100 mg/dL). Os menores valores de HDL (<40 mg/dL) foram encontrados
nos pacientes Child-Pugh C, enquanto que valores intermediários (40-59) foram observados
nos pacientes Child-Pugh A. Em relação à bilirrubina total, a elevação dos níveis séricos é
diretamente proporcional à progressão do Child-Pugh. Ao analisar a creatinina, constatou-se
valores intermediários nos pacientes Child-Pugh A (1-1,49 mg/dL), valores baixos (<1
mg/dL) nos pacientes Child-Pugh B e valores elevados (≥1,5 mg/dL) nos pacientes ChildPugh C. Níveis mais baixos de RNI (<1,7) foram encontrados nos pacientes Child-Pugh A, os
níveis intermediários (1,7-22) e alto (>2,2) associaram-se com Child-Pugh C. Quanto ao
sódio, os pacientes Child-Pugh A relacionaram-se significativamente com os níveis mais altos
(≥135 mEq/L) e os de Child-Pugh C com níveis intermediários (131 – 134,9 mEq/L) e baixos
(≤130 mEq/L).
As correlações existentes entre o perfil lipídico, os critérios de prognóstico ( ChildPugh e MELD) e as variáveis bioquímicas estão demonstradas na Tabela 3. Houve associação
direta estatisticamente significativa (p<0,05) entre perfil lipídico, albumina e sódio.
Associação positiva também foi observada entre as plaquetas e o perfil lipídico, exceto com o
HDL. Associação inversa estatisticamente significativa entre o perfil lipídico e variáveis BT,
RNI e os escores Child-Pugh e MELD.
As análises realizadas para verificar a associação entre as alterações do perfil lipídico e
as etiologias da cirrose (Tabela 4) mostram diferenças estatística nas variáveis CT (P=0,003),
LDL ( P=0,002), Alb ( p=0,008), BT ( p=0,05), Cr (p=0,003), Na ( p = 0,017). Níveis mais
elevados de CT (160,3 + 45,1), LDL (95,3 + 37,8) e creatinina (1,20 + 0,54) foram observados
nos pacientes com cirrose por álcool, quando comparado com os demais grupos, que não
diferiram entre si. Pacientes com cirrose por álcool e vírus C apresentaram níveis mais baixos
de albumina (3,18 ± 0,58) e Na (137,4 ± 2,78), quando comparados com o grupo com cirrose
por álcool. Esses pacientes com cirrose por álcool/VHC também apresentaram os maiores
níveis de bilirrubina total.
Com relação ao genótipo, não foram constatadas diferenças estatisticamente
significativas com o perfil lipídico. A única variável associada, de forma significativa, com o
genótipo foi a creatinina (Tabela 5).
41
Tabela 1 – Caracterização da amostra, dados clínicos e demográficos.
Características
AT
n=153 (%)
95 (62,1)
59,3 ± 9,4
Álcool
n=50
( 32,7%)
44 (88,0)
58,8 ± 9,2
VHC
n=82
(53,6%)
31 (37,8)
60,6 ± 9,0
Álcool/ VHC
n=21
(13,7%)
20 (95,2)
55,6 ± 10,7
Sexo Masculino – n(%)
Idade – Média ± DP
Faixa etária – n(%)
<50
50 – 59
60 – 69
≥ 70
Genótipo* – n(%)
1
2
3
Child-Pugh – n(%)
A
B
C
MELD – Média ± DP
< 15
15 – 19
≥ 20
22 (14,4)
57 (37,3)
50 (32,7)
24 (15,7)
8 (16,0)
19 (38,0)
17 (34,0)
6 (12,0)
8 (9,8)
29 (35,4)
30 (36,6)
15 (18,3)
6 (28,6)
9 (42,9)
3 (14,3)
3 (14,3)
0,245
49 (47,6)
2 (1,9)
52 (50,5)
-
40 (48,8)
1 (1,2)
41 (50,0)
9 (42,9)
1 (4,8)
11 (52,4)
0,543
71 (46,4)
48 (31,4)
34 (22,2)
13,5 ± 5,6
99 (64,7)
37 (24,2)
17 (11,1)
27 (54,0)
14 (28,0)
9 (18,0)
13,4 ± 5,2
35 (70,0)
8 (16,0)
7 (14,0)
38 (46,3)
27 (32,9)
17 (20,7)
13,1 ± 6,0
55 (67,1)
20 (24,4)
7 (8,5)
6 (28,6)
7 (33,3)
8 (38,1)
15,1 ± 4,7
9 (42,9)
9 (42,9)
3 (14,3)
0,268
* somente para Vírus da Hepatite C (VHC)
AT: amostra total; MELD: Model for End-stage Liver Disease
p
<0,001
0,085
0,342
0,121
42
Tabela2 – Associação entre Child-Pugh , perfil lipídico e variáveis bioquímicas.
Características
Colesterol (mg/dL)
Total
<100
100 – 149
≥ 150
VLDL
<16
≥16
LDL
<70
70 – 99
≥ 100
HDL
<40
40 – 59
≥ 60
TG
<70
70 – 99
≥ 100
Alb (g/l)
<2,8
2,8 – 3.5
> 3,5
BT (mg/dL)
<2
2–3
>3
Cr (mg/dL)
<1
1 – 1,49
≥ 1,50
Plaquetas (mm3 x 103)
<70
70 – 140
> 140
RNI
< 1,7
1,7 – 2,2
> 2,2
Na (mEq/L)
≤ 130
131 – 134,99
≥ 135
AT
(n=153)
n (%)
Child-Pugh A
(n=71)
n (%)
Child-Pugh B
(n=48)
n (%)
Child-Pugh C
(n=34)
n (%)
p*
<0,001
23 (15,0)
68 (44,4)
62 (40,5)
2 (2,8)
24 (33,8)
45 (63,4)**
5 (10,4)
30 (62,5)**
13 (27,1)
16 (47,1)**
14 (41,2)
4 (11,8)
83 (54,2)
70 (45,8)
25 (35,2)
46 (64,8)**
32 (66,7)**
16 (33,3)
26 (76,5)**
8 (23,5)
66 (43,1)
49 (32,0)
38 (24,8)
18 (25,4)
25 (35,2)
28 (39,4)**
24 (50,0)
18 (37,5)
6 (12,6)
24 (70,6)**
6 (17,6)
4 (11,8)
47 (30,7)
81 (52,9)
25 (16,3)
10 (14,1)
48 (67,6)**
13 (18,3)
13 (27,1)
24 (50,0)
11 (22,9)
24 (70,6)**
9 (26,5)
1 (2,9)
60 (39,2)
56 (36,6)
37 (24,2)
18 (25,4)
27 (38,0)
26 (36,6)**
23 (47,9)
19 (39,6)
6 (12,5)
19 (55,9)**
10 (25,4)
5 (14,7)
21 (13,7)
55 (35,9)
77 (50,3)
0 (0,0)
13 (18,3)
58 (81,7)**
3 (6,3)
27 (60,4)**
16 (33,3)
18 (52,9)**
13 (38,2)
3 (8,9)
89 (58,2)
32 (20,9)
32 (20,9)
64 (90,1)**
6 (8,5)
1 (1,4)
19 (39,6)
18 (37,5)**
11 (22,9)
6 (17,6)
8 (23,5)
20 (58,5)**
72 (47,1)
70 (45,8)
11 (7,2)
26 (36,6)
40 (56,3)**
5 (7,0)
33 (68,8)**
15 (31,3)
0 (0,0)
13 (38,8)
15 (44,1)
6 (17,6) **
34 (22,2)
77 (50,3)
42 (27,5)
4 (5,6)
35 (49,3)
32 (45,1)**
19 (39,6)**
21 (43,8)
8 (16,7)
11 (32,4)
21 (61,8)
2 (5,9)
130 (85,0)
14 (9,2)
9 (5,9)
70 (98,6)**
0 (0,0)
1 (11,1)
43 (89,6)
3 (6,3)
2 (4,2)
17 (50,0)
11 (32,4)**
6 (66,7)**
6 (3,9)
7 (4,6)
140 (91,5)
0 (0,0)
0 (0,0)
71 (100)**
1 (2,1)
3 (6,3)
44 (91,7)
5 (14,7)**
4 (11,8)**
25 (73,5)
<0,001
<0,001
<0,001
0,003
<0,001
<0,001
0,001
<0,001
<0,001
<0,001
* teste qui-quadrado de Pearson; ** associação estatisticamente significativa pelo teste dos resíduos ajustados (p<0,05)
AT: amostra total; Alb: albumina; BT: bilirrubina total; Cr: creatinina; ; HDL: lipoproteína de alta densidade; LDL:
lipoproteína de baixa densidade; TG: triglicerídeos; RNI: relação normatizada internacional; Na: sódio; VLDL: lipoproteína
de muito baixa densidade
43
Tabela 3 – Coeficiente de correlação de Pearson (R) entre o perfil lipídico e os testes de função
hepática e renal.
Variáveis
Alb
BT
Child-Pugh
Cr
MELD
Plaquetas
RNI
Na
Correlação
Pearson
r
P
rs
P
rs
P
r
P
r
P
rs
P
r
P
r
P
CT
VLDL
LDL
HDL
TG
0,459*
<0,001
-0,465*
<0,001
-0,553
<0,001
-0,071
0,381
-0,574*
<0,001
0,263
0,001
-0,461*
<0,001
0,398*
<0,001
0,204
0,011
-0,280
<0,001
-0,333
<0,001
0,070
0,392
-0,236
0,030
0,227
0,005
-0,227
0,005
0,198
0,014
0,343*
<0,001
-0,362*
<0,001
-0,448
<0,001
-0,065
0,423
-0,422*
<0,001
0,244
0,002
-0,334*
<0,001
0,321*
<0,001
0,463*
<0,001
-0,350*
<0,001
-0,442
<0,001
-0,081
0,322
-0,599*
<0,001
0,100
0,220
-0,473*
<0,001
0,334
<0,001
0,204
0,011
-0,280
<0,001
-0,333
<0,001
0,070
0,392
-0,236
0,030
0,227
0,005
-0,227
0,005
0,198
0,014
r=coeficiente de correlação de Pearson; rs=coeficiente de correlação de Spearman; * associação regular (0,3 a 0,6) Alb:
albumina; BT: bilirrubina total; Cr: creatinina; CT: colesterol total ; MELD:Model for End-stage Liver Disease ;VLDL:
lipoproteína de muito baixa densidade; LDL: lipoproteína de baixa densidade; HDL:lipoproteína de alta densidade; TG:
triglicerídeos; RNI: relação normatizada internacional, Na: sódio
Tabela 4 – Medidas descritivas (média + desvio padrão) das análises bioquímicas que avaliaram perfil
lipídico, função renal, função hepática e o teste de comparação das variáveis entre as etiologias da
cirrose.
Características
Colesterol (mg/dL)
Total
VLDL
LDL
HDL
TG
Alb (g/l)
BT (mg/dL)***
Cr (mg/dL)
Plaquetas(mm3 x 103) ***
RNI
Na (mEq/L)
Álcool
(n=50)
Média ± DP
Cirrose VHC
(n=82)
Média ± DP
Álcool/VHC
(n=21)
Média ± DP
P
160,3 ± 45,1b
18,1 ± 7,0
95,3 ± 37,8b
46,8 ± 14,9
90,6 ± 35,0
3,75 ± 0,76b
1,5 (0,8 – 2,7)a
1,20 ± 0,54b
106,5 (79,5 – 143)
1,36 ± 0,37
140,3 ± 3,48b
136,1 ± 42,2a
16,1 ± 6,9
74,4 ± 30,6a
45,5 ± 16,2
80,4 ± 34,7
3,52 ± 0,72ab
1,5 (0,8 – 2,7)a
0,99 ± 0,28a
97,5 (63 – 150)
1,49 ± 0,72
139,5 ± 4,2ab
129,7 ± 46,4a
16,1 ± 7,7
74,5 ± 35,8a
38,5 ± 16,7
80,5 ± 38,5
3,18 ± 0,58a
2,9 (1,6 – 4,4)b
0,93 ± 0,15a
94 (81 – 148)
1,52 ± 0,48
137,4 ± 2,78a
0,003*
0,250*
0,002*
0,124*
0,250*
0,008*
0,005**
0,003*
0,860**
0,315*
0,017*
* Análise de Variância (ANOVA) one-way.; ** Teste de Kruskal-Wallis; *** descrita por mediana (percentis 25 – 75); a,b
Letras iguais não diferem pelo Teste de Tukey (distribuição simétrica) ou Mann-Whitney (distribuição assimétrica).; AT:
amostra total; Alb: albumina; BT: bilirrubina total; Cr: creatinina; HDL: lipoproteína de alta densidade; LDL: lipoproteína
de baixa densidade; TG: triglicerídeos; RNI: relação normatizada internacional; Na: sódio; VHC: vírus da hepatite C;
VLDL: lipoproteína de muito baixa densidade
44
Tabela 5 – Medidas descritivas (média + desvio padrão) das análises bioquímicas que avaliaram perfil
lipídico, função renal, função hepática e o teste de comparação das variáveis entre os genótipos.
Características
Colesterol (mg/dL)
Total
VLDL
LDL
HDL
TG
Alb (g/l)
BT (mg/dL)***
Cr (mg/dL)
Plaquetas (mm3 x 103) ***
RNI
Na(mEq/L)
Genótipo 1
(n=49)
Média ± DP
Genótipo 2
(n=2)
Média ± DP
Genótipo3
(n=52)
Média ± DP
P
138,2 ± 46,2
17,2 ± 7,3
77,8 ± 34,8
43,2 ± 16,1
86,1 ± 36,6
3,40 ± 0,68
1,5 (0,95 – 2,95)
1,07 ± 0,31b
101 (69,6 – 144,5)
1,49 ± 0,70
138,6 ± 4,52
165,0 ± 18,3
15,5 ± 0,42
99,0 ± 25,5
50,5 ± 2,12
77,5 ± 2,12
3,65 ± 1,34
1,9 (0,3 – 3,4)
0,80 ± 0,14ab
126 (83 – 169)
1,38 ± 0,48
139,0 ± 0,0
130,4 ± 40,1
15,0 ± 6,9
70,3 ± 28,0
44,6 ± 17,3
75,2 ± 34,3
3,45 ± 0,71
1,8 (0,8 – 3,2)b
0,90 ± 0,16a
90 (56 – 150)
1,53 ± 0,67
139,5 ± 3,63
0,404*
0,304*
0,263*
0,777*
0,304*
0,749*
0,870**
0,003*
0,808**
0,904*
0,519*
* Análise de Variância (ANOVA) one-way.; ** Teste de Kruskal-Wallis; *** descrita por mediana (percentis 25 – 75)
a,b
Letras iguais não diferem pelo Teste de Tukey (distribuição simétrica) ou Mann-Whitney (distribuição assimétrica)
Alb: albumina; BT: bilirrubina total; Cr: creatinina; HDL: lipoproteína de alta densidade; LDL: lipoproteína de baixa
densidade; TG: triglicerídeos; RNI: relação normatizada internacional; Na: sódio; VHC: vírus da hepatite C; VLDL:
lipoproteína de muito baixa densidade.
DISCUSSÃO
O fígado tem um papel central na regulação da síntese, degradação e armazenamento
dos lipídeos e das lipoproteínas. A velocidade da síntese e do catabolismo dessas partículas é
regulada, principalmente, pelas apoproteínas (Apo) presentes em suas superfícies. Já foi
constatado que as concentrações de CT e de lipoproteínas diminuem com a progressão da
fibrose e, ainda mais, com o início da cirrose14, e que essa modificação nos níveis lipídicos
pode ser utilizada para estimar o prognóstico de pacientes cirróticos11,26.
Acredita-se que a redução dos níveis séricos de CT decorra da diminuição na síntese
ou do bloqueio, parcial, do processo de esterificação do mesmo, provavelmente, em virtude do
declínio na produção da enzima ACAT (acil CoA:colesterol aciltransferase)11,23. A
diminuição dos níveis de VLDL associa-se com a deficiência da proteína microssomal
transferidora de triglicerídeos (MTP)25 e com a inibição, parcial, da síntese do colesterol11. A
formação de LDL está diretamente relacionada com a produção de VLDL e, uma vez que essa
lipoproteína tem seu metabolismo prejudicado, as demais frações lipídicas, sequenciais a ela,
45
também sofrem alterações26. Com relação à queda dos níveis de HDL, sugere-se forte
correlação com a diminuição da síntese da Apoproteína AI (Apo AI), principal lipoproteína da
HDL13 . O estudo realizado por Tsai35 mostrou que os baixos níveis de Apo AI e de HDL
estão associados a altos níveis de citocinas inflamatórias, ao aumento da atividade do sistema
renina-angiotensina-aldolsterona (SRAA), a múltiplas disfunções orgânicas e a alta
mortalidade em pacientes cirróticos com sepse severa. Estudos sugerem que o aumento da
produção de citocinas, durante infecções e processos inflamatórios, quadro “relativamente”
comum em hepatopatas crônicos descompensados, pode ser responsável pela redução das
concentrações de lipídeos32.
O presente estudo mostra que a redução do CT, suas frações e os TG estão
relacionados
significativamente
à
progressão
da
doença.
Hipocolesterolemia
e
hipotrigliceridemia – definidas como CT<100 mg/dL; VLDL<16 mg/dl; LDL-C<70 mg/dL;
HDL< 40 mg/dL e TG< 70 mg/dL - associam-se aos critérios de prognóstico Child-Pugh e
MELD e a alguns parâmetros bioquímicos utilizados como marcadores da função hepática,
entre eles, albumina, bilirrubina total, creatinina, RNI, sódio e plaquetas.
O prognóstico da cirrose depende da etiologia, gravidade da doença, presença de
doenças associadas e complicações. Vários sistemas de avaliação clínica e laboratorial vêm
sendo desenvolvidos ao longo dos anos para auxiliar no estadiamento da hepatopatia. Dentre
eles, os mais utilizados são a classificação de Child-Pugh e o escore MELD. O escore MELD
(the Model for End Stage Liver Disease) tem sido utilizado como medida de priorização dos
pacientes em lista de espera para transplante hepático2,7, sendo considerado um preditor
independente de morbidade24 e de mortalidade para pacientes com cirrose4,12. Brandão e
colaboradores3 , através de um estudo de coorte com 271 pacientes, concluíram que o escore
MELD é uma escala contínua de gravidade que, de maneira acurada, prediz mortalidade, em
três meses, de pacientes com doenças hepáticas crônicas, incluindo os em lista de espera para
transplante.
Nossos resultados mostram que pacientes Child-Pugh C tiveram associação com CT <
100 mg/dL, VLDL < 16 mg/dL, LDL e TG < 70 mg/dl, HDL< 40 mg/dl . Cicognani6 avaliou
os níveis de CT, VLDL, LDL, HDL em pacientes com hepatite crônica e com cirrose e
relacionou os resultados à gravidade da doença (Child-Pugh). Os resultados encontrados
mostram que nos pacientes com cirrose houve uma diminuição significativa do CT, LDL e
HDL quando comparados com os demais grupos (hepatite crônica e controle), e essa redução
estava relacionada à progressão da doença (Child-Pugh C). D’Arienzo8 avaliou o papel
46
prognóstico da hipocolesterolemia em pacientes com cirrose avançada e, como resultado final,
observou uma progressiva diminuição no colesterol plasmático em 34 pacientes com cirrose
viral, Child-Pugh C. Todos os pacientes com nível de CT < 100 mg/dL morreram dentro de 17
meses, enquanto que 75% daqueles com nível de CT >100 mg/dL sobreviveram pelo menos 2
anos.
Ao se analisar as correlações existentes entre perfil lipídico, albumina, sódio,
plaquetas, transaminases, bilirrubina total e os escores MELD e Child-Pugh, verificou-se
associação direta e significativa entre os valores de CT, VLDL, LDL, HDL e TG e à redução
da albumina e do sódio, ou seja, o declínio nos níveis séricos dos lipídeos acompanharam a
diminuição dos níveis de albumina e sódio. Estudos têm demonstrado que a hiponatremia
(Na<130 mEq/L) e hipoalbuminemia (alb < 3,5 mg/dL) podem ser consideradas como fatores
preditivos negativos, independentes, na sobrevida dos pacientes cirróticos1,16,36. Na presente
investigação, a associação entre as plaquetas e a redução do perfil lipídico mostrou-se
significativa, de forma direta, com todos os parâmetros (CT, VLDL, LDL, TG), exceto com o
HDL. Em contrapartida, correlação significativa, contudo inversa, foi observada entre a
redução do perfil lipídico e os valores séricos de BT e RNI e os escores Child-Pugh e MELD.
Tais resultados sugerem que o perfil lipídico possa vir a ser utilizado como uma ferramenta
para auxiliar no prognóstico da cirrose, uma vez que apresentou diferença estatisticamente
significativa com instrumentos validados para tal objetivo. Habib13 analisou 413 pacientes
cirróticos por diferentes etiologias e encontrou que o nível de HDL é um indicador de
prognóstico em pacientes com cirrose avançada. HDL< 30mg/dL foi associado à maior
probabilidade de transplante hepático no prazo de um ano. Além disso, o autor verificou
correlação significativa entre o HDL, marcadores bioquímicos (albumina, bilirrubina e RNI) e
o escore MELD. Jiang11 avaliou 198 pacientes cirróticos descompensados e constatou que os
níveis de TG, CT, HDL e LDL diminuíram com o aumento do MELD. MELD>21 e
CT<108mg/dL foram considerados como fatores independentes de prognóstico em pacientes
com cirrose. Ao analisar a curva de sobrevida (Kaplan-Meier), o autor encontrou que MELD
>21 combinado com CT< 108 mg/dL pode distinguir entre os pacientes que iriam sobreviver e
morrer em 1 ano.
Entre os marcadores bioquímicos utilizados para avaliar o prognóstico da hepatopatia,
destacam-se a bilirrubina total19,33, albumina séria9,28,34, sódio5,16,17,27 e creatinina15,18,22,29.
Nossos resultados mostram associação entre Child-Pugh C e os níveis mais elevados de
bilirrubina total (BT >3 mg/dL) , creatinina ( Cr > 1,5 mg/dL) e RNI (> 2,2) e níveis mais
47
baixos de albumina (Alb < 2,8 mg/dL) e sódio (Na <130 mEq/L). Zauner e col37 examinaram
a mortalidade de 196 pacientes cirróticos exigindo cuidados intensivos. Eles descobriram que
o nível de colesterol foi independentemente associado à mortalidade intra-hospitalar,
juntamente com os níveis de bilirrubina total, creatinina e lactato. A pesquisa realizada com
99 pacientes cirróticos em lista de transplante hepático encontrou redução significativa no
tempo de sobrevivência dos pacientes que apresentaram hipoalbuminemia (Alb <2,5 g/dL),
hipocolesterolemia (CT < 100 mg/dL) e hiponatremia (Na < 130 mEq/L)30 .
Nas análises realizadas entre os genótipos do VHC e as variáveis em estudo, somente a
creatinina apresentou resultados estatisticamente significativos, diferindo de outros autores.
Siagris31 estudou a relação entre genótipos do vírus C e os níveis séricos de colesterol total na
população da Grécia e encontrou que os pacientes com genótipo 3 tinham os níveis séricos de
CT mais baixos do que os demais genótipos. Em contrapartida, Moriya20 demonstrou que
pacientes infectados com genótipo 1b tinham níveis significativamente mais baixos de
colesterol e apolipoproteínas do que aqueles infectados com genótipo 2a, no entanto, vale
destacar que naquela população o genótipo 3 é raro. Petit26 investigou os fatores virais
associados à hipobetalipoproteinemia em 109 pacientes com hepatite crônica por vírus C. Os
resultados mostraram que pacientes infectados com genótipo 3 apresentaram uma diminuição
de LDL, em comparação com os genótipos 1, 2, 4, 5.
CONCLUSÃO
Constatamos que a redução do perfil lipídico, nos pacientes com cirrose por VHC e ou
álcool, está associada, significativamente, com a progressão da cirrose. Essa associação foi
verificada através das correlações significativas entre as frações lipídicas (CT, VLDL, LDL,
HDL, TG), as variáveis bioquímicas (albumina, sódio, plaquetas, creatinina e RNI) e os
critérios de prognóstico (Chil-Pugh e MELD). Ao analisarmos as correlações entre o perfil
lipídico e os genótipos do VHC não observamos diferença estatística.
Esses achados sugerem que a inclusão, nos exames de rotina, da avaliação do perfil
lipídico de pacientes cirróticos – análise acessível a todos os serviços, com baixo custo e
rapidez na obtenção dos resultados – possa ser utilizada como um indicador de prognóstico
para progressão da doença.
Ressalta-se a necessidade da realização de estudos adicionais para verificar a
aplicabilidade em cirrose de outras etiologias.
48
REFERÊNCIAS BIBLIOGRÁFICAS
1.Arroyo V, Colmenero J.Ascite and hepatorenal syndrome in cirrhosis: Pathophysiological
basis of therapy and current management. J Hepatol. 2003;38:S69-89.
2. Boursier J, Cesbron E, Tropet AL, Pilette C. Comparison and Improvement of MELD and
Child-Pugh Score Accuracies for the Prediction of 6-month Mortality in Cirrhotic Patients. J
Clin Gastroenterol. 2009;43:580-85.
3.Brandao A, Fuchs SC, Gleisner AL, Marroni C, Zanotelli ML, Cantisani G. Model for the
end-stage liver disease and death prediction in a cohort of Brazilian patients on the waiting list
for liver transplantation. Clin Transplant. 2008;22:651-6.
4. Brandão,A; Fuchs, S C; Marroni C; Zanotelli, M L; Cantisani, G. MELD and other
predictors of survival after liver transplantation. Clin Transplantat.2009;23:220–27.
5. Chang-Chyi Jenq, Ming-Hung Tsai, Ya-Chung Tian,Ming-Yang Chang, Chan-Yu Lin,
Jau-Min Lien, Yung-Chang Chen, Ji-Tseng Fang, Pan-Chi Chen, and Chih-Wei Yang.
Serum Sodium Predicts Prognosis in Critically Ill Cirrhotic Patients. J Clin Gastroenterol.
2010;44:220-26.
6. Cicognani C; Malavolti M; Morselli-Labate AM; Zamboni L, Sama C, Barbara L. Serum
lipid and lipoprotein patterns in patients with liver cirrhosis and chronic active hepatitis. Arch
Intern Med. 1997;157:792–96.
7. Colmenero J, Castro-Narro G, Navasa M. Utilidad del MELD ( Model for End-stage liver
disease) para asignar prioridade en el transplante hepático. Gastroenterol Hepatol. 2010;
33:330-36.
8. D'Arienzo A, Manguso F, Scaglione G, Vicinanza G, Bennato R, Mazzacca G. Prognostic
value of progressive decrease in serum cholesterol survival in Child-Pugh C viral cirrhosis.
Scand J Gastroenterol.1998;33:1213–18.
9. Das V;Boelle P-Y; Galbois A; Guidet B ; Maury E ; Carbonell N ; Moreau R; Offenstadt G.
Cirrhotic patients in the medical intensive care unit: Early prognosis and long-term survival.
Crit Care Med. 2010;38:2108-16.
10- Fabris C, Federico E, Soardo G, Falleti E, Piristi M. Blood lipids of patients with chronic
hepatitis: differences related to viral etiology. Clin Chimica Acta. 1997; 261(2):159-165.
11. Jiang M ,Liu F, Xiong WJ, Zhong L, Xu W, Xu F, Liu YB. Combined MELD and blood
lipid level in evaluating the prognosis of decompensated cirrhosis. World J Gastroenterol.
2010;16:1397-01.
12. Kamath PS, Kim WR. The model for end-stage liver disease ( MELD). Hepatology. 2007;
45:797-05.
49
13. Habib A, Mihas AA, Abou–Assi SG, Williams LM, Gavis E , Pandak WM, Heuman DM.
High-Density Lipoprotein Cholesterol as an Indicator of Liver Function and Prognosis in
Noncholestatic Cirrhotics. Clin Gastroenterol Hepatol. 2005;3:286–91
14.Imbert-Bismut F, Ratziu V, Pieroni L,Charlotte F, Benhamou Y, Poynard T. Biochemical
markers of liver fibrosis in patients with hepatitis C virus infection: a prospective study.
Lancet. 2001;357:1069–75.
15. Lim YS (Young-Suk Lim) , Larson TS, Benson JT, Kamath PS, Kremers WK, Therneau
TM, Kim WR.Serum sodium, renal function, and survival of patients with end-stage liver
disease. J Hepatol. 2010;52:523-8.
16. Londoño MC, Cárdenas A, Guevara M, Quintó L, de Las Heras D, Navasa M, Rimola A,
Garcia-Valdecasas JC, Arroyo V, Ginès P. MELD score and serum sodium in the prediction
of survival of patients with cirrhosis awating liver transplantatiton. Gut. 2007; 56:1283-90.
17. Luca A ,Angermayr B, Bertolini G, Koenig F, Vizzini G, Ploner M, Peck-Radosavljevic
M, Gridelli B, Bosch J.An integrated MELD model including serum sodium and age improves
the prediction of early mortality in patients with cirrhosis. Liver Transpl. 2007;13:1174-80.
18.Mathurin, Sebastián; Jaimet, Celia; Turletti, Carolina; Arosio, Andrea; González,
Guadalupe; Kuzmicz, Gisela. Renal failure in patients with cirrhosis and ascites: incidence,
etiology and predictive factors. Acta Gastroenterol. Latinoam. 2008;38:116-25.
19. Medeiros DM, Oliveira AC, Barros MF, Cury RA, Sette H Jr, Abdala E, Canedo LF,
Makdissi FF, Andraus W, Martino RB, Rocha-Santos V, Figueira ER, Machado MA, Carrilho
FJ, Cançado EL, Bacchella T, Machado MC. Early mortality in liver transplantation: bilirubin
as predictor of outcome. Transplant Proc. 2004; 36:931-2.
20. Moriya K, Shintani Y, Fujie H, Miyoshi H, Tsutsumi T, Yotsuyanagi H, Iino S, Kimura S,
Koike K. Serum lipid profile of patients with genotype 1b hepatitis C viral infection in Japan.
Hepatol Res. 2003; 25:371-76.
21.Napolitano M, Giuliani A, Alonzi T, Mancone C, D'Offizi G, Tripodi M, Bravo E. Very
low density lipoprotein and low density lipoprotein isolated from patients with hepatitis C
infection induce altered cellular lipid metabolism. J. Med. Virol. 2007; 79(3):254–258.
22. Narayanan Menon KV, Nyberg SL, Harmsen WS, DeSouza NF, Rosen CB, Krom RA,
Wiesner RH.MELD and other factors associated with survival after liver transplantation. Am
J Transplant. 2004;4:819-25.
23. Nashaat EH. Comparative study of serum lipid profile between chronic hepatitis C
Egyptian patients and normal controls and the effect of viral eradication on lipids profile.
Report and Opinion. 2010; 2:14-20.
50
24. Oberkofler CE, Dutkowski P,Stocker R, Schuepbach RA, Stover JF, Pierre-Alain Clavien
P-A, Markus Béchir M. Model of end stage liver disease (MELD) score greater than 23
predicts length of stay in the ICU but not mortality in liver transplant recipients. Crit Care.
2010,14:R117
25. Perlemuter G, Sabile A, Letteron P, Vona G, Topilco A, Chrétien Y, Koike K, Pessayre D,
Chapman J, Barba G, Bréchot C. Hepatitis C vírus core protein inhibits microsomal
triglyceride transfer protein activity and very low density lipoprotein secretion: A model of
viral-related steatosis. FASEB J. 2002;16:185–94.
26.Petit JM, Benichou M, Duvillard L, Jooste V, Bour JB, Minello A, et al. Hepatitis C
Virus–Associated Hypobetalipoproteinemia Is Correlated With Plasma Viral Load, Steatosis,
and Liver Fibrosis. Am J Gastroenterol. 2003;98:1150-54.
27. Ruf AE, Kremers WK, Chavez LL, Descalzi VI, Podesta LG, Villamil FG.Addition of
serum sodium into the MELD socre predicts waiting lista mortality better than MELD alone.
Liver Transpl.2005;11:336-43.
28. Sanchez EQ, Gonwa TA, Levy MF, Goldstein RM, Mai ML, Hays SR, Melton LB,
Saracino G, Klintmalm GB. Preoperative and perioperative predictors of the need for renal
replacement therapy after orthotopic liver transplantation. Transplantation. 2004;78:1048-54.
29.Sánchez-Perez B, Santoyo J, Fernández-Aguilar JL, Suárez MA, Pérez JA, Jiménez M,
González-Poveda I, González-Sánchez A, Aranda JM, De la Fuente A.Preoperative factors
and models predicting mortality in liver transplantation. Transplant Proc.2005;37:1499-501.
30. Selcuk H, Uruc I, Temel MA, Ocal S, Huddam B, Korkmaz M, Unal H, Kanbay M, Savas
N, Gur G, Yilmaz U, Haberal M. Factors Prognostic of Survival in Patients Awaiting Liver
Transplantation for End-Stage Liver Disease. Dig Dis Sci. 2007;52:3217–23.
31. Siagris D, Christofidou M, Theocharis GJ, Pagoni N, Papadimitriou C, Lekkou A,
Thomopoulos K, Starakis I, Tsamandas AC, Labropoulou-Karatza C. Serum lipid pattern in
chronic hepatitis C:histological and virological correlations. J. Viral Hepat. 2006;13:56–61.
32. Tietge UJ, Maugeais C, Lund-Katz S, Grass D, deBeer FC, Rader DJ.Human secretory
phospholipase A2 mediates decreased plasma levels of HDL cholesterol and apoA-I in
response to inflammation in human apoA-I transgenic mice. Arterioscler Thromb Vasc Biol.
2002;22:1213–18.
33. Thuluvath PJ, Yoo HY, Thompson RE. A model to predict survival at one month, one
year, and five years after liver transplantation based on pretransplant clinical characteristics.
Liver Transpl. 2003;9:527-32.
24. Toshikuni N ;Izumi A, Nishino K,Inada N, Sakanoue R ,Yamato R ,Suehiro M, Kawanaka
M,Yamada G. Comparison of outcomes between patients with alcoholic cirrhosis and those
with hepatitis C virus-related cirrhosis. J Gastroenterol Hepatol. 2009;24:1276–83.
51
35.Tsai MH, Peng YS, Chen YC, Lien JM, Tian YC, Fang JT, Weng HH, Chen PC, Yang
CW, Wu CS. Low serum concentration of apolipoprotein A-I is an indicator of poor prognosis
in cirrhotic patients with severe sepsis. J Hepatol. 2009;50:906–15.
36. Valdivia RL, Quiroz FJ. Hiponatremia como factor pronóstico de mortalidad en pacientes
cirróticos internados en el Hospital Nacional Guillermo Almenara Irigoyen. 2003 - 2005. Rev.
Gastroenterol Perú. 2007;27:37-46.
37. Zauner C, Schneeweiss B, Schneider B, Madl C, Klos H, Kranz A, Ratheiser K, Kramer
L, Lenz K. Short-term prognosis in critically ill patients with liver cirrhosis: an evaluation of a
new scoring system. Eur J Gastroenterol Hepatol. 2000;12:517-22.
52
ANEXO
TERMO DE UTILIZAÇÃO DOS DADOS
O presente estudo será realizado na Santa Casa de Porto Alegre. Este é um trabalho
retrospectivo onde serão revisados prontuários e exames laboratoriais de pacientes atendidos
pelos médicos desta instituição de março 2006 a julho 2010. Nos comprometemos a utilizar os
dados e as informações coletadas nos prontuários dos sujeitos da pesquisa de forma
confidencial , garantindo assim o anonimato dos pacientes. Os dados coletados serão
exclusivamente utilizados para fins científicos vinculados a esse projeto. O mesmo foi
aprovado pelo Comitê de Ética em Pesquisa da Universidade Federal de Ciências da Saúde de
Porto Alegre (UFCSPA), protocolo no 1021/10.