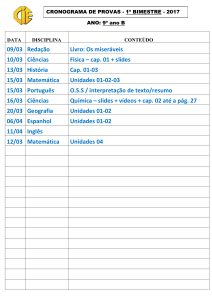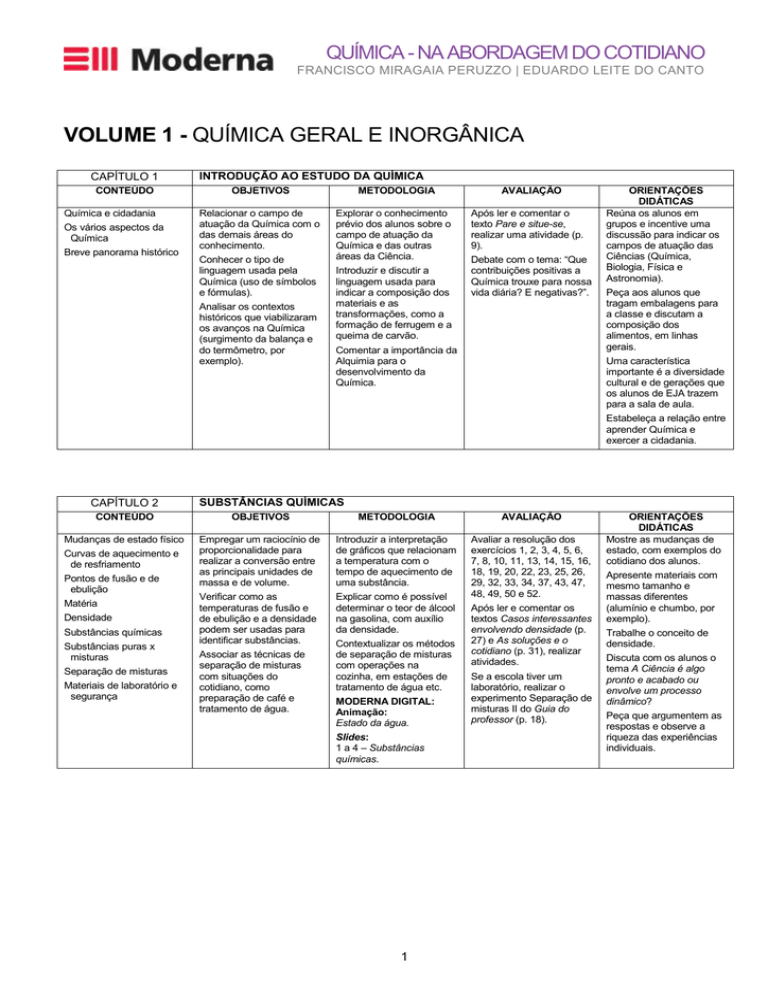
QUÍMICA - NA ABORDAGEM DO COTIDIANO
FRANCISCO MIRAGAIA PERUZZO | EDUARDO LEITE DO CANTO
VOLUME 1 - QUÍMICA GERAL E INORGÂNICA
CAPÍTULO 1
CONTEÚDO
Química e cidadania
Os vários aspectos da
Química
Breve panorama histórico
CAPÍTULO 2
INTRODUÇÃO AO ESTUDO DA QUÍMICA
OBJETIVOS
METODOLOGIA
Relacionar o campo de
atuação da Química com o
das demais áreas do
conhecimento.
Explorar o conhecimento
prévio dos alunos sobre o
campo de atuação da
Química e das outras
áreas da Ciência.
Introduzir e discutir a
linguagem usada para
indicar a composição dos
materiais e as
transformações, como a
formação de ferrugem e a
queima de carvão.
Conhecer o tipo de
linguagem usada pela
Química (uso de símbolos
e fórmulas).
Analisar os contextos
históricos que viabilizaram
os avanços na Química
(surgimento da balança e
do termômetro, por
exemplo).
AVALIAÇÃO
Após ler e comentar o
texto Pare e situe-se,
realizar uma atividade (p.
9).
Debate com o tema: “Que
contribuições positivas a
Química trouxe para nossa
vida diária? E negativas?”.
Comentar a importância da
Alquimia para o
desenvolvimento da
Química.
OBJETIVOS
METODOLOGIA
AVALIAÇÃO
Mudanças de estado físico
Empregar um raciocínio de
proporcionalidade para
realizar a conversão entre
as principais unidades de
massa e de volume.
Verificar como as
temperaturas de fusão e
de ebulição e a densidade
podem ser usadas para
identificar substâncias.
Associar as técnicas de
separação de misturas
com situações do
cotidiano, como
preparação de café e
tratamento de água.
Introduzir a interpretação
de gráficos que relacionam
a temperatura com o
tempo de aquecimento de
uma substância.
Explicar como é possível
determinar o teor de álcool
na gasolina, com auxílio
da densidade.
Avaliar a resolução dos
exercícios 1, 2, 3, 4, 5, 6,
7, 8, 10, 11, 13, 14, 15, 16,
18, 19, 20, 22, 23, 25, 26,
29, 32, 33, 34, 37, 43, 47,
48, 49, 50 e 52.
Após ler e comentar os
textos Casos interessantes
envolvendo densidade (p.
27) e As soluções e o
cotidiano (p. 31), realizar
atividades.
Pontos de fusão e de
ebulição
Matéria
Densidade
Substâncias químicas
Substâncias puras x
misturas
Separação de misturas
Materiais de laboratório e
segurança
Peça aos alunos que
tragam embalagens para
a classe e discutam a
composição dos
alimentos, em linhas
gerais.
Uma característica
importante é a diversidade
cultural e de gerações que
os alunos de EJA trazem
para a sala de aula.
Estabeleça a relação entre
aprender Química e
exercer a cidadania.
SUBSTÂNCIAS QUÍMICAS
CONTEÚDO
Curvas de aquecimento e
de resfriamento
ORIENTAÇÕES
DIDÁTICAS
Reúna os alunos em
grupos e incentive uma
discussão para indicar os
campos de atuação das
Ciências (Química,
Biologia, Física e
Astronomia).
Contextualizar os métodos
de separação de misturas
com operações na
cozinha, em estações de
tratamento de água etc.
MODERNA DIGITAL:
Animação:
Estado da água.
Slides:
1 a 4 – Substâncias
químicas.
1
Se a escola tiver um
laboratório, realizar o
experimento Separação de
misturas II do Guia do
professor (p. 18).
ORIENTAÇÕES
DIDÁTICAS
Mostre as mudanças de
estado, com exemplos do
cotidiano dos alunos.
Apresente materiais com
mesmo tamanho e
massas diferentes
(alumínio e chumbo, por
exemplo).
Trabalhe o conceito de
densidade.
Discuta com os alunos o
tema A Ciência é algo
pronto e acabado ou
envolve um processo
dinâmico?
Peça que argumentem as
respostas e observe a
riqueza das experiências
individuais.
QUÍMICA - NA ABORDAGEM DO COTIDIANO
FRANCISCO MIRAGAIA PERUZZO | EDUARDO LEITE DO CANTO
CAPÍTULO 3
CONTEÚDO
O conceito de reação
química
Exemplos de reação
química
Reagentes e produtos
A Lei de Conservação da
Massa, de Lavoisier
A Lei das Proporções
Constantes, de Proust
CAPÍTULO 4
CONTEÚDO
A Teoria Atômica, de
Dalton
Equação química
Explicação para as leis de
Lavoisier e de Proust
INTRODUÇÃO AO CONCEITO DE REAÇÃO QUÍMICA
OBJETIVOS
METODOLOGIA
AVALIAÇÃO
Representar fenômenos do
cotidiano, como formação
de ferrugem e queima de
carbono, por equações
químicas.
Entender o princípio de
conservação da massa dos
materiais participantes de
uma transformação
química.
Verificar os conceitos
prévios dos alunos sobre
transformações químicas.
Exemplificar reações do
cotidiano e equacioná-las
usando os símbolos e as
fórmulas correspondentes.
Executar a atividade
experimental
demonstrativa Um
experimento com palha de
aço (p. 53).
MODERNA DIGITAL:
Slides:
5 a 7 – Reação química.
Debater sobre a análise da
imagem e do texto da
seção O que você pensa a
respeito?.
Avalie a resolução dos
exercícios: 2, 3, 4, 9, 10,
12 e 13.
Após ler e comentar o
texto de Antoine Laurent
Lavoisier, realizar uma
atividade (p. 62).
ORIENTAÇÕES
DIDÁTICAS
Faça uma demonstração
de transformação química
(reação de bicarbonato de
sódio com vinagre, por
exemplo).
Após a análise do texto da
página 62, peça que os
alunos socializem suas
respostas e identifique
aqueles que apresentam
dificuldades para
expressar suas opiniões.
Explore a seção Reavalie
o que você pensa a
respeito para que os
alunos formalizem suas
ideias iniciais.
DO MACROSCÓPICO AO MICROSCÓPICO: ÁTOMOS E MOLÉCULAS
OBJETIVOS
Verificar como o modelo
atômico de Dalton pode
ilustrar o rearranjo dos
átomos numa reação
química.
Representar uma reação
usando o modelo atômico
de Dalton.
Reconhecer como a
conservação da massa é
uma consequência da
conservação do número de
átomos de cada elemento
numa transformação.
METODOLOGIA
AVALIAÇÃO
Fundamentar e
exemplificar o uso de
modelos para estudar
fenômenos físicos e
químicos.
Equacionar uma
transformação química
entre hidrogênio (H2) e
oxigênio (O2) formando
água (H2O).
Ressaltar a importância do
balanceamento no
equacionamento.
MODERNA DIGITAL:
Slides:
8 e 9 – Átomos e
moléculas.
Avaliar a resolução dos
exercícios 2, 3, 4, 5, 6, 15,
16, 17, 25, 27, 28 e 32.
2
Após ler e comentar o
texto Pare e situe-se,
realizar uma atividade (p.
65).
ORIENTAÇÕES
DIDÁTICAS
Peça aos alunos que
realizem a atividade
proposta (p. 71).
Pergunte o que
aconteceria com o número
de moléculas das demais
substâncias se uma das
reações dessa atividade
fosse executada com o
dobro de moléculas de um
dos reagentes.
Valorize as respostas
individuais e identifique os
conhecimentos, corretos
ou não, sobre a Química
para diferenciar ciência de
senso comum.
QUÍMICA - NA ABORDAGEM DO COTIDIANO
FRANCISCO MIRAGAIA PERUZZO | EDUARDO LEITE DO CANTO
CAPÍTULO 5
CONTEÚDO
A natureza elétrica da
matéria
Modelo atômico de
Thomson
Modelo atômico de
Rutherford
Íons
CAPÍTULO 6
INTRODUÇÃO À ESTRUTURA ATÔMICA
OBJETIVOS
METODOLOGIA
Interessar-se pelas ideias
científicas e pela Ciência
como maneira de entender
melhor o mundo que nos
cerca.
Diferenciar os modelos
atômicos de Rutherford e
de Thomson.
Apresentar as limitações
do modelo atômico de
Dalton.
Levantar os
conhecimentos básicos
dos alunos sobre
eletrostática.
Mostrar o surgimento dos
modelos atômicos como
avanço no entendimento
da estrutura da matéria.
MODERNA DIGITAL:
Animação:
Experimento de
Rutherford.
Slides:
10 a 13 – Modelo atômico.
AVALIAÇÃO
Avaliar a resolução dos
exercícios 1, 2, 3, 4, 5, 7,
9, 11, 14, 15, 17, 18, 25,
32, 33 e 34.
Após ler e comentar o
texto Alguns íons
existentes no organismo
humano, realizar uma
atividade
(p. 90).
Leia o texto sobre
nanotecnologia e discuta
sua importância na
indústria e na pesquisa (p.
93).
ORIENTAÇÕES
DIDÁTICAS
Leia e discuta o texto (p.
79).
Use dados comparativos
das dimensões do átomo e
de seu núcleo para dar
uma noção de como na
matéria predomina o
espaço vazio.
Proponha que se
determinem os números de
cada tipo de partícula
subatômica em átomos de
vários elementos.
Repita essa atividade com
íons positivos e íons
negativos.
NOÇÃO MAIS DETALHADA DA ESTRUTURA ATÔMICA
CONTEÚDO
OBJETIVOS
METODOLOGIA
AVALIAÇÃO
Espectros atômicos
Modelo atômico de Bohr
Algumas aplicações do
modelo atômico de Bohr
Relacionar os espectros
emitidos por íons com a
distribuição de seus
elétrons em camadas.
Analisar fenômenos de
emissão de luz de
materiais, como cloreto de
sódio sob aquecimento.
Exemplificar alguns
fenômenos de emissão de
chama colorida em íons.
Associar o modelo de Bohr
ao comportamento de íons
metálicos sob
aquecimento.
MODERNA DIGITAL:
Slides:
14 a 16 – Estrutura
atômica.
Avaliar a resolução dos
exercícios 1, 2, 3, 4, 6 e 8.
3
Após ler e comentar o
texto O espectro
eletromagnético, realizar
uma atividade
(p. 98).
ORIENTAÇÕES
DIDÁTICAS
Fale sobre os fogos de
artifício e suas cores para
ilustrar essa aula. Vincule
ao repertório do aluno.
Apresente o modelo
atômico de Bohr como
ferramenta para explicar o
comportamento dos fogos
de artifício e verifique o
conhecimento dos alunos.
Sempre aproxime a teoria
do cotidiano para facilitar a
compreensão.
Explore exemplos de
ondas eletromagnéticas,
como a luz, as ondas de
rádio e de TV, as microondas e os raios X.
QUÍMICA - NA ABORDAGEM DO COTIDIANO
FRANCISCO MIRAGAIA PERUZZO | EDUARDO LEITE DO CANTO
CAPÍTULO 7
A TABELA PERIÓDICA DOS ELEMENTOS
CONTEÚDO
OBJETIVOS
METODOLOGIA
Estrutura da tabela
periódica atual
Importância dos elementos
no cotidiano
Entender a importância de
ter, como fonte de
consulta, uma tabela que
apresente os elementos
químicos segundo suas
propriedades físicas e
químicas.
Indicar as propriedades
físicas e químicas de
alguns elementos que
fazem parte do cotidiano
do aluno. Exemplo: sódio,
cloro, oxigênio, cálcio,
carbono etc.
Comparar as principais
características desses
elementos com as de
elementos situados no
mesmo grupo da tabela
periódica.
MODERNA DIGITAL:
Animação:
Tabela periódica:
Introdução, Período,
Grupos, Classificação.
Scientific American
Brasil Aula Aberta 5:
Nitrogênio.
Slides:
17 e 18 – Tabela
periódica.
CAPÍTULO 8
OBJETIVOS
METODOLOGIA
Os três tipos de ligação
química interatômica
Os gases nobres e a regra
do octeto
Ligação iônica
Reconhecer algumas
propriedades das
substâncias pelo tipo de
ligação entre as partículas
que a formam.
Rever como os íons
podem ser formados.
Usar substâncias como o
cloreto de sódio, o gás
carbônico e o alumínio
metálico para mostrar a
estrutura e as
propriedades de
substâncias iônica,
molecular e metálica,
respectivamente.
Reconhecer as principais
propriedades das ligas
metálicas.
MODERNA DIGITAL:
Animação:
Tipos de ligações químicas
interatômicas.
Slides:
19 a 21 – Ligações
químicas.
Comparando as
substâncias iônicas,
moleculares e metálicas
Avaliar a resolução dos
exercícios: 1, 2, 3, 4, 5, 6,
8, 9 e 10.
Após ler e comentar o
texto Valência e tabela
periódica, realizar uma
atividade
(p. 127).
ORIENTAÇÕES
DIDÁTICAS
Leia e analise o texto (p.
114).
Utilize a tabela dos
elementos químicos no
cotidiano para identificar no
repertório dos alunos
informações verdadeiras
ou falsas (p. 118 e 119).
A contextualização
estabelece uma ponte
entre o conhecimento
científico e o cotidiano dos
alunos da EJA.
Consulte a tabela periódica
no site:
http://educar.sc.usp.
br/quimica/tabela.html
LIGAÇÕES QUÍMICAS INTERATÔMICAS
CONTEÚDO
Ligação covalente
Ligação metálica
AVALIAÇÃO
4
AVALIAÇÃO
Avaliar a resolução dos
exercícios: 3, 4, 8, 9, 11,
13, 14, 21, 22, 23, 25, 26,
31, 36, 42, 43, 45, 47, 49,
50, 51 e 54.
Após ler e comentar o
texto Por que algumas
substâncias conduzem
corrente elétrica e outras
não?, realizar uma
atividade (p. 161).
ORIENTAÇÕES
DIDÁTICAS
Peça para um aluno ler o
texto (p. 141), em voz alta,
e estimule a participação
dos demais.
Analise com os alunos os
exercícios resolvidos 1, 2,
20 e 21.
Incentive a participação
dos alunos na resolução
de problemas.
Explore o mapa conceitual
para elaborar proposições
sobre os conceitos de
forma contextualizada.
Consulte o site:
http://www.saberweb.co
m.br/quimica/liga_metali
ca.html
QUÍMICA - NA ABORDAGEM DO COTIDIANO
FRANCISCO MIRAGAIA PERUZZO | EDUARDO LEITE DO CANTO
CAPÍTULO 10
CONTEÚDO
Algumas soluções
aquosas conduzem
corrente elétrica
Dissociação iônica e
ionização
Soluções eletrolíticas e
soluções não eletrolíticas
CAPÍTULO 11
CONDUTIVIDADE ELÉTRICA DE SOLUÇÕES AQUOSAS
OBJETIVOS
Caracterizar dissoluções
em água como boas
condutoras e más
condutoras de corrente
elétrica.
METODOLOGIA
AVALIAÇÃO
Analisar a condutibilidade
do meio resultante da
dissolução em água de:
cloreto de sódio, sacarose
e cloreto de hidrogênio.
Caracterizar as condições
para que um meio seja
eletrólito.
MODERNA DIGITAL:
Slides:
26 a 28 – Soluções
aquosas.
Avaliar a resolução dos
exercícios: 1, 2, 3, 4, 5, 6,
7, 8, 9, 10, 11, 13 e 14.
Após ler e comentar o
texto O emprego de
parâmetros físicos e
químicos para a avaliação
da qualidade de águas
naturais, realizar uma
atividade (p. 199).
PRINCÍPIOS DA QUÍMICA INORGÂNICA
CONTEÚDO
OBJETIVOS
METODOLOGIA
AVALIAÇÃO
Conceituação de ácidos e
bases
Identificar as estruturas de
ácidos, bases, sais e
óxidos e discorrer sobre as
propriedades dos
principais representantes
de cada grupo.
Reconhecer as reações de
neutralização e discutir
situações do cotidiano em
que elas são provocadas.
Caracterizar as estruturas
químicas de ácidos, bases,
sais e óxidos.
Analisar as situações do
cotidiano em que ácidos,
bases, sais e óxidos estão
presentes.
Avaliar a resolução dos
exercícios: 1, 2, 3, 4, 5, 6,
12, 13, 14, 27, 30, 34, 36,
37, 41, 49, 51, 56 e 63.
Após ler e comentar os
textos A escala de pH
(p. 218) e Sais e cotidiano
(p. 227), realizar
atividades.
Pesquisar sobre as
riquezas minerais do Brasil
e sua aplicação.
Ácidos
Bases
Sais
Ácidos, bases e sais como
eletrólitos
Óxidos: definição e
nomenclatura
ORIENTAÇÕES
DIDÁTICAS
Leia com os alunos o texto
introdutório do capítulo e
identifique se há
dificuldade na
compreensão (p. 191).
Incentive os alunos a
realizar o experimento
(p. 192) e peça que
expliquem o fenômeno a
partir da correlação com o
cotidiano.
Facilite a socialização do
conhecimento em sala de
aula.
Discutir a importância das
reações de neutralização
como, por exemplo, a
correção da acidez do solo
ou o uso de antiácidos
estomacais.
MODERNA DIGITAL:
Slides:
29 a 33 – Princípios da
Química Inorgânica.
5
ORIENTAÇÕES
DIDÁTICAS
Peça aos alunos que
realizem oralmente a
atividade proposta na
seção O que você pensa a
respeito?.
Incentive-os a construir um
jogo que relacione o nome
das substâncias e suas
fórmulas.
Utilize o exercício 47 para
ilustrar as reações de
neutralização.
Para mais informações
sobre pH, consulte a
revista Química Nova na
Escola,
no 17, ou o site
qnesc.sbq.org.br/online/
qnesc17/a07.pdf
QUÍMICA - NA ABORDAGEM DO COTIDIANO
FRANCISCO MIRAGAIA PERUZZO | EDUARDO LEITE DO CANTO
CAPÍTULO 13
CONTEÚDO
Estabelecendo relação
entre massa e
quantidade
Massa atômica de um
elemento e massa
molecular
MOL
OBJETIVOS
Relacionar massa
molecular e massa molar.
Associar a massa de uma
substância com sua
quantidade de matéria.
Massa de íons
A grandeza quantidade de
matéria e a Constante de
Avogadro
Quantidade de matéria
Constante de Avogadro
METODOLOGIA
Rever as medidas usadas
no cotidiano para
determinar massa,
volume etc.
Conceituar massas
atômicas e massas
moleculares.
Introduzir os conceitos de
mol.
MODERNA DIGITAL:
Slides:
35 e 36 – Mol.
AVALIAÇÃO
Avaliar a resolução dos
exercícios 1, 2, 8, 11, 12,
16, 19, 20, 21, 22, 23, 27,
28, 30, 33, 35, 45, 47, 48,
51, 56, 72 e 75,
individualmente ou em
grupo.
Após ler e comentar o
texto Contando átomos (p.
298), realizar uma
atividade.
Massa molar
ORIENTAÇÕES
DIDÁTICAS
Apresente o conceito de
massa atômica.
Mostre como calcular a
massa molecular da água
com base nas massas
atômicas do hidrogênio e
do oxigênio, fornecidas na
tabela periódica.
Divida a turma em grupos
e peça que leiam o texto
da seção Informe-se sobre
a Química para trabalhar
as situações propostas (p.
305).
Aproveite as atividades
para identificar o preparo
dos alunos de EJA.
CAPÍTULO 14
CONTEÚDO
Transformações
envolvendo massa fixa
de gás
Equação geral dos gases
Volume molar dos gases
Lei do Gás Ideal
Misturas gasosas
O COMPORTAMENTO FÍSICO DOS GASES
OBJETIVOS
Analisar a relação entre
pressão, volume e
temperatura e a
quantidade de gás em
um recipiente.
METODOLOGIA
AVALIAÇÃO
Conceituar pressão
gasosa usando como
instrumento
contextualizador a
calibragem de pneus.
Avaliar a resolução dos
exercícios 2, 3, 4, 5, 12,
13, 17, 18, 20, 25, 26, 33,
35, 39, 40, 43, 44, 66, 67,
69, 84, 90 e 94.
Montar uma tabela com
dados referentes à
pressão, ao volume, à
temperatura e à
quantidade de matéria de
um gás.
Leitura e interpretação do
texto Pressurização de
cabine de avião (p. 351352).
Sugerir o experimento
Contração do ar submetido
a resfriamento, para casa,
e posterior relatório. O
experimento encontra-se
disponível no Guia do
professor.
Deduzir, com base na
tabela anterior, a
aplicabilidade da equação
de estado dos gases
(Equação de Clapeyron).
MODERNA DIGITAL:
Animação:
Transformação dos gases.
Scientific American
Brasil Aula Aberta 1:
A magia das bolhas de
champanhe.
Slides:
37 a 42 – Gases.
6
ORIENTAÇÕES
DIDÁTICAS
Utilize os exercícios
resolvidos 6 e 8 para
ilustrar as transformações
gasosas.
Leia e comente o texto
Gás ideal versus gás real
(p. 338).
Peça aos alunos para
apresentar seminários com
o tema Aspectos físicos e
químicos da atmosfera:
efeito estufa, destruição da
camada de ozônio e
aquecimento global,
incentivando a busca de
alternativas para esses
problemas.
Valorize as experiências
dos alunos.
QUÍMICA - NA ABORDAGEM DO COTIDIANO
FRANCISCO MIRAGAIA PERUZZO | EDUARDO LEITE DO CANTO
CAPÍTULO 15
ASPECTOS QUANTITATIVOS DAS REAÇÕES QUÍMICAS
CONTEÚDO
OBJETIVOS
Relações estequiométricas
fundamentais
Analisar transformações
como queima de etanol e
oxidação de ferro metálico,
do ponto de vista das
quantidades dos materiais
envolvidos.
METODOLOGIA
Usar a equação
balanceada de formação
de ferrugem a partir de
ferro metálico, como
fundamento para
estabelecer relações de
massa e volume das
substâncias envolvidas.
MODERNA DIGITAL:
Slides:
43 e 44 – Reações
químicas.
AVALIAÇÃO
Avaliar a resolução dos
exercícios 2, 3, 5, 6, 7, 13,
15, 16 e 23.
Após ler e comentar o
texto (p. 356), realizar uma
atividade.
Leitura, debate e
interpretação do texto
Mudanças climáticas
(p. 382-384).
ORIENTAÇÕES
DIDÁTICAS
Leia e analise, com os
alunos, o texto introdutório
(p. 355).
Analise os exercícios
resolvidos 1, 11, 19 e 29.
Proponha a troca de
receitas e peça aos alunos
que as alterem. Peça que
exponham suas opiniões
sobre os resultados que
podem obter com essa
mudança.
Estimule sempre a
resolução de situações-problema e o
desenvolvimento da lógica
dos alunos de EJA.
VOLUME 2 - FÍSICO-QUÍMICA
CAPÍTULO 1
CONTEÚDO
Alguns conceitos
introdutórios
Concentração comum
Densidade de solução x
concentração comum
Título, porcentagem e
partes por milhão
Diluição de soluções
EXPRESSANDO A CONCENTRAÇÃO DE SOLUÇÕES AQUOSAS
OBJETIVOS
METODOLOGIA
AVALIAÇÃO
Reconhecer a importância
de se expressar
numericamente as
concentrações de
soluções.
Apresentar duas soluções
aquosas de sacarose
(açúcar) de diferentes
concentrações.
Associar as concentrações
das soluções à intensidade
do sabor que elas
apresentam (lembrar que,
em laboratório, as
soluções não devem ser
tocadas ou
experimentadas).
Usar o exemplo da adição
de água a sucos de frutas
como analogia à diluição
de soluções.
MODERNA DIGITAL:
Animação:
Efeito da concentração no
equilíbrio químico.
Slides:
45 a 47 – Soluções
aquosas.
Avaliar a resolução dos
exercícios 1, 2, 4, 5, 6, 7,
19, 20, 21, 23, 24, 25, 26,
27, 40, 50, 55, 56, 58, 62,
64, 65, 66, 73, 78, 79 e 83.
7
Após ler e comentar o
texto introdutório, realizar
uma atividade (p. 9).
ORIENTAÇÕES
DIDÁTICAS
Peça aos alunos que
discutam o exercício
resolvido 13 (p. 17)
Aproveite a diversidade de
gerações e origens para
estimular os alunos a
comentar o texto Oceanos:
uma solução de eletrólitos
(p. 40). Proponha a
reflexão sobre os
problemas que o planeta
enfrenta, relacionados com
a poluição dos mares e
oceanos.
Estimule a lógica para
resolver problemas.
QUÍMICA - NA ABORDAGEM DO COTIDIANO
FRANCISCO MIRAGAIA PERUZZO | EDUARDO LEITE DO CANTO
CAPÍTULO 2
PROPRIEDADES COLIGATIVAS
CONTEÚDO
OBJETIVOS
METODOLOGIA
AVALIAÇÃO
É possível ferver a água
sem aquecê-la?
Diagrama de fases de uma
substância pura
Pressão de vapor de um
líquido
Temperatura de ebulição
de um líquido
Reconhecer como as
temperaturas de fusão e
de ebulição de um líquido
podem ser influenciadas
pela presença de soluto.
Discutir em que consiste a
osmose e suas aplicações
(conservação de
alimentos, por exemplo).
Mostrar como a adição de
aditivos na água de
radiadores de automóveis
aumenta a temperatura de
ebulição e diminui a
temperatura de
solidificação da água.
Avaliar a resolução dos
exercícios 3, 5, 11, 12, 13,
14, 15, 16, 17, 18, 21, 22,
33, 34, 35, 38, 42, 43 e 53.
Aumento da temperatura
de ebulição
(ebulioscopia)
Abaixamento da
temperatura de
solidificação (crioscopia)
Osmose
CAPÍTULO 3
Apresentar, graficamente,
os fenômenos coligativos.
Contextualizar as
aplicações da osmose.
MODERNA DIGITAL:
Animação:
Osmose.
Após ler e comentar os
textos O uso de
anticongelantes nos
veículos em países frios
(p. 65) e O cloreto de
sódio e a osmose (p. 72),
realizar atividades.
ORIENTAÇÕES
DIDÁTICAS
Trabalhe e discuta o
exercício resolvido 24 (p.
62), estimulando a
participação de todos.
Divida a sala em grupos e
peça que leiam e identifiquem os principais pontos
do texto na seção Informese sobre a Química (p.8283).
Peça que ilustrem com
exemplos do seu cotidiano.
Valorize a diversidade
regional e cultural dos
alunos de EJA.
Para saber mais detalhes
sobre osmose, consulte a
revista Química Nova na
Escola, no 26, novembro
de 2007, ou o site
http://qnesc.sbq.org.br/o
nline/qnesc26/v26a11.pdf
PROCESSOS DE OXIRREDUÇÃO
CONTEÚDO
OBJETIVOS
Transferência de elétrons,
oxidação e redução
O conceito de número de
oxidação
Reações de oxirredução
Caracterizar os fenômenos
de oxidação.
Identificar os fatores que
facilitam a oxidação dos
metais.
METODOLOGIA
Analisar fenômenos de
oxidação que ocorrem no
cotidiano (formação de
ferrugem, por exemplo).
Discutir as condições que
favorecem a corrosão de
objetos metálicos.
MODERNA DIGITAL:
Slide:
48 – Oxirredução.
AVALIAÇÃO
Avaliar a resolução dos
exercícios 2, 6, 12, 18, 23,
30 e 38.
Realizar uma atividade
sobre o texto O bafômetro
de dicromato (p. 104).
Desenvolver a reação de
oxirredução para obtenção
do ferro. Logo após,
discutir a aplicação desse
metal na sociedade.
ORIENTAÇÕES
DIDÁTICAS
Analise e comente os
exercícios resolvidos 1
(p. 93), 8 (p. 98), 19 (p.
101) e 28 (p. 104).
Resolva com os alunos o
exercício 33 (p. 105) e
comente a atuação da
vitamina C na alimentação
como antioxidante.
Leia o texto sobre o
processo fotográfico em
preto e branco e discuta as
questões com os alunos.
Favoreça a
interdisciplinaridade.
8
QUÍMICA - NA ABORDAGEM DO COTIDIANO
FRANCISCO MIRAGAIA PERUZZO | EDUARDO LEITE DO CANTO
CAPÍTULO 4
CONTEÚDO
Celas eletroquímicas
Estudo das celas
galvânicas
Potencial-padrão de
semicela
Aplicações da tabela de
potenciais-padrão
ELETROQUÍMICA: CELAS GALVÂNICAS
OBJETIVOS
METODOLOGIA
AVALIAÇÃO
Verificar como se pode
obter corrente elétrica a
partir de uma reação.
Descrever em que consiste
uma corrosão e como ela
pode ser atenuada.
Contextualizar a corrosão
indicando como esse
fenômeno ocorre nos
materiais de uso cotidiano.
Avaliar a resolução dos
exercícios 2, 3, 4, 6, 7, 8,
9, 10, 13, 14, 15, 16 e 19.
Realizar uma atividade
sobre o texto Diferença de
potencial e corrente
elétrica (p. 124), com
exemplos de pilha comum
e bateria automotiva.
Pilhas e baterias
comerciais
CAPÍTULO 5
CONTEÚDO
Conceito de eletrólise
Eletrólise ígnea
Eletrólise aquosa
Aplicações da eletrólise
Noções de metalurgia
Apresentar o esquema da
pilha de Daniell,
mostrando como a
corrente elétrica é
produzida.
Montar pilhas galvânicas
com outros pares de
metais.
MODERNA DIGITAL:
Animação:
Pilha seca comum ou de
Leclanché, Pilha alcalina,
pilha de mercúrio e tipos
de baterias.
Simulador:
Pilha de Daniell.
Slides:
49 a 52 – Eletroquímica.
ORIENTAÇÕES
DIDÁTICAS
Analise e comente o
exercício resolvido 1,
exercitando a lógica nos
alunos (p. 128).
Peça aos alunos que
identifiquem os metais que
sofrem oxidação. Ilustre
com exemplos do
ambiente de trabalho,
principalmente dos que
autam na construção civil
ou em empresas
metalúrgicas.
Obtenha mais informações
sobre corrosão na revista
Química Nova na Escola,
no 19, maio de 2004, ou no
site
http://qnesc.sbq.org.br/o
nline/qnesc19/a04.pdf
ELETROQUÍMICA: CELAS ELETROLÍTICAS
OBJETIVOS
METODOLOGIA
Constatar como uma
corrente elétrica pode
provocar uma reação.
Identificar como a eletrólise
pode ser usada na
galvanoplastia.
Discutir a importância da
eletrólise na obtenção de
metais como o alumínio e
magnésio.
Esquematizar a
niquelação de um objeto
metálico.
Discutir as aplicações da
eletrólise.
MODERNA DIGITAL:
Animação:
Eletrólise ígnea e aquosa.
Slide:
53 – Eletrólise.
9
AVALIAÇÃO
Avaliar a resolução dos
exercícios 1, 2, 3, 4, 6, 9,
10, 21, 28, 31, 32, 33, 34,
35, 39, 41, 42 e 43.
Realizar uma atividade
sobre o texto A importância
de reciclar o alumínio
(p. 189).
ORIENTAÇÕES
DIDÁTICAS
Incentive a leitura e a
interpretação do texto
Indústrias de
galvanoplastia (p. 169).
Se algum aluno trabalhar
nessa área, peça para que
compartilhe informações.
Leia e discuta os itens 7.2
(p. 174), 7.3 (p. 175) e 7.4
(p. 176).
QUÍMICA - NA ABORDAGEM DO COTIDIANO
FRANCISCO MIRAGAIA PERUZZO | EDUARDO LEITE DO CANTO
CAPÍTULO 6
CONTEÚDO
Calor e unidades para
expressá-lo
Entalpia e variação de
entalpia
Entalpia-padrão de
combustão
CAPÍTULO 7
TERMOQUÍMICA: O CALOR E OS PROCESSOS QUÍMICOS
OBJETIVOS
METODOLOGIA
AVALIAÇÃO
Identificar reações
endotérmicas e
exotérmicas no cotidiano.
Analisar o teor calórico dos
alimentos.
Analisar a relação entre as
unidades de medida de
energia.
Discutir como o teor
calórico dos alimentos está
relacionado à
termoquímica.
MODERNA DIGITAL:
Vídeo:
Efeito da temperatura no
equilíbrio químico.
Slides:
54 e 55 – Termoquímica.
Avaliar a resolução dos
exercícios 1, 2, 3, 4, 5, 6,
7, 9, 13, 19, 20, 21, 23, 27,
28, 29, 30, 31, 32, 33, 34 e
48.
Realizar uma atividade
sobre o texto Nutrientes,
suas funções e seu
conteúdo calórico (p. 203).
Realizar o experimento em
sala: Sensações térmicas
podem ser enganosas, do
Guia do Professor.
CINÉTICA QUÍMICA: O TRANSCORRER DAS REAÇÕES QUÍMICAS
CONTEÚDO
OBJETIVOS
METODOLOGIA
AVALIAÇÃO
Quantificando a rapidez de
uma reação
Efeito da concentração
sobre a rapidez
Efeito da temperatura
sobre a rapidez
Analisar os fatores que
influem na rapidez de uma
reação.
Reconhecer nos rótulos de
produtos industrializados
aspectos relacionados à
sua conservação.
Discutir como a
temperatura influi na
rapidez de uma reação.
Contextualizar essa
análise com o exemplo do
uso da geladeira para
diminuir a velocidade de
decomposição dos
alimentos.
Avaliar a resolução dos
exercícios 2, 5, 7, 11, 12,
13, 15, 16, 19, 24, 25, 26,
27, 28, 29, 30, 31, 36 e 37,
Discutir como um
catalisador influi na
rapidez de uma reação.
Realizar o experimento
indicado no Guia do
professor: Cinética química
e conservação dos
alimentos (p. 40).
Efeito da superfície de
contato sobre a rapidez
Efeito do catalisador sobre
a rapidez
Contextualizar essa
discussão lembrando
como a água oxigenada se
decompõe mais
rapidamente na presença
de sangue.
MODERNA DIGITAL:
Animação:
Efeito do catalisador e da
concentração sobre a
velocidade da reação.
Slides:
56 a 58 – Cinética
química.
CAPÍTULO 8
ORIENTAÇÕES
DIDÁTICAS
Identifique os
conhecimentos prévios dos
alunos por meio da seção
O que você pensa a
respeito?.
Valorize o repertório dos
alunos de EJA sobre o
conhecimento do valor
calórico dos alimentos.
Use o texto Saúde,
consumo e propaganda
para embasar a discussão
e ilustre com as
experiências das dietas (p.
206).
Peça que leiam o texto A
reação exotérmica de
autodefesa do besouro-bombardeiro (p. 210) para
avaliar a aplicação na
natureza.
Realizar uma atividade
sobre o texto A destruição
da camada de ozônio:
uma catálise homogênea
(p. 260).
EQUILÍBRIO QUÍMICO: A COEXISTÊNCIA DE REAGENTES E PRODUTOS
10
ORIENTAÇÕES
DIDÁTICAS
Trabalhe o exercício
resolvido 1 (p. 236).
Faça o experimento (p.
244). Mobilize os
elementos do raciocínio
científico e do cotidiano,
que os alunos usam para
compreender esse
fenômeno.
Peça aos alunos que
discutam sobre a poluição
do ar e que proponham
soluções para esse
problema. Utilize o texto (p.
261).
Encontre mais informações
sobre catalisadores no site
http://www.unicamp.br/u
nicamp/unicamp_hoje/ju/
outubro2008/ju413_pag0
4.php
Com auxílio do texto
proposto no Guia do
professor, explique por que
uma vela se apaga quando
abanada, mas o carvão em
brasa fica mais
incandescente.
QUÍMICA - NA ABORDAGEM DO COTIDIANO
FRANCISCO MIRAGAIA PERUZZO | EDUARDO LEITE DO CANTO
CONTEÚDO
Conceito de equilíbrio
químico
Constante de equilíbrio em
função das
concentrações
Deslocamento de
equilíbrio
OBJETIVOS
Reconhecer a importância
do pH na determinação da
acidez ou basicidade de
um meio aquoso.
Entender a relação entre
os indicadores ácido-base
e a acidez do meio.
Equilíbrio de soluções de
eletrólitos
pH e pOH
Indicadores ácido-base
CAPÍTULO 9
CONTEÚDO
A descoberta da
radioatividade
Radioatividade é um
fenômeno nuclear
Estudo das emissões alfa,
beta e gama
Cinética dos decaimentos
radioativos
Algumas aplicações da
radioatividade
Fissão nuclear
Fusão nuclear
METODOLOGIA
Relacionar os valores de
pH de soluções aquosas
com as diferentes
concentrações de
hidrogênio que elas
apresentam.
Estudar os indicadores
ácido-base como um
sistema em equilíbrio em
que reagentes e produtos
apresentam cores
diferentes.
MODERNA DIGITAL:
Animação:
Conceito de Equilíbrio
Químico.
Scientific American
Brasil Aula Aberta 2:
Água potável.
Slides:
59 a 61 – Equilíbrio
químico.
AVALIAÇÃO
Avaliar a resolução dos
exercícios 1, 2, 3, 10, 11,
14, 40, 41, 43, 68, 69, 75,
80 e 97.
Realizar uma atividade
sobre o texto O princípio
de Le Chatelier bem na
frente dos seus olhos (p.
282).
Realizar o experimento Sal
no refrigerante, proposto
no Guia do professor (p.
51).
ORIENTAÇÕES
DIDÁTICAS
Trabalhe e comente os
exercícios resolvidos 4 e 8
(p. 271).
Leia e discuta com os
alunos o texto da seção
Informe-se sobre a
Química (p. 317).
Peça que eles tragam
exemplos de erros
médicos.
Discuta com os alunos a
questão da cárie dental,
principalmente em
crianças. Solicite que
identifiquem ou que
proponham soluções para
esse problema no Brasil.
RADIOATIVIDADE: FENÔMENOS DE ORIGEM NUCLEAR
OBJETIVOS
METODOLOGIA
AVALIAÇÃO
Discutir as consequências
de expor um organismo
vivo à radioatividade.
Reconhecer a importância
da meia-vida na avaliação
da radioatividade residual
de uma amostra.
Analisar os perigos da
exposição à
radioatividade.
Estudar as aplicações da
radioatividade.
Analisar como os meios de
comunicação divulgaram
os problemas radioativos
no Japão, a fim de
entender os diferentes
processos de geração de
energia nuclear.
MODERNA DIGITAL:
Animação:
Datação do carbono 14.
Slides:
62 a 64 – Radioatividade.
Avaliar a resolução dos
exercícios 1, 4, 14, 20, 21,
22, 23, 26, 27, 28,44, 48,
50, 51 e 52.
Conhecer as aplicações da
radioatividade.
11
Após ler e comentar o
texto O acidente do césio137, realizar uma atividade
(p. 350).
ORIENTAÇÕES
DIDÁTICAS
Leia com os alunos o texto
introdutório do capítulo (p.
323).
Os alunos de EJA trazem
diferentes leituras de
problemas antigos como a
explosão das bombas
atômicas na Segunda
Guerra Mundial e a atual
situação do Japão com o
vazamento de radiação.
Complemente essa
discussão com o texto
O acidente de Chernobyl
(p.352).
Mais informações sobre
radioterapia podem ser
encontradas no site
http://www.inca.gov.br/co
nteudo_view.asp?ID=100
QUÍMICA - NA ABORDAGEM DO COTIDIANO
FRANCISCO MIRAGAIA PERUZZO | EDUARDO LEITE DO CANTO
VOLUME 3 - QUÍMICA ORGÂNICA
CAPÍTULO 1
CONTEÚDO
O que é Química
Orgânica?
Alguns exemplos de
compostos orgânicos
Cadeia carbônica
Fórmulas estruturais
simplificadas
Classificação dos
carbonos
Benzeno e compostos
aromáticos
Classificação das cadeias
carbônicas
O petróleo e os
hidrocarbonetos
Nomenclatura
CAPÍTULO 2
CONTEÚDO
Classes funcionais na
Química Orgânica
Álcoois
Aldeídos
Cetonas
Ácidos carboxílicos
Outras formas de
nomenclatura para
ácidos carboxílicos,
aldeídos, álcoois e
cetonas
Éteres
Ésteres
Aminas
Amidas
Compostos halogenados
Fenóis
INTRODUÇÃO À QUÍMICA DOS COMPOSTOS DE CARBONO
OBJETIVOS
METODOLOGIA
Caracterizar as
substâncias orgânicas.
Analisar e interpretar os
vários tipos de
representações usadas
para estudar uma molécula
de substância orgânica.
Saber relacionar a
estrutura molecular com
algumas de suas
propriedades.
Apresentar exemplos de
substâncias orgânicas do
cotidiano (metano, etanol,
acetona, 2-metilfenol –
presente na creolina,
vitamina C, etc.), por meio
de suas fórmulas
estruturais e simplificadas.
Analisar os vários tipos de
cadeias carbônicas das
substâncias mencionadas.
Comentar a importância do
petróleo e de seus
derivados.
Ter uma postura crítica
diante dos usos do
petróleo.
Conhecer as regras
básicas de nomenclatura.
MODERNA DIGITAL:
Animação:
Classificação das cadeias
carbônicas.
Slides:
65 a 67 – Hidrocarbonetos.
AVALIAÇÃO
Avaliar a resolução dos
exercícios 1, 3, 4, 6, 7, 8,
10, 11, 13, 14, 25, 26, 31,
32, 33, 36, 37, 43, 44, 58,
59, 62, 63, 65, 66, 67, 68,
72, 76, 77, 78, 80 e 82.
Após ler e comentar o
texto introdutório (p. 9) e
Gás natural (p. 30),
realizar uma atividade
sobre ele (p. 350).
Realizar a atividade
sugerida no Guia do
professor e elaborar um
comercial de rádio
alertando sobre os riscos
da automedicação (p. 14).
ORIENTAÇÕES
DIDÁTICAS
Trabalhe e discuta os
exercícios resolvidos 1, 5,
19, 20 e 64.
Leia e comente o texto
Nem todo composto
aromático é tóxico (p. 18).
Peça aos alunos que
construam os modelos
moleculares (p.23).
Leia e comente o texto O
cigarro e o risco que
oferece (p. 47). Aproveite
para explorar as opiniões
divergentes sobre as
campanhas contra o fumo.
Explore mais referências
no site
http://www.inca.gov.br/ta
bagismo/
AS PRINCIPAIS CLASSES FUNCIONAIS DE COMPOSTOS ORGÂNICOS
OBJETIVOS
METODOLOGIA
Reconhecer os principais
grupos funcionais ao
observar a fórmula
estrutural de compostos
orgânicos.
Compreender as
características das
principais classes
funcionais de compostos
orgânicos.
Identificar substâncias
orgânicas presentes em
nosso cotidiano.
Analisar a utilização de
alguns tipos de compostos
orgânicos na alimentação
(vitamina C nos sucos de
frutas, alicina no alho, etc.)
Estudar alguns tipos de
compostos orgânicos que
podem oferecer riscos ao
ser humano e à natureza.
MODERNA DIGITAL:
Modelos 3D:
Etano, Metanol, Propano,
Butano, Propanona,
Metilamina, Ureia, Fenol,
Ácido Etanoico.
Slides:
68 a 71 – Funções
orgânicas.
12
AVALIAÇÃO
Avaliar a resolução dos
exercícios 1, 2, 5, 8, 10,
11, 12, 13, 14, 18, 19, 22,
23, 24, 25, 26, 33, 35, 36,
38, 39, 40, 41, 42, 43, 52,
53, 54, 57, 58, 64, 65, 67,
70, 71, 72 e 73.
Realizar uma atividade
sobre o texto Ureia: uma
amida muito importante (p.
78), com destaque para o
papel dessa substância no
organismo e também na
indústria.
ORIENTAÇÕES
DIDÁTICAS
Leia e analise com a sala o
texto As bebidas alcoólicas
representam risco (p. 60).
Incentive a discussão
sobre a Lei Seca, que foi
implantada recentemente.
Aborde os dados do IBGE
sobre a taxa de
mortalidade decorrente de
acidentes de trânsito.
Realize o experimento do
Guia do professor
Investigando olfato e
paladar para que o aluno
constate que o que
costumamos chamar de
“sabor” dos alimentos se
deve à percepção
simultânea das sensações
de olfato e paladar (p. 18).
QUÍMICA - NA ABORDAGEM DO COTIDIANO
FRANCISCO MIRAGAIA PERUZZO | EDUARDO LEITE DO CANTO
CAPÍTULO 4
CONTEÚDO
Conceito de isômeros
Isomeria plana
Isomeria geométrica (ou
cis-trans)
CAPÍTULO 8
CONTEÚDO
Oxidação de álcoois
Esterificação
Hidrólise básica de ésteres
ISOMERIA
OBJETIVOS
Mostrar, por meio de
exemplos, que uma
determinada fórmula
molecular pode
representar várias
substâncias orgânicas.
METODOLOGIA
AVALIAÇÃO
Apresentar exemplos de
isômeros cis e trans de
substâncias presentes em
alimentos.
Avaliar a resolução dos
exercícios 1, 4, 12, 13, 16,
17 e 27.
Realizar uma atividade
sobre o texto Visão
envolve conversão entre
isômeros geométricos (p.
145).
Discutir os efeitos da
“gordura trans” no
organismo humano.
MODERNA DIGITAL:
Animação:
Isomeria óptica.
Slides:
75 a 78 – Isomeria.
ORIENTAÇÕES
DIDÁTICAS
Faça uma análise com os
alunos do texto introdutório
(p. 137).
Resolva com os alunos o
exercício 39 (p. 158).
Aproveite para comentar
que os isômeros
geométricos apresentam
propriedades diferentes.
Divida a turma em grupos
e peça que façam as
atividades propostas na
seção Você entendeu a
leitura? (p. 161). Incentive
a participação coletiva e a
troca de informações.
OXIRREDUÇÃO, DESIDRATAÇÃO E ESTERIFICAÇÃO
OBJETIVOS
METODOLOGIA
Analisar as condições em
que os álcoois são
oxidados e determinar os
possíveis produtos dessas
oxidações.
Usar as informações do
enunciado do exercício 40
para contextualizar e
introduzir as reações de
oxidação de álcoois e
esterificação.
Descrever a hidrólise
básica de um éster e usála como exemplo de
reação de formação de
sabão.
MODERNA DIGITAL:
Slides:
86 e 87 – Oxirredução.
Descrever a obtenção de
éster (tipo de substância
usada como flavorizante
nos alimentos, por
exemplo).
Analisar o processo de
obtenção de sabões.
13
AVALIAÇÃO
Avaliar a resolução dos
exercícios 9, 10, 12, 33,
34, 35 e 40.
Realizar uma atividade
sobre o texto Colorindo e
descolorindo os cabelos
(p. 231).
Explore o experimento
Tinta invisível, proposto no
Guia do professor, e
discuta a reação resultante
(p. 43-44).
ORIENTAÇÕES
DIDÁTICAS
Leia e comente o texto
Oxidação dos alimentos
(p. 238). Apresente o filme
Ilha das Flores, que traz
uma reflexão sobre o
desperdício de alimento.
Discuta sobre os antigos
métodos para preservar
alimentos e sobre os
processos atuais utilizados
pela indústria.
Discuta com os estudantes
os Oito Objetivos do
Milênio da ONU. Convideos a pensar soluções
práticas para o problema
da fome.
QUÍMICA - NA ABORDAGEM DO COTIDIANO
FRANCISCO MIRAGAIA PERUZZO | EDUARDO LEITE DO CANTO
CAPÍTULO 9
CONTEÚDO
Polímeros de adição
Polímeros de
condensação
Fibras têxteis
CAPÍTULO 10
CONTEÚDO
Triacilgliceróis
Sabões e detergentes
Proteínas
Carboidratos
POLÍMEROS SINTÉTICOS
OBJETIVOS
Entender a importância e a
abrangência do uso de
polímeros no mundo atual.
Discutir os impactos
ambientais do descarte de
plásticos no meio
ambiente.
Destacar as aplicações
dos vários tipos de
polímeros no cotidiano.
METODOLOGIA
Valorizar o levantamento
de conhecimento prévio
sobre polímeros e sua
importância econômica.
Incentivar um debate
sobre as vantagens e
desvantagens do uso de
materiais plásticos.
MODERNA DIGITAL:
Slides:
88 a 91 – Polímeros.
AVALIAÇÃO
Avaliar a resolução dos
exercícios 1, 3, 5, 6, 12, 15
e 16.
Realizar uma atividade
sobre o texto O que os
ecologistas veem de
errado na água
engarrafada
(p. 259).
Dividir a classe em dois
grupos e discutir o
seguinte tema: “Plásticos
são realmente melhores
que os materiais
naturais?”. A seguir,
solicitar um texto de cada
grupo.
ORIENTAÇÕES
DIDÁTICAS
Leia e analise com os
alunos os textos O impacto
ambiental causado pelos
plásticos e Sacola plástica
usada pelo comércio
(p. 260).
Peça que elaborem um
projeto social para
conscientizar a população
sobre esse tema.
Realize a apresentação de
todos os projetos.
Utilize a cartilha
Construindo um projeto de
voluntariado, do Instituto
Faça Parte
www.facaparte.org.br.
NOÇÕES SOBRE ALGUNS COMPOSTOS PRESENTES EM SERES VIVOS
OBJETIVOS
METODOLOGIA
AVALIAÇÃO
Analisar as estruturas de
sabões, materiais obtidos,
por exemplo, a partir de
gordura animal.
Discutir a importância dos
aminoácidos nos seres
vivos.
Reconhecer a importância
dos carboidratos como
fonte de energia.
Analisar as estruturas de
substâncias presentes nos
seres vivos.
Avaliar a resolução dos
exercícios 1, 11, 12, 13,
20, 22, 23, 32, 36, 37, 38 e
39.
Realizar uma atividade
sobre o texto
Fenilcetonúria e o teste do
pezinho (p. 284).
Estudar a obtenção de
sabões.
Analisar como os
aminoácidos se ligam
formando estruturas
proteicas.
Estudar a produção de
etanol (álcool) por
fermentação de sacarose.
MODERNA DIGITAL:
Slides:
92, 93 e 94.
14
Traga uma receita de pão
caseiro e destaque a
importância do fermento
biológico. A seguir,
questione o “teste da
bolinha”, conforme
orientação no Guia do
professor (p. 56).
ORIENTAÇÕES
DIDÁTICAS
Leia e comente com os
alunos o texto introdutório
do capítulo (p. 271).
Divida a sala em grupos e
peça que eles falem sobre
seus hábitos alimentares,
com base na leitura dos
textos (p. 273, 288 e 298).
Os alunos de EJA trazem
para a sala de aula uma
diversidade rica em hábitos
e costumes; valorize esse
conhecimento para
analisar com eles as
leituras propostas.
QUÍMICA - NA ABORDAGEM DO COTIDIANO
FRANCISCO MIRAGAIA PERUZZO | EDUARDO LEITE DO CANTO
CAPÍTULO 11
CONTEÚDO
Petróleo
Carvão mineral
Efeito estufa
Biogás
O lixo e seu destino
A QUÍMICA ORGÂNICA E O AMBIENTE
OBJETIVOS
Analisar os aspectos
positivos e negativos do
uso de combustíveis
fósseis para o meio
ambiente.
Entender o efeito estufa e
analisar alternativas para
que suas consequências
sejam atenuadas.
Descrever as vantagens do
reaproveitamento
(reciclagem) de material
descartado (lixo).
METODOLOGIA
AVALIAÇÃO
Descrever os
desequilíbrios ecológicos
causados pelos produtos
da queima dos
combustíveis fósseis.
Indicar as alternativas para
descarte e tratamento do
lixo.
Analisar técnicas de
reaproveitamento do lixo.
MODERNA DIGITAL:
Animação:
Torre de fracionamento.
Scientific American
Brasil Aula Aberta 3:
Dispensar o Petróleo?
Slides:
95 a 99 – Química
Orgânica.
Avaliar a resolução dos
exercícios 1, 5, 6, 7, 8, 12,
14, 16, 18, 20, 21, 28, 29,
32, 33, 34, 35, 36, 37, 38,
39, 43, 44, 45, 49, 50 e 51.
Realizar atividades sobre
os textos Aquecimento
global: previsões e
controvérsias (p. 316) e
Cidadania e
desenvolvimento
sustentável (p. 323).
15
ORIENTAÇÕES
DIDÁTICAS
Leia e analise o texto
introdutório (p. 302).
Leia e comente o texto
Medidas que podem ser
implantadas em nosso dia
a dia para reduzir a
produção de lixo e
estimular o consumo
consciente
(p. 322 ).
Divida a turma em grupos
e peça que produzam um
texto com o tema Criança
e consumo.
Utilize como fonte de
referência o site
www.institutoalana.org.b
r
Destaque locais de coleta
seletiva em sua cidade e
incentive a reciclagem.