QUÍMICA na abordagem do cotidiano
Tema
• TITO CANTO
Condutividade elétrica de
substâncias e de soluções
10
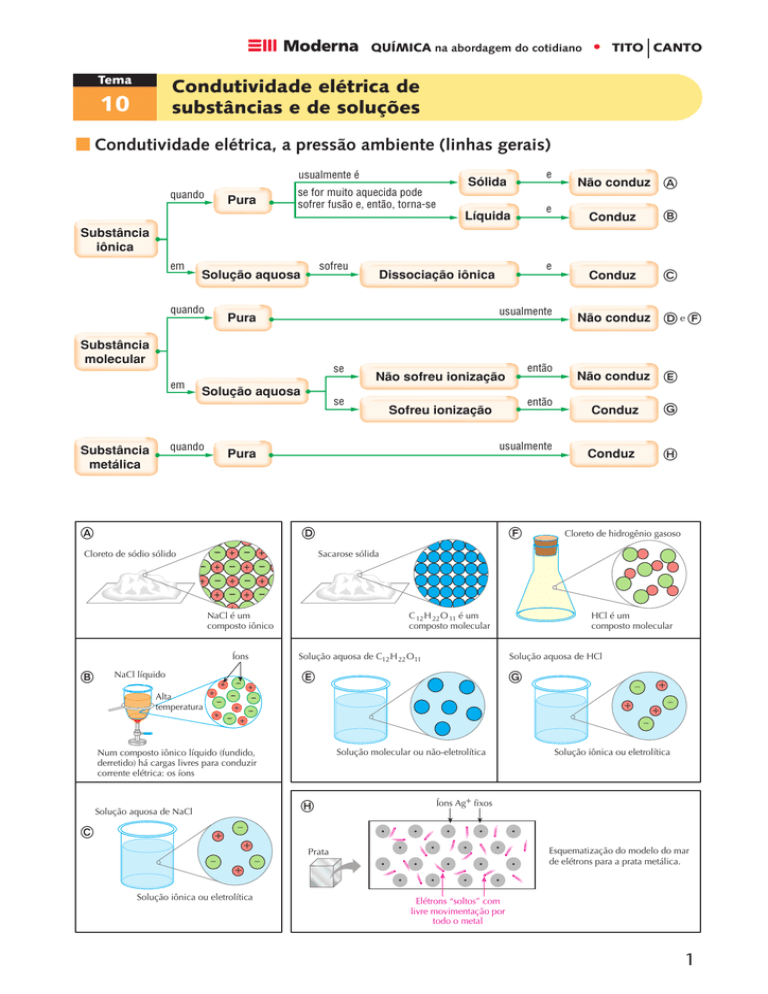
Condutividade elétrica, a pressão ambiente (linhas gerais)
usualmente é
quando
Pura
se for muito aquecida pode
sofrer fusão e, então, torna-se
e
Sólida
Líquida
e
Não conduz
훽
Conduz
훾
Conduz
훿
Substância
iônica
em
sofreu
Solução aquosa
quando
usualmente
Pura
Substância
molecular
se
em
Solução aquosa
quando
Substância
metálica
훽
Cloreto de sódio sólido
se
– +
+ –
+ – +
– + –
– +
usualmente
– +
+ –
– +
+ –
–
–
Íons
NaCl líquido
Alta
temperatura
+ – +
+
–
–
C 12 H 22 O 11 é um
composto molecular
Conduz
Conduz
Cloreto de hidrogênio gasoso
HCl é um
composto molecular
–
+
–
+
+
–
–
Solução molecular ou não-eletrolítica
Solução aquosa de NaCl
–
Não conduz
Solução aquosa de HCl
+ –
+ –
+
+
e
Solução aquosa de C12 H 22 O11
Num composto iônico líquido (fundido,
derretido) há cargas livres para conduzir
corrente elétrica: os íons
훿
Não conduz
Sacarose sólida
NaCl é um
composto iônico
훾
então
Sofreu ionização
+
então
Não sofreu ionização
Pura
+
e
Dissociação iônica
Solução iônica ou eletrolítica
Íons Ag+ fixos
–
+
+
Solução iônica ou eletrolítica
–
Esquematização do modelo do mar
de elétrons para a prata metálica.
Prata
Elétrons “soltos” com
livre movimentação por
todo o metal
1