Anexo 1
Microscopia e princípios de coloração
A1.1 Introdução
A microscopia para doenças sexualmente transmissíveis
(DST) fornece um teste simples, rápido e de baixo custo,
que pode ser utilizado próximo ao paciente (1). Ela pode
ser sensível e específica, é ideal para triagens e,
frequentemente, pode fornecer um diagnóstico
presuntivo que orienta o tratamento, quebrando, dessa
forma, a cadeia de transmissão. A interpretação de
imagens microscópicas é uma habilidade que requer
treinamento, incluindo um bom conhecimento
profissional do microscópio (1).
A1.2 Preparação de esfregaços para
microscopia
Um espécime de boa qualidade, coletado a partir do local
apropriado com o auxílio de uma haste adequada ou
alça, é um requisito essencial para uma boa técnica de
microscopia. É importante que a lâmina esteja limpa e
que o espécime seja colocado do lado correto, caso a
lâmina seja fosca em um dos lados. Para preparações
frescas, uma quantidade suficiente de amostra é
depositada sobre a lâmina com uma gota de solução
salina, se necessário, devendo ser examinada
imediatamente sob baixo aumento, sem óleo de imersão.
Para esfregaços para coloração de Gram, o espécime
deve ser espalhado uniformemente sobre a lâmina e
fixado por calor ou álcool, adequadamente corado e
examinado com óleo de imersão.
A1.3 Microscopia de transmissão de luz
A orientação principal para uma boa microscopia é
montar o microscópio corretamente e sentar
confortavelmente na bancada, com as costas apoiadas,
e com as oculares na altura dos olhos. O microscopista
deve ter um bom conhecimento dos componentes
individuais do microscópio (Figura A1.1). O microscópio
deve ser mantido limpo e coberto, quando não estiver
em uso, e precisa ser revisado regularmente. É uma boa
prática manter a platina longe das lentes e usar o menor
aumento capaz de fornecer uma boa imagem.
Procedimentos para montar o microscópio de luz:
1.
2.
3.
4.
Ligue o microscópio
Abaixe a platina, coloque a lâmina
Selecione a objetiva de 10x
Olhando para a platina, eleve-a (pensando na
distância a ser trabalhada)
5. Ajuste a distância intraocular e focalize o espécime
6. Feche o diafragma de campo e abra totalmente o
condensador
7. Mova o condensador para cima e para baixo até que
o canto fique nítido
8. Utilizando o charriot, centralize a imagem
9. Abra o diafragma de campo (tenha cuidado com a
intensidade da luz)
10. Reajuste a intensidade da luz para uma visão
confortável
11. Feche lentamente o condensador até que a imagem
fique nítida e o brilho intenso desapareça
12. Reajuste a intensidade da luz, caso seja necessário.
Definições-chave
Aumento - o número de vezes que o comprimento, a
largura ou o diâmetro, mas não a área, de um objeto são
multiplicados.
a. “Aumento útil” é quando a imagem é nítida e os
pequenos detalhes são revelados, normalmente a um
máximo de 1.000x.
b. “Aumento vazio” é quando a a nitidez da imagem se
perde e mais nenhum detalhe é revelado.
Aumento = poder da ocular x poder da objetiva x poder
do canhão. Normalmente, é melhor utilizar um aumento
menor para ver claramente os detalhes do objeto e obter
um maior campo de visão.
Anexo 1. Microscopia e princípios de coloração
189
Resolução – a capacidade de revelar detalhes
estruturais adjacentes como separados e distintos.
Definição – a capacidade de uma lente de tornar claras
e distintas as margens da imagem de um objeto.
Diafragma de campo – protege o objeto do excesso de
calor e luz que não é necessário para a formação da
imagem.
Condensador – focaliza a luz no objeto. Os instrumentos
modernos possuem lentes auxiliares para o uso de
objetivas de 20x ou mais para evitar o reajuste contínuo
da óptica.
Problemas que podem ocorrer com a microscopia de luz:
•
Objeto desfocado e incapacidade de obter foco claro
- Óleo nas lentes, que pode ser limpo com um
solvente recomendado
Condensador ou diafragma de abertura – contribui
para a resolução e contraste da imagem. Não o utilize
para o controle do brilho.
- O óleo pode estar atrás das lentes, sendo
necessário contatar o fabricante
Ajuste interpupilar
Ocular (lentes oculares)
Corpo
Revólver
Braço
Lentes objetivas (4)
Platina ou mesa
Parafuso macrométrico
Condensador
Controle da abertura do diafragma
Base com fonte de luz
Nivelador do diafragma de campo
Parafuso micrométrico
Charriot
Controlador da intensidade de luz
Figura A1.1
Componentes de um microscópio de transmissão de luz.
Fonte: reproduzido com permissão da Associação Britânica para Saúde Sexual e HIV (BASHH, do inglês British
Association for Sexual Health and HIV).
- As lentes condensadoras podem estar sujas de
óleo
- A lâmina podia estar molhada antes de se
aplicar o óleo
- Óleos de diferentes lotes podem ter se
misturado
- A lamínula pode ser muito espessa
- O material não está suficientemente espalhado
na lâmina ou esta é muito espessa
- Não se utilizou o lado correto da lâmina
190
•
- A lamínula pode estar suja com óleo ou marcas
de impressão digital
- Óleo seco na lâmina
Bolhas se movendo pela lâmina
- Óleos de diferentes lotes podem ter se
misturado
- A lâmina podia estar molhada antes de se
aplicar o óleo
- As bolhas de ar podem ter se formado ao se
aplicar o óleo
Diagnóstico laboratorial de doenças sexualmente transmissíveis, incluindo o vírus da imunodeficiência humana.
•
•
Iluminação desigual
Os seguintes problemas podem ocorrer com a
- O microscópio não foi montado de forma
correta; o condensador não está centralizado
microscopia de fluorescência:
-
•
As lentes do revólver não estão alinhadas
corretamente
esperado: o microscópio pode ter sido montado de
forma incorreta ou o obturador pode estar fechado;
Aparecimento de partículas estranhas
- Pode haver presença de poeira nas oculares,
lentes, lâmina ou lamínula, a qual deve ser
cuidadosamente removida.
Ausência de imagem ou imagem mais escura que o
•
O espécime está emitindo fluorescência secundária
ou autofluorescência causada por coloração
inespecífica do espécime ou devido a lentes
objetivas sujas;
A1.4 Microscopia de fluorescência
•
componentes do microscópio podem não estar
A microscopia de fluorescência pode ser utilizada para
devidamente alinhados;
permitir a visualização de algumas bactérias e vírus
que não são facilmente visualizados por microscopia
•
imunofluorescência. Esse método pode ser útil para a
detecção de agentes microbianos tais como
Brilho em excesso nas lentes oculares: os filtros
corretos podem não estar presentes;
de luz, mediante a coloração por um anticorpo
específico ligado a um fluorocromo, produzindo a
Imagem iluminada de forma desigual: os
•
Rápido branqueamento do espécime ao ser
visualizado.
Treponema pallidum, Chlamydia trachomatis e o vírus
A1.5 Microscopia de campo escuro
da herpes simples, ou para auxiliar na identificação de
A microscopia de campo escuro difere da microscopia
organismos utilizando anticorpos espécie-específicos,
tais como para Neisseria gonorrhoeae. A microscopia
de fluorescência necessita de treinamento para
conferir experiência à interpretação, principalmente
para distinguir uma base fluorescente artificial de
uma fluorescência específica. O microscópio é melhor
mantido e utilizado em uma sala que possa
permanecer escura.
Na microscopia de fluorescência, a amostra é corada
utilizando um fluorocromo, e então, iluminada por
meio de um feixe de luz com comprimento de onda
que excite o fluorocromo na amostra, o que é
capturado pelas lentes objetivas. Para fins gerais de
DST, tal pode ser obtido mediante um acoplamento a
um microscópio de transmissão de luz que possua
uma lâmpada (vapor de mercúrio ou tungstêniohalogênio) e apresente dois filtros: um filtro de
iluminação (ou excitação), que garanta que a
iluminação seja próxima à monocromática e no
comprimento de onda correto; e um filtro de segunda
emissão (ou de barreira), que garanta que nenhuma
fonte de luz excitatória alcance o detector.
de transmissão de luz pelo fato de que somente os
raios de luz que atingem os organismos ou partículas
em um ângulo oblíquo entram na objetiva do
microscópio, dando origem a corpos luminescentes
brancos e brilhantes contra um fundo preto (Figura
A1.2). A microscopia de campo escuro para a detecção
de T. pallidum, no diagnóstico de sífilis, necessita ser
realizada por profissionais bem treinados e experientes,
capazes de ajustar o microscópio corretamente e de
diferenciar o T. pallidum de treponemas não
patogênicos e outros organismos espiralados,
encontrados comumente nas membranas mucosas
genital e anal. Uma vez que a cavidade oral é
frequentemente colonizada por espiroquetas diferentes
dos treponemas, a análise de material de lesões orais
por campo escuro não é recomendada.
Procedimento para o uso do microscópio de campo
escuro:
1. Faça uma preparação fina (Capítulo 10) utilizando
lâmina e lamínula bem limpas. O material em
excesso pode anular o efeito.
Anexo 1. Microscopia e princípios de coloração
191
transmitida
campo escuro
Figura A1.2
Comparação do caminho de luz entre um microscópio de
transmissão de luz e um microscópio de campo escuro.
Fonte: Reproduzido com permissão da Associação
Britânica para Saúde Sexual e HIV (BASHH, do inglês
British Association for Sexual Health and HIV).
2. Abaixe o condensador e coloque uma gota de óleo
no topo das lentes. Tome cuidado para evitar a
formação de bolhas.
3. Coloque a lâmina na platina e suba o condensador
lentamente até que o óleo toque a lâmina. Um breve
feixe de luz será visualizado. Tome cuidado para não
permitir a formação de bolhas.
4. Focalize o objeto com uma objetiva de menor poder
(10x). Se o condensador estiver focalizado de forma
correta, um pequeno ponto de luz iluminará o objeto
contra o fundo escuro. Se for visualizado um anel de
luz, o condensador precisa ser ajustado.
5. Com o auxílio do charriot, ajuste o condensador até
que o ponto de luz fique no meio do campo.
6. Coloque uma gota de óleo na lamínula e focalize o
objeto com as lentes para óleo de imersão. Caso se
utilize uma objetiva com diafragma de íris, pode ser
necessário um pequeno ajuste. Se as objetivas não
estiverem centralizadas, talvez seja preciso
centralizar o condensador.
7. A microscopia de campo escuro é melhor conduzida
em uma sala escura.
Os seguintes problemas podem ocorrer na microscopia
de campo escuro:
192
•
As lâminas ou lamínulas podem ser muito espessas
•
Pode haver muitas bolhas de ar na preparação.
•
O condensador pode não estar focado ou
centralizado corretamente.
•
Pouca intensidade da iluminação.
•
O campo de vista é muito pequeno (diafragma de
campo aberto).
•
O centro do campo de vista é escuro (a lâmina é
muito espessa ou o condensador está em uma
posição errada).
A1.6 Microscopia de contraste de fase
A microscopia de contraste de fase raramente está
disponível ou é utilizada, mas apresenta algumas
vantagens para a análise de espécimes vivos, não
corados, uma vez que estes apresentam o mesmo índice
de refração que o fluido de montagem, e os detalhes
internos podem ser de difícil visualização. Pode-se
considerar que os objetos não corados apresentam
propriedades de uma grade de difração. A luz que passa
através de diferentes partes do objeto é afetada e sua
fase muda levemente, mas isso não é discernível aos
olhos. Entretanto, por meios ópticos, essa mudança de
fase pode tornar-se visível como áreas claras e escuras.
São necessários para a microscopia de contraste de fase:
1. Um condensador especial apresentando uma série
de diafragmas anelares, com o tamanho anelar
variando de acordo com a abertura numérica da
objetiva utilizada;
2. Objetivas de fase especiais, contendo uma placa de
fase. Essa placa consiste em um disco de vidro
contendo um vale circular, de tal profundidade que a
luz que passa por essa porção apresenta uma
diferença de fase de um quarto de um comprimento
de onda quando comparada com o resto da placa.
Procedimentos para o uso do microscópio de contraste
de fase:
1. Prepare uma lâmina de espécime fina, não muito
carregada, e a posicione para ser observada pela
objetiva (as objetivas são marcadas como Ph, Phaco
ou similar).
Diagnóstico laboratorial de doenças sexualmente transmissíveis, incluindo o vírus da imunodeficiência humana.
2. Gire o anel apropriado para a objetiva na posição do
condensador.
3. Verifique se o anel e a placa de fase estão na
posição correta, utilizando o telescópio fornecido
com o sistema.
4. Remova uma ocular e insira o telescópio. As
imagens do anel e da placa de fase devem coincidir.
Caso contrário, ajuste com o charriot.
5. Recoloque a ocular e examine o espécime.
6. As objetivas de todos os aumentos podem ser
utilizadas, desde que estejam ajustadas a uma
placa de fase e que haja um anel adequado no
condensador.
Os seguintes problemas podem ocorrer na microscopia
de contraste de fase:
•
O condensador e a objetiva podem não ser
compatíveis, de acordo com o código Ph;
•
A placa de fase não está alinhada, sendo necessária
a verificação por meio de um telescópio;
•
O diafragma de campo não está focalizado na
superfície do espécime, o que pode ser resolvido
movendo-o para cima e para baixo.
A1.7 Coloração de Gram
Essa coloração foi descrita primeiramente em 1984 por
Gram e demonstra a morfologia de bactérias e fungos.
Ela divide as bactérias em dois grupos: aquelas que
aparecem positivas e aquelas que aparecem negativas.
Por sua vez, estas podem ser divididas em cocos
(esferas) ou bacilos (bastonetes), resultando em quatro
grupos. Muitas bactérias que aparecem bastante
distintas, tais como a N. gonorrhoeae, são diplococos
Gram-negativos, mas é importante lembrar que a reação
da coloração de Gram fornece apenas uma identificação
presuntiva. Outros métodos de identificação são
necessários para classificar qualquer bactéria. Os fungos
aparecem como Gram-positivos.
A1.7.1 Princípios da coloração de Gram
A coloração de Gram reflete as diferenças na estrutura
da parede celular bacteriana, de modo que as bactérias
Gram-positivas apresentam uma grande quantidade de
peptidoglicano na parede celular, o que retém a
coloração violeta (Figura A1.3a), enquanto que as
bactérias Gram-negativas apresentam uma parede
celular complexa, com menos peptidoglicano, não
retendo a coloração violeta, mas assumindo o
contrastante rosa (Figura A1.3b).
A1.7.2 Método de uso
O esfregaço fixado é inundado com cristal de violeta
por 30 segundos, durante os quais todas as bactérias
adquirem a coloração (Figura A1.4). O esfregaço é,
então, lavado gentilmente em água corrente e
inundado com Lugol por mais 30 segundos, o qual
atua como um mordente e fixa a coloração violeta na
parede celular.
Após a lavagem com água, um descolorante é utilizado
para remover o excesso de coloração. É nesse estágio
que o complexo cristal violeta/Lugol é lavado da parede
celular das bactérias Gram-negativas, uma vez que não
há peptidoglicano suficiente para retê-lo. Vários
descolorantes são utilizados, desde o álcool, que é de
ação lenta e suave, até a acetona, que é mais forte e
rápida. O tempo durante o qual descolorante é deixado
no esfregaço varia de alguns minutos, para o álcool, a
apenas poucos segundos, para acetona. É aconselhável
segurar o esfregaço sobre a pia e deixar que o
descolorante corra sobre ele. O complexo violeta irá se
desprender do esfregaço e, assim que parar de escorrer,
deve-se lavar o esfregaço com água. Nessa etapa, é
possível que o esfregaço descolore demais,
principalmente se for utilizada acetona; muitos
consideram a mistura acetona e álcool (1:1) uma boa
combinação, uma vez que a velocidade da acetona é
levemente moderada pelo álcool.
Após a descoloração, o esfregaço é inundado com um
contrastante por, aproximadamente, um minuto; é nesse
estágio que as bactérias Gram-negativas retêm a
coloração rosa. Novamente, vários contrastantes podem
ser utilizados: safranina, vermelho neutro e
carbolfucsina. A safranina e o vermelho neutro são bons
corantes para esfregaços que contêm polimorfos, uma
vez que eles fornecem uma boa definição para a
estrutura celular, enquanto que a carbolfucsina é
preferível para bactérias.
Anexo 1. Microscopia e princípios de coloração
193
Peptideoglicano
Exterior
Espaço
periplasmático
Interior
Membrana celular
Figura A1.3A
Estrutura de uma parede celular Gram-positiva.
Fonte: reproduzido com permissão da Associação Britânica para Saúde Sexual e HIV (BASHH, do inglês British
.
Association for Sexual Health and HIV).
Exterior
Lipídeo A
Porina
Lipoproteína
Espaço periplasmático
Fosfolipídeo
Peptideoglicano
Membrana celular
Interior
Figura A1.3B
Estrutura de uma parede celular Gram-negativa.
Fonte: reproduzido com permissão da Associação Britânica para Saúde Sexual e HIV (BASHH, do inglês British Association
for Sexual Health and HIV).
194
Diagnóstico laboratorial de doenças sexualmente transmissíveis, incluindo o vírus da imunodeficiência humana.
Os tempos individuais utilizados para cada um dos
corantes podem variar, mas os tempos absolutos
utilizados são cruciais. Entretanto, é importante lembrar
que enquanto o corante primário (cristal de violeta) atua
quase que instantaneamente, a coloração de contraste é
um processo lento e requer mais tempo. É aconselhável
deixar o contrastante atuando o dobro do tempo utilizado
para a coloração primária.
A1.7.3 Problemas e soluções
Para produzir esfregaços bem corados, é essencial o uso de
corantes adequadamente preparados e armazenados. Os
corantes individuais estão disponíveis comercialmente e,
hoje em dia, a preparação a partir do pó é relativamente
incomum. Entretanto, mesmo quando os corantes são
adquiridos prontos para utilização, ou como concentrados
para diluição e uso, é importante armazená-los
corretamente. Os corantes devem ser colocados em
garrafas limpas e, se estas forem reutilizadas, deve-se
eliminar qualquer resíduo de corante e então enxaguar com
água antes de enchê-las novamente. O armazenamento
inadequado pode resultar no depósito de corante sobre todo
o esfregaço ou causar a aderência das células epiteliais, as
quais podem ser confundidas com “células indicadoras”.
O esfregaço precisa apresentar espessura apropriada. Um
esfregaço muito espesso irá reter o corante e impedir a
diferenciação entre os organismos Gram-negativos e
positivos; já um esfregaço muito fino, com material
insuficiente, pode não fornecer uma representação
verdadeira da amostra.
Gram-negativa
Gram-positiva
Fixação
Cristal violeta
Tratamento com iodo
Descoloração
Mancha contrastante
de safranina
Figura A1.4
Reação de bactérias Gram-positivas e Gramnegativas aos diferentes estágios da coloração de
Gram
Fonte: reproduzido com permissão da Associação
Britânica para Saúde Sexual e HIV (BASHH, do inglês
British Association for Sexual Health and HIV).
de gonorreia e fornece uma imagem distintiva com alto
valor preditivo em pacientes de alto risco.
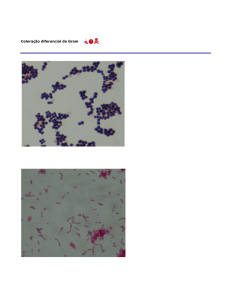
A1.9 Coloração de Giemsa
A coloração de Giemsa é uma coloração diferencial
utilizada para o diagnóstico de donovanose. Consiste em
uma mistura de azul de metileno, eosina e azure B e está
disponível comercialmente. Um esfregaço é preparado,
fixado em metanol por 30 segundos, imerso em corante
de Giemsa 5% fresco por 20-30 minutos, lavado e
deixado a secar.
A1.10 Imunofluorescência
O passo de descoloração é o mais crucial na coloração
Gram e, quando feito em excesso ou insuficiente,
resultará na categorização incorreta da bactéria como
Gram-negativa ou Gram-positiva, respectivamente.
A1.8 Coloração de azul de metileno
O uso do azul de metileno como corante único é muito
útil em lugares com infraestrutura ou recursos
inadequados para a coloração de Gram. Ele mostra a
morfologia tanto das células bacterianas como
hospedeiras, mas não permite a diferenciação obtida
com a coloração de Gram. É utilizado, principalmente, na
coloração de esfregaços para o diagnóstico presuntivo
A imunofluorescência é uma técnica que utiliza a ligação
altamente específica de um anticorpo ao seu antígeno
para marcar proteínas específicas ou outras moléculas
na célula. Uma amostra é tratada com um anticorpo
primário específico para a molécula de interesse. Um
fluoróforo pode ser conjugado diretamente ao anticorpo
primário. Alternativamente, pode-se utilizar um anticorpo
secundário conjugado a um fluoróforo, que se liga
especificamente ao primeiro anticorpo.
A1.11 Saúde e segurança
Deve-se nomear uma pessoa responsável pela saúde e
segurança em cada local de trabalho, tanto em clínicas
Anexo 1. Microscopia e princípios de coloração
195
quanto laboratórios. Os métodos de coloração devem
estar descritos em procedimentos operacionais padrão
revisados regularmente, os quais devem ser lidos e
compreendidos por todos os funcionários.
É necessário haver uma série de regras básicas:
•
Não comer, fumar ou beber na área de laboratório.
•
Providenciar uma boa ventilação nas áreas
utilizadas para a realização de coloração, a fim de
evitar a inalação de gases e o risco de incêndio.
•
196
Utilizar luvas e jalecos adequados para laboratório
ao manusear os reagentes individuais utilizados
para a coloração, pois se sabe que estes são
tóxicos; algumas colorações de Gram são
cancerígenas.
•
Armazenar os corantes cuidadosamente para evitar
que derramem.
•
Tomar cuidado ao descartar lâminas e lamínulas de
pacientes infectados.
•
Armazenar os materiais inflamáveis em um armário
específico e longe de fontes de calor.
A1.12 Referência
British Association for Sexual Health and HIV (BASHH).
Microscopy for Sexually Transmitted Infections (http://
www.bsig-resources.org.uk/).
Diagnóstico laboratorial de doenças sexualmente transmissíveis, incluindo o vírus da imunodeficiência humana.