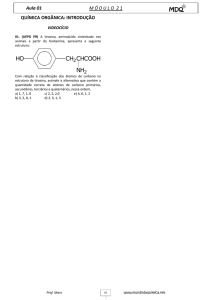
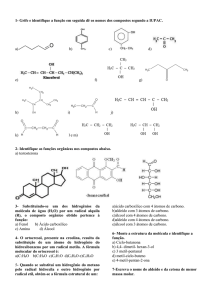
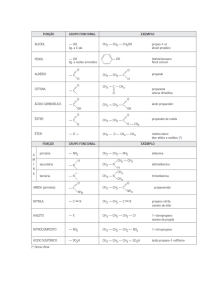
~ 1 ~ ~ 2 ~ Equipe de elaboração das Apostilas Promopetro: Coordenador:
Sérgio Lucena
Edição de Apostilas
Aklécio Silva
Cléber Souza
Maria Bethânia Valença
Paloma Boa Vista Felix
Sérgio Lucena
Valnísia Nogueira
Arte
Cléber Souza
Paloma Boa Vista Felix
~ 3 ~ APLICAÇÃO DA QUÍMICA Objetivos da apostila:
Apresentar conceitos químicos, suas propriedades, classificações, e discutir
exemplos de fixação baseados em casos típicos da engenharia. Através de
casos práticos, são mostrados tais conceitos e sua utilização na engenharia.
O projeto Promopetro:
O projeto tem como metodologia a elaboração de material didático impresso
e multimídia, sobre as disciplinas de ensino médio, e fará uso de simulação
computacional, de aulas expositivas e práticas possibilitando visualização de
unidades de processo através de maquetes virtuais. As apostilas fazem a
ligação entre as informações e conhecimentos sobre assuntos abordados na
Engenharia e os assuntos estudados no ensino médio.
A metodologia desenvolvida neste material didático procura utilizar conceitos
ligados à engenharia para estabelecer uma conexão entre as atividades de
ensino das ciências exatas, como matemática, física, química e informática, e
as áreas de processos petroquímicos e de bicombustíveis. Isto permitirá
envolver os alunos de ensino médio com os problemas tecnológicos e a
escolha do seu futuro profissional.
Estas disciplinas ligadas à engenharia, mesmo abordadas dentro de uma
perspectiva de ensino médio trazem informação e conteúdo para uma
formação adequada do aluno, e fazem uso de uma forte base das ciências
exatas. A concepção do processo químico, o dimensionamento dos
equipamentos, o desenho dos equipamentos de processo e o simulador
computacional de processos serão apresentado se executados passo a passo
pelos alunos envolvidos. Isso permitirá uma interação entre atividades de
ensino superior e as atividades de ensino das ciências exatas no ensino médio.
~ 4 ~ Sumário Capítulo 1 - Eletroquímica .............................................................................. 6
1-
As Pilhas .................................................................................................. 7
1.1-
Eletroquímica ........................................................................................... 10
1.2-
Pilha Ou Célula Galvânica: ................................................................... 12
1.3- Corrosão: ..................................................................................................... 18
1.4- Eletrólise:....................................................................................................... 19
Capítulo 2- Fundamentos Da Química Orgânica: ..................................... 22
2-
Petróleo E Sua Composição:............................................................... 24
2.1-
Histórico: .................................................................................................... 26
2.2-
Características Do Carbono:................................................................. 27
2.3-
Hibridização .............................................................................................. 28
2.4-
Tipos De Carbono Numa Cadeia Carbônica: ................................... 29
2.5-
Classificação Das Cadeias Carbônicas: ............................................. 31
2.6-
Elementos Organógenos:....................................................................... 36
Capítulo 3: Nomenclatura De Compostos Orgânicos E Hidrocarbonetos:40
3.1-
Nomenclatura De Compostos Orgânicos E Hidrocarbonetos: ....... 42
3.2 - Prefixo: Número De Átomos De Carbono: ............................................ 42
3.3 – Infixo: Tipo De Ligação Entre Carbonos: ............................................... 43
3.4 - Sufixo – Grupo Funcional: ......................................................................... 43
3.5-Compostos Com Cadeia Ramificada ..................................................... 45
3.6-Funções Químicas: ...................................................................................... 47
Capítulo 4: Isômeros E Ocotidiano............................................................... 58
4- Os Isômeros E A Indústria ......................................................................... 60
4.1- Isômeros: ...................................................................................................... 63
Capítulo 5: Reações Orgânicas. .................................................................. 77
5- Saponificação: A Reação Do Sabão. ..................................................... 78
~ 5 ~ 5.1- Reações Orgânicas: Classificações E Principais Tipos, Casos Especiais
.............................................................................................................................. 83
5.1.1- Reação De Substituição: ....................................................................... 84
5.1.2- Reações De Adição: .............................................................................. 87
5.1.3- Reações De Combustão: ...................................................................... 89
5.1.4- Reações De Esterificação...................................................................... 90
5.2- Saponificação: ........................................................................................... 90
5.3- Detergentes:................................................................................................ 91
Glossário: ............................................................................................................. 99
~ 6 ~ CAPÍTULO 1 - ELETROQUÍMICA
As pilhas e os aparelhos: O que acontece quando
acionamos o interruptor?
Para podermos chegar a uma conclusão dessa
pergunta precisamos primeiro saber que a
eletroquímica é o estudo das reações nas
quais ocorre conversão de energia química em
energia elétrica e vice-versa.
Assim, quando é acionado o interruptor de um
aparelho movido a pilha, fecha-se o circuito de
Figura 1: Brinquedo com controle remoto uma corrente elétrica alimentada pela reação
sustentado por pilhas.
química que ocorre no interior das pilhas, deste
modo, percebemos claramente um exemplo
de processo de natureza eletroquímica.
~ 7 ~ 1- AS PILHAS
Como é constituída a pilha?
Portanto, para que esse processo ocorra é necessário entender um pouco sobre
o funcionamento das pilhas (pilhas galvânicas), que consiste em um dispositivo
que permite a obtenção de corrente elétrica por meio de uma reação de oxido
redução espontânea.
Em relação a uma pilha, é importante determinar os
polos, o cátodo e o ânodo, as semi-reações, a d.d.p. ou
voltagem e o sentido da corrente elétrica liberada. Mas,
antes disto, estudaremos alguns conceitos básicos
necessários.
Portanto, neste capítulo será apresentado como são
constituídas as pilhas bem como seu funcionamento
através do estudo da eletroquímica. Figura 2: Circuito conectado a uma Pilha
No tópico a seguir, será conhecido como teve origem a
pilha e o mecanismo para que ela funcione e assim será
possível entender o que ocorre com a corrente elétrica
na prática, como um simples acionamento de interruptor,
porexemplo.
Figura 3: Pilha comum
~ 8 ~ Por definição pilha é uma fonte de energia portátil,
tratando-se de um dispositivo que a partir das reações
de óxido-redução converte energia química em
energia elétrica.
A pilha é constituída por uma solução de ácido
sulfúrico em água, na qual se mergulham eletrodos
de cobre e um de zinco.
Observando a figura 1.5, se for conectado o cobre ao
zinco por um condutor c, a corrente elétrica passará
nesse condutor, dirigida do cobre para o zinco, o que
indica que há uma diferença de potencial entre eles.
A solução com os dois eletrodos constitui então um
gerador.
Figura 4: Pilhas comuns
Os dois eletrodos são chamados polos, ou terminais
do gerador. Chama-se polo positivo aquele por onde
a corrente sai, e polo negativo por onde a corrente
entra.
Figura 5: Célula Eletrolítica Os materiais utilizados para os componentes do ânodo e cátodo são diversos
e é pela escolha dos mesmos que resultam pilhas com diferentes
características técnicas.
Existem 4 tipos de pilha:
1-Pilhas primárias:
¾ Pilha seca
~ 9 ~ ¾ Pilha alcalina
¾ Pilha de mercúrio
2-Pilhas secundárias
¾ Bateria de chumbo
¾ Bateria de níquel-cádmio
3-Pilhas de combustível
4-Pilhas de concentração
Pilha seca ou de Leclanché:
Nestas pilhas, o eletrólito não está completamente seco, estando antes
incorporado numa mistura úmida. São usadas, por exemplo, nas lanternas
portáteis, nos rádios, nos brinquedos, etc.
Na pilha seca, o ânodo de zinco (polo
negativo) é constituído pelo recipiente da
pilha. O cátodo (polo positivo) é uma
barreira de grafite que atua como eletrodo
inerte.
Entre os eletrodos existe uma solução de
cloreto de amônio misturado com cloreto de
zinco e dióxido de manganês.
Figura 6: Esquema de uma pilha de Leclanché
Pilha alcalina:
Esta pilha é constituída por um ânodo de zinco e um cátodo de óxido de
manganês. O eletrólito alcalino é geralmente de hidróxido de potássio.
Possuem voltagem de 1,5 V e não são recarregáveis. Comparando-as com as
pilhas secas comuns, as alcalinas são mais caras, pois mantém a voltagem
constante por mais tempo e duram cinco vezes mais. Isso ocorre porque o
hidróxido de sódio ou potássio é melhor condutor eletrolítico, o que resulta em
uma resistência interna da pilha muito menor do que na pilha de Leclanché.
Pilha de mercúrio:
Esta pilha é formada por um ânodo de zinco e mercúrio e um cátodo que é
uma pasta de óxido de mercúrio (II) e botão de aço.
~ 10 ~ Existem dois tipos básicos de pilhas - pilha primária (não recarregável) e pilha
secundária ou acumulador. Ambas têm o mesmo princípio de
funcionamento:
- transformação de energia química em elétrica, mas na secundária o
processo pode ser revertido, isto é, pode ser recarregada.
Na pilha primária a reação química acaba por destruir um dos eletrodos,
normalmente o negativo. A pilha secundária é mais comumente chamada
de bateria.
1.1- Eletroquímica
A eletroquímica é o estudo das reações nas quais ocorre conversão de
energia química em energia elétrica e vice-versa.
A eletroquímica abrange todos os processos químicos que envolvem
transferência de elétrons. Quando um processo químico ocorre, produzindo
transferência de elétrons, é chamado de pilha ou bateria, mas quando o
processo químico é provocado por uma corrente elétrica (variação da
quantidade de elétrons no tempo), este processo é denominado de eletrólise.
(Resumindo: pilha e bateria são processos químicos que ocorrem
espontaneamente gerando corrente elétrica, já eletrólise é um processo
químico (reação química) que ocorre de forma não espontânea, ou seja,
ocorre na presença de uma corrente elétrica).
Em eletroquímica são estudadas as reações de oxido-redução (oxidação é a
doação de elétrons acompanhado de um aumento do Nox, enquanto que
redução é o recebimento de elétrons acompanhados de uma diminuição do
Nox) que geram ou consomem energia.O Número de Oxidação (NOX) de um
elemento químico é a carga que ele recebe em uma reação química.
Como exemplo de uma reação de oxido-redução, temos a reação entre o íon
de cobre e o zinco metálico:
~ 11 ~ Figura 7: Reação de oxi‐redução
O zinco sofreu oxidação: perdeu elétrons e seu número de oxidação
aumentou. Já o íon Cu2+ sofreu redução: recebeu elétrons e seu número de
oxidação diminui.
Na prática ocorre que o zinco desloca o íon cobre, o zinco metálico passa
para o meio aquoso sofrendo oxidação enquanto que o íon cobre sofre
redução passando a cobre metálico que se deposita sobre a barra de zinco.
Figura 8: Experimento para reação de oxi‐redução A partir deste experimento comparamos a reatividade dos elementos e
comprovamos que o zinco é mais reativo (sofre oxidação) que o cobre. É
possível construirmos uma fila de reatividade.
As reações de oxirredução também são usadas na fabricação de produtos
químicos nas indústrias. O hidrogênio age como um agente redutor, em muitos
processos industriais. Ele pode ser usado para fazer o encurtamento de óleos
vegetais em um processo conhecido como hidrogenação e pode ainda
reduzir os íons de metais tais como a prata e tungstênio para metais puros.
~ 12 ~ Ordem de reatividade dos metais
9: Reatividade dos Metais Figura Quando diminui a reatividade, diminui também a capacidade de perder e-.
Conhecendo-se essa fila, podemos prever o que ocorrerá numa reação de
deslocamento.
1.2- Pilha ou célula Galvânica:
Pilha é qualquer dispositivo no qual uma reação de redox espontânea produz
corrente elétrica.
A pilha tem dois polos:
¾ Cátodo é o eletrodo no qual há redução (ganho de elétrons). É o polo
positivo da pilha.
¾ Ânodo é o eletrodo no qual há oxidação (perda de elétrons). É o polo
negativo da pilha.
Os elétrons saem do ânodo (polo negativo) e entram no cátodo (polo
positivo) da pilha.
A placa de zinco vai sofrendo corrosão e desaparecendo, já a placa de
cobre vai tendo a sua massa aumentada.
~ 13 ~ CONSTRUINDO A PILHA:
Figura 10: Esquema de uma pilha experimental
Nesta pilha é possível verificar as semi-equações da reação.
O íon cobre (Cu2+) da solução é reduzido
por 2 e- que vem da corrente elétrica.
O zinco é oxidado, formando íon zinco (Zn2+)
e 2e-. Estes elétrons serão os responsáveis
pela geração da corrente elétrica do
sistema (pilha).
Figura 11: Oxidação do Zinco e Redução do Cobre
Com o desenvolvimento da reação,
ocorrerá formação de cobre metálico, que
se depositará na superfície do eletrodo de
cobre.
Já o eletrodo de cobre será corroído, pois o
zinco está se transformando em íons que
irão para a solução de sulfato de zinco.
Figura 12: Representação da Pilha
~ 14 ~ A pilha de Daniell pode ser escrita por:
Ou
Onde, || representa a ponte salina.
Quando a pilha começa a funcionar os elétrons começam a migrar. O
eletrodo de zinco que sofre oxidação tem a sua massa diminuída enquanto
que o eletrodo de cobre que sofre redução tem sua massa aumentada.
Figura 13: Transferência de elétrons durante a reação da pilha Dessa forma temos basicamente o funcionamento de uma pilha de Daniell, e
o potencial de redução será utilizado para se prever quem irá oxidar e reduzir
na pilha.
POTENCIAL PADRÃO DE REDUÇÃO:
Toda pilha possui um potencial, ou seja, produz uma voltagem, sendo este
potencial medido na pilha. (No caso das pilhas comerciais, que se usam em
rádios, controles remotos e brinquedos, a voltagem, geralmente é de 1,5V, só
variando o tamanho de reserva das pilhas. Tamanhos: A,AA, D, etc.)
O potencial da pilha pode ser dado, de uma maneira simplificada por:
Sendo Emaior e Emenor, os potenciais padrões de redução de cada semiequação.
Potencial padrão é medido em relação ao hidrogênio, que teve por
convenção a denominação de potencial padrão de Hidrogênio, que vale 0V.
~ 15 ~ É a partir ddp(diferença de potencial) de uma pilha, que se sabe se a reação
ocorre ou não. Quando a variação de potencial da pilha, ∆E, é maior que zero
a reação é espontânea. Quando o potencial é negativo, a reação não
ocorre espontaneamente e quanto maior for o potencial, positivo, maior será
a eficiência da pilha.
Tabela de potenciais-padrões de redução (em volts)
Aumenta
A força
Oxidante
ALTO Eº ALTA TENDÊNCIA DE SOFRER REDUÇÃO (RECEBER ELÉTRONS) BAIXO Eº BAIXA TENDÊNCIA DE SOFRER REDUÇÃO (RECEBER ELÉTRONS) ALTA TENDÊNCIA DE SOFRER OXIDAÇÃO (PERDER ELÉTRONS) ALTA TENDÊNCIA PARA ATUAR COMO AGENTE OXIDANTE ALTA TENDÊNCIA PARA ATUAR COMO AGENTE REDUTOR Tabela 1: Resumo do funcionamento do potencial padrão Curiosidade: Pilhas e o Meio Ambiente
As pilhas e baterias apresentam em sua
composição metais considerados perigosos
à saúde humana e ao meio ambiente
como mercúrio, chumbo, cobre, zinco,
cádmio, manganês, níquel e lítio. Dentre
esses metais os que apresentam maior risco
à saúde são o chumbo, o mercúrio e o
cádmio.
As pilhas não podem ser jogadas no lixo
comum, porque algumas pilhas de uso
doméstico
possuem
elevadas
concentrações
de
metais
pesados,
produtos que podem contaminar o solo, a
água e o ar e são prejudiciais à saúde
humana.
Figura 14: Ilustração sobre o Meio Ambiente
~ 16 ~ EXERCÍCIOS RESOLVIDOS:
1-A imersão de um fio de cobre num recipiente contendo solução aquosa de
cloreto de mercúrio II provoca, depois de algum tempo, o aparecimento de
gotículas de um líquido de brilho metálico no fundo do recipiente, e a solução
que era inicialmente incolor adquire coloração azul. Explique o que
aconteceu do ponto de vista químico. Escreva a reação do processo,
identificando os produtos formados.
Solução:
A partir da fila de tensões eletrolíticas.
Figura 15: Reatividade dos elementos Assim, quando o íon metálico estiver na fila em uma posição à direita do metal
(que foi introduzido no recipiente) a reação ocorrerá.
Formaram-se Hg metálico e íons Cu2+(aq), de cor azul.
Ou
2-São
dadas as seguintes semi-reações com os respectivos potenciais de
eletrodos:
Considere agora as seguintes reações:
~ 17 ~ Quais das reações acima são espontâneas?
Solução:
Somente a 1,2 e 3.
(Reação Não Espontânea)
~ 18 ~ 1.3- Corrosão:
A corrosão é um processo de deterioração do
material que produz alterações prejudiciais e
indesejáveis nos elementos estruturais. Sendo o
produto da corrosão um elemento diferente do
material original, a liga acaba perdendo suas
qualidades
essenciais,
tais
como
resistência
mecânica, elasticidade, ductilidade, estética, etc. Em certos casos quando a corrosão está em níveis
elevados, torna-se impraticável sua remoção, sendo,
portanto a prevenção e controle as melhores formas
de evitar problemas.
Figura 16: Ferramentas em processo
CORROSÃO DO FERRO
Figura 17: Correntes de ferro sofrendo corrosão A reação que ocorre na formação da ferrugem é uma reação de óxidoredução, que acontece da seguinte forma:
Reação anódica (oxidação):
Reação catódica (redução):
Neste processo, os íons Fe2+ migram em direção à região catódica, enquanto
os íons OH - direcionam-se para a anódica.
Em uma região intermediária, ocorre a formação do hidróxido ferroso:
Em meio com baixo teor de oxigênio, o hidróxido ferroso sofre a seguinte
transformação:
~ 19 ~ Caso o teor de oxigênio seja elevado
Produto final da corrosão (ferrugem):
¾ Fe3O4 (coloração preta) e
¾ Fe2O3. H2O (coloração alaranjada ou castanha- avermelhada).
Produzir a corrosão metálica é possibilitar a transformação de um material
metálico ou liga metálica pela sua interação química ou eletroquímica por
meio de exposição.
Proteção contra a corrosão
Ferro galvanizado (ferro revestido de zinco)
Lata (ferro revestido de estanho)
Ferro com plaquetas de Zn ou Mg presas na superfície e que funcionam como
eletrodo de sacrifício
Tabela 2: Materiais e suas respectivas proteções contra a corrosão
1.4- Eletrólise:
É uma reação de oxirredução não espontânea produzida pela passagem da
corrente elétrica.
Pilha
Célula eletrolítica
Pólo positivo
Cátodo
Ânodo
Pólo negativo
Ânodo
Cátodo
~ 20 ~ Tabela 3: Mudança de pólo negativo/positivo na pilha e na eletrólise
Na eletrólise em solução aquosa de sais
de metais alcalinos (Na+, K+...), alcalinoterrosos (Ca2+, Ba2+...) e de alumínio (Al3+),
a descarga no cátodo não é a dos
respectivos cátions, mas ocorre segundo a
equação:
Figura 18: Esquema de Eletrólise em solução aquosa de HCL
Nas eletrólises em solução aquosa e com ânodo inerte (Pt ou grafite) de sais
oxigenados (SO42-, NO3-, PO43-...) não há a descarga dos respectivos ânions
oxigenados, mas ocorre a descarga segundo a equação:
O ânion F-, embora não seja oxigenado, comportam-se como os ânions
oxigenados em relação à descarga no ânodo.
Nas eletrólises em solução aquosa com ânodo de metal não inerte M (prata
ou metal mais reativo que a prata), a descarga que ocorre no ânodo é
segundo a equação:
Algumas aplicações da eletrólise:
¾ Obtenção de elementos químicos como metais, hidrogênio e cloro.
¾ Obtenção de substâncias como soda cáustica (NaOH) e água
oxigenada(H2O2).
¾ Purificação eletrolítica de metais como cobre e outros. Faz-se a
eletrólise de CuSO4 em solução aquosa usando como cátodo um fio de
cobre puro e como ânodo um bloco de cobre impuro. Nesse processo,
~ 21 ~ precipita a lama anódica que contém impurezas de Au, Ag, Pt, etc., da
qual são posteriormente extraídos esses metais
¾ Galvanização: Eletrodeposição de metais tais como cromagem,
niquelagem, cobreagem e outros.
EXERCÍCIOS RESOLVIDOS:
1-Representar
a equação química da eletrólise doNaCl em solução aquosa.
Solução:
Eletrólise do NaCl(aq)
Figura 19: Eletrólise do NaCl
Íons presentes na solução:
dissociação do sal: NaCl(aq)
Na+ + Clionização da água: H2O
H+ + OHdescarga no ânodo: Cl–
descarrega no cátodo: H+
Assim, mostraremos, através da seqüência
de equações, como se chega à reação global da eletrólise:
1º passo: Dissociação do Eletrólito: 2NaCl(aq)
2º passo: Ionização da Água: 2 H2O
2 H+ + 2OH-
3º passo: Semi- Reação Anódica: 2 Cl4º passo: Semi – Reação Catódica: 2 H+ + 2e
Equação Global: 2NaCl + 2H2O
2 Na + + 2 Cl-
Cl2 (g) + 2e
H2 (g)
H2 (g) + Cl2 (g) + 2 Na + + 2 OH-(aq)
2NaOH
~ 22 ~ CAPÍTULO 2- FUNDAMENTOS DA
QUÍMICA ORGÂNICA:
Origem Do Petróleo
Atualmente, a teoria da origem orgânica do petróleo é a mais aceita para
explicar a sua existência. Esta teoria orgânica moderna pode ser definida nos
seguintes termos:
A matéria orgânica depositada com os
sedimentos
é
convertida
por
processos
bacterianos e químicos, durante o soterramento,
num polímero complexo, o querogênio, que
contém pequena quantidade de nitrogênio e
oxigênio. Este processo é acompanhado pela
remoção da água e compactação dos
sedimentos. O querogênio, por sua vez, é
convertido
em
hidrocarbonetos
por
craqueamento
térmico
em
maiores
profundidades e temperaturas relativamente
elevadas.
Figura 20: Estrutura molecular do Etil‐
benzeno
A exploração é realizada pela equipe de sísmica, geofísica, geólogos; ela
compreende os vários métodos e técnicas para a descoberta e comprovação
da possibilidade da existência de petróleo. Vale salientar que não basta
descobrir o reservatório, é necessário verificar se há viabilidade econômica de
produção do campo descoberto.
Atualmente a prospecção de petróleo utiliza aviões, navios e satélites que
possuem equipamentos que conseguem fazer uma verdadeira “radiografia” do
subsolo.
A fase explotatória (Perfuração + Produção) do campo petrolífero engloba as
técnicas de desenvolvimento e produção da reserva comprovada de
hidrocarbonetos de um campo petrolífero. A explotação corresponde a
perfuração e posterior produção do reservatório a partir do poço perfurado.
A fase de produção em poços terrestres (on-shore) pode ocorrer de três
formas:
a) Bombeamento Mecânico;
b) Injeção de Gás;
c) Injeção de Água.
~ 23 ~ A produção em mar, através de plataformas, é denominada de off-shore.
O transporte é feito por oleodutos ou em
superpetroleiros, e nas refinarias o petróleo é
separado em seus constituintes por destilação
fracionada.
Desse modo, neste capítulo iremos verem que
grupo o petróleo se encaixa na química
orgânica, bem como suas funções e
características desse grupo.
No próximo tópico iremos conhecer como se
originou o petróleo e sua composição,
observando também como a química
orgânica se identifica com esse composto.
Figura 21: Explotação de petróleo com cavalo de pau
~ 24 ~ 2- PETRÓLEO E SUA COMPOSIÇÃO:
O petróleo formou-se há milhares de anos, quando pequenos animais e
vegetais marinhos foram soterrados e submetidos à ação de microrganismos,
do calor e de pressões elevadas, ao longo do tempo.
O petróleo quando extraído no campo de produção é chamado Óleo Cru e,
a depender da Rocha Reservatório de onde o mesmo foi extraído, pode
apresentar diversos aspectos visuais e características diferentes. Por isso,
existem petróleos de várias cores: amarelo, marrom, preto e verde.
O petróleo no seu estado natural é sempre uma mistura complexa de diversos
tipos de hidrocarbonetos, contendo também proporções menores de
contaminantes (enxofre, nitrogênio, oxigênio e metais). Os contaminantes são
considerados como impurezas e podem aparecer em toda a faixa de
ebulição (destilação) do petróleo, mas tendem a se concentrar nas frações
mais pesadas.
Olé Cru (petróleo) = Hidrocarbonetos + Contaminantes O que são hidrocarbonetos?
São substâncias compostas somente por átomos de carbono (C) e de
hidrogênio (H), formando diversos tipos de moléculas.
A classificação do petróleo depende basicamente das características da
rocha reservatório e do processo de formação.
Os Alcanos:
Podem também serem denominados de hidrocarbonetos parafínicos ou
simplesmente parafina. Os alcanos abrangem os compostos que possuem
cadeia carbônica aberta, normal e saturada, apresentando também cadeia
carbônica ramificada. O petróleo parafínico apresenta até 90% de alcanos.
Figura 22: Cadeias carbônicas contidas em petróleo parafínico
~ 25 ~ No óleo cru pode aparecer também a combinação dos três tipos de
hidrocarbonetos acima mencionados, onde dessa maneira a classificação do
óleo será determinada pela predominância do tipo de hidrocarboneto.
Além dessa mistura de hidrocarbonetos, o óleo cru também contém em
proporções
bem
menores, outras
substâncias
conhecidas
como
Contaminantes.
Figura 23: Hidrocarbonetos cíclicos presentes no petróleo. Os heteroátomos (contaminantes) mais comuns são os átomos de enxofre (S),
nitrogênio (N), oxigênio (O), e de metais como níquel (Ni), ferro (Fe), cobre
(Cu), sódio (Na) e vanádio (V), podendo inclusive estar combinados de muitas
formas.
O enxofre (S) é o contaminante de maior predominância e está presente em
vários tipos de petróleo. Os contaminantes sulfurados (que contém enxofre)
causam problemas no manuseio, transporte e uso dos derivados.
Abaixo uma tabela que exemplifica a composição elementar do óleo cru (%
em peso):
HIDROGÊNIO CARBONO ENXOFRE NITROGÊNIO OXIGÊNIO METAIS 11 ‐14 % 83 – 87 % 0,06 – 8 % 0,11 – 1,7 % 0,1 – 2 % ATÉ 0, 3 % Tabela 4: Composição do óleo Cru
Dessa maneira podemos observar que o petróleo é composto basicamente
de carbono e hidrogênio. Entre os contaminantes, o enxofre é aquele que
apresenta o maior percentual de presença.
~ 26 ~ No reservatório, o óleo normalmente é encontrado juntamente com água, gás
e outros compostos orgânicos. Essas substâncias, incluindo o óleo, estão no
reservatório posicionado de acordo com suas densidades.
Na zona superior do reservatório, geralmente há uma “capa” de gás rico em
metano (CH4), conhecido como Gás Associado. Esse gás é composto também
por outros hidrocarbonetos (no estado gasoso) e por gases corrosivos, como o
gás sulfídrico (H2S) e o dióxido de carbono (CO2).
Na zona intermediária, estão o óleo propriamente dito, contendo água
emulsionada e também os mesmos componentes presentes no gás associado.
Na zona inferior, encontramos água livre (não misturada com óleo), com Sais
Inorgânicos dissolvidos e Sedimentos.
Portanto, neste capítulo, iremos estudar como é a química orgânica, bem
como sua origem, seus princípios e funcionamentos e como podem ser
adaptados na utilização da indústria.
2.1- Histórico:
A química orgânica era definida como um ramo químico que estuda os
compostos extraídos dos organismos vivos.
Em 1807 (Jöns Jacob Berzelius): Foi formulada a Teoria da Força Vital. Ela
baseava-se na ideia de que os compostos orgânicos precisavam de uma força
maior (a vida) para serem sintetizados. "Somente os seres vivos podem
transformar substâncias minerais em orgânicas."
Em 1828 (Friedrich Wöhler): Discípulo de Berzelius, a partir do cianato de amônio,
produziu a uréia; começando, assim, a queda da teoria da força vital. Essa
obtenção ficou conhecida como síntese de Wöhler.
Em 1854 (Pierre Eugene MarcellinBerthelot): Iniciou toda uma série de
experiências e em 1862 sintetizou o acetileno.
Em 1858 (Friedrich A. Kekulé): Foi definida a Química Orgânica como sendo a
parte da química dos compostos do carbono. “Química Orgânica é o ramo da
Química que estuda os compostos do carbono“. Essa afirmação está correta,
contudo, nem todo composto que contém carbono é orgânico, mas todos os
compostos orgânicos contêm carbono.
Em 1866 (Berthelot): Foi obtida, por aquecimento, a polimerização do acetileno
em benzeno e, assim, é derrubada a Teoria da Força Vital.
~ 27 ~ 2.2- Características do carbono:
O carbono é tetravalente:
A configuração eletrônica do carbono apresenta 2 e 4
elétronsrespectivamente nas camadas K e L, ou seja, por
possuir 4 elétrons na camada de valência efetua 4
ligações.
Os ângulos entre as valências são de 109º 28’, adquirindo a
forma de um tetraedroregular. Figura 24: Carbono Tetravalente
As quatro ligações simples de um carbono são iguais:
As 4 valências do carbono são iguais entre si. Assim, por exemplo, as 4 fórmulas
exemplificadas a seguir representam, na realidade, um único composto de
fórmula molecular CHCl3.
gura 25: Esquema de rotação da molécula de Clorofórmio Ligações entre átomos de carbono
Ligações múltiplas, isto é, forma ligações simples, duplas e triplas.
O caráter da ligação é anfótero (não importa se é metal ou não-metal). Figura 26: Tipos de Ligações realizadas pelo Carbono
Fi
~ 28 ~ Os átomos de carbono podem ligar-se entre si, formando cadeias.
As cadeias carbônicas podem possuir 3tipos de hibridizações: sp³, sp² e sp.
2.3- Hibridização
Sp³ (tetraédrica):
Carbono liga-se a outros quatro átomos. É a fusão de quatro orbitais (um do
tipo s e três do tipo p) formando quatro orbitais do tipo sp3.
Figura 27: Ligações do tipo sp3 do carbono Forma somente ligações simples, cujo ângulo
entre as valências é 109º 28’, que é uma
característica dos alcanos.
Figura 28: Fórmula geométrica e estrutural da forma sp³
Sp² (trigonal):
Carbono liga-se a outros três átomos. É a fusão de um orbital s com dois
orbitais p, formando três orbitais do tipo sp2, forma duas ligações simples e uma
dupla e o ângulo entre as valências: 120º, que é uma característica dos
alcenos.
Sp (linear):
Figura 29: Fórmula geométrica e estrutural da hibridização sp² Carbono liga-se a outros dois átomos. É a fusão de um orbital s com um p
formando dois orbitais do tipo sp e pode formar duas ligações duplas ou uma
tripla e uma simples, seu ângulo entre as valências: 180º. É característica dos
alcinos e alcadienos.
~ 29 ~ Figura 30: Fórmula estrutural e geométrica da hibridização sp
Como são as ligações do Carbono?
Sigma (δ): É a primeira ligação entre dois átomos. Ocorre, neste caso, uma
superposição de orbitais (overlap).
PI (π): São as segundas e terceiras ligações entre os átomos. Agora, o que
ocorre é uma aproximação entre os orbitais.
2.4- Tipos de carbono numa cadeia carbônica:
Carbono Primário:
É o que se liga apenas a outro átomo de carbono. São primários osátomos de
carbono situados nas extremidades da cadeia e quando houver somente um
átomode carbono, este será considerado primário.
Figura 31: Exemplo de cadeias carbônicas com carbono Primário: a) metano, b) 2,2 dimetil‐butano
Carbono Secundário:
É o que se liga a dois outros átomos de carbono
~ 30 ~ Figura 32: Exemplo de cadeias carbônicas com carbono secundário: a) propano, b) 2,2 dimetil‐butano
Carbono Terciário:
Está ligado a três outros átomos de carbono.
Figura 33: Exemplo de cadeias carbônicas com carbono terciário: a) 2 metil‐propano , b)2,2 dimetil‐3‐
metil‐butano
Carbono quaternário:
Está ligado a quatro outros átomos de carbono.
Figura 34: Exemplo de cadeias carbônicas com carbono quaternário: a) 2,2 dimeti‐propano, b) 2,2 dimetil‐ 3 metil‐ butano
~ 31 ~ 2.5- Classificação das cadeias carbônicas:
SATURADA:
Cadeia cujos carbonos, se unem por ligaçãosimples.
INSATURADA:
Cadeia cujos carbonos se unem por duplas e/ou triplas ligações.
Figura 35: Hidrocarbonetos com cadeias insaturadas. À esquerda, propeno e à direita, propino
HOMOGÊNEA:
Cadeia cujo núcleo só é constituído por carbonos.
Figura 36: Cadeia homogênea. Ácido etanóico
A cadeia carbônica do ácido acético (etanóico) é homogênea, pois
entre os átomos de carbono não existe nenhum heteroátomo e na saturada
entre os dois átomos de carbono existe apenas uma ligação simples.
~ 32 ~ HETEROGÊNEA:
Cadeia que apresenta um heteroátomo (N, O, S), ou seja, átomo diferente de
carbono unido a pelo menos dois outros carbonos.
Figura 37: Cadeias heterogêneas. Da esquerda para a direita, éter dietílico e etilmetilamina.
NORMAL:
Cadeia não ramificada, ou seja, constituída por carbonos primários e
secundários somente.
Figura 38: Cadeia normal. Exemplo: Acetona RAMIFICADA:
Cadeia que apresenta ramos ou ramificações (radicais).
Figura 39: Cadeias ramificadas. Exemplos: à esquerda, metil‐propano e à direita, dimetil‐propano ~ 33 ~ MISTA:
Cadeia cíclica ramificada, ou seja, apresentando parte cíclica e parte
acíclica.
Figura 40: Exemplo de cadeia mista: éter metil‐propílico A cadeia do composto da figura 41 apresenta átomos de carbono primário e
secundário com três extremidades considerado ramificada.
HOMOCÍCLICA:
Cadeia cujo núcleo só apresenta átomos de carbono:
Figura 41: Cadeia homocíclica. À esquerda, benzeno e sua representação simplificada. À direita, o cicloexano e a representação simplificada HETEROCÍCLICA:
Cadeia cíclica com heteroátomo.
Figura 42: Cadeias heterocíclicas: À esquerda, furano e sua representação simplificada, no centro piridina e sua representação simplificada e por fim Cadeia heterocíclica, ácido barbitúrico ~ 34 ~ AROMÁTICA:
Cadeia cíclica que apresenta efeito de ressonância. Contêm núcleo benzênico,
classificados em cadeia aromática. Exemplo: o fenol comum (C6H5OH) é
considerado um sólido, pouco solúvel em água, empregado como desinfetante,
na fabricação de corantes, plásticos, etc.
A cadeia aromática pode ser composta por mais de um núcleo benzênico. Figura 43: Cadeia aromática. Fenol e sua representação simplificada MONONUCLEADA:
Um único núcleo ressonante. Figura 44: Metil‐bezeno (tolueno) POLINUCLEADA DE NÚCLEOS CONDENSADOS:
Mais de um núcleo fundido. Seus anéis possuem átomos de carbono
comum. Naftaleno ou naftalina (C10H8) é considerada um sólido branco que sofre
sublimação para ser usado como inseticida sendo encontrado no alcatrão de
hulha.
Figura 45: Cadeia polinucleada. Naftaleno (à esquerda) e Antraceno (à direita) ~ 35 ~ Os aromáticos possuem ampla utilização na indústria com seus compostos,
como por exemplo, o tolueno, por sua alta pureza, excelente poder de
solvência e volatilidade moderada, é amplamente utilizado como solvente
ativo e diluente para grande número de resinas. Também é utilizado nas
formulações de adesivos à base de borracha e como solvente nas tintas a
base de alumínio para repinturac de botijões de gás. Outra aplicação ainda é
como matéria-prima na fabricação de explosivos e para a produção de
secantes, aditivos, desinfetantes, ácido benzóico, entre outros
RESUMINDO: Figura 46: Resumo da classificação das cadeias carbônicas ~ 36 ~ 2.6- Elementos Organógenos:
Existem vários compostos orgânicos e esses são formados pelos elementos
organógenos, que são:
C, H, O, N
(Carbono, Hidrogênio, Oxigênio e Nitrogênio, respectivamente)
Os elementos organógenos são os elementos químicos que aparecem com
maior frequência entre os compostos orgânicos. Eles também são conhecidos
como elementos geradores dos compostos orgânicos.
Aparecem também outros elementos químicos nos compostos orgânicos,
porem com uma frequência menor, são eles:
Br, I, S, P, Cl, etc.
A maioria dos compostos orgânicos é obtida por síntese em laboratórios e em
indústrias; o número de compostos orgânicos isolados, encontrados nas
plantas e nos animais é bem menor.
CURIOSIDADES: O que é Adrenalina:
A adrenalina é um hormônio liberado pelas glândulas que ficam sobre os rins
(glândulas suprarrenais). A presença no organismo se dá através de um sinal
liberado em resposta ao grande estresse físico ou mental ou também, situações
de forte emoção como, por exemplo, descida em montanha russa alta de
pára-quedas e esportes radicais em geral.
A adrenalina atua como um neurotransmissor
que tem efeito sobre o sistema nervoso
simpático, preparando o organismo para um
grande esforço físico.
Os sintomas característicos da liberação de
adrenalina são: suor, vaso constrição,
aumento
dos
batimentos
cardíacos, Figura 47: Adrenalina, nome IUPAC: (R)‐
4‐[1‐hidroxi‐2‐(metilamino) ‐
dilatação das pupilas e brônquios (aumenta a
etilbenzeno‐1,2‐diol visão e deixa a respiração ofegante), eleva o
nível de açúcar no sangue, entre outros.
~ 37 ~ A adrenalina pode ocasionar amorte?
O aumento dos batimentos cardíacos faz
com que o sangue seja bombeado mais
rapidamente, esse efeito só ocorre por que os
vasos se contraem ficando mais finos,
acelerando a circulação sanguínea.
O problema é que, se alguma artéria que
leva sangue ao coração estiver um pouco
entupida, o estreitamento agravará o quadro,
levando a não circulação do sangue e então
ocorre a morte de um conjunto de células por
falta de oxigênio, mais conhecido como
infarto.
Figura 48: Montanha Russa, atividade que aumenta os batimentos do coração.
Como se vê, a adrenalina recebe duas
classificações: hormônio e neurotransmissor.
Mas se tratando das classes orgânicas, ela se
caracteriza como Amina (presença de NH2).
O neurotransmissor foi nomeado como
"adrenalina" pelo cientista que conseguiu
isolá-lo pela primeira vez, o bioquímico japonês JokichiTakamine.
Figura 49: Estrutura molecular da Ele se inspirou na localização do hormônio no adrenalina organismo:
ad(prefixo
que
indica
proximidade), renalis (relativo aos rins) e o
sufixo-ina, (referente à classe pertencente, às
aminas).
~ 38 ~ EXERCÍCIO RESOLVIDO:
1-O
petróleo bruto é o ponto de partida para muitas substâncias diferentes
porque contém hidrocarbonetos. Os hidrocarbonetos são moléculas que
contém hidrogênio e carbono e existem em diferentes tamanhos e
estruturas, com cadeias ramificadas e não ramificadas e anéis. Após o
processo de destilação do petróleo é possível obter vários tipos de produtos
desde o gás natural, a gasolina e até o asfalto que é o ultimo resíduo da
fração destilada.
Figura 50: Gás Metano à esquerda e a direita a Gasolina Isoctano Figura 51: Isoparafinas. Molécula superior: C15H32 Molécula inferior C12H26 (querosenes)
Com base nos compostos acima, escreva as classificações quanto às cadeias
carbônicas de cada composto.
Solução:
Gás metano: Possui cadeia aberta ou acíclica, saturada, normal, homogênea.
Gasolina: Possui cadeia aberta ou acíclica, saturada, ramificada, homogênea.
~ 39 ~ Os querosenes: Possuem cadeias abertas ou acíclicas, saturadas, ramificadas,
homogêneas.
2-Pireno hidrocarbonetos de núcleo condensado, obtido no resíduo da
destilação pirolítica do alcatrão do carvão em éter e insolúvel em água
apresenta a seguinte fórmula estrutural plana:
Figura 52: Molécula do pireno
Responda qual é a forma molecular do Pireno e sua classificação carbônica:
Solução:
Fórmula molecular: C16H10
Possui cadeia carbônica cíclica ou fechada, aromática.
~ 40 ~ CAPÍTULO 3: NOMENCLATURA DE
COMPOSTOS ORGÂNICOS E
HIDROCARBONETOS:
GN X GLP - Semelhanças e Características.
O gás natural é um combustível fóssil
encontrado em rochas porosas no
subsolo, podendo estar associado ou
não ao petróleo, onde se apresenta
de forma inodora e incolor, não é
tóxico e é mais leve que o ar.
C1 a C4 (20º) Gases
Nafta (70º) C5 a C10 (120º) Gás natural, por ser encontrado no
subsolo terrestre ou marinho, é
composto por hidrocarbonetos, cujo
maior parte dessa composição (cerca
de 70%) é de metano CH4. Já em
menores
quantidades
podemos
encontrar gases como CO2, N2, H2S,
água, ácido clorídrico, metanol e
outras impurezas.
Gasolina C10 a C16 (170º) Querosene C14 a C20 (270º) Diesel C20 a C50 A exploração do gás natural consiste
na pesquisa e perfuração do poço. Já
na sua produção, o gás deve passar
por vasos separadores que serão
delineados e equipados para tirar os
hidrocarbonetos
e
água
que
estiverem em estado líquido e as
partículas sólidas.
Óleos Lubrificados C20 a C70 FUEL (600 º) > C70Resíduo/ Alcatrão Figura 53: Representação dos produtos obtidos através do petróleo
O uso do GN nas residências seja para
cozimento, seja para calefação, além da
segurança e praticidade, tem a vantagem de
substituir o GLP (derivado de petróleo
importado pelo Brasil), que exige complexa
infra-estrutura
de
transporte
e
armazenamento.
~ 41 ~ Figura 54: Armazenamento de GLP em botijão (gás de cozinha)
Mais conhecido como “gás de cozinha”, o GLP (Gás Liquefeito de Petróleo) é
utilizado em maior quantidade, cerca de 90% para cocção de alimentos,
podendotambém ser encontrado como combustível industrial em fábricas, na
utilização deCombustíveis de empilhadeiras em ambientes fechados.
O GLP é armazenado em botijões cilíndricos no estado líquido com
aproximadamente 13 kg de gás. Sua obtenção é em maior parte através do
refino do petróleo podendo também ser obtido nas Unidades de
Processamento de Gás Natural. Nas refinarias, o GLP é um dos subprodutos do
fracionamento, sendo obtido a uma temperatura de aproximadamente 70 °C.
É um dos primeiros hidrocarbonetos retirados da coluna de destilação. Uma
característica marcante do GLP é não possuir cor nem cheiro próprio. No
entanto, por motivo de segurança, uma substância do grupo Mercaptan¹ é
adicionada ao GLP ainda nas refinarias. Ela produz o cheiro característico
quando há um vazamento de gás. O GLP não é uma substância tóxica, porém
se
inalado
em
grande
quantidade,
produz
efeito
anestésico.
Curiosidades sobre o gás:
O gás não associado caracteriza-se pela
ausência de óleo ou ínfima presença. No caso
de gás associado, sua produção está
intimamente vinculada à produção do
petróleo, diferentemente dos reservatórios de
gás não associado.
Daí a necessidade de manter-se o preço do
gás atrelado a um combustível cujos custos
sejam estáveis. Igualmente, a composição do
Figura 55: Flare em unidade gás natural também é bastante variável,
industrial.
dependendo também de estar ou não
associado.
Fundamentalmente, compõe-se de metano, etano e propano. Apesar da
pequena quantidade, é bastante comum estar contaminado com nitrogênio,
dióxido de carbono, água e compostos de enxofre.
Da mesma forma que o GLP, o gás natural também é inodoro, incolor,
inflamável. Assim sendo, por questões de segurança, é impregnado com
compostos de enxofre que, apesar de caracterizar-lhe o odor, não tem
propriedades corrosivas. Apesar de ser transportado basicamente por dutos,
~ 42 ~ em seu estado gasoso, o gás natural também pode ser pressurizado e
transportado em cilindros (GNC) ou ainda em estado líquido (GNL), onde seu
volume é reduzido em aproximadamente 600 vezes, facilitando o transporte
em caminhões, navios ou barcaças criogênicos (-1600C).
No próximo tópicoserá conhecido todo o grupo ao qual o gás natural
pertence, suas funções e aplicabilidades, e também como esses compostos
são chamados oficialmente, seguindo normas e procedimentos.
3.1- Nomenclatura De Compostos Orgânicos E
Hidrocarbonetos:
Grupo funcional: é o átomo ou grupo de átomos responsáveis pelas
propriedades químicas dos compostos pertencentes a uma determinada
função química.
A nomenclatura orgânica oficial começou a ser criada em 1892 em um
congresso internacional em Genebra, após várias reuniões surgiu a
nomenclatura IUPAC (União Internacional de Química Pura e Aplicada)
Hidrocarbonetos são compostos formados exclusivamente por carbono e
hidrogênio. A fórmula geral dos hidrocarbonetos é CxHy. Sendo que x
representa o número de átomos de carbono e y é o número de átomos de
hidrogênio.
Os hidrocarbonetos se dividem em: alcanos, alcenos, alcinos, alcadienos,
cicloalcanos, cicloalcenos e hidrocarbonetos aromáticos.
Pela IUPAC, a nomenclatura dos hidrocarbonetos pode ser obtida tanto pela
maneira oficial que é pela IUPAC quanto pela maneira usual.
NOMENCLATURA OFICIAL PELA IUPAC:
COMPOSTO ORGÂNICO DE CADEIA NORMAL.
PREFIXO+INFIXO+SUFIXO
Nº de C+tipo de ligação +grupo funcional
3.2 - PREFIXO: NÚMERO DE ÁTOMOS DE CARBONO:
Indica o número de átomos de carbono pertencentes à cadeia principal.
1C = MET 6C = HEX 11C = UNDEC ~ 43 ~ 2C = ET 7C = HEPT 12C= DODEC 3C = PROP 8C = OCT 13C = TRIDEC 4C = BUT 9C = NON 15C = PENTADEC 5C = PENT 10C = DEC 20C = EICOS Tabela 5: Prefixo para nomenclatura 3.3 – INFIXO: TIPO DE LIGAÇÃO ENTRE CARBONOS:
TIPO DE LIGAÇÃO ENTRE EXEMPLO CARBONO SIMPLES C‐ C‐C‐C INFIXO DUPLA C‐C=C‐C EN DUAS DUPLAS C‐C=C=C DIEN TRIPLA C‐C C‐C IN DUAS TRIPLAS C‐C C C DIIN AN Tabela 6: Nomenclatura para os tipos de ligações 3.4 - SUFIXO – GRUPO FUNCIONAL:
Indica a função química do composto orgânico:
FUNÇÃO
SUFIXO
HIDROCARBONETO - CXHY
NO
ALCOOL- OH
OL
ALDEÍDOH–C=O
AL
CETONA-C=O
ONA
ÁC. CARBOXILÍCO H-C=OH
ÓICO
AMINAS H-C-N
AMIINA
ÉTER C-O-C
ÓXI
Tabela 7: Nomenclatura para a função química
EXEMPLOS:
~ 44 ~ ¾ 2 átomos de carbono: ET
Ligação simples: NA
Função álcool: OL
NOME OFICIAL: ETANOL
Figura 56: Molécula do Etanol ¾ 5 átomos de carbono: PENT
Ligações simples: AN
Função álcool: OL
Posição do carbono da função: 2
NOME OFICIAL: 2- PENTANOL
Figura 57: Molécula do 2‐pentanol ¾ Posição do carbono com ligação Dupla: 2,3,5 7 átomos de carbono: HEPT
3 ligações duplas: TRIEN
Função Hidrocarboneto: NO
Figura 58: Molécula do 2,3,5 heptatrieno NOME OFICIAL: 2,3,5 HEPTATRIENO
¾ Posição do carbono com insaturação: 5
Posição do carbono da função: 2
6 átomos de carbono: HEX
1 ligação dupla: EM
Função Cetona: ONA
NOME OFICIAL: 5 - HEXEN-2 – ONA
Figura 59: Molécula do 5 – hexen‐2‐ona Para compostos com 3 ou mais carbonos, que apresentam grupo funcional ou
insaturações, a cadeia carbônica deverá ser numerada pela extremidade
mais próxima do grupo funcional ou da insaturação.
~ 45 ~ Para compostos que apresentem tanto o grupo funcional quanto a insaturação
a ordem de importância é
.
3.5-COMPOSTOS COM CADEIA RAMIFICADA
Escolha da cadeia principal
¾
¾
¾
¾
¾
Considerar como cadeia principal, a cadeia carbônica mais longa
possível;
Engloba o maior número de insaturações;
Numere a cadeia principal de forma que as ramificações recebam os
menores números possíveis (regra dos menores números);
Elaborar o nome do hidrocarboneto citando as ramificações em ordem
alfabética, precedidos pelos seus números de colocação na cadeia principal
e finalizar com o nome correspondente a cadeia principal;
Os números são separados uns dos outros por vírgulas e os números
devem ser separados das palavras por hífens;
Quando a cadeia for mista, preferencialmente a cadeia principal é a parte
alicíclica ou aromática.
Nomenclatura dos Radicais
O que fica por fora da cadeia principal é conhecido como radical. Na figura
3.8, segue um exemplo de nomenclatura com cadeia ramificada.
Figura 60: Molécula do propil‐ciclobutano (à esquerda) e 3,4 dimetil‐heptano (à direita) Localização dos radicais na cadeia principal
A localização deve ser informada pela numeração dos carbonos da cadeia;
A cadeia deve ser numerada a partir dessa ordem de importância:
Grupo funcional >insaturação> radical
Exemplo:
~ 46 ~ Figura 61: Molécula de 5‐metil‐2‐hexanol. Obs.: O 2 indica onde a hidroxila está localizada Figura 62: Exemplo de radicais mais comuns No caso de haver dois, três, quatro, etc. grupos iguais ligados na cadeia
principal, usam-se os prefixos di, tri, tetra, etc. diante dos nomes dos grupos.
Os prefixos di, tri, tetra, iso, sec, terc, não são levados em consideração na
colocação dos nomes em ordem alfabética.
~ 47 ~ Figura 63: Exemplo de nomenclatura de cadeias longas 3.6-FUNÇÕES QUÍMICAS:
Classe de compostos que apresentam propriedades químicas semelhantes.
As principais são:
Hidrocarboneto
DerivadosHalogenados
Álcool
Fenol
Cetona
Aldeído
Ácido Carboxílico (óico)
Sais de Ácido Carboxílico
Cloretos de Ácidos
Anidridos de Ácidos
Éster
Éter
Amina
Amida
Tabela 8: Semelhança entre os compostos químicos
3.6.1-Hidrocarbonetos:
Os hidrocarbonetos são muito importantes porque formam o "esqueleto" das
demais funções orgânicas.
São compostos que apresentam em sua composição átomos de Carbono e
Hidrogênio. Vejamos as características dos principais Hidrocarbonetos
ALCANOS:
Hidrocarbonetos alifáticos saturados, isto é, apresentam cadeia aberta com
simples ligações apenas. Fórmula geral: CnH2n+2 . Também conhecidos como
parafinas.
~ 48 ~ EXEMPLO:
BUTANO C4H10 Figura 64: Estrutura molecular do butano ALCENOS OU OLEFINAS:
Hidrocarbonetos alifáticos insaturados que apresentam uma dupla ligação.
Fórmula geral: CnH2n . Também conhecidos por hidrocarbonetos etilênicos, são
hidrocarbonetos de cadeia aberta (acíclicos) contendo uma única dupla
ligação.
EXEMPLO:
ETENO C2H4
Figura 65: Estrutura molecular do eteno ALCINOS OU ALQUINOS
Alcinos,
alquinos
ou
hidrocarbonetos
hidrocarbonetos acíclicos contendo uma única
fórmula geral CnH2n-2.
acetilênicos
são
ligação tripla. Possuem
EXEMPLO:
ETINO: C2H2
Figura 66: Estrutura molecular do etino ALCADIENOS:
~ 49 ~ São hidrocarbonetos acíclicos (abertos) contendo duas duplas ligações.
Possuem fórmula geral: CnH2n-2.
EXEMPLO:
1,3 BUTADIENO C4H6
Figura 67: Estrutura molecular do butadieno
A CLASSIFICAÇÃO DOS
HIDROCARBONETOS DE CADEIAS ABERTA É DADA POR:
Hidrocarboneto
Alcano ou Parafina
Cadeia Aberta
Só ligações simples
Exemplo
Fórmula Geral
CnH2n + 2
Alqueno ou Alceno ou 1 ligação dupla
Olefina
Alquini ou Alcino
1 Ligação Tripla
CnH2n
Alcadieno ou Dieno
CnH2n-2
2 Duplas Ligações
CnH2n-2
Tabela 9: Quadro com o resumo dos hidrocarbonetos alifáticos
CICLOALCANOS:
Apresentam cadeia fechada com apenas simples ligações. Possuem fórmula
geral CnH2n onde "n" deve ser maior ou igual a 3.Na indústria do petróleo, eles
são chamados de hidrocarbonetos naftênicos. Também são conhecidos por
ciclanos ou cicloparafinas.
EXEMPLO:
CICLOHEXANO C6H12
Figura 68: Estrutura molecular do ciclohexano CICLOALCENOS:
~ 50 ~ São hidrocarbonetos cíclicos insaturados por uma dupla ligação. A fórmula
geral é CnH2n-2. Também chamados deciclenos ou ciclo-olefinas ou cicloalqueno. Ele é muito útil na formulação de remédios, na área da medicina.
EXEMPLO:
CICLOBUTENO C4H6
Figura 69: Estrutura molecular do ciclobuteno
HIDROCARBONETO
AROMÁTICO
São os hidrocarbonetos que possuem um ou mais anéis benzênicos, que
também são chamados de anéis aromáticos. Para ser anel benzênico, tem
que ter 6 átomos de carbono realizando ligações simples e duplas alternadas.
Fórmula Geral: CnH2n-6. São encontrados em óleos de baleia, casca
de árvores e carvão mineral.
EXEMPLO:
ANEL BENZENO C6H6
Figura 70: Estrutura molecular do Benzeno RESUMINDO A CLASSIFICAÇÃO DOS HIDROCARNONETOS DE CADEIAS
FECHADA TEMOS:
Hidrocarbonetos Cadeia Cíclica
Ciclo Alcano ou Ligações Simples
Ciclano
Exemplo
Ciclo Alqueno 1 Ligação Dupla
ou Cicleno
Aromático
Areno
ou Com Anel Benzênico
Tabela 10: Resumo dos hidrocarbonetos cíclicos
Fórmula Geral
CnH2n
CnH2n-2
-----------
~ 51 ~ ÁLCOOL
Todo composto orgânico que apresenta em sua estrutura a hidroxila (-OH),
que deve estar ligada a um átomo de carbono saturado.(R-OH) (OH ligado a
carbono saturado), onde R= grupo ou grupamento orgânico; Ar = anel
aromático ou anel benzênico.
EXEMPLO:
ETANOL
C2H5 – OH
FENOL
Compostos orgânicos que contêm o grupo funcional Hidroxila (-OH) ligado
diretamente a um carbono de anel aromático. São ácidos em razão
do hidrogênio ionizável ligado ao oxigênio. São antibacterianos efungicidas.
EXEMPLO:
FENOL
C6H6-OH
Figura 72: Estrutura molecular do fenol ÉTER
Compostos que apresentam um átomo de Oxigênio entre dois radicais
orgânicos. Quando esses radicais forem iguais, o éter é chamado de simétrico,
e assimétrico caso contrário. R-O-R' ou Ar-O-Ar
Eles possuem caráter básico, são geralmente usados como anestésicos
ou solventes. São pouco solúveis em água (cadeia pequena), e totalmente
insolúveis quando a
cadeia carbônica for
longa. São altamente
inflamáveis e voláteis.
Figura 71: Etanol em sua forma molecular
~ 52 ~ EXEMPLO:
ETILMETOXIMETANO
CH3CH3 – O – CH3
Figura 73: Estrutura molecular do metoximetano
ALDEÍDO
Os aldeídos são uma função orgânica cujas moléculas apresentam a
fórmula (H-C=O) ligado a um radical alifático (de cadeia aberta ou fechada)
ou a um radical aromático. (H-COH ou R-COH ou Ar-COH)
A fórmula básica dos aldeídos é a de um álcool correspondente em número
de carbonos menos dois átomos de hidrogênio, ou ainda, a substituição de
dois átomos de hidrogênio de um hidrocarboneto por um de oxigênio.
De uma forma geral, os aldeídos de menor massa molecular apresentam odor
desagradável (a exemplo do formol), enquanto que os de maior massa
possuem odor agradável de frutas (odoríferos naturais).
EXEMPLO:
METANAL
H-COH
Figura 74: Formaldeído (metanal) em sua forma molecular
CETONA (R-CO-R' ou R-CO-Ar ou Ar-CO-Ar)
As cetonas são compostos orgânicos que contém o grupo funcional carbonila
ligado a dois radicais.
As cetonas são obtidas através da oxidação de alcoóis secundários (o
oxigênio se ligará ao hidrogênio do carbono secundário, o que é muito
instável), que formará então a cetona + água:
~ 53 ~ EXEMPLO:
Propanona H6C-C=O
Além dos ésteres; os
voláteis também possuem
fazendo parte dos aromas
Figura 75: Fórmula molecular da propanona, ou comercialmente conhecida como acetona.
aldeídos e as cetonas
propriedades odoríferas,
de frutas, flores e outros
Figura 76: Reação de oxidação para formação de uma cetona
materiais de origem natural.
O uso destes compostos na indústria de perfumes é muito comum, os aldeídos
constituem uma das principais famílias olfativas empregadas na confecção de
perfumes. O citral, um dos componentes mais comuns de perfumes com
toques cítricos, é na verdade uma mistura de dois aldeídos isoméricos: o
geranial e o neral. O famoso Chanel no 5, criado em 1925 por Ernest Beaux, foi
o primeiro perfume famoso a empregar aldeídos sintéticos em sua
composição.
Cetonas também são muito utilizadas na indústria de perfumes. Uma delas, a
muscona, cujo nome oficial é (R)-3-metilciclopentadecanona, é o principal
componente do odor de almíscar, que na natureza é encontrado em
glândulas presentes nas quatro espécies de veado almiscareiro
(Moschusssp)Outras cetonas naturais empregadas em perfumaria são a
civetona, obtida da civeta africana, a jasmona, extraída do jasmim, e a αirona, componente do aroma de violetas.
~ 54 ~ O ácido metanóico é um líquido incolor decheiro
irritante, que ao ser injetado nos tecidos, provoca dor,
é denominado também como ácido fórmico. Este
nome provém de seu histórico: o ácido foi extraído a
partir da maceração de formigas.
Daí o porquê da irritação causada na pele ao ser
injetado, é a mesma da picada de formigas.
Figura 78: Ácido metanóico (fórmico) presente nas formigas
ÁCIDO CARBOXÍLICO:
Os ácidos carboxílicos são caracterizados pelo grupo carboxila (-COOH),
ligado a um carbono da cadeia principal. Afórmula estrutural plana da
carboxila é:
Esses compostos são ácidos
compostos orgânicos mais
de
10
carbonos,
são
graxos. No ser humano,
presentes no suor, o que faz
reconheçam seus donos
exalam.
Figura 77: Estrutura molecular do ácido metanóico
fracos, mesmo assim são os
ácidos. Quando têm mais
conhecidos como ácidos
esses
ácidos
estão
com que alguns animais
apenas pelo cheiro que
Podem ser obtidos pela oxidação de alcoóis ou aldeídos.
EXEMPLO:
Ácido Metanóico:
HCOOH
AMINAS:
As aminas são compostos orgânicos derivados da amônia (NH3), onde os
hidrogênios são substituídos por radicais orgânicos.Elas são classificadas em
primárias quando há apenas um radical orgânico preso ao nitrogênio;
secundárias se forem 2 radicais; e terciárias se forem 3 radicais.
~ 55 ~ EXEMPLO:
Amina primária: CH3-NH2 (metanoamina)
Amina secundária: CH3-NH-CH3 (dimetanoamina)
Amina terciária: (trimetanoamina)
Figura 79: Exemplo de amina terciária
~ 56 ~ EXERCICIOS RESOLVIDOS:
1- O gás natural é usado como combustível em residências, nos fogões,
aquecedores de água e, em países de clima frio, nos sistemas de calefação. É
utilizado também como combustível industrial no aquecimento de caldeiras
onde água é transformada em vapor. Este, por sua vez, é utilizado para
movimentar turbinas.
O gás natural não é usado apenas como combustível. Diversos subprodutos do
gás natural bruto, como o metano, o etano, o propano e o butano são usados
como matéria-prima na obtenção de substâncias sintéticas. Os subprodutos
do gás natural são separados uns dos outros por compressão, que os
transformam em líquidos a temperaturas diferentes.
Represente na forma de estruturas e molecular os hidrocarbonetos que
representam o produto e os subprodutos do gás natural.
Solução:
Como o GN é constituído basicamente de
metano temos a seguinte fórmula estrutural:
E sua fórmula molecular é: CH4
Figura 80: Estrutura molecular do metano
O etano encontra-se no petróleo, no gás natural
e no gás das instalações de coque, podendo
também ser obtido por adição de hidrogênio ao
etileno.
O etano é usado principalmente para
aquecimento. Para o etano temos a seguinte
estrutura:
Figura 81: Estrutura molecular do etano
E sua fórmula molecular é: C2H6
O propano tem sua estrutura representada ao
lado.
E sua fórmula molecular é: C3H8
Figura 82: Estrutura molecular do propano
~ 57 ~ O butano representado pela estrutura ao lado
É um gás e sua fórmula molecular é: C4H10
Figura 83: Estrutura molecular do butano
Os compostos exemplificados acima são chamados de hidrocarbonetos
saturados, porque os átomos de carbono unem-se por apenas uma ligação
de valência. Compostos saturados não podem
aceitar hidrogênio adicional.
2-Da
refinação do petróleo obtém-se a fração que constitui o GLP, cuja
composição química predominante consiste de hidrocarbonetos
(A) ramificados.
(B) alicíclicos
(C) aromáticos.
(D) saturados.
(E) insaturados.
Solução:
Resposta letra D. Os hidrocarbonetos presentes no GLP (mas comumente
chamado de “gás de cozinha”) é composto praticamente de etano, propano
e butano, que são saturados por terem apenas ligações simples.
~ 58 ~ CAPÍTULO 4: ISÔMEROS E OCOTIDIANO
Com o avanço da tecnologia e suas novas criações para uma melhor e mais
saudável expectativa de vida, vemos como a química orgânica participa do
cotidiano das pessoas, um exemplo simples e corriqueiro disso é quando
vamos ao supermercado e procuramos pelos alimentos sem gorduras trans.
Mas o que são e para que utilizamos esses alimentos?
Os alimentos trans são um tipo de gordura obtido por um processo químico
industrial, onde através da hidrogenação é possível transformar óleos vegetais
líquidos em gorduras sólidas.
A resposta a esse tipo de fenômeno das gorduras trans, devemos as diversas
técnicas de determinação da estrutura da molécula, onde para os “trans”
temos um conjunto de moléculas que possuem iguais formas empíricas. A esse
tipo de igualdade chamamos de isomeria.
A isomeria ocorre quando dentre
dois compostos temos a mesma
fórmula molecular, mas diferentes
estruturas
moleculares
e
propriedades.
No entanto, os isômeros não
atuam somente na indústria
alimentícia em gorduras, mas
também nos açúcares e em vários
outros setores como a indústria
farmacêutica,
de
fragrâncias
entre outras.
Figura 84: Talidoamida e seus isômeros S e R
Usamos os isômeros na indústria farmacêutica para conseguir um desejado
efeito ou efeito nenhum de um determinado medicamento como, por exemplo,
a talidomida, (C13H10N2O4) uma substância usualmente utilizada como
medicamento sedativo, antiinflamatório e hipnótico, é um derivado do ácido
glutâmico cuja estrutura possui dois anéis amida e um único centro quiral.
Este composto existe na forma dos isômeros S(-) e R(-) que se interconvertem
rapidamente em condições fisiológicas. O enantiômero S está relacionado com
os efeitos teratogênicos da talidomida enquanto que o enantiômero R é
responsável pelas propriedades sedativas da mesma.
~ 59 ~ (a) (b) Já as moléculas do limoneno, um
composto químico oleoso, que pode ser
encontrado nas cascas de frutas cítricas,
sobretudo de limões e laranjas, e de
alguns pinheiros, é volátil e incolor, o dlimoneno é considerado uma das fontes
mais puras de terpeno monocíclico.
Apresenta
isomeria
óptica
cujo
enantiômero S ocorre no fruto dos
Figura 85: Limoneno nas suas formas pinheiros e tem cheiro semelhante ao da
ópticas (a) é o (S) com odor de limão e o (b) terebintina, já o seu isômero R é o que
é o (R) com odor de laranja.
produz o odor das laranjas.
No tópico a seguir veremos como funciona na indústria a utilização dos
isômeros e sua importância no mundo químico e na saúde.
~ 60 ~ 4- OS ISÔMEROS E A INDÚSTRIA
A isomeria estuda as diferentes formas moleculares que um mesmo composto
pode ter, e por causa dessa diferença estrutural, esses compostos possuem
diferentes propriedades químicas.
Por serem muito estudados na química, os
isômeros passaram a ter grande influência no
ramo industrial, onde seus feitos apresentam
várias formas de aplicação em diversos tipos de
indústrias como na indústria alimentícia, usado
no processo de hidrogenação formando a
gordura trans.
Quem nunca ouviu falar de alimentos trans? Pois
é, o mercado alimentício hoje está voltado para
alimentos mais saudáveis que melhorem as
condições de vida bem como sua qualidade.
Figura 86: Manteiga, alimento rico em ácidos graxos.
Os alimentos trans são, portanto, nada mais que a composição dos
triacilgliceróis cujas moléculas são formadas do glicerol e ácidos graxos
podendo ser saturados ou insaturados, ou seja, são formados através de um
processo químico de hidrogenação, onde as moléculas de gorduras
“recebem” o hidrogênio sob altas temperaturas e pressão.
No entanto, essas gorduras trans são prejudiciais à saúde, pois contribuem
para formar as placas nas artérias aumentando assim, os riscos de um enfarte
ou derrames, além de contribuir para obesidade. Um exemplo comum e
bastante utilizado dessas gorduras são as margarinas. Sabendo disso, as
indústrias têm trabalhado no processo de alimentos livres de gorduras trans.
Figura 87: Reação de esterificação ~ 61 ~ Figura 88: Ácidos graxos
Para as gorduras trans, na parte química, as
moléculas têm os hidrogênios ligados aos
carbonos pela conformação Trans, já para a
forma Cis, a gordura é não saturada.
Em função da presença de uma
insaturação entre átomos de carbono, temse a possibilidade de ocorrência dos dois
isômeros geométricos: Cis e trans.
Em virtude da tensão provocada por dois
seguimentos volumosos presentes do
mesmo lado da ligação dupla, os
isômeros cis são
termodinamicamente
menos estáveis (Solomons e Fryhle, 2005).
Figura 89: Alimentos que contém ácidos graxos. Ácidos Graxos Trans:
Os isômeros trans de ácidos graxos na alimentação humana são encontrados
na maioria das vezes em frituras, no processo de hidrogenação de óleos e
vegetais entre outros.
Já nos alimentos vindos de animais mamíferos como os bovinos, temos os
ácidos graxos trans obtidos naturalmente através das carnes, leites e
derivados. (Wolff, 1994; Martin e cols., 2005)
Atualmente, os principais alimentos que contêm um significativo teor de ácidos
graxos trans são: sorvetes, chocolates diet., barras achocolatadas, salgadinhos
de pacote, bolos/tortas industrializados, biscoitos, bolachas com creme, frituras
comerciais, molhos prontos para salada, massas folhadas, produtos de
pastelaria, maionese, cobertura de açúcar cristalizado, pipoca de micro-
~ 62 ~ ondas, sopas enlatadas, margarinas, cremes vegetais, gorduras vegetais
hidrogenadas, pães e produtos de padarias e batatas fritas entre outros.
Hidrogenação de óleos vegetais:
Os ácidos graxos trans tem como principal fonte de obtenção a hidrogenação
parcial de óleos vegetais usados na produção de margarina e gordura
hidrogenada. Após a descoberta de que esses alimentos possuem efeitos
prejudiciais à saúde, principalmente o colesterol, a sua substituição por
gorduras vegetais hidrogenadas foi impulsionada.
Industrialmente, a hidrogenação é conduzida em tanques herméticos, nos
quais é feita a mistura do óleo com hidrogênio e um catalisador, geralmente
níquel finamente dividido, a temperaturas superiores a 180ºC, com pressões
entre 0,5 e 4 atm (Ribeiro e cols., 2007).
O mecanismo da reação tem início com a adsorção da molécula de hidrogênio na superfície do catalisador metálico, havendo o rompimento da
ligação entre os átomos de hidrogênio e a formação da ligação do
hidrogênio com o metal decorrente do emparelhamento do elétron do
hidrogênio com um elétron desemparelhado do catalisador metálico. A
molécula de triacilglicerol adsorve na superfície do catalisador mediante a
interação da ligação π com o catalisador metálico. Em seguida, ocorre a
transferência dos átomos de hidrogênio para a molécula orgânica com o
rompimento da ligação π e formação de uma ligação saturada entre átomos
de carbono. Por fim, tem-se a dessorção da molécula hidrogenada e a
liberação dos sítios metálicos para uma nova etapa de hidrogenação
(Solomons e Fryhle, 2005).
Isomerização de ácidos graxos Cis:
Nas condições da hidrogenação, em paralelo à adição de hidrogênio,
também ocorrem reações de isomerização das ligações duplas remanescentes. As reações de isomerização são de dois tipos: conversão cis-trans e
mudança de posição da ligação dupla ao longo da cadeia carbônica. Como
a isomerização de posição não altera o tipo de isômero geométrico, os
principais estudos reportam apenas a reação de formação dos isômeros trans.
Um provável modelo para que
ocorra a reação isomerização
durante
o
processo
de
hidrogenação, tem início na
ligação da molécula de ácido
insaturado à superfície do
catalisador por meio de sua
interação com a ligação π.
Figura 90: Reação de isomerização cis‐trans
~ 63 ~ Entretanto, essa interação não é estável e se o ácido se desligar antes da
adição de hidrogênio, tem-se a regeneração da ligação dupla. Todavia,
como a configuração trans é mais estável termodinamicamente, esse isômero
é formado preferencialmente frente à configuração cis (Doyle, 1997; Semma,
2002).
4.1- ISÔMEROS:
Os isômeros são compostos que possuem fórmulas moleculares iguais, mas
propriedades químicas diferentes devido às fórmulas estruturais diferentes.
Isômeros são compostos que sofrem isomeria. A palavra isômero vem do grego
(iso = igual, meros = partes).
A isomeria é bastante comum na química orgânica, podendo ser separada
em dois tipos fundamentais que são a isomeria de constituição e a
estereoisomeria.
~ 64 ~ Para um melhor entendimento desta divisão segue o seguinte fluxograma:
Figura 91: Classificação utilizada na isomeria
4.2- ISOMERIA PLANA:
Na isomeria plana, os isômeros diferem um dos outros, apenas pela fórmula
estrutural plana. Este tipo de isomeria pode ser dividido em cinco, veja:
I- Isomeria de constituição:
Os isômeros podem ocorrer dentro da mesma função ou entre funções
diferentes.
Diferente esqueleto
carbônico
Fórmula Molecular
C4 H10
Isômeros constitucionais
(n-butano)
e
Isobutano
~ 65 ~ Diferente
posição C3 H7 Cl
do grupo funcional
1-cloropropano
2-cloropropano
Diferente
funcional
grupo C6 H6 O
Álcool etílico
terdimetílico
II- Isomeria de posição:
Os isômeros pertencem à mesma função química e possuem a mesma cadeia
Tabela 11: Quadro com a classificação dos isômeros por grupo funciona
carbônica, diferenciando-se apenas pela posição de uma ramificação, de um
Figura 92:Exemplos de isômeros de posição: Cloropropano e metil‐fenol (fig. superior) e pentino (fig. Inferior)
grupo funcional, ou uma insaturação(ligações duplas, ou triplas).
Isomeria de constituição dentro da mesma função:
III-
Isomeria de cadeia ou núcleo:
~ 66 ~ Os isômeros pertencem à mesma função química, mas possuem cadeias
carbônicas diferentes.
Figura 93: Exemplos de isômeros de cadeia: butano (sem e com ramificação, fig. esquerda) e Penteno (cadeia aberta e fechada, fig. direita)
Isomeria de constituição entre funções diferentes:
IV-
Isomeria de função:
Os isômeros pertencem a funções químicas diferentes.
Figura 94: Exemplos de isômeros funcionais: Álcool e éter (fig. superior), Ácido Carboxílico e éster (fig. esquerda), Álcool e fenol (fig. direita)
Na figura 94, tanto o Penteno como o Ciclopentano são hidrocarbonetos,
confirmando a sua isomeria de cadeia.
~ 67 ~ Metameria ou isomeria de compensação:
Os isômeros pertencem à mesma função e apresentam a mesma cadeia
carbônica, mas apresentam diferença na posição do heteroátomo. A
metameria pode ser considerada um caso de isomeria de posição.
(Heteroátomo - átomo dentro da cadeia carbônica diferente do carbono.
São considerados heteroátomos: N, O, P, S.)
Figura 95: Isomeria de compensação entre: ésteres (fig. acima), aminas (fig. abaixo) V- Tautomeria:
É um caso especial de isomeria de função. A tautomeria acontece quando
ocorre um rearranjo de átomos ou grupo de átomos em uma molécula. Isso
ocorre como em uma reação, onde um composto se transforma em outro,
sendo mantido um equilíbrio.
Os principais casos da tautomeria (tautos = dois de si mesmo) envolvem
compostos hidrogenados.
Figura 96: Tautomeriaaldo ‐ enólica (fig.esquerda) e ceto ‐ enólica (fig. direita)
4.3- ISOMERIA ESPACIALOU ESTEREOISOMERIA: ~ 68 ~ Os isômeros espaciais possuem a mesma fórmula molecular e também a
mesma fórmula estrutural plana, diferenciando apenas nas fórmulas estruturais
espaciais.
Os isômeros espaciais podem ser divididos em geométricos e ópticos.
I- Isomeria geométrica (cis-trans ou Z-E):
Os isômeros são compostos que possuem a distribuição espacial diferente. Este
tipo de isomeria espacial ocorre, caso existam ligações duplas ou cadeia
fechada ou ainda, os ligantes estejam ligados a carbonos diferentes. Os
isômeros podem ser classificados como cis(Z) ou trans (E):
I.Cis(Z) -Do mesmo lado, juntos, no mesmo lado do plano de simetria.
II.Trans (E) -Em lados opostos do plano de simetria.
Os isômeros cis e trans possuem propriedades físicas diferentes, tais como,
ponto de fusão (PF), ponto de ebulição (PE) e densidade.
Figura 97: Isomeria cis‐trans do 1,2‐ dicloro etileno (fig. esquerda)e do 2‐buteno (fig. direita)
Figura 98: Isômeros cis‐trans do dibromo ‐ciclopropano
II- Isomeria óptica:
Diferente de todos os isômeros, os ópticos não possuem propriedades físicas
diferentes, tais como PF, PE e densidade. Apenas podemos diferenciá-los
~ 69 ~ quando eles estão frente a luz polarizada.Há três maneiras de uma molécula
ser assimétrica:
Possuindo carbono assimétrico (por definição, é o átomo de carbono que
possui 4 ligantes diferentes e que também pode receber o nome de carbono
quiral),
Possuindo um anel assimétrico ou sendo um derivado especial do propadieno.
Apresentando carbono assimétrico.
Os isômeros ópticos podem ser separados em dois grupos, os levógiros e os
dextrógiros.
Levógiros ("l" ou "-")
São os isômeros que desviam a luz polarizada para a esquerda.
Dextrogiros ("d" ou "+")
São os isômeros que desviam a luz polarizada para a direita.
Luz polarizada é um conjunto de ondas eletromagnéticas que se propagam
em apenas uma direção. Numa lâmpada incandescente a fonte de luz é não
polarizada, pois a luz é emitida em todas as direções. Para tornar esta luz
polarizada basta utilizar um polarizador, que terá a função de direcionar
apenas uma direção de luz.
Figura 99: Forma de propagação da luz não polarizada e luz polarizada Onde temos a seta de duas pontas significa que a propagação da onda
eletromagnética esta no formato de luz polarizada.
Os isômeros ópticos são compostos capazes de desviar a luz polarizada. Os
possíveis sinônimos para isômero óptico são: antípoda óptico, enantiômero e
enantiomorfo.
Caso o isômero óptico provoque o giro da luz polarizada para a direita, o
enantiômero é denominado Dextrógiro (D, +). Caso o enantiômero provoque o
giro da luz polarizada para a esquerda, o composto é denominado levógiro (L,
~ 70 ~ -).É necessário atenção, pois os enantiômeros não são superponíveis, assim o
levógiro não se superpõe ao dextrógiro.
Figura 100: Representação de isômeros ópticos refletidos como num espelho. O fato de um composto provocar o "giro" da luz polarizada, faz com que ele
possua atividade óptica. Atividade óptica só é possível em moléculas
assimétricas, ou seja, moléculas que possuem carbono quiral (ou
estereocentro).
Figura 101: Representação carbono quiral. O
carbono
quiral
marcado com um (*) e este possui todos os ligantes diferentes.
é
Os compostos enantioméricossão a imagem especular do outro, ou seja, um é
a imagem refletida do outro. No entanto, eles não são superponíveis. Como
suas mãos, direita e esquerda. Uma é a imagem da outra, mas não são
superponíveis.
Mistura racêmica:
É uma mistura de isômeros ópticos, ou seja, é
uma mistura de 50% de levógiro e 50% de
dextrógiro.
A quantidade de isômeros opticamente ativos,
pode ser dada a partir da quantidade de
carbonos quirais em uma molécula.
Figura 102: Dois estereocentros (carbonos quirais) ¾ IOA- isômero oticamente ativo
¾ IOA = 2n, sendo n o número de estereocentros.
~ 71 ~ Para a molécula da figura 102, temos:
¾ IOA = 22 = 4, 4 isômeros ópticos ativos
Curiosidades: AÇÚCAR INVERTIDO
Por que o termo “invertido” para este açúcar?
Já ouviu falar do açúcar invertido? Talvez nunca
tenha ouvido falar dele, mas com certeza já o
experimentou. Sabe aqueles deliciosos chocolates
com recheios cremosos?
Quando você os morde, o doce contido escorre
pela boca, temos aí o açúcar invertido. A
explicação para o termo se baseia na isomeria da
molécula.
Vejamos o modo de preparo deste açúcar:
Figura 103: Mistura água+açúcar
O açúcar comum, conhecido como sacarose, é composto de moléculas de
glicose e frutose. Se aquecermos o açúcar na presença de água ocorrerá a
reação química chamada hidrólise.
Equação do processo:
O procedimento provoca a quebra da sacarose em dois açúcares que
formam a sua molécula: glicose e frutose. Quando esta reação ocorre com a
adição de um ácido, surge uma espécie de xarope que foi batizado de
açúcar invertido. O termo "invertido" decorre de uma característica física da
sacarose: ela inverte o plano da luz polarizada quando submetida à análise
noaparelho polarímetro (aparelho óptico que permite identificar se
umasubstância possui poder rotatório e se é dextrógira ou levógira).
Análise de açúcar no polarímetro
O raio de luz polarizada que incide sobre o açúcar comum gira para a
direita, ou seja, a sacarose é originalmente uma molécula dextrógira (D,+).
Mas após o procedimento descrito, a luz incidente passa a ser desviada para
a esquerda, portanto o açúcar
invertido é levógiro
(L, -).
Utilização do açúcar invertido
~ 72 ~ Este açúcar é vastamente utilizado na fabricação de balas e biscoitos.
A aplicação em balas previne a cristalização do açúcar (fator desagradável
que dá ao produto a consistência arenosa e seca). A função do açúcar
invertido em biscoitos é proporcionar ao produto maciez e coloração
caramelada. (“Por Líria Alves, Graduada em Química, Equipe Brasil Escola,
JANEIRO 2012”)
~ 73 ~ EXERCICIOS RESOLVIDOS:
1-
O limoneno, de nomenclatura IUPAC 1-metil-4-isopropenilciclohex-1 eno, é um
hidrocarboneto cíclico insaturado que pertence à família dos terpenos. Tratase de um líquido incolor, volátil e oleoso naturalmente encontrado nas cascas
das frutas cítricas, sobretudo de limões e laranjas, e de alguns pinheiros. É,
inclusive, o responsável pelo forte odor característico dessas frutas. De forma
molecular C10H16, ele possui um centro quiral e seus dois isômeros ópticos são o
R-limoneno, que desvia a luz polarizada para a direita, e o S-limoneno, que
desvia a luz polarizada para a esquerda. É um terpeno relativamente estável,
resistente à hidrólise cujo universo de aplicações se expandiu bastante na
última década – sendo utilizado como solvente biodegradável, componente
aromático, na síntese de novos compostos etc.
Abaixo segue as seguintes estruturas moleculares dos isômeros do limoneno.
Com base no texto acima responda qual isomeria se refere esses isômeros e
cite exemplo de isômeros que tenha mesma isomeria do limoneno:
Figura 104: Isômeros do Limoneno
Solução:
Os isômeros do limoneno são do tipo estereoisomeros (Enantiômeros) e
possuem isomeria óptica. Possuem características semelhantes como P.F, P.E,
solubilidade em água, pressão de vapor e densidade, mas diferem na sua
estrutura.
Isomeria óptica estuda o comportamento das substâncias que têm a
propriedade de desviar o plano de vibração da luz, elas são, por isso,
denominadas de isômeros ópticos. No mesmo contexto, temos o conceito de
simetria, que define o comportamento de objetos frente ao espelho. Uma
~ 74 ~ estrutura para ser considerada simétrica precisa apresentar um plano de
simetria: quando colocada diante de um espelho reflete uma imagem
idêntica a ela.
Exemplos:
Figura 105: Isômeros ópticos do Ácido Lático Figura 106: Isômeros ópticos do Butanol Como podemos observar esses dois exemplos de isomeria óptica apresentam
apenas um carbono assimétrico na molécula, tendo então dois isômeros
opticamente ativos, um dextrógiro e outro levógiro.
2-
A hulha é uma variedade de carvão resultante da fossilização da madeira em
ausência de ar. A destilação da hulha produz três frações: fração gasosa, que
já foi muito usada como combustível doméstico e industrial (gás de rua), mas
que tem sido substituída pelo gás natural, menos poluente e hoje é usada
industrialmente como fonte de hidrogênio; fração líquida, constituída das
chamadas águas amoniacais (alto teor de NH3 e usada para a obtenção de
fertilizantes) e o alcatrão da hulha, maior fonte de produtos aromáticos e a
partir de sua destilação é possível obter várias frações de hidrocarbonetos
como, por exemplo, o benzeno, tolueno e os xilenos. Com base neste texto
responda a seguinte questão:
Os compostos aromáticos são obtidos industrialmente a partir do alcatrão da
hulha.Responda a que tipo de isômeros se refere os xilenos.
Solução:
~ 75 ~ Figura 107: Da esquerda para direita os compostos são respectivamente: orto‐xileno, meta‐xileno e para‐xileno. Os isômeros dos xilenos correspondem à isomeria plana do tipo de posição,
onde esta isomeria corresponde aos isômeros que pertencem à mesma
função química e possuem a mesma cadeia carbônica, diferenciando-se
apenas, pela posição de uma ramificação, de um grupo funcional, ou uma
insaturação (ligações duplas, ou triplas).
Para outro exemplo de isomeria de posição temos:
Figura 108Isomeria de posição para o álcool propílico Figura 109: Exemplo de isomeria de posição Na figura 110, os três compostos mostradossão três fenóis. Eles diferem na
posição de seus grupos ao longo do anel principal.
Figura 110: Isômeros de posição das moléculas presentes no cravo da índia (à esquerda) e na noz moscada (à direita) ~ 76 ~ Outro exemplo são essas duas moléculas na figura 110, que são
respectivamente conhecidas como cravo da índia e a noz moscada,
condimentos utilizados na culinária e que apresentam isomeria de posição,
pois as ligações duplas das duas moléculas se encontram em posições
diferentes na cadeia alifática.
~ 77 ~ CAPÍTULO5: Reações orgânicas.
Sabão: A reação que deu certo!
As reações estão presentes em todos os momentos
do dia- a dia, muitas das quais nem percebemos,
como o simples ato de cozinhar, cujo oxigênio do ar
é o responsável pela chama, até quando ligamos o
carro e o colocamos em movimento, através da
queima da gasolina.
Uma das reações que produz um produto muito
importante no nosso cotidiano e remota dos tempos
Figura 111: Sabão líquido de mais antigos desde antes de Cristo e cada vez mais
uso doméstico
vem sendo aprimorada é a reação de
saponificação. Através dela conseguimos obter o
sabão. Mas, como é feito o sabão?
Nos tempos remotos, o sabão era feito a partir da mistura
de cinza vegetal, rica em carbonato de potássio, e
gordura animal, após fazer essa mistura era preciso
esperar por um longo período para que eles reagissem
entre si e formassem o sabão.
Figura 112: Sabão em barra de uso doméstico
Hoje, essa prática está em desuso, o sabão é feito
através da saponificação cujo processo ocorre quando
um éster em solução aquosa de base inorgânica origina
um sal orgânico e álcool, ou seja, são sais de ácidos
carboxílicos de cadeia longa (os chamados ácidos
graxos).
Esses sais possuem caráter misto, em termos de solubilidade em água: por
possuírem cadeia hidrocarbônica longa, esta tende a ser insolúvel em água,
mas capaz de interagir com espécies apolares, como gorduras e outras que
denominamos comumente sujeira.
Por outro lado, possuem também uma região polar, que é o grupamento
ácido carboxílico ionizado (carboxilato), capaz de interagir com moléculas de
água. Assim, as moléculas de sabão podem interagir tanto com água como
com gorduras, levando à dispersão destas naquele solvente, ou seja,
proporcionando aquilo que chamamos limpeza. Cuja reação segue abaixo:
ÓLEO OU GORDURA + BASE
SABÃO + GLICEROL
~ 78 ~ Portanto neste capítulo iremos aprender sobre as reações orgânicas e seus
principais tipos aplicados a indústria.
No tópico a seguir, iremos conhecer como o sabão é formado, quais os tipos
das reações e produtos obtidos no processo e como uma técnica milenar deu
tão certo até os dias de hoje.
5- SAPONIFICAÇÃO: A REAÇÃO DO
SABÃO.
Considerada uma das atividades industriais mais antigas da civilização, a
fabricação de sabão tem como origem um período anterior ao século XXV
a.C.. Esse processo era feito misturando dois ingredientes: cinza vegetal, rica
em carbonato de potássio, e gordura animal. Então, era esperar por um longo
tempo até que eles reagissem entre si. Atualmente o sabão é obtido de
gorduras (de boi, de porco, de carneiro, etc.) ou de óleos (de algodão, de
vários tipo de palmeiras) e NaOH.
Hoje esse processo é chamado de saponificação, que nada mais é quando
um éster em solução aquosa de base inorgânica origina um sal orgânico e
álcool.
Os sabões são um tipo de detergente simples, que compreendem todos os sais
de ácidos gordurosos, eles podem ser divididos em sabão duro ou sódicos e
moles ou potássicos, já os detergentes são produtos sintéticos também
conhecidos como surfactantes, são destinados a retirar os detritos de
superfícies solidas lisas ou porosas.
SABÕES E DETERGENTES - ESTRUTURAS E PROPRIEDADES
Uma aplicação muito importante dos ácidos carboxílicos é na fabricação dos
sabões. Mas o que é um sabão?
~ 79 ~ Figura 113: Estrutura de um sal de ácidos carboxílicos, mostrando seu caráter misto Sabões são sais de ácidos carboxílicos de
cadeia longa (os chamados ácidos
graxos).
Esses sais possuem caráter misto, em
termos de solubilidade em água: por
possuírem cadeia hidrocarbônica longa,
esta tende a ser insolúvel em água, mas é
capaz de interagir com espécies
apolares, como gorduras e outras que
denominamos comumente de sujeira.
Figura 114: Esquema de uma micela
Por outro lado, possuem também uma
região polar, que é o grupamento ácido
carboxílico ionizado (carboxilato), capaz
de interagir com moléculas de água.
Assim, as moléculas de sabão podem
interagir tanto com água como com
gorduras, levando à dispersão destas
naquele
solvente,
ou
seja,
proporcionando
aquilo
que
chamamos limpeza.
Os sabões, uma vez em solução aquosa,
formam as chamadas micelas. Micelas
são estruturas em que várias moléculas de
sabão se agregam, formando uma
estrutura esférica.
Figura 115: Esquema de ação do sabão contra a gordura nos tecidos E os sabonetes? Sabonetes são sabões que tiveram seu pH ajustado ao pH da
pele, para não agredi-la, aos quais se adicionam perfume, corante e outros
aditivos, como creme hidratante ou glicerina.
Enquanto sabões são sais de ácidos carboxílicos, detergentes são sais de
ácidos sulfônicos. Enquanto os sais de ácidos carboxílicos com íons divalentes
e trivalentes (Ca2+ e Fe3+, por exemplo) são insolúveis em água, os sais de
ácidos sulfônicos desses mesmos íons são solúveis.
~ 80 ~ Assim, os detergentes são capazes
de
produzir
espuma
mesmo
empregando-se águas duras, isto é,
águas ricas em íons metálicos como
cálcio, magnésio e ferro.
Figura 116: Emulsificação da gordura pelo ânion tensoativo do sabão
Os detergentes, ao contrário dos
sabões, são de origem sintética.
Muitos
detergentes
causam
problemas ambientais, ao serem
lançados em cursos de rios, levando
à formação de espumas.
Assim, é importante que aja tratamento de resíduos de indústrias, de forma a
diminuir a degradação do meio ambiente. Também é importante o uso de
detergentes biodegradáveis, que são sais dealquilbenzenosulfonatos lineares.
Os microrganismos presentes no ambiente são capazes de oxidar essas
cadeias lineares, ou seja, promovem a biodegradação desses detergentes,
enquanto os de cadeia ramificada não são oxidados, permanecendo no
ambiente e contaminando-o.
Sabões e detergentes são denominados tensoativos aniônicos, porque em
ambos o grupo polar é um ânion (carboxilato ou sulfonato). Existem outros
tipos de tensoativos: os catiônicos, que possuem como grupo polar um
nitrogênio quaternário (sal de amônio quaternário), os anfóteros ou betaínicos,
que possuem dois grupos ionizados – um aniônico e outro catiônico –, e os
não-iônicos, que são poliálcoois, como os polietilenos glicóis (PEG). (Adaptado
de A química e os sentidos I – paladar e olfato, acessado em janeiro, 2012).
SAPONIFICAÇÃO, REAÇÃO QUIMICA PARA OBTENÇÃO DO SABÃO:
Como sabemos, os óleos e as gorduras são ésteres que sofrem reação de
hidrólise ácida ou básica. A hidrólise ácida irá produzir apenas glicerol e ácidos
graxos constituintes. Já na hidrólise básica, temos o glicerol e os sais dos ácidos
graxos.
~ 81 ~ Figura 117: Reação de saponificação Deste modo, quando a gordura é aquecida em presença de base, temos
uma reação química que irá produzir sabão. Essa reação, a hidrólise básica de
um triéster de ácidos graxos e glicerol, são chamados de saponificação.
Resumindo temos:
ÓLEO OU GORDURA + BASE →SABÃO + GLICEROL A GLICERINA:
A glicerina (ou glicerol) é um subproduto da fabricação do sabão. Por esse
motivo toda fábrica de sabão também pode vender glicerina. Ela é
adicionada aos cremes de beleza e sabonetes, pois é um bom umectante,
isto é, mantém a umidade da pele. Em produtos alimentícios, ela também é
adicionada com a finalidade de manter a umidade do produto e aparece no
rótulo com o código "umectante U. I.".
Outra aplicação da glicerina é na fabricação do explosivo conhecido
como nitroglicerina
Figura 118: Reação de formação da nitroglicerina ~ 82 ~ Não estranhe se chamamos a nitroglicerina de éster, pois ela é formada pela
reação de um ácido (HNO3) e um álcool (a glicerina). Trata-se de um éster
derivado de um ácido inorgânico.
A seguir temos os fluxogramas das indústrias de sabões e detergentes
respectivamente:
Figura 119: Fluxograma de uma indústria de sabão
~ 83 ~ Figura 120: Fluxograma de uma indústria de detergentes
5.1- REAÇÕES ORGÂNICAS: Classificações e principais tipos,
casos especiais
Na natureza existem milhares de substâncias que podem provocar reações há
quase todo instante, por isso neste capítulo vamos estudar o comportamento
e classificação das reações orgânicas.
As reações químicas são processos que transformam reagentes em produtos e
esse processo pode ocorrer espontaneamente como também através de
certas circunstâncias como através de calor, presença de luz ou também por
acontecimentos externos como mudança de cor, luz entre outras.
As mais importantes reações orgânicas são as seguintes:
¾
¾
¾
¾
Reação de adição
Reação de substituição
Reação de oxidação
Reação de eliminação
~ 84 ~ TIPOS DE REAÇÕES:
5.1.1- REAÇÃO DE SUBSTITUIÇÃO:
São aquelas onde um átomo ou um grupo de átomos de uma molécula
orgânica é substituído por outro átomo ou grupo de átomos.
As principais reações de substituição são:
¾ Halogenação
¾ Nitração
¾ Sulfonação
Exemplo:
I- SUBSTITUIÇÃO EM ALCANOS:
Halogenação:
Os alcanos podem ser transformados em haletos de alquila.
Exemplo:
Com o excesso de halogênio (realizando sucessivas halogenações), podemos
obter a partir do metano, catalisadas por luz e calor:
Onde temos:
CH4
CH3Cl
CH2Cl2
CHCl3
CCl4
Metano
Cloro metano
Diclorometano Triclorometano Tetracloreto
ou clorofórmio de carbono
Tabela 12: Para dirigentes mais comuns
Quando essas reações ocorrem, chamamos de REAÇÂO EM CADEIA. A ordem
como composto perde o hidrogênio com facilidade é:
CTERCIÁRIO > CSECUNDÁRIO> CPRIMÁRIO
~ 85 ~ Nitração:
É a reação de um hidrocarboneto com o acido nítrico. (HNO3 = HONO2)
Exemplo: Nitrometano
Sulfonação:
É a reação de um hidrocarboneto com o acido sulfúrico. (H2SO4 ou HOSO3H).
Exemplo:
Ac. etano sulfúrico
Monocloramina: NH4+(aq) + HOCl(aq)
NH2Cl(aq) + H2O(l) + H+(aq)
Dicloramina: NH2Cl(aq) + HOCl(aq)
NHCl2(aq) + H2O(l)
Tricloramina: NHCl2(aq) + HOCl(aq)
NCl3(aq) + H2O(l)
A formação dos três tipos de cloraminas é dependente da relação
cloro/nitrogênio, do pH, da temperatura e do tempo de reação, sendo que a
diminuição do pH e o aumento da relação cloro/nitrogênio favorece a
formação de produtos mais clorados. Em pH 8,5, a monocloramina encontrase em maior quantidade. Em pH 4,4, virtualmente toda cloramina se encontra
na forma de tricloramina, cuja presença é responsável, em parte, pelo odor e
gosto desagradáveis na água.
Para a aplicação das cloraminas como desinfetantes primários em uma
estação de tratamento de água, o amônio e o cloro são adicionados à água
simultaneamente ou em sucessões próximas.
II- SUBSTITUIÇÃO EM AROMÁTICOS:
Halogenação: (Cl2 ou Br2)
Exemplo:
~ 86 ~ Também é possível observar uma aplicação dos halogênios nas
Cloraminasque é uma classe de desinfetantes alternativos usados no
tratamento desinfetante das águas, obtidas a partir da reação do cloro
residual com a amônia. Podem-se formar três tipos de cloraminas, a partir das
reações seqüenciais ilustradas a seguir.
Nitração: Sulfonação:
Alquilação De Friedel-Crafts:
Reações que ocorrem envolvendo hidrocarbonetos aromáticos e haletos
orgânicos.
Exemplo: ~ 87 ~ Radicais Dirigentes
As posições 1,2; 1,3; 1,4 nos compostos aromáticos são chamadas,
respectivamente, de posições orto, meta, para.
Quando um radical estiver ligado ao anel benzenico ou a um grupo funcional,
estes dirigirão a substituição e serão denominados radicais dirigentes.
5.1.2- REAÇÕES DE ADIÇÃO:
Quando uma ou mais substâncias se juntam e formam um produto. A
molécula se torna mais saturada. São caracterizadas pela quebra das
ligações duplas e triplas. Nos hidrocarbonetos insaturados, a quebra ocorre na
ligação mais fraca (ligação π) e ocorre a formação de duas novas ligações
(ligações δ).
As principais reações de adição são:
¾
¾
¾
¾
¾
Hidrogenação catalítica
Halogenação
Adição de HX
Adição de água
Adição a aromático
Exemplo:
1,2- Dicloroetano
REGRA DE MARKOVNIKOV:
O hidrogênio do haleto ou da água liga-se ao átomo de carbono mais
hidrogenado da dupla ligação, ou seja, ao carbono que possui mais ligações
~ 88 ~ com o hidrogênio. Esta regra é geralmente usada quando o reagente é
HX(HCl, HBr, HI) e H2O.
Exemplo:
2- Cloro propano
O hidrogênio se liga ao carbono da dupla ou tripla mais hidrogenada.
PRINCIPAIS REAÇÕES DE ADIÇÃO:
I- HIDROGENAÇÃO CATALÍTICA: (ADIÇÃO DE H2)
Ocorre em alcenos e alcinos. Essa reação ocorre com a ajuda de um
catalisador para adicionar o gás hidrogênio. Pode ser usado o metal níquel
(Ni) ou platina (Pt).
Essa reação é usada na indústria de alimentos como base na produção de
margarinas a partir de vegetais. Os óleos vegetais possuem ligações duplas. A
reação de adição, hidrogenação catalítica transforma esses óleos, que são
líquidos em gorduras, que são sólidas.
Exemplo:
Eteno
Etano
Etino
Eteno
II- HALOGENAÇÃO: (ADIÇÃO DE Cl2 OU Br2)
Adiciona-se halogênio (Cl2 e Br2) a um alceno ou alcadieno.
Exemplo:
Eteno
1,2- Dibromoetano
~ 89 ~ Propadieno
2,3- Dibromopropeno
III- ADIÇÃO DE HX: (HCL, HBR, HI)
Esta reação é feita adicionando HX aos alcenos. Onde X é o halogênio.
Exemplo:
Etino
Cloroeteno (Cloreto de vinila)
Em alguns casos, obtemos dois produtos. O “teoricamente” esperado deve
seguir a Regra de Markovnikov.
IV‐ HIDRATAÇÃO: (ADIÇÃO DE H2O) Ocorre de maneira semelhante com a reação de adição de HX.
É uma reação catalisada por ácido e também segue a regra de Markovnikov.
O hidrogênio entra no carbono mais hidrogenado e a hidroxila no carbono
menos hidrogenado. Formam como produto, álcool primário e secundário.
Exemplo:
Eteno
Etanol (Álcool Primário)
V- ADIÇÃO DE AROMÁTICO:
Os aromáticos sofrem reações de substituição, porém em alguns casos ocorre
uma adição. Quando há hidrogenação total do anel benzênico, a reação é
de adição. Esta reação não é tão fácil de ser feita.
Exemplo:
Benzeno Hexaclorocicloexano (BHC-Inseticida)
5.1.3- REAÇÕES DE COMBUSTÃO:
Reação que libera calor ocorre formação de gás carbônico e água.
Exemplo:
Combustão completa:
~ 90 ~ Combustão incompleta:
Combustão incompleta:
5.1.4- REAÇÕES DE ESTERIFICAÇÃO
Reação reversível de álcool junto com um ácido orgânico ou inorgânico,
produzindo éster e água. Quando areação é inversa, ela é denominada
hidrólise do éster.
Exemplo:
Ácido Etanóico
Ou Acido Acético
Etanoato de Metila
ou Acetato de Metila 5.2- SAPONIFICAÇÃO:
Ocorre quando um éster em solução aquosa de base inorgânica origina um
sal orgânico e álcool. Portanto o sabão nada mais é do que um sal “do bom”.
Exemplo:
Utilizando como exemplo a reação da figura 117, nela ocorre uma hidrólise
alcalina de um óleo (glicerol). Dizemos que é uma hidrólise em razão da
presença de água (H2O) e que é alcalina pela presença da base NaOH (soda
cáustica).
~ 91 ~ ¾ Sabão é um sal de ácido graxo, isto é, um sal de ácido carboxílico de
cadeia longa.
¾ A utilização de NaOH irá originar sabão duro, e quando utilizarmos KOH,
obteremos sabão mole.
¾ Sabões e detergentes são agentes emulsificantes. Geralmente, o nome
detergente é reservado para ácidos sulfônicos e seus derivados.
5.3- DETERGENTES:
Também conhecidos como surfactantes, os detergentes são, assim como os
sabões, substâncias que reduzem atensão superficial de um líquido, sendo
estes compostos também, considerados tensoativos. Eles são formados por
moléculas anfipáticas, ou seja, são moléculas que apresentam uma cadeia
polar e outra apolar, por apresentarem essa propriedade hidrofílica, na prática
elas são responsáveis por eliminar quimicamente a gordura ou impurezas
orgânicas.
No exemplo a seguir vemos um tipo de detergente obtido da conversão dos
álcoois de C12 a C18 em sais de hidrogenosulfato de alquila.
Neste exemplo é possível ver que a cadeia alquílica é a parte apolar e a
“cabeça” da cadeia –OSO3- Na+é a parte polar.
Álcool Laurílico
Hidrogenosulfato de LaurilaSulfato Lauril de Sódio
CURIOSIDADES: Saiba o que é Saponificação Cadavérica
Aargh! É nojento, mas é verdade. Quando uma pessoa morre, seu corpo
pode, através de processos naturais, apodrecer e ter sua carne consumida
pela "flora cadavérica" até se tornar um esqueleto; mumificar-se pela ação
físico-química do ambiente ou se transformar simplesmente em sabão por
ações físico-químicas.
~ 92 ~ Corpo em estado de Saponificação.
Este processo pelo qual um corpo se transforma numa
espécie
de
sabão
é
chamado
de
saponificaçãocadavérica.
Consiste na transformação da gordura dos tecidos em
adipocera - substância amarelo-clara, semelhante à cera
ou queijo, com um odor rançoso e desagradável.
Os lipídeos são transformados em sabão e o corpo
transforma-se numa massa pastosa e, em muitos casos,
sem forma. Há uma transformação gordurosa e calcária
do
cadáver.
O processo ocorre devido às circunstâncias que são
intrínsecas ao cadáver e principalmente ao meio onde
este permanece.
Como condições individuais, temos: a idade (facilidade
nas crianças); obesidade; causa mortis (intoxicações pelo
álcool e pelo fósforo facilitam). E como condições
ambientais têm: local úmido ou meio semi-líquido, com
água que escoa e se renova, e solo argiloso que retém a
água, ambos ricos em sais de cálcio.
Figura 121:Corpo saponificado pela formação da adipocera
Dessa forma, transforma o terreno ao redor da cova numa espécie de tanque
de conservação.
A adipocera transforma quimicamente todos os tecidos do cadáver,
conservando este sua forma com as feições como se tivesse acabado de
morrer. A pele é pouco alterada. As gorduras se transformam em glicerinas e
ácidos graxos, estes por sua vez, se combinam com álcalis (bases) originando
sabões amoniacais e alcalinos terrosos. Posteriormente estes se transformam
em sabões calcários, por ação dos sais da água, adquirindo o cadáver uma
maior resistência à decomposição.
A adipocera começa cerca de 1 mês de permanência do corpo na água; é
visível e franca na face aos 3 meses. A transformação completa requer cerca
de 1 ano. No início do processo ainda é possível reconhecer os diversos
órgãos, depois todos são idênticos.
SAPONIFICAÇÃO RETARDA ROTATIVIDADE EM CEMITÉRIOS EM BELÉM DO PARÁ
Um estudo coordenado pela professora Lúcia Maria da Costa e Silva, em 1996,
comprovou que o cemitério do Benguí, em Belém, estava contaminando o
~ 93 ~ fluxo de água subterrânea que segue para a área residencial vizinha. A
pesquisa, junto com a análise da água, motivou o fechamento do cemitério.
Os cemitérios públicos de Belém, como o do Benguí e o do Tapanã, foram
implantados dentro do conceito de rotatividade. Periodicamente, a Prefeitura
realiza a exumação observando o tempo de inumação – sete anos para
homens e três para crianças até sete anos – período em que o processo de
putrefação já teria cumprido suas quatro fases. No entanto, pesquisadores da
Faculdade de Geofísica da UFPA comprovaram um fenômeno no cemitério
do Benguí: a saponificação dos corpos, interrompendo qualquer um dos
quatro estágios da putrefação, postergando-o e, conseqüentemente,
retardando em vários anos qualquer tentativa de exumação.
Lúcia Costa e Silva observa que a legislação municipal, baseada em normas
do período colonial, está em flagrante oposição à realidade amazônica e
que, em outros países, onde a ocorrência da saponificação é remota, a
exumação só é realizada após 25 anos. O cemitério do Benguí foi desativado
em 1997. Ocupando uma área de 450x600 m², que é absolutamente imprópria
para abrigar um cemitério, porque o nível hidrostático é inferior a 1,20m no
inverno, ou seja, a água entra nas sepulturas, caso não reportado na literatura,
diz a professora. O que mais surpreendeu os pesquisadores da área de
geofísica da UFPA é que o fenômeno da saponificação não está restrito ao
baixo terreno do cemitério desativado. Também no Tapanã, edificado sobre
um terreno alto, com nível hidrostático em torno de 7,5 metros, os estudos
registraram o fenômeno.
No Benguí, a exumação e a limpeza da área são necessárias para eliminar a
contaminação e para uma futura reutilização com outra finalidade. Quanto
ao Tapanã, a exumação é parte do processo de rotatividade, liberando
sepulturas para novos enterramentos. Diferentemente da situação extrema do
Benguí, o Tapanã, aparentemente, apresenta condições ideais para abrigar
um cemitério, mas a análise da subsuperfície apresentou uma característica
típica da Amazônia: a presença excessiva de argila. Impermeável, ela retém a
água da chuva, formando um grande bolsão de lama em torno do cadáver,
cujo desenvolvimento, durante vários meses, foi monitorado pelos
pesquisadores com instrumentação sofisticada. É essa lama a responsável pela
saponificação.
Os coveiros do cemitério informaram aos pesquisadores que a saponificação
está impedindo a realização de exumações periódicas. A situação tende ao
agravamento, pois o cemitério já enfrenta problemas de superlotação, que
motivaram o uso das passarelas de terra para sepultamentos, bem como a
construção de um novo ossuário, eliminando, assim, o depósito num dos
banheiros. A porção final do cemitério, por sua vez, não pode ser ocupada,
porque o lençol de água subterrânea está muito próximo da superfície.
“Nossos estudos mostram que a saponificação é freqüente. Isso vale para a
~ 94 ~ Amazônia inteira. A solução mais viável é o forno crematório”, alerta Lúcia
Costa e Silva, diante da proposta da Prefeitura de construir um cemitério
vertical.
Comparando os dois tipos, a pesquisadora ressalta que a cremação é rápida,
eficiente, agride menos o ambiente e precisa, apenas, de um bom dispositivo
para filtrar odores, enquanto o cemitério vertical requer tratamento de gases e
líquidos produzidos. Pesquisa de opinião realizada pelos pesquisadores mostra
que, ao contrário do que muitos podem pensar, a cremação é aceita pela
população. O Pará é o único Estado brasileiro com dois crematórios
particulares. Em muitos países, há centenas de crematórios, caso dos EUA,
Japão e Alemanha, entre outros. (Texto adaptado de Marcelo Aviz, ilustrações
e CIA, acessado em Janeiro, 2012, http://marceloaviz.blogspot.com/)
~ 95 ~ EXERCÍCIOS RESOLVIDOS:
1-
Quando um éster em solução aquosa de base inorgânica origina um sal
orgânico e álcool, temos a reação de saponificação.
Na reação de saponificação
, Os produtos X e Y são:
a) álcool etílico e proprionato de sódio.
b) ácido acético e propóxido de sódio.
c) acetato de sódio e álcool propílico.
d) etóxido de sódio e ácido propanóico.
e) ácido acético e álcool propílico
Solução:
Resposta letra C. Sabemos que toda reação de saponificação produz um
sabão mais glicerol que são respectivamente um sal de ácido graxo, isto é, um
sal de ácido carboxílico de cadeia longa, e um composto orgânico
pertencente a função álcool, conhecido também como 1,2,3 propanotriol.
Como foi utilizado NaOH, o sabão originado será do tipo duro, se o KOH tivesse
sido usado, o sabão seria do tipo mole.
ÓLEO OU GORDURA + BASE
2-
SABÃO + GLICEROL
O rum é uma bebida alcoólica obtida a partir da fermentação do melaço e
outros derivados da produção de açúcar, além do caldo de cana
fermentado e posterior destilação. O rum é uma bebida secular, de
características refinadas e aroma suave.
O Rum pode ser obtido de duas maneiras: a agrícola e a industrial. Em ambas
o resultado é uma bebida cristalina, que pode se tornar amarelada por meio
~ 96 ~ de envelhecimento em barris de carvalho ou pela adição de corante
caramelo.
O éster responsável pelo aroma do rum tem a seguinte fórmula estrutural:
Figura 122: Éster que dá o aroma do rum a) Escreva a reação química completa que permite obter o éster descrito
acima.
b) Escreva o nome do éster representado na figura acima.
Solução:
a) álcool isobutílico + ácido acético → água + acetato de isobutila
b) etanoato de isobutila ou acetato de isobutila
A reação de esterificação se dá quando uma reação reversível de álcool
junto com um ácido orgânico ou inorgânico, produzindo éster e água. Já
quando areação é inversa, ela é denominada hidrólise do éster.
ÁCIDO + ÁLCOOL
ÉSTER + ÁGUA
3-
esterificação
hidrólise
ÉSTER + ÁGUA
ÁCIDO + ÁLCOOL
(VUNESP) Um álcool pode ser obtido pela reação entre um alceno e ácido
sulfúrico, num processo de duas etapas.
A primeira etapa envolve um ataque de íons H+ à dupla ligação do alceno,
ocorrendo sua adição ao átomo de carbono mais hidrogenado (Regra de
Markovnikov).
A segunda etapa envolve a reação de hidrólise do composto formado na
primeira etapa, obtendo-se o álcool correspondente e regenerando o ácido
sulfúrico.
Escreva:
a) as equações balanceadas das duas etapas da reação, quando o alceno
utilizado é o propeno;
~ 97 ~ b) o nome e a fórmula estrutural do álcool obtido no processo.
Solução:
a) Pela regra de Markovnikov O hidrogênio do haleto ou da água liga-se ao
átomo de carbono mais hidrogenado da dupla ligação, ou seja, ao carbono
que possui mais ligações com o hidrogênio, ou seja, O hidrogênio se liga ao
carbono da dupla ou tripla mais hidrogenada.
A reação de hidrólise é uma reação catalisada por ácido e também segue a
regra de Markovnikov. O hidrogênio entra no carbono mais hidrogenado e a
hidroxila no carbono menos hidrogenado. Formam como produto, álcool
primário e secundário.
1º Etapa:
2º Etapa:
b) Como produto da 2º etapa temos como composto o álcool secundário 2Propanol.
Figura 123: Estrutura do álcool isopropílico ~ 98 ~ REFERÊNCIAS BIBLIOGRÁFICAS
SOLOMONS, T. W. Graham; FRYHLE, Craig B. Química Orgânica, V. 2 8ª ed. Rio
de Janeiro, LTC, 2006.
SHRIVER, D. F.; ATKINS, P. W. Química Inorgânica. Porto Alegre, Bookman, 2003.
RUSSEL, John. Química Geral. V.1. 2ª ed. São Paulo, MAKRON, 1994
RUSSEL, John. Química Geral. V.2. 2ª ed. São Paulo, MAKRON, 1994.
Bruice. P. Y. Química Orgânica - volume 1. 4ª. Ed. - Rio de Janeiro: Pearson /
Prentice Hall.
Shreve, R. Norris. E Jr, Joseph A. Brink. Indústrias de Processos Químicos. 4ª
Edição. Editora Guanabara Koogan S.A. Rio de Janeiro, 1997.
NewsComex - Comércio Exterior e Logístico. Petrobras espera dobrar produção
de
gás
natural.
Disponível
em:
http://www.newscomex.com.br/mostra_noticia.php?codigo=16396>
acesso
em 12/02/12
CALFO, Jorge. O Gás Natural, capitulo 1: Tecnologia d eProcessamento e gás
natural. Disponível em: http://www.slideshare.net/jorgecalfo/o-gas-naturalcapitulo-i-6116235> acesso em 13/02/12
Cesnors, Ufsm. Bioquímica: Glicídios/ Carboidratos. Disponível em:
http://www.cesnors.ufsm.br/professores/adrisalamoni/todos-materiais-ate-022011/Bioquimica%20de%20carboidratos.pdf> acesso em 20/02/12
Silva, Erivanildo e Guimarães, Ricardo. Isômeros de constituição e
estereoisômeros. Disponível em:
http://educacao.uol.com.br/quimica/isomeria.jhtm> acesso em 23/02/12
Peruzzo, Francisco e Canto, Eduardo. Química na abordagem do cotidiano.
Editora Moderna (2003). Disponível em:
http://quimicasemsegredos.com/documents/Teoria/Saboes-eDetergentes.pdf> acesso em 03/03/12
~ 99 ~ GLOSSÁRIO:
CAMPO PETROLÍFERO: Área onde foi comprovada a existência de depósitos
produtivos de petróleo: assim, "poço" pode ser no terreno da produção de
petróleo, uma região com uma abundância de poços de petróleo extraindo
óleo bruto (dito também "cru") do solo abaixo.
CATALISADOR: Um catalisador é tudo aquilo que facilita reações químicas sem
nelas
participar,
como
enzimas
ou
sais
minerais
ionizados
Um catalisador é uma substância que afeta a velocidade de uma reação,
mas emerge do processo inalterado. Um catalisador normalmente muda a
velocidade de reação, promovendo um caminho molecular diferente
(mecanismo) para a reação. Por exemplo, hidrogênio e oxigênio gasosos são
virtualmente inertes à temperatura ambiente, mas reagem rapidamente
quando expostos à platina, que por sua vez é o catalisador da reação.
Catálise é a ocorrência e uso de catalisadores e processos catalíticos.
Catalisadores químicos comerciais são extremamente importantes.
Aproximadamente um terço de todo material do produto nacional bruto dos
Estados Unidos envolve um processo catalítico em alguma etapa entre a
matéria-prima e os produtos acabados. Como um catalisador torna possível a
obtenção de um produto final por um caminho diferente (por exemplo, uma
barreira de energia mais barata), ele pode afetar tanto o rendimento quanto
a seletividade.
CÉLULA GALVÂNICA: Pilha elétrica,célula galvânica,pilha galvânicaou
aindapilha voltaicaé um dispositivo que utiliza reações de óxido-redução para
converterenergia químicaemenergia elétrica
CRAQUEAMENTO TÉRMICO:O craqueamento térmico ou pirólise é processo que
provoca a quebra de moléculas por aquecimento a altas temperaturas, isto é,
pelo aquecimento da substância na ausência de ar ou oxigênio a
temperaturas superiores a 450°C, formando uma mistura de compostos
químicos com propriedades muito semelhantes às do diesel de petróleo. Em
algumas situações esse processo é auxiliado por um catalisador para a quebra
das ligações químicas, de modo a gerar moléculas menores. O texto acima é
apenas uma breve introdução.
DESSORÇÃO DA MOLÉCULA:É o processo inverso da sorção, que é a ação
tanto de absorção e adsorção, respectivamente; o efeito de gases e/ou
líquidos serem incorporados num material de um estado diferente, chamado
sorvente, seja em sua porosidade interna, seja como película, partículas ou
mesmo moléculas à superfície da substância, dita conforme o
caso, absorvente ou adsorvente. A substância absorvida ou adsorvida,
genericamente, é chamada de sorvato, e conforme o processo, absorvato ou
adsorvato.
~ 100 ~ DESTILAÇÃO FRACIONADA: Método utilizado para separar misturas
homogêneas, do tipo líquido – líquido. Exemplo de mistura deste tipo é o
petróleo, ou uma simples mistura de água e álcool, que será demonstrada a
seguir. Na destilação fracionada os líquidos são separados através de seus
pontos de ebulição, desde que eles não sejam muito próximos. Durante o
aquecimento da mistura, é separado, primeiramente o líquido de menor P.E (
ponto de ebulição ) , depois o líquido de P.E intermediário e sucessivamente
até o líquido de P.E maior .
EFEITO DE RESSONÂNCIA: Algumas espécies químicas não são representadas
por apenas uma estrutura de Lewis simplesmente por aquela não ser a real. É
dito que, se mais de um arranjo for necessário para descrever a real estrutura
de uma espécie, tem-se o efeito mesomérico ou ressonância.
ELETRODO DE SACRIFÍCIO: É um metal que é colocado próximo a outro para
que sofra corrosão no lugar do metal que deve proteger. Exemplo: em
oleodutos (feitos de aço) de distancia em distancia acrescenta-se magnésio
metálico, ligado ao tubo por fios condutores. Quando o ferro do duto for
oxidado, tiver que doar elétrons, o magnésio faz isto por ele.
ELETRÓLITO: é toda a substância que, dissociada ou ionizada, origina íons positivos (cátions) e íons negativos (ânions), pela adição de um solvente ou
aquecimento.
ÉLETRON DESEMPARELHADO: São elétrons que estão sozinhos em um
determinado orbital, de modo que seu campo magnético não é anulado,
então substâncias que tem esses elétrons desemparelhados geralmente são
atraídas por imãs.
FIO DE COBRE: Cobre --- o "Metal Vermelho” --- é um elemento natural. Suas
características únicas o tornam um material altamente valorizado para a
produção de fio para fins de utilidade, bijuteria e até mesmo a pesca em
águas profundas.
GEOFÍSICA: É a ciência que estuda a estrutura, a composição, as
propriedades físicas e os processos dinâmicos da Terra. O geofísico investiga os
fenômenos elétricos, térmicos, magnéticos, gravitacionais e sísmicos do
planeta. Com instrumentos especiais e leis da matemática, da física e da
química, ele mede as forças que afetam a superfície, o subsolo e a atmosfera
terrestre. Observa e calcula os movimentos do solo e do subsolo e pesquisa a
origem e a atividade dos vulcões, a curvatura do planeta e outras
características geofísicas do globo. Detecta e mede a intensidade de
terremotos e maremotos, investiga a estrutura das formações rochosas e as
propriedades físico-químicas dos mares. Antes da construção de grandes
obras, como represas, estradas e túneis, avalia a estabilidade do solo e
localiza lençóis de água e jazidas minerais. Pode trabalhar também na
prospecção de petróleo.
~ 101 ~ GLP: O gás de petróleo liquefeito (GPL), também chamado de gás liquefeito
de petróleo(GLP), é uma mistura de gases de hidrocarbonetos utilizado como
combustível em aplicações de aquecimento (como em fogões) e veículos.
GNGÁS NATURAL
GNC – GAS NATURAL COMPRIMIDO
GNL: Gás natural liquefeito ou GNL (em inglês referido pela sigla LNG, de
liquified natural gás) é basicamente gás natural que, após purificado, é
condensando ao estado líquido por meio da redução da sua temperatura a 163 graus Celsius
GNV: O GNV diferencia-se do gás liquefeito de petróleo(GLP) por ser
constituído por hidrocarbonetos na faixa do metano e do etano, enquanto o
GLP possui em sua formação hidrocarbonetos na faixa do propano e do
butano.O GNV trabalha com uma pressão de 220 bar, enquanto que o GLP o
faz a somente 8 bar.
HIDROCARBONETOSALIFÁTICOS: São hidrocarbonetos com átomos de carbono estruturais em cadeias abertas e fechadas (cíclicas), não aromáticas.
HIDROGENAÇÃO: Hidrogenação é a reação química que ocorre quando uma
molécula é obtida pela adição de hidrogênio a uma molécula insaturada
(aquela que contém dupla ou tripla ligação). Este processo é muito utilizado
na indústria, para fabricação de margarinas, alcanos (partindo de alcenos e
alcinos), alcoóis (partindo de ésteres). É um processo bastante rentável para a
indústria. Os principais métodos que utilizam a hidrogenação são:
¾ Método de Sabatier: Consiste na hidrogenação catalítica com
níquel de alcenos ou alcinos para a obtenção de alcanos:
¾ Obtenção da margarina: Os óleos vegetais são ésteres líquidos
constituídos por ácidos graxos insaturados. A margarina é um
produto alimentício obtido da hidrogenação destes óleos: Óleo de
soja + H2 ---> Margarina de soja
¾ Obtenção industrial de alcoóis: Sob condições energéticas, pressão
de 200 atm, catalisada por um sal de cobre II, obtém industrialmente
alcoóis a partir da hidrogenação de ésteres: R - COO - R' + H2 ---> R CH2 - OH + R' –OH
IUPAC: União Internacional de Química Pura e Aplicada (em inglês:
International Union of Pureand Applied Chemistry,IUPAC) é uma organização
não governamental(ONG) internacional dedicada ao avanço da química. Foi
criada em Genebrano ano de 1919.
~ 102 ~ MICELAS: Micelas são aglomerados de átomos, íons ou moléculas, as micelas
podem adquiri carga elétrica positiva ou negativa, dependendo em que tipo
de
sistema
se
encontra.
Esses
sistemas
podem
ser:
Sistemas com excessos de cátions, onde as partículas do disperso irão adsorver
esses cátions, adquirindo carga elétrica positiva, ou - Sistemas com excessos
de ânions, onde as partículas do disperso irão adsorver esses ânions,
adquirindo
carga
elétrica
negativa.
Além disso é importante observar que haverá um momento, durante essa
transformação, em que as micelas serão neutras e a dispersão coloidal, e
descarregada, neste momento dizemos que a dispersão coloidal atingiu seu
ponto isoelétrico.
OLEODUTOS: Oleoduto é uma tubulação fechada que é utilizada para
transportar petróleo e seus derivados. O fluido é movido de um lugar a outro
através de um sistema de pressão. Os oleodutos têm duas desvantagens: não
se pode mudar o percurso nem parar o caminho.
PETROLEIRO: É um tipo particular de navio tanque, utilizado para o transporte
de hidrocarbonetos, nomeadamente petróleo bruto (petroleiros para pretos) e
derivado (petroleiros para brancos). Desde os finais do (século XIX) que são
criados exclusivamente para este fim. Atualmente, os petroleiros dividem-se
entre navios de um só casco e os de casco duplo: nos primeiros, o próprio
casco do navio é também a parede dos tanques de petróleo, enquanto nos
navios de casco duplo duas paredes de aço separadas cumprem cada uma
destas funções.
POLÍMEROS: Os polímeros são macromoléculas formadas a partir de unidades
estruturais menores (os monômeros).A palavra polímero vem do grego poli
(muitas) + mero (partes), e é exatamente isto, a repetição de muitas unidades
(poli) de um tipo de composto químico (mero). E polimerização é o nome
dado ao processo no qual as várias unidades de repetição (monômeros)
reagem para gerar uma cadeia de polímero.
RESERVATÓRIO DE PETRÓLEO: Em geologia e engenharia de petróleo,
reservatório é o nome que se dá a uma rocha existente no subsolo, onde se
acumulou petróleo em seu interior em épocas muito antigas. O petróleo
permaneceu lá até a época atual, quando então foi constatada a sua
existência.
SURFACTANTES: São substâncias que atuam à superfície do líquido reduzindolhe a tensão superficial; (a tensão superficial é devida ao balanço de forças
entre moléculas na superfície do líquido).Possuem atividade detergente. A
estrutura química espacial é semelhante a um cotonete onde a parte de
~ 103 ~ algodão seria a extremidade POLAR (solúvel em água) da molécula e a haste
flexível seria a parte APOLAR (não solúvel em água) da molécula.
TANQUES HERMÉTICOS: Recipientes vedados completamente para evitar a
entrada de qualquer corpo estranho e/ou bactérias indesejáveis.