CAPÍTULO 14: INSUFICIÊNCIA RENAL AGUDA
Luís Yu, Emmanuel Burdmann, Antônio Carlos Seguro, Cláudia Maria de Barros Helou e
Roberto Zatz
Introdução
Os rins são essenciais à homeostase, não apenas porque eliminam produtos
indesejáveis do metabolismo, como também por manter constantes o volume extracelular
(Capítulos 5 e 9), a concentração extracelular de potássio (Capítulo 8), a pressão osmótica
(Capítulos 4 e 11) e o equilíbrio ácido-base (Capítulo 12) do organismo, além de
desempenhar um papel fundamental na regulação da pressão arterial (Capítulo 10) e de
desempenhar funções endócrinas, como a produção de eritropoietina e da forma ativa da
vitamina D.
A importância dos rins torna-se evidente quando se observam as conseqüências da
perda de função renal. O indivíduo em insuficiência renal retém progressivamente os
produtos do metabolismo nitrogenado, como a uréia, acumula líquidos sob forma de edema,
perde a capacidade de diluir e concentrar a urina e torna-se incapaz de regular o equilíbrio
ácido–base ou de manter o balanço e os níveis plasmáticos de eletrólitos tais como sódio,
potássio, magnésio, cálcio e fósforo. Se a perda de função renal ocorrer lentamente devido
à perda progressiva de néfrons (nefropatias progressivas), os néfrons remanescentes podem
adaptar-se e manter a homeostase durante um longo período – o indivíduo desenvolve uma
insuficiência renal crônica (ver Capítulo 15). Se no entanto a perda de função renal ocorrer
de modo abrupto, o indivíduo terá desenvolvido uma insuficiência renal aguda (IRA). O
impacto da disfunção renal será imediato e potencialmente grave: o indivíduo desenvolve
rapidamente retenção de uréia e outros catabólitos, acidose metabólica, distúrbios
eletrolíticos, tais como hiperpotassemia e hiponatremia, retenção de volume, podendo
desenvolver por exemplo edema pulmonar. Quando a perda da função renal é muito grave,
o paciente não chega a sobreviver mais do que alguns dias na ausência de tratamento
intensivo. A IRA é portanto definida como uma perda significativa e abrupta da função
renal. Apesar de seu caráter potencialmente catastrófico, a IRA é em princípio reversível e
as chances de recuperação de um paciente sem alteração de outros órgãos são grandes. No
entanto, os mecanismos que conduzem à IRA são extremamente complexos, conforme
veremos ao longo deste capítulo.
A IRA passou a ser estudada de forma sistemática durante a Segunda Guerra
Mundial. Numa tentativa de subjugar a Inglaterra, os alemães bombardearam com grande
intensidade a cidade de Londres. Observou-se que muitos indivíduos previamente
saudáveis, que eram resgatados dos escombros e sobreviviam aos ferimentos iniciais,
desenvolviam importante diminuição do volume urinário (oligúria) e IRA. Autópsias
realizadas nestes pacientes encontraram necroses focais em segmentos dos túbulos renais,
em contraste com os glomérulos, cujo aspecto era normal. Denominou-se esse quadro, que
apresentava altíssima mortalidade, síndrome do esmagamento (“crush syndrome”). Durante
a Guerra da Coréia, a disponibilidade de métodos substitutivos de depuração renal (diálise)
em hospitais de campanha reduziu dramaticamente a mortalidade dos pacientes com IRA
para aproximadamente 50%. Na Guerra do Vietnã desenvolveram-se as técnicas de punção
venosa profunda (o “intracath”), permitindo a reposição endovenosa precoce de grandes
quantidades de fluidos nos soldados feridos em batalha, o que diminuiu significativamente
a incidência de IRA. No entanto, a mortalidade continuou praticamente inalterada apesar da
disponibilidade de diálise para os pacientes. Mais de cinqüenta anos se passaram e, a
despeito do enorme avanço tecnológico experimentado nas últimas décadas, a mortalidade
dos indivíduos com IRA permanece elevada, ao redor de 50%, podendo atingir valores de
até 80% ou mais em subgrupos específicos, como pacientes idosos oligúricos ou pacientes
com insuficiência múltipla de orgãos, internados em Unidades de Terapia Intensiva.
Calcula-se que até 5% dos pacientes internados em hospitais terciários desenvolvam
IRA. No Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo, a
incidência de IRA em pacientes internados no ano de 1993 foi de 0,79%. Essas
porcentagens variam muito em função das características dos pacientes e da população
estudada. Por outro lado, é evidente que a IRA pode acometer pacientes em todas as áreas
de atuação médica, fazendo com que médicos de praticamente todas as especialidades
tenham contato com essa patologia.
O perfil epidemiológico dos pacientes com IRA sofreu profundas alterações desde
os relatos pioneiros desenvolvidos durante a Segunda Guerra Mundial. Há nos pacientes
atuais um nítido predomínio de indivíduos mais idosos, com doenças crônicas prévias e
quadros clínicos graves, com insuficiências orgânicas múltiplas. Esse predomínio ajuda a
explicar por que a letalidade da IRA continua semelhante à observada durante a Segunda
Guerra, apesar dos recursos terapêuticos mais poderosos hoje disponíveis (ver adiante). Por
outro lado, um grande número de casos de IRA desenvolve-se durante internações
hospitalares, em decorrência de procedimentos potencialmente lesivos ao rim ou em
conseqüência do uso de medicamentos nefrotóxicos inexistentes há algumas décadas, como
vários
imunussupressores,
antifúngicos, antivirais, etc.
antiinflamatórios
não-hormonais,
aminoglicosídeos,
Classificação da IRA
A IRA é classificada em três grandes grupos, de acordo com os mecanismos
básicos que levam à disfunção renal: 1) IRA pré-renal. 2) IRA renal. 3) IRA pós renal. Uma
relação das causas mais importantes de IRA aparece na Tabela 14-1.
Tabela 14-1
Principais causas de IRA
I. Causas pré-renais:
1. Cardiovasculares: diminuição do débito cardíaco
agudas: Infarto agudo do miocárdio, trauma, arritmias, hipertensão maligna, tamponamento
pericárdico, doenças valvulares
crônicas: miocardiopatias (isquêmicas, hipertensivas), disfunções valvulares
2. Hipovolemia:
perdas gastrointestinais: vômitos, diarréia
perdas renais: nefropatias perdedoras de sal, uso de diuréticos, diurese osmótica
3. Diminuição da volemia arterial efetiva:
estados hipoalbuminêmicos: síndrome nefrótica, doença hepática avançada, desnutrição
causas físicas: peritonites, queimaduras, traumatismos
vasodilatação periférica: hipotensão arterial, choque, sepsis, síndrome hepatorenal
II. Causas renais:
1. Necrose tubular aguda (NTA)
isquêmica: hipovolemia, hipoperfusão renal
tóxica: aminoglicosídeos, antifúngicos (anfotericina B), drogas imunosupressoras (CsA, FK506),
antivirais (aciclovir), contrastes radiológicos, pigmentos (hemoglobina, mioglobina), metais
pesados, peçonhas
2. Nefrites intersticiais:
drogas: penicilinas, cefalosporinas, rifampicina, sulfonamidas, diuréticos (furosemida, tiazídicos,
clortalidona ), anti-inflamatórios não-hormonais
infecções
infiltração: linfomas, leucemias, sarcoidose
imunológica: Sjoëgren, uveíte-nefrite intersticial
3. Doenças vasculares:
inflamatórias (vasculites): glomerulonefrite necrotizante pauci-imune, poliarterite nodosa,
granulomatose de Wegener, doença do soro
microangiopática: síndrome hemolítico-urêmica (SHU), púrpura trombocitopênica trombótica
(PTT), hipertensão maligna, esclerodermia
4. Glomerulopatias:
pós-infecciosa: Streptococcus, vírus, endocardite, abscessos abdominais, shunts
glomerulonefrite membranoproliferativa
GN rapidamente progressiva: lupus eritematoso sistêmico
(LES), idiopática, Goodpasture,
poliarterite, granulomatose de Wegener, púrpura de Henoch-Schönlein, SHU, esclerodermia
III. Causas pós-renais:
1. Ureteral e pélvica:
obstrução intrínseca: coágulos, cálculos, infecções fúngica e bacteriana
obstrução extrínseca: tumores, fibrose retroperitoneal, ligadura inadvertida de ureteres
2. Vesical:
cálculos
coágulos
hipertrofia ou neoplasia prostática
carcinoma de bexiga
neuropatia
3. Uretral:
estreitamentos
fimose
Nos casos em que o rim está funcionalmente íntegro mas a perfusão sangüínea que a
ele chega está reduzida, a IRA é denominada pré-renal. Essa hipoperfusão renal é
geralmente causada por hipovolemia aguda, como por exemplo, em casos de desidratação
por perdas gastrointestinais (ver Capítulo 7) ou hemorragia grave. No entanto, pode
decorrer também de situações em que a volemia arterial efetiva está reduzida, como por
exemplo na insuficiência cardíaca congestiva grave, na cirrose hepática e na síndrome
nefrótica por “underfilling” (ver Capítulo 9). Esse quadro é essencialmente reversível se o
distúrbio volêmico for corrigido em tempo. No entanto, a manutenção prolongada dessa
hipoperfusão renal pode causar lesão e necrose de células tubulares, principalmente nos
segmentos renais localizados na medula externa (pars recta do túbulo proximal e porção
espessa da alça de Henle). Nesse caso, instala-se um quadro de IRA renal, caracterizado
principalmente por necrose tubular aguda (NTA), embora possam aparecer outras
alterações, à vezes sutis, como a condensação de cromatina nuclear, as lesões de cristas
mitocondriais e a vacuolização citoplasmática, freqüentemente visíveis apenas à
microscopia eletrônica. A IRA renal, também denominada intrínseca, parenquimatosa,
orgânica, ou estabelecida, constitui a modalidade mais comum de IRA. Cerca de 70-90%
dos casos de IRA renal decorrem de NTA, enquanto o restante é causado por vasculites,
glomerulopatias agudas e nefrites intersticiais. O quadro de IRA renal é freqüentemente
caracterizado por perda quase total da função renal, o que exige tratamento em ambiente
hospitalar, muitas vezes de natureza intensiva com uso de métodos dialíticos. Apesar de sua
gravidade, a IRA renal é potencialmente reversível, se tratada adequadamente. A alta
letalidade da IRA deve-se em grande parte ao fato de que esses pacientes freqüentemente
apresentam falência de outros órgãos e complicações graves como sangramentos e
infecções que podem evoluir para septicemias..
Na IRA pós-renal, o fluxo urinário é dificultado ou mesmo interrompido por
obstrução mecânica das vias urinárias, devido por exemplo à presença de cálculos ou
crescimento tumoral. Essa modalidade de IRA é potencialmente reversível caso seja
realizada a desobstrução precoce das vias urinárias. No entanto, a recuperação pode ser
mais difícil ou evoluir para NTA se a duração do processo obstrutivo tiver sido demasiado
longa (ver adiante).
FISIOPATOLOGIA DA IRA
IRA pré-renal
Embora a IRA pré-renal seja menos freqüente do que a IRA renal, o estudo dos
mecanismos envolvidos na sua gênese é extremamente importante por duas razões. Em
primeiro lugar, uma parcela substancial dos casos de IRA pré-renal acaba evoluindo para a
forma renal. Em segundo lugar, a IRA pré-renal é uma condição reversível se tratada em
tempo. Conforme mencionado acima, a IRA pré-renal é conseqüência de hipoperfusão
renal, associada à redução da volemia ou ao deslocamento de fluido para o território venoso
(diminuição da volemia arterial efetiva).
Para entender os mecanismos que levam à queda da função renal na IRA pré-renal é
importante considerar a lógica de funcionamento do rim e do sistema cardiovascular no que
diz respeito à regulação do volume vascular. Normalmente, os rins filtram por dia uma
enorme quantidade de plasma, equivalente a mais de 30 vezes o volume plasmático
(Capítulo 1). Para que essa tarefa seja cumprida, é necessário que 25% do débito cardíaco
sejam destinados aos rins, que representam apenas 5% da massa corpórea. Apesar das
enormes proporções dessa filtração e dessa perfusão sangüínea, os rins realizam um
delicado trabalho de ajuste fino da excreção de sódio, de modo a manter rigorosamente
constante o volume extracelular (Capítulos 5 e 9). Normalmente, esse ajuste envolve uma
parcela tão pequena da carga filtrada de sódio (inferior a 1%) que o túbulo coletor é
perfeitamente capaz de se desincumbir da tarefa, sem necessidade de intervenção dos
demais segmentos do néfron (Capítulo 5). Em outras palavras, a fração de excreção de
sódio (FENa%= carga excretada/carga filtrada100, ver Capítulo 5) é muito baixa, inferior a
1%, em condições normais. Em condições de depleção de volume extracelular, muda a
lógica do funcionamento renal: a prioridade passa a ser a conservação de sódio a qualquer
custo. Todos os segmentos do néfron são envolvidos nesse esforço. A FENa% cai a quase
zero. O próprio ritmo de filtração glomerular (RFG) diminui, devido à queda do fluxo
plasmático e da pressão hidráulica glomerular. Essas alterações hemodinâmicas são
causadas por intensa vasoconstrição das arteríolas glomerulares, por sua vez mediada por
uma série de vasoconstritores, como a angiotensina II, as catecolaminas, a endotelina e o
Pcreat, mg/100 ml
20
15
10
5
0
0
10 20 30 40 50 60 70 80 90 100
RFG, ml/min
Figura 14.1 – Relação inversa entre a concentração plasmática de
creatinina (Pcreat) e o RFG
próprio hormônio antidiurético (Capítulo 2). Sob tais condições, a taxa de creatinina
plasmática se eleva em proporção inversa à magnitude da queda do RFG segundo uma
função não linear (Fig. 14-1), enquanto a concentração sangüínea de uréia sofre aumento
desproporcional, devido à avida absorção de água e sódio no túbulo proximal (ver Capítulo
7). Se examinarmos a composição da urina nesta fase, observaremos um quadro altamente
descritivo da lógica de funcionamento renal: o fluxo urinário reduz-se a menos de 400
ml/dia e a concentração de sódio na urina torna-se muito baixa, assim como a FeNa%. A
concentração de potássio também se reduz, embora em proporção inferior à do sódio. Na
verdade, o quociente [Na]/[K], geralmente superior a 1 na urina (refletindo um consumo de
sódio maior do que o de potássio), inverte-se na IRA pré-renal. A concentração urinária de
potássio reduz-se menos que a de sódio, indicando a persistência da secreção desse íon no
túbulo coletor, possivelmente acelerada pela avidez com que aquele segmento está
absorvendo sódio (ver Capítulo 5). A osmolalidade urinária está alta, alcançando até cerca
de 3 vezes a osmolalidade do plasma, o que reflete as altas taxas circulantes de hormônio
antidiurético (ver Capítulos 4 e 11) e o correto funcionamento do sistema de contracorrente
medular (Capítulo 4). Portanto, o exame da urina na IRA pré-renal indica a preservação da
integridade renal: o rim está fazendo o que dele se espera, ou seja, busca tenazmente
conservar sódio e água. Um caso típico de IRA pré-renal, com seus achados laboratoriais
característicos, é mostrado na Tabela 14-2.
Tabela 14-2
Valores típicos de exames laboratoriais na IRA pré-renal
Concentração plasmática de creatinina: 3,5 mg/dL (normal 0,8 a 1,2)
Concentração plasmática de uréia: 177 mg/dL (normal 25-45)
Fluxo urinário = 310 ml/dia (normal 600 a 1.500)
[Na+] urinária = 5 mmol/L (muito baixa)
[K+] urinária = 32 mmol/L (baixa)
Osmolalidade urinária = 720 mOsm/Kg (2,5 vezes mais alta que a do plasma)
Se a situação que levou à hipoperfusão renal se agravar, levando a hipotensão
arterial acentuada e a um estado de choque circulatório, passa a imperar outra lógica: a
prioridade agora é garantir a perfusão dos tecidos cerebral e miocárdico e com isso a
sobrevivência imediata do indivíduo, ainda que para isso seja necessário promover a
isquemia de outros territórios, como o próprio rim. A vasoconstrição renal se intensifica,
RFG = 30 L/dia
PROXIMAL
ALÇA FINA
DESCENDENTE
ALÇA FINA
ASCENDENTE
ALÇA
ESPESSA
DISTAL
COLETOR
Fig. 14-2 – Representação esquemática da filtração,
absorção e excreção de água ao longo dos vários
segmentos do néfron na IRA pré-renal. A largura da
região em amarelo representa o fluxo de água
remanescente no lume tubular. As linhas pontilhadas
representam os valores normais. Na IRA pré-renal o RFG
é baixo e a absorção tubular de água e sódio é quase
completa. Ver também Fig. 5.1
reduzindo a valores muito baixos o RFG e o fluxo sangüíneo renal. A absorção de água e
sódio se intensifica, reduzindo ainda mais o fluxo urinário (Fig. 14-2). É nesse momento
que a vulnerabilidade do rim à isquemia e à hipóxia se manifestam, podendo determinar a
passagem, infelizmente muito comum, de IRA pré-renal à IRA renal.
A transição da IRA pré-renal à IRA renal.
Como é possível a um tecido que recebe uma fatia tão generosa do débito cardíaco
ser tão vulnerável à hipóxia? Para responder a essa questão é necessário examinar de perto
a relação entre a oferta e a demanda de oxigênio nas diversas regiões em que se divide o
90
80
ml/min/100g
70
60
50
40
30
20
10
0
CÉREBRO
MIOCÁRDIO
RIM
MEDULAR
EXTERNA
Fig. 14-3 –. O rim recebe uma quantidade de oxigênio muito superior à
necessária, porém a região medular externa consome mais de 80% do aporte
de oxigênio, superando cérebro e miocárdio. A porção azul da barra representa
o consumo de oxigênio, enquanto a altura total da mesma representa o aporte
total de oxigênio ao tecido.
parênquima renal. É útil para isso a comparação com outros tecidos (Fig. 14-3). Enquanto
no miocárdio o consumo de oxigênio alcança 70% do aporte total, os rins consomem
apenas 10% do oxigênio que lhes chega. Isso ocorre porque a maior parte do fluxo
sangüíneo renal é destinada à região cortical, de modo a privilegiar o processo de filtração
glomerular, altamente dependente de fluxo (ver Capítulo 1). Conseqüentemente, os néfrons
corticais recebem um aporte de oxigênio muito superior às suas necessidades. Quando no
entanto examinamos a relação entre a oferta e a demanda de oxigênio na região medular
externa do rim, o quadro é outro: 80% do aporte de oxigênio são ali consumidos. A razão
para que essa relação entre oferta e demanda de oxigênio seja assim precária é que, de um
lado, a medular externa abriga dois segmentos do néfron onde o transporte ativo de NaCl é
muito intenso: a pars recta do túbulo proximal e a porção espessa da alça de Henle. De
outro, a tensão de oxigênio nessa região tende a ser mais baixa do que na córtex. A razão
para isso é a disposição em contracorrente dos vasa recta (ver Capítulo 4). Esse arranjo em
“U” é extremamente útil para que os vasa recta ajudem a manter a hipertonicidade
O2
Fig. 14-4 – A tensão de oxigênio decresce em direção à ponta
da papila devido ao arranjo em contracorrente dos
vasa recta
medular. No entanto, esse mesmo arranjo faz com que a tensão de oxigênio se reduza
gradativamente em direção à ponta da papila: o oxigênio contido no ramo descendente do
vaso tende a difundir precocemente em direção ao ramo ascendente, cuja tensão de
oxigênio é mais baixa em razão do consumo ocorrido nas regiões mais profundas (Fig. 144). Na região medular interna, as baixas tensões de oxigênio decorrentes desse movimento
não chegam a representar um problema, uma vez que é relativamente pequena a magnitude
do transporte iônico ali realizado pelas porções finais do túbulo coletor e pelas porções
finas das alças de Henle. Já na região medular externa, a relação oferta/demanda de
oxigênio torna-se crítica. Portanto, a região medular externa vive constantemente à beira
da hipóxia, sendo a primeira a ser afetada por um processo de isquemia renal grave. Essa
vulnerabilidade é ainda agravada pelo fato de que a isquemia renal decorrente de uma
hipovolemia não é homogênea: enquanto o fluxo sangüíneo diminui para 60% dos níveis
basais na córtex superficial, a redução é superior a 80% na região medular externa.
IRA renal
Enquanto o rim permanecer capaz de concentrar a urina e reduzir substancialmente
a excreção de sódio, a IRA pré-renal pode ainda ser revertida através da correção da
hipovolemia e do distúrbio primário, que geralmente consiste em perda gastrointestinal ou
hemorragia (ver adiante). Se no entanto a hipovolemia e a hipoperfusão renal persistirem, a
IRA pré-renal pode transformar-se em IRA renal.
É importante notar que, embora a maior parte dos casos de IRA renal tenha
passado por uma fase de IRA pré-renal, isso nem sempre é verdadeiro: uma parte dos
casos de IRA renal decorre de hipovolemias que se instalaram de modo extremamente
rápido, sem tempo para uma fase pré-renal. Outros casos originam-se de um efeito
tóxico sobre o rim, provocado por medicamentos, peçonhas ou pigmentos, conforme
veremos mais adiante.
Na IRA renal, algumas das características da IRA pré-renal persistem: as
concentrações plasmáticas de uréia e creatinina continuam altas e tendem a elevar-se ainda
mais. No entanto, a desproporção entre as concentrações de uréia e creatinina tende a
desaparecer, sugerindo que a intensa absorção proximal de uréia verificado na IRA prérenal não mais ocorre. Na maior parte dos casos, o fluxo urinário cai a valores muito
baixos, inferiores a 100 ml/dia. Denominamos esses casos IRA renal oligúrica, em
contraposição à IRA renal não oligúrica, que analisaremos logo adiante. Em qualquer dos
casos, o exame da composição da urina revela um quadro muito diferente do observado na
IRA pré-renal: a concentração de sódio é muito mais alta, da ordem de dezenas de mmol/L,
chegando a aproximar-se dos níveis normalmente encontrados no plasma. A concentração
urinária de potássio, em contraste, é varias vezes inferior à de sódio. A osmolalidade
urinária é muito próxima à do plasma. Todos esses achados laboratoriais encontram-se
exemplificados na Tabela 14-3.
Tabela 14-3
Valores típicos de exames laboratoriais na IRA renal oligúrica
Concentração plasmática de creatinina: 4,5 mg/dL (normal 0,8 a 1,2)
Concentração plasmática de uréia: 127 mg/dL (normal 25-45)
Fluxo urinário = 80 ml/dia (normal 600 a 1.500)
[Na+] urinária = 80 mmol/L (alta)
[K+] urinária = 12 mmol/L (baixa)
Osmolalidade urinária = 303 mOsm/Kg (próxima à do plasma)
Esses resultados indicam que os néfrons deixaram de desempenhar adequadamente
suas funções: não estão ávidos por sódio, não parecem estar secretando potássio em
quantidade significativa, nem estão empenhados em concentrar a urina para reter água. Em
outras palavras, não parece estar havendo um processamento da pequena quantidade de
filtrado glomerular que ainda se forma. É importante notar que, na ausência de qualquer
absorção tubular, mesmo um RFG muito baixo, de por exemplo 5 ml/min, corresponderia a
uma poliúria de 5L/min1440 min/dia = 7,2 L/dia. O baixíssimo fluxo urinário encontrado
nesses pacientes, inferior a 0,1 L/dia, indica que o escasso filtrado glomerular é de alguma
forma reclamado em sua quase totalidade, sem ser no entanto modificado substancialmente
CARGA FILTRADA = 17 L/dia
CARGA FILTRADA = 2400 mEq/dia
PROXIMAL
PROXIMAL
ALÇA FINA
DESCENDENTE
ALÇA FINA
DESCENDENTE
ALÇA FINA
ASCENDENTE
ALÇA FINA
ASCENDENTE
ALÇA
ESPESSA
ALÇA
ESPESSA
DISTAL
DISTAL
COLETOR
COLETOR
Fig. 14-5 – Representação esquemática da filtração, absorção e excreção de água ao longo dos vários
segmentos do néfron na IRA renal. A largura da região em amarelo representa o fluxo de água
remanescente no lume tubular. As linhas pontilhadas representam os valores normais. A).Na IRA renal
oligúrica o RFG é baixo e quase todo o filtrado abandona a luz tubular antes de chegar ao final do
néfron, em grande parte devido a retrovazamento. B) Na IRA renal não oligúrica, uma boa parte do
filtrado chega ao fim do néfron devido à baixa taxa de absorção tubular. Mesmo sendo muito pequena,
a magnitude do RFG garante um fluxo suficiente para causar poliúria
(Fig. 14-5A). Essa disfunção tubular tem uma base anatômica definida: em vários pontos
do rim as células tubulares aparecem necrosadas ou ausentes, restando aos túbulos, em
certos segmentos, apenas a membrana basal.
Uma vez instalada, a IRA renal não mais pode ser revertida, mesmo que seja
corrigido o distúrbio que a originou. O RFG e o fluxo urinário permanecem muito baixos e
não respondem à administração de fluidos, a qual pode na administração excessiva
provocar até mesmo a morte do paciente por edema pulmonar. O paciente passa a
necessitar de assistência especializada em ambiente hospitalar, muitas vezes requerendo
diálise (ver adiante). Somente após a recuperação espontânea do tecido renal é que o
indivíduo poderá novamente regular de modo independente o balanço de água e eletrólitos.
Na IRA renal não oligúrica, a retenção de uréia e creatinina e a composição
urinária são semelhantes àquelas encontradas na IRA renal oligúrica (Tabela 14-4). A única
Tabela 14-4
Valores típicos de exames laboratoriais na IRA renal não oligúrica
Concentração plasmática de creatinina: 4,1 mg/dL (normal 0,8 a 1,2)
Concentração plasmática de uréia: 119 mg/dL (normal 25-45)
Fluxo urinário = 1.800 ml/dia (normal 600 a 1.500)
[Na+] urinária =90 mmol/L (alta)
[K+] urinária = 6 mmol/L (baixa)
Osmolalidade urinária =298 mOsm/Kg (próxima à do plasma)
4,5
diferença entre as duas modalidades reside no fluxo urinário: enquanto na forma não
oligúrica o fluxo urinário é usualmente inferior a 100 ml/dia, é comum na forma não
oligúrica a presença de débitos urinários elevados, às vezes superiores a 2 L/dia, indicando
que, nessa forma de IRA, a recuperação da pequena quantidade de filtrado que se forma é
apenas parcial (Fig. 14-5B). A distinção entre as duas formas de IRA é importante por duas
razões: em primeiro lugar, o prognóstico da IRA renal não oligúrica é melhor do que o da
forma oligúrica. Em segundo lugar, o controle do balanço hídrico é mais fácil na forma não
oligúrica do que na oligúrica, uma vez que é menor a tendência à retenção de volume.
Entretanto, apesar da poliúria, o RFG permanece baixo, podendo ocorrer tanto
hiperidratação quanto desidratação se o balanço hidríco não for adequadamente controlado.
Mecanismos de lesão anatômica e funcional na IRA renal
Por que a hipóxia prolongada do tecido renal provoca uma depressão tão persistente
do RFG e das funções tubulares, que se mantém mesmo depois de corrigido o distúrbio
inicial? A resposta a esta questão permanece incompleta. Sabe-se no entanto que uma série
de alterações vasculares contribuem para manter baixos o fluxo sangüíneo renal e o RFG.
Essas alterações levam a uma intensa vasoconstrição das arteríolas glomerulares, o que
promove hipoperfusão, bem como a uma redução do Kf glomerular (ver Capítulo 1),
diminuindo o RFG. Essa vasoconstrição pode ser mediada pela disfunção de diversos
compostos vasoativos (ver Capítulo 2). Entre estes incluem-se 1) excesso de
vasoconstritores, como a angiotensina II (produzida principalmente pelas células do
complexo justaglomerular); a endotelina (produzida principalmente por células
endoteliais), e o tromboxane B (produzido por plaquetas) e 2) deficiência de
vasodilatadores, como as prostaglandinas vasodilatadoras (PGE2 e prostaciclina),
importantes para a manutenção do fluxo sangüíneo renal em situações de vasoconstrição
intensa; o óxido nítrico (NO), que desempenha um papel importante na regulação do fluxo
sangüíneo renal em condições normais, mas que pode também exercer um efeito tóxico
direto sobre os túbulos renais em situações de hipóxia; e o fator natriurético atrial,
produzido pelos átrios, capaz de aumentar substancialmente o RFG. Apesar dessa riqueza
de mediadores, inexistem até o momento evidências conclusivas apontando para qualquer
um desses compostos em particular.
Embora possa estar envolvida na queda do RFG observada na IRA renal, a
produção exagerada de vasoconstritores não explica outras alterações observadas nessa
condição, como a necrose de células tubulares, além da óbvia disparidade entre as formas
oligúrica e a não oligúrica. Para compreender esses fenômenos, é necessário examinar os
efeitos deletérios da própria hipóxia sobre epitélios transportadores complexos como os que
constituem os túbulos renais. Esses epitélios são obrigados a consumir grandes quantidades
de ATP, utilizados como fonte de energia metabólica para a realização de transporte ativo.
A manutenção da integridade de estruturas epiteliais como o túbulo proximal e a porção
espessa da alça de Henle exige a síntese de moléculas especializadas, as integrinas, que
ajudam a manter as células firmemente ancoradas à matriz extracelular. A manutenção do
citoesqueleto, que também exige dispêndio de energia, é duplamente essencial ao
funcionamento dos epitélios transportadores: em primeiro lugar, as integrinas devem fixarse ao citoesqueleto para poder conectar com firmeza a célula à matriz extracelular. É
também por intermédio do citoesqueleto que as células aderem umas às outras através da
zonula ocludens. Em segundo lugar, a integridade do citoesqueleto permite que a célula
epitelial mantenha-se polarizada, ou seja, conserve uma assimetria entre a membrana
basolateral, onde se localiza a Na-K-ATPase, presente em todas as células transportadoras
do néfron, e a membrana apical, onde se localizam estruturas que facilitam a entrada de
sódio na célula (canais específicos, cotransportadores e contratransportadores) (ver
Capítulo 5). Além dessas funções específicas de epitélios transportadores, essas células
necessitam de ATP para a realização de tarefas de manutenção comuns a todos os tipos
celulares, tais como a manutenção de seu volume (tarefa ainda mais difícil quando as
células estão imersas em meio hipertônico como a medula renal), a extrusão de cálcio do
interior da célula, visando manter baixas concentrações desse íon no citosol, a biossíntese
de proteínas, etc.
Quando as células transportadoras renais são submetidas a hipóxia durante um
período prolongado, todas essas funções podem ser comprometidas. A polarização das
células pode ser perdida, o que a faz por exemplo inserir moléculas de Na-K-ATPase em
ambas as membranas. Com isso, a célula deixa de realizar transporte resultante de sódio e
água, tornando-se portanto não transportadora (Fig. 14-6). A perda de polaridade estende-se
também às integrinas, que passam a aparecer em ambas as membranas. A desorganização
do citoesqueleto impede a correta ligação das integrinas e portanto o ancoramento da célula
à matriz extracelular. Como a conexão intercelular também fica comprometida, as células
perdem sua fixação e desgarram-se do epitélio, invadindo a luz tubular (Fig. 14-7A). Como
Na
+
Na
Na+
ATP
K
K
+
ATP
+
+
K
+
SEM TRANSPORTE RESULTANTE DE SÓDIO
Fig. 14-6 – Células submetidas a hipóxia prolongada podem perder a polaridade,
deixando de realizar transporte resultante de água, sódio e demais eletrólitos
as integrinas ainda estão localizadas ao longo da superfície das células, estas tendem a
aderir umas às outras, formando “cilindros” que entopem a luz tubular (Fig. 14-7B). A
deposição de restos celulares e de fragmentos de microvilosidades (“borda em escova”),
associada à presença de proteínas de origem tubular (Tamm-Horsfall) contribui para
aumentar ainda mais as dimensões desses “cilindros”. É provável que essa micro-obstrução
tubular reduza a zero o RFG do respectivo néfron, de modo análogo ao da obstrução das
vias urinárias. A repetição desse fenômeno em muitos outros néfrons deve contribuir para
reduzir ainda mais o RFG total. É importante lembrar que uma alteração desse porte não é
facilmente reversível, o que pode ajudar a entender a lentidão com que esses pacientes se
recuperam uma vez superada a condição de hipóxia.
As alterações descritas acima interferem profundamente com o funcionamento da
célula e do próprio néfron. No entanto, as células assim afetadas permanecem vivas e, se
não chegarem a se desgarrar das estruturas adjacentes, podem até mesmo se recuperar logo
após a reoxigenação do tecido. Outras células, no entanto, sofrem necrose e desintegram-se.
Há várias razões para que as células tubulares sucumbam dessa maneira à hipóxia.
Conforme mencionado acima, a manutenção de baixas concentrações de cálcio no citosol
depende fortemente da disponibilidade de ATP. Na ausência deste, a concentração de cálcio
intracelular sobe rapidamente. Há várias evidências experimentais de que, em
concentrações inadequadamente altas, o cálcio exerce um efeito extremamente tóxico sobre
a célula, podendo levá-la à necrose ou, em outros casos, à apoptose, que é uma forma de
morte celular programada.
Fiig. 14-7 – A) Células submetidas a hipóxia durante longos períodos têm alteração de seu
citoesqueleto e enfraquecimento de suas ligaçõescom as estruturas vizinhas, desgarrando-se
do epitélio e invadindo a luz tubular. B) Células desgarradas e restos de células destruídas
formam “cilindros” que obstruem o túbulo e dificultam a filtração glomerular naquele
néfron. As lacunas deixadas pelas células que se desprenderam permitem o retrovazamento
de fluido em direção ao interstício
Paradoxalmente, a hipóxia pode exercer um efeito profundamente deletério sobre as
células no momento mesmo em que deixa de existir, ou seja, quando ocorre a reperfusão. A
razão para isso é complexa e requer um pouco de conhecimento do metabolismo do próprio
ATP. Enquanto perdura a hipóxia, o estoque de ATP da célula é rapidamente consumido,
gerando quantidades enormes de adenosina e de seu principal metabólito, a hipoxantina
(Fig. 14-8). A metabolização da hipoxantina só pode ocorrer em condições aeróbicas.
ATP
ADP
AMP
Adenosina
Hipoxantina
Hipoxantina
--
OO2
SOD
H2HOO2
2
2
Xantina
2
CAT
H2O + O2
.
OH
Ácido úrico
Fig. 14-8 – Em condições de anaerobiose prolongada, o uso dos estoques de ATP
resulta no acúmulo de hipoxantina no interior da célula. A metabolização da
hipoxantina no momento da reperfusão gera quantidades muito grandes de
superóxido (O2-) e hidroxila (OH-), radicais livres extremamente citotóxicos,
promovendo destruição celular
Portanto, a hipoxantina acumula-se na célula até que a oxigenação da mesma seja
restabelecida. Quando isso finalmente acontece, todo esse estoque de hipoxantina é
rapidamente transformado em xantina e ácido úrico, que é o catabólito final. Essa reação
gera também o superóxido e a hidroxila (não confundir com o ânion hidroxila presente nas
bases fortes), radicais livres bastante citotóxicos. Em condições normais, esses compostos
são formados em quantidade pequena o suficiente para que a célula evite facilmente a
elevação de seus níveis através de enzimas que os removem. Nas condições especiais da
reperfusão, no entanto, o acúmulo de hipoxantina leva à formação de grandes quantidades
desses radicais livres que, embora existam durante um intervalo de tempo extremamente
curto, têm um efeito tóxico devastador. Outro radical livre que pode exercer um efeito
deletério na reperfusão é o óxido nítrico (NO), que é sintetizado pelas células renais e
também por macrófagos e outros leucócitos (ver Capítulo 2). Normalmente, o NO exerce
um importante papel fisiológico devido a seu efeito efeito vasodilatador, que ajuda a
modular o efeito de vasoconstritores como a angiotensina II e as catecolaminas. Em
situações de hipóxia, no entanto, o NO pode exercer um efeito tóxico, especialmente em
presença de grandes quantidades de superóxido, com o qual se combina para gerar o ânion
peroxinitrito, mais tóxico do que qualquer de seus precursores.
O descolamento de células da membrana basal, ou seu aniquilamento puro e simples
por necrose ou apoptose, leva à formação de grandes lacunas no epitélio tubular.
Combinadas à micro-obstrução dos túbulos por células desgarradas e restos celulares, essas
aberturas facilitam a passagem direta de fluido para o interstício, ou retrovazamento (Fig.
14-7B). É evidente que esse movimento de fluido não constitui propriamente uma absorção
tubular, servindo apenas para promover edema intersticial, o que vai aumentar a pressão
hidrostática do interstício e levar à obstrução de outros túbulos, contribuindo para agravar o
processo. É evidente também que o retrovazamento ajuda a explicar por que o volume
urinário é tão baixo em uma parte dos pacientes (IRA oligúrica).
Conforme discutido acima, a perda de polaridade, além de interferir com a aderência
da célula às estruturas vizinhas, anula o transporte resultante de água e solutos,
transformando-a em uma célula não transportadora. As conseqüências dessa disfunção são
evidentes: a falta de absorção faz com que o fluido intratubular que chega à célula seja
pouco absorvido. A presença dessa disfunção em um número grande de células leva à
rejeição de uma parcela considerável do fluido filtrado. Os néfrons em que esse tipo de
lesão predomina contribuem à formação de urina com um fluido pouco alterado em relação
ao filtrado glomerular, ajudando a explicar as características da urina nos pacientes com
IRA renal oligúrica (Tabela 14-3). É razoável supor que, se esse distúrbio predominar em
um grande número de néfrons, a tendência do paciente será a de desenvolver uma forma
não oligúrica. Quando, ao contrário, o predomínio de néfrons com micro-obstrução e/ou
retrovazamento é quase total, o paciente tenderá a apresentar a forma oligúrica.
IRA renal de origem tóxica
Nem todos os casos de IRA são decorrentes de hipovolemia. Vários compostos
químicos podem causar uma queda abrupta do RFG promovendo diretamente uma
vasoconstrição renal, com conseqüente redução do fluxo sangüíneo renal. Outros
compostos promovem lesão do parênquima renal por uma agressão tóxica tubular direta,
causando destruição celular semelhante à causada por isquemia prolongada. Os agentes
capazes de causar IRA nefrotóxica podem ser divididos em três grandes grupos: 1)
medicamentos e outros agentes introduzidos no organismo devido à ação do médico, como
os contrastes iodados; 2) peçonhas, venenos de origem animal como os de serpentes,
escorpiões e aranhas. 3) pigmentos, como a hemoglobina e a mioglobina (ver Tabela 14-1).
Os mecanismos através dos quais cada um desses grupos de agentes provoca seus efeitos
tóxicos, sejam estes vasculares ou celulares, não foram ainda completamente estabelecidos.
Uma discussão detalhada sobre as hipóteses atualmente propostas para explicar esses
efeitos foge aos objetivos deste texto.
É importante notar que, independente do mecanismo de ação, o rim é
particularmente susceptível a agentes tóxicos, especialmente os de ação celular direta. Há
três razões básicas para essa vulnerabilidade. Em primeiro lugar, o rim recebe, conforme
mencionado no início deste capítulo, cerca de 25% do débito cardíaco, estando portanto
exposto mais rápida e diretamente a qualquer agente tóxico circulante. Em segundo lugar, o
rim concentra o filtrado glomerular – é uma de suas funções – aumentando portanto em
várias vezes o potencial tóxico de qualquer agente. Em terceiro lugar, as células da pars
recta do túbulo proximal possuem um sistema de transporte de solutos orgânicos, estando
portanto mais diretamente expostas a agentes tóxicos.
Outras causas de IRA renal
Além de poder ser causada por hipovolemia e por agentes tóxicos, a IRA renal pode
também representar, com menor freqüência, uma complicação de outras patologias renais.
É o caso das glomerulonefrites, que em suas formas mais graves chega a provocar necrose
tubular aguda, das glomerulonefrites rapidamente progressivas e das vasculites primárias
ou secundárias a doenças sistêmicas, como o lupus eritematoso. A IRA pode ser causada
também por lesões intersticiais de causa infecciosa ( pielonefrites) ou de fundo alérgico, e
por nefrites intersticiais agudas secundárias a drogas, a intoxicações químicas, a processos
alérgicos ou a infecções.
IRA pós renal
O mecanismo básico envolvido na gênese da IRA pós-renal é a obstrução das vias
urinárias. Para que a IRA se estabeleça nesses casos, é necessário que a obstrução atinja
ambos os ureteres, ou que se estabeleça em um indivíduo com rim único. A causa mais
freqüente de obstrução renal são os cálculos ureterais. Outras causas comuns são os
coágulos decorrentes de sangramento renal ou das vias urinárias, os tumores das própria
vias urinárias ou extrínsecos a elas, a fibrose retroperitoneal, as neoplasias da próstata e da
bexiga, os cálculos vesicais e os estreitamentos uretrais. (ver Capítulo 1). A obstrução ao
fluxo urinário acarreta elevação da pressão hidráulica da via urinária, que se transmite aos
túbulos e ao espaço de Bowman, levando em última análise à anulação da pressão efetiva
de ultrafiltração e à cessação do processo de filtração glomerular (ver Capítulo 1). Após 1
ou 2 dias de obstrução, outros mecanismos, como a produção local de vasoconstritores,
entram em ação, contribuindo para manter baixo o RFG. Nos casos de IRA pós-renal é
imperioso desfazer o mais rapidamente possível a obstrução do trato urinário, uma vez que
é possível reverter a queda do RFG. No entanto, se a obstrução persistir, pode haver lesão
do parênquima renal, com a instalação de necrose tubular aguda e/ou infecção renal e das
vias urinárias, que podem levar à perda do órgão. Essa complicação é mais freqüente em
casos de obstrução unilateral, especialmente quando os sintomas associados são pouco
intensos. Ao alívio da obstrução, segue-se uma fase de intensa diurese, denominada diurese
pós-obstrutiva, durante a qual o paciente pode até mesmo desenvolver desidratação iso ou
hipotônica (ver Capítulo 7).
Diagnóstico da IRA
O primeiro dado clínico a levantar a suspeita diagnóstica de IRA é evidentemente o
fluxo urinário. A diminuição do fluxo urinário a valores inferiores a 400 ml/dia é
considerada oligúria. Esse limite foi assim definido por corresponder ao volume mínimo
necessário à excreção diária de solutos como a uréia, o sódio e o potássio (ver Capítulo 11).
No entanto, aproximadamente 50% dos casos de IRA observados atualmente são da forma
não-oligúrica. Um dos fatores responsáveis por essa tendência é o crescimento do uso de
drogas nefrotóxicas. Além disso, os médicos tendem cada vez mais a intervir de modo
precoce e enérgico nesses casos, procurando restaurar o volume intravascular e utilizar
diuréticos precocemente. Assim, o achado de um volume urinário superior a 400 ml/dia não
exclui de modo algum o diagnóstico de IRA.
O parâmetro laboratorial mais utilizado para a definição de insuficiência renal (sem
no entanto distinguir entre insuficiência renal aguda ou crônica) é a medida da
concentração plasmática de creatinina (Pcreat). Esta substância é produzida pelos músculos
de forma constante, sendo eliminada principalmente por filtração glomerular. No entanto,
este é um método pouco sensível, pois a Pcreat só se elevará de forma inequívoca quando o
RFG for inferior a 50% do normal. Mais ainda, como a Pcreat depende da massa muscular,
pode apresentar níveis enganosamente baixos em indivíduos com massa muscular reduzida,
como idosos, pacientes desnutridos, crianças etc. Assim, níveis de creatinina plasmática
acima de 1,5 mg/dl praticamente confirmam o diagnóstico de insuficiência renal, mas
"níveis normais" de creatinina não excluem essa possibilidade.
Uma vez diagnosticada a insuficiência renal, é essencial definir se esta é crônica ou
aguda. Anamnese e exame físico cuidadosos são fundamentais para este diagnóstico. A
história clínica de insuficiência renal crônica (IRC) costuma ser pobre, devido à natureza
insidiosa do processo, oligossintomático até os seus estágios mais avançados. Essa
característica da IRC decorre da grande capacidade de adaptação dos néfrons
remanescentes à perda progressiva de massa renal (ver Capítulo 15). Por outro lado, a IRA
geralmente tem história de curta duração, com fator desencadeante definido e
sintomatologia exuberante. Um exame de grande valia é a ultrassonografia renal. Rins
pequenos e/ou com perda da delimitação córtico-medular são indicativos de IRC, enquanto
rins de tamanho normal com córtex preservada são fortemente sugestivos de IRA.
É de grande importância a detecção precoce da causa da IRA, para tratamento
rápido e eficiente das formas reversíveis, como a IRA pré-renal, a IRA pós-renal, as
glomerulites, as vasculites e as nefrites intersticiais. O diagnóstico diferencial entre IRA
pré-renal e NTA é particularmente relevante. Conforme discutido acima, na IRA pré-renal
os mecanismos de reabsorção de sódio e água estão altamente ativados, levando à excreção
de uma urina com baixa concentração de sódio e alta osmolalidade. Por outro lado, na NTA
o dano tubular impede a reabsorção de sódio e a concentração urinária, fazendo com que os
rins produzam uma urina com alta concentração de sódio e osmolalidade próxima à do
plasma. Um parâmetro extremamente útil para se discernir entre uma IRA pré-renal e uma
NTA é a fração de excreção de sódio (FENa%). A FENa% é calculada dividindo-se a carga
excretada de sódio (UNa V) pela carga filtrada de sódio (PNa RFG) e multiplicando-se o
resultado por 100 (a FENa% é expressa em porcentagem), onde UNa é a concentração
urinária de sódio, V é o fluxo urinário (em mL/min) e PNa é a concentração plasmática de
sódio. Na prática clínica, o RFG é medido calculando-se a taxa de depuração de creatinina.
Quando a FENa% é inferior a 1%, é alta a probabilidade de se tratar de uma IRA pré-renal,
enquanto uma FENa% superior a 3% sugere a presença de uma NTA. No entanto, na
maioria das vezes os valores do sódio urinário, da osmolalidade e da fração de excreção de
sódio situam-se numa "zona cinzenta", impossibilitando o diagnóstico conclusivo. Desta
forma, a melhor maneira de distinguir entre uma IRA pré-renal e uma NTA é a realização
de um teste terapêutico: corrige-se o débito cardíaco e/ou o volume intravascular
utilizando-se as medidas terapêuticas apropriadas: cardiotônicos e diuréticos no caso de
uma insuficiência cardíaca grave, reposição de volume em casos de hipovolemia por perdas
externas. Se essa correção resultar em uma rápida recuperação do fluxo urinário, impõe-se
o diagnóstico de IRA pré-renal. Por outro lado, se a oligúria e o baixo RFG persistirem
apesar da correção do débito cardíaco e do volume intravascular, é altamente provável
estarmos lidando com uma IRA renal. É importante notar que esse teste terapêutico deve
ser realizado com extremo cuidado, para evitar sobrecargas hídricas que coloquem em risco
os pacientes portadores de IRA renal estabelecida.
Manifestações clínicas da IRA
A queda abrupta da filtração glomerular faz com que várias substâncias tóxicas
normalmente eliminadas pelo rim, principalmente os catabólitos finais dos compostos
nitrogenados, como a uréia, passem a ser retidas. Essa retenção provoca disfunções em
vários órgãos e sistemas e origina o quadro clínico de uremia, que é a manifestação mais
dramática da insuficiência renal. Apesar do nome, sabe-se hoje que a uréia não é o principal
responsável pela síndrome urêmica, não havendo ainda consenso acerca de qual ou quais
são as principais toxinas causadoras desse quadro. Na IRA renal oligúrica, em que ocorre
lesão renal grave, os rins perdem, além de sua função de eliminar escórias, também a
capacidade de regular o balanço de água e sódio, o que provoca retenção de fluidos e o
desenvolvimento de hipertensão e edema, incluindo o edema agudo pulmonar, com
conseqüências obviamente graves e potencialmente mortais. Se o balanço positivo de água
predominar em relação ao de sódio, pode ocorrer hiponatremia e edema intracelular, com
graves conseqüências neurológicas (ver Capítulo 7).
A IRA compromete também a excreção de outros eletrólitos além do sódio. A alteração
eletrolítica potencialmente mais perigosa provocada pela IRA é a hipercalemia, que pode
causar arritmias graves e mesmo mortais (ver Capítulo 8). Quadros de acidose metabólica
com anion gap normal ou elevado são comuns (ver Capítulo 12). Finalmente, as funções
renais endócrinas também podem ser prejudicadas, o que pode gerar anemia e distúrbios do
metabolismo do cálcio. É freqüente a ocorrência de hipocalcemia, hiperfosfatemia e
hipermagnesemia, que usualmente não necessitam de correção. A Tabela 14-5 resume os
principais sinais e sintomas da IRA renal, agrupados com base nos órgãos e sistemas
acometidos.
O quadro clínico da NTA persiste durante 2 a 4 semanas, até que ocorra a recuperação
das estruturas renais comprometidas, com resolução das micro-obstruções tubulares e
regeneração dos túbulos necrosados. Usualmente, a recuperação da diurese precede a
normalização da filtração glomerular, o que possivelmente reflete o tempo necessário a que
se refaça completamente a anatomia dos túbulos e a polarização das células. Vale ressaltar
que essa regeneração nem sempre acontece: cerca de 1 a 5% dos pacientes com IRA jamais
recuperam a função renal, evoluindo para IRC terminal e tornando-se permanentemente
dependentes de diálise.
Tabela 14-5
Principais manifestações clínicas da IRA renal
Digestivo: inapetência, náuseas, vômitos incoercíveis, sangramento digestivo
Cárdio-respiratório: dispnéia, edema, hipertensão arterial, insuficiência cardíaca, edema
agudo de pulmão, arritmias, pericardite
Neurológico: sonolência, tremores, agitação, convulsão, coma
Hematológico: sangramentos, anemia
Imunológico: depressão imunológica, tendência a infecções
Nutricional: catabolismo aumentado, balanço nitrogenado negativo, perda de
massa muscular
Cutâneo: prurido
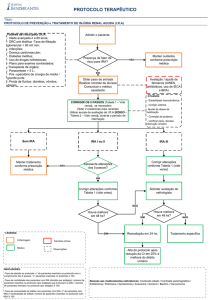
Tratamento e profilaxia da IRA
A conduta profilática mais importante para a prevenção da NTA é a otimização
rápida e adequada do volume intravascular e do débito cardíaco. Mesmo em quadros de
IRA renal já estabelecida, deve-se manter o doente convenientemente hidratado para evitar
agressão isquêmica adicional ao rim (obviamente o excesso de volume deve ser evitado
com rigor ainda maior). Drogas e substâncias nefrotóxicas devem ser utilizadas
judiciosamente, sempre com monitoração da função renal. Patologias específicas como
glomerulites, vasculites e nefrites intersticiais devem ser adequadamente tratadas.
Conforme discutido acima, quadros de obstrução renal devem ser resolvidos com a maior
rapidez possível.
Por outro lado, uma vez instalado o quadro de NTA, não existe conduta capaz de
revertê-lo. O tratamento desses pacientes baseia-se essencialmente em medidas de suporte,
essenciais para manter o paciente em boas condições clínicas enquanto se aguarda a
recuperação da função renal. Estas medidas incluem prevenção e tratamento da
hipervolemia (e também , quando necessário, da hipovolemia), a prevenção e o tratamento
da hiponatremia e da hipercalemia, a profilaxia de sangramentos digestivos, a nutrição
adequada e a prevenção de infecções. Alguns clínicos recomendam o uso de diuréticos de
alça, numa tentativa de trazer o fluxo urinário a níveis mais próximos dos fisiológicos.
Com isso, busca-se tornar mais fácil a manutenção do balanço hídrico do paciente, sem
necessidade de diálise. Outros argumentam que esse procedimento pode transformar a IRA
renal oligúrica em uma não oligúrica, melhorando assim o prognóstico da doença. Não se
estabeleceu até o momento se essa conduta tem realmente um impacto benéfico sobre o
prognóstico e a sobrevida desses pacientes.
Quando as conseqüências clínicas da IRA chegam a ameaçar a sobrevivência
imediata do paciente e não respondem ao tratamento convencional, não resta outra
alternativa a não ser o tratamento dialítico. São indicações clássicas de diálise as
manifestações características da síndrome urêmica, tais como a presença de vômitos
incoercíveis, sangramentos, pericardite ou confusão mental. Indica-se também a realização
de tratamento dialítico quando o paciente manifesta tendência, não responsiva a tratamento
clínico, à retenção de fluidos e ao desenvolvimento de hipervolemia e edema pulmonar.
Também a hipercalemia e a acidose persistentes exigem essa indicação. A tabela 14-6 lista
as indicações principais de diálise em IRA.
Tabela. 14-6 - INDICAÇÕES DE DIÁLISE NA IRA
_________________________________________________________________
- Hiperpotassemia
- Hipervolemia: edema periférico, derrames pleural e pericárdico, ascite,
hipertensão arterial e ICC
- Uremia: sistema nervoso central (sonolência, tremores, coma e convulsões)
sistema cardiovascular (pericardite e tamponamento pericárdico),
pulmões (congestão pulmonar e pleurite)
aparelho digestivo (náuseas, vômitos e hemorragias digestivas)
Acidose metabólica
Outras: hipo ou hipernatremia, hipo ou hipercalcemia, hiperuricemia,
hipermagnesemia, hemorragias devido a distúrbios plaquetários,
insuficiência cardíaca congestiva refratária, hipotermia e intoxicação exógena
Nos últimos anos diversos métodos dialíticos tem-se tornado disponíveis para o
tratamento da IRA, conforme descrito na Tabela 14-7.
Tabela 14-7. Métodos dialíticos para o tratamento da IRA
_______________________________________________________________________
Métodos intermitentes
Métodos contínuos
_________________________________________________________________
Diálise peritoneal (DP) intermitente
DP ambulatorial contínua
Hemodiálise intermitente
Ultrafiltração contínua lenta
Hemofiltração intermitente
Hemofiltração A-V contínua
Hemofiltração V-V contínua
Hemodiálise A-V contínua
Hemodiálise V-V contínua
Hemodiafiltração A-V contínua
Hemodiafiltração V-V contínua
_______________________________________________________________________
A-V (arteriovenosa) ; V-V (veno-venosa)
A diálise consiste na depuração sangüínea através de membranas semi-permeáveis
naturais (peritôneo) ou extra-corpóreas (filtros de hemodiálise/hemofiltração), aplicada em
substituição à função renal. A diálise permite a remoção de substâncias tóxicas e de fluidos
(ultrafiltrado), a fim de manter o equilíbrio ácido-básico, eletrolítico e volêmico. A diálise
peritoneal (DP) é realizada através de cateteres introduzidos na cavidade peritoneal para
que esta seja irrigada com soluções salinas balanceadas contendo dextrose. A remoção das
toxinas e fluidos se faz por difusão (transporte de solutos através de membrana semipermeável a favor de um gradiente de concentração) e por convecção (transferência em
massa de solutos através da membrana semi-permeável, arrastados pelo fluxo de água). A
proporção entre esses dois componentes no procedimento dialítico varia conforme a
necessidade do paciente. Se a prioridade for a remoção de fluido (pacientes em
hipervolemia), o procedimento indicado pode ser a hemofiltração, que se baseia
exclusivamente no movimento de fluido. Se também houver necessidade de remoção de
solutos, a escolha poderá recair sobre a hemodiálise, na qual ocorre a remoção de fluido e
também de solutos. Já a hemodiafiltração utiliza membranas de alta permeabilidade, que
permitem a retirada rápida de fluido e também a remoção de moléculas maiores, como por
exemplo certos mediadores inflamatórios em casos de sepsis.
O procedimento dialítico pode ser artério-venoso (o fluxo extra-corpóreo inicia-se
em uma artéria e termina em uma veia) ou veno-venoso (com início e término em uma veia
central). Esta última via de acesso vascular é mais utilizada atualmente, através da
implantação de cateteres de dupla luz em veias centrais. Todos os procedimentos dialíticos
podem ser intermitentes ou contínuos, dependendo das necessidades dos pacientes, da
presença de patologias associadas, da disponibilidade de equipamentos e do treinamento
das equipes médicas e de enfermagem.
EXERCÍCIOS
Reveja a absorção de água, sódio e potássio no néfron na situação “normal”.
Observe a composição dos solutos urinários nessas condições, assim como as
concentrações urinárias de sódio e de potássio. Elas nos auxiliarão a distinguir entre os
tipos de IRA.
Reveja também os efeitos do furosemide e da administração de volume sobre os
parâmetros mencionados acima.
3-) Simule agora uma IRA pré-renal. O que acontece ao RFG? E às cargas
excretadas de sódio e potássio? E às concentrações urinárias de sódio e potássio? E à
composição de solutos da urina? O que acontece à osmolalidade urinária?Qual o efeito da
reposição de volume? Faz sentido administrar furosemide nessas circunstâncias? Por que?
Observe os comentários que aparecem no alto à direita. Eles vão aparecer outras vezes
4-) Repita os procedimentos acima após simular uma IRA renal. Observe o que
acontece às células tubulares nessas circunstâncias (clique em “ver célula”).
4-) Repita os procedimentos acima após simular uma IRA não oligúrica. Clique em
“ver célula” novamente para observar o que acontece às células tubulares
5-) Com base nessas observações: a) como se pode distinguir entre uma IRA prérenal e uma IRA renal? Qual o melhor tratamento para uma IRA pré-renal? O que fazer
quando se tem uma IRA renal? E uma IRA não-oligúrica?