QUÍMICA GERAL
P R O F. PAU LO VA L I M
11
GABARITO
E aí Gás Nobre,
Aqui está o gabarito das questões, não olhe o gabarito antes de tentar resolvê-las.
Tá bom?
Tô de olho em vc! RHUM! :)
40
AAAAAAHHHHHH
RÁÁÁÁÁÁ
TEM CERTEZA QUE JÁ
TENTOU RESOLVER
PRIMEIRO?
41
CUIDADO
GABARITO
NA
PRÓXIMA
PÁGINA!!!
42
REAGE
GÁS
NOBRE!!!!
VAI RESOLVER A
QUESTÃO
E DEPOIS
VC VOLTA AQUI!
43
Acabou a zuera rsrs, aqui o gabarito. Tudo isso é para o seu bem! =)
CAPÍTULO I - INTRODUÇÃO A QUÍMICA
Questão 01 - (UPE PE/2013)
Gab: E
Questão 02 - (UFT TO/2013)
Gab: A
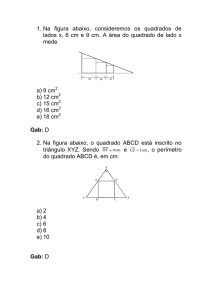
Questão 03 - (UNICAMP SP/2012)
Gab:
a)
A reação que ocorre na superfície do óleo é uma combustão. Ela pode ser contida com a colocação do pano
molhado porque ele diminui o contato do gás oxigênio com o óleo e a temperatura do sistema.
b)
A água jogada na panela em chamas poderia ferver na superfície do óleo, e o vapor d’água, em elevada temperatura, acarretaria risco de ferimento em quem estivesse próximo.
Questão 04 - (UFRN/2012)
Gab: D
Questão 05 - (PUC MG/2013)
Gab: A
Questão 06 - (UPE PE/2012)
Gab: C
Questão 07 - (FUVEST SP/2012)
Gab: A
Questão 08 - (FAMECA SP/2012)
Gab: B
Questão 09 - (FGV SP/2013)
Gab: D
Questão 10 - (UEPG PR/2013)
Gab: 23
Questão 11 - (UEM PR/2012)
Gab: 24
44
Questão 12 - (IFSP/2013)
Gab: A
Questão 13 - (UFGD MS/2013)
Gab: C
Questão 14 - (UEFS BA/2013)
Gab: D
Questão 15 - (UFPB/2013)
Gab: A
Questão 16 - (IFSP/2013)
Gab: B
Questão 17 - (UEM PR/2013)
Gab: 23
Questão 18 - (UERJ/2013)
Gab: Substância A
Destilação, pois seus pontos de ebulição são distintos.
Questão 19 - (UFPR/2013)
Gab: A
CAPÍTULO II - O ÁTOMO
Questão 01 - (UFG GO/2013)
Gab: C
Questão 02 - (UECE/2013)
Gab: B
Questão 03 - (UEFS BA/2013)
Gab: E
Questão 04 - (UFG GO/2012)
Gab:
a)
A Lei de Conservação das Massas formula o princípio empírico de que a massa dos reagentes é a mesma dos
produtos. Dessa forma, na combustão, a massa residual (sólida) é menor, considerando-se que parte dos reagentes é trans
45
formada em produtos gasosos que, antes dos experimentos de Lavoisier, não eram quantificados. Na oxidação dos metais,
a massa residual é aumentada em decorrência da reação com o oxigênio que produz óxidos metálicos sólidos.
b)
C (s) + O2 (g) CO2 (g)
Mg(s) + ½ O2 (g) MgO(s)
Questão 05 - (UFG GO/2013)
Gab: D
Questão 06 - (UFGD MS/2013)
Gab: D
Questão 07 - (UFRN/2013)
Gab: A
Questão 08 - (UECE/2013)
Gab: B
Questão 09 - (UNIFOR CE/2013)
Gab: A
Questão 10 - (UERJ/2012)
Gab: D
Questão 11 - (UNEMAT MT/2012)
Gab: B
Questão 12 - (UDESC SC/2012)
Gab: A
Questão 13 - (MACK SP/2013)
Gab: E
Questão 14 - (UEPG PR/2013)
Gab: 15
Questão 15 - (UERJ/2013)
Gab: B
Questão 16 - (UDESC SC/2013)
Gab: D
46
Questão 17 - (UEPG PR/2013)
Gab: 18
Questão 18 - (UFPB/2013)
Gab: C
Questão 19 - (UDESC SC/2012)
Gab: B
CAPÍTULO III – QUANTIDADES E MEDIDAS
Questão 01 - (UFPE/2012)
Gab: VVVFF
Questão 02 - (UECE/2012)
Gab: C
Questão 03 - (UFPE/2011)
Gab: FVVFV
Questão 04 - (UFPE/2011)
Gab: FFFVV
Questão 05 - (UCS RS/2013)
Gab: D
Questão 06 - (UEM PR/2013)
Gab: 23
Questão 07 - (UEM PR/2012)
Gab: 09
Questão 08 - (UCS RS/2011)
Gab: C
Questão 09 - (PUC RJ/2013)
Gab: C
Questão 10 - (UFTM MG/2013)
47
Gab: B
Questão 11 - (PUC Camp SP/2013)
Gab: B
Questão 12 - (ACAFE SC/2013)
Gab: C
Questão 13 - (UEM PR/2013)
Gab: 12
Questão 14 - (UNICAMP SP/2013)
Gab: C
CAPÍTULO IV – TABELAS PERIODICAS
Questão 01 - (UERJ/2014)
Gab: B
Questão 02 - (UERJ/2014)
Gab: A
Questão 03 - (FUVEST SP/2013)
Gab: E
Questão 04 - (PUC RJ/2013)
Gab: C
Questão 05 - (PUC RJ/2013)
Gab: E
Questão 06 - (UCS RS/2013)
Gab: C
Questão 07 - (UDESC SC/2013)
Gab: D
Questão 08 - (UEPG PR/2013)
Gab: 09
48
Questão 09 - (UERJ/2013)
Gab: C
Questão 10 - (MACK SP/2013)
Gab: C
Questão 11 - (UDESC SC/2013)
Gab: E
Questão 12 - (UECE/2013)
Gab: C
Questão 13 - (UEG GO/2013)
Gab:
a)
O elemento A apresenta um número atômico (Z) igual a 20.
b)
A perda de elétrons por parte do átomo eletricamente neutro leva a uma espécie química como maior carga
nuclear efetiva, o que confere ao íon um menor raio atômico.
Questão 14 - (UEM PR/2013)
Gab: 21
Questão 15 - (UEPG PR/2013)
Gab: 27
Questão 16 - (UFG GO/2013)
Gab:
a)
Os compostos NaCl, HCl, CH3COOH e NaOH são alguns exemplos formados a partir de combinações entre
os elementos citados que apresentam solubilidade e condutividade elétrica em solução aquosa.
b)
Na > Cl > C > O > H. O raio atômico aumenta de acordo com a quantidade de camadas eletrônicas. No
mesmo nível da tabela periódica, ou seja, quando os átomos tem a mesma quantidade de níveis eletrônicos, considera-se
que o aumento do número de prótons aumenta a atração sofrida pelos elétrons de valência, reduzindo o raio atômico.
CAPÍTULO V - LIGAÇÕES
Questão 01 - (UEPG PR/2013)
Gab: 30
Questão 02 - (UERJ/2013)
Gab:
ZrO2
Ligação iônica
Um dos alótropos:
49
- grafite
- fulereno
Questão 03 - (UFRN/2013)
Gab: C
Questão 04 - (Fac. Santa Marcelina SP/2013)
Gab: C
Questão 05 - (UDESC SC/2013)
Gab: A
Questão 06 - (UEG GO/2013)
Gab:
a)
A situação de maior estabilidade ocorre no ponto 4 (quatro) devido a máxima sobreposição dos orbitais
atômicos entre os átomos de hidrogênio, o que é justificado pelo ponto de mínima energia na curva de energia potencial
relativa.
b)
No ponto 1 (um) a interação entre os átomos de hidrogênio é considerada nula, o que é justificado por uma
energia potencial relativa igual a zero.
Questão 07 - (UEM PR/2013)
Gab: 19
Questão 08 - (UEG GO/2013)
Gab:
a)
!
!
!
!
b)
Metano: Tetraédrica
Amônia: Piramidal
Água: Angular
Hidrogênio: Linear
Questão 09 - (FATEC SP/2013)
Gab: E
Questão 10 - (UEM PR/2013)
Gab: 03
Questão 11 - (UEG GO/2012)
Gab: D
50
Questão 12 - (UEM PR/2012)
Gab: 14
Questão 13 - (UEPG PR/2013)
Gab: 21
Questão 14 - (UFPE/2013)
Gab: VFFFV
Questão 15 - (UDESC SC/2012)
Gab: D
Questão 16 - (UECE/2012)
Gab: C
Questão 17 - (IFGO/2012)
Gab: C
Questão 18 - (UFG GO/2011)
Gab:
!
a)
b)
Os elementos do Grupo 16 são mais eletronegativos que os elementos do Grupo 14, assim suas ligações com
o hidrogênio são mais polares, formando interações intermoleculares mais fortes. Já os elementos do grupo 14 possuem
interações intermoleculares mais fracas.
Questão 19 - (ACAFE SC/2011)
Gab: B
51