COLÉGIO RESSURREIÇÃO NOSSA SENHORA
Data:
Série/Turma:
01/12/2015
2ª Série
Disciplina:
Professor(a):
Química
Natan
Exercícios
Período:
Recuperação final
4o. Bimestre
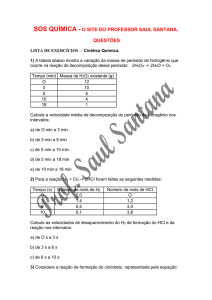
01. Para investigar a cinética da reação representada pela equação:
NaHCO3(s) + H+X-(s) H O
Na+(aq) + X-(aq) + CO2(aq) + H2O(l)
+
H X (s) = ácido orgânico sólido.
foram realizados três experimentos, empregando comprimidos de antiácido efervescente, que contêm os dois reagentes
no estado sólido. As reações foram iniciadas pela adição de iguais quantidades de água aos comprimidos, e suas
velocidades foram estimadas observando-se o desprendimento de gás em cada experimento. O quadro a seguir resume
as condições em que cada experimento foi realizado.
Assinale a alternativa que apresenta os experimentos em ordem crescente de velocidade de reação:
A - I, II, III
Experimento
Forma de adição de
Temperatura
B -II, I, III
cada comprimido (2g)
da água (°C)
C -III, I, II
I
Inteiro
40
D -II, III,
II
Inteiro
20
E -III, I, II
III
Moído
40
2
02. Uma certa quantidade de acetaldeído se decompõe, segundo a reação abaixo, com uma cinética de segunda ordem
(k = 2,0 mol-1 s-1). C2H4O(g) → CH4(g) + CO(g)
Assinale a alternativa incorreta.
a) Se a concentração inicial do acetaldeído for duplicada, a reação ocorre com uma velocidade inicial 4 vezes maior.
b) A velocidade da reação depende da temperatura.
c) Se a reação ocorrer em um recipiente fechado, à temperatura constante, a pressão aumenta à medida que a reação
de formação dos produtos ocorre.
d) Se a concentração inicial de acetaldeído for 0,002 mol.L-1, a velocidade inicial da reação será 0,004 mol.L-1.s-1.
e) A energia de ativação de uma reação é a energia mínima que o(s) reagente(s) precisam para formar os produtos,
isto é, para que a reação se inicie.
03. A quantidade mínima de energia necessária para o início de uma reação espontânea é chamada:
a) energia de ativação; b) entalpia da reação; c) entropia da reação; d) energia da reação.
04. Em aquários, utilizam-se borbulhadores de ar para oxigenar a água. Para um mesmo volume de ar bombeado nesse
processo, bolhas pequenas são mais eficientes, porque em bolhas pequenas:
a) a área superficial total é maior;
b) a densidade é menor;
c) a pressão é maior;
d) a velocidade de ascensão é menor;
e) o volume total é menor.
05. Analise as afirmativas abaixo.
I. A energia de ativação de uma reação química aumenta com o aumento da temperatura do sistema reacional.
II. A velocidade de uma reação química é determinada pela etapa mais lenta.
III. A variação de entalpia de uma reação independe do uso de catalisadores.
IV. Todas as colisões entre as moléculas de um reagente são efetivas, excetuando-se quando os reagentes são
líquidos e em temperaturas baixas.
Assinale a alternativa que contempla as afirmativas corretas:
A - I, II e IV, apenas.
B -II, III e IV, apenas. C -I, III e IV, apenas. D - II e III, apenas.
E -I e III, apenas.
06. No filme O Náufrago, o personagem teve de iniciar uma fogueira a partir do aquecimento de cascas
secas de coco através do calor gerado pelo atrito de pedaços de madeira. Quimicamente, o atrito
desses pedaços de madeira serve como:
a) entalpia inicial;
b) catalisador;
c) calor de combustão;
d) inibidor; e)energia de ativação.
07. Julgue como verdadeira ou falsa cada uma das afirmações abaixo:
( ) I. Todas as colisões moleculares entre quaisquer gases diferentes levam à reação química.
( ) II. A colisão molecular é efetiva se tiver orientação adequada e se estiver promovida de um mínimo de energia.
( ) III. A energia mínima de que as moléculas necessitam para reagir por colisão chama-se energia de ativação, que
pode ser baixada pelo uso de um catalisador.
( ) IV. Em processos que se apresentam duas ou mais etapas, a velocidade da reação é determinada pela etapa
mais rápida, por requerer maior energia de ativação.
( )V. A energia de ativação de uma reação depende da natureza das substâncias reagentes.
08. com relação à reação 2A + 3B 2C + D, podemos afirmar que:
a) os reagentes (A e B) são consumidos com a mesma velocidade;
b) a velocidade de desaparecimento de A é igual à velocidade de aparecimento de C;
c) os produtos (C e D) são formados com a mesma velocidade;
d) a velocidade de aparecimento de D é três (3) vezes maior que a velocidade de desaparecimento de B;
e) a velocidade de desaparecimento de A é a metade da velocidade de aparecimento de D.
09. A combustão total de gás propano, dada abaixo pela equação não balanceada, ocorre à velocidade de x litros por
minuto, medidos nas CNTP. a velocidade de formação de gás carbônico, medida nas mesmas condições,
comparada à de combustão de gás propano:C3H8 + O2 CO2 + H2O
a) quadruplica;
b) triplica;
c) duplica;
d) é a mesma; e) é três vezes menor.
10. Se a velocidade de uma reação química é dada pela expressão v- k[A]n, diz-se que a reação é de ordem:
a) A
b) l
c) k
d) v
e) n
11. Encontrou-se experimentalmente que para uma certa reação, quando a concentração de um reagente A era
duplicada, a velocidade da referida reação se tornava quatro vezes maior. Tal constatação permite afirmar que a
reação é, em relação a A, de:
a) ordem zero; b) primeira ordem;
c) segunda ordem;
d) terceira ordem;
e) quarta ordem.
12. Outubro é um mês de festas para os cidadãos de Belém. É neste mês que se realiza o Círio de N. S. de Nazaré,
considerado o Natal dos paraenses. É um mês em que se cometem muitos exageros alimentares. Come-se de um
tudo, principalmente pato no tucupi, maniçoba e outras comidas típicas, nem um pouco facilmente digeríveis pelos
ácidos gástricos. Nosso estômago e fígado sofrem com os exageros cometidos. Para combater a “azia”, que
geralmente acompanha esse festival gastronômico, é comum tomarmos algum antiácido. Supondo que seja um
comprimido efervescente, assinale a alternativa que indica a situação em que esse comprimido agirá mais
rapidamente em nosso organismo:
a) inteiro, em água a cerca de 45°C;
b) pulverizado, em água a uma temperatura aproximada de 45°C;
c) inteiro, em água a aproximadamente 6°C;
d) pulverizado, em água a uma temperatura aproximada de 6°C.
13. No mundo moderno, são utilizadas diversas formas de conservação de alimentos com o objetivo de preservar a
saúde das pessoas, bem como prolongar o tempo de vida e a qualidade dos alimentos consumidos pela sociedade.
Entre os processos de conservação de alimentos relacionados a seguir, todos objetivam a eliminação da reação do
oxigênio do ar com os alimentos, com exceção de:
a) Armazenar carne frita ou cozida em óleo ou banha.
b) Armazenar os alimentos em embalagens a vácuo.
c) Adição de substâncias antioxidantes aos alimentos.
d) Embalar os embutidos e carne em uma película de parafina.
e) Adição de cloreto de sódio às carnes e secá-las ao sol.
14. “Colocar o alimento no freezer retarda a ação dos microrganismos; usar conservantes diminui a velocidade da
reação, ou seja, o alimento irá se conservar mais tempo.”
“Os aditivos atuam protegendo os alimentos dos microrganismos e deixando inalterados a cor, o aroma, a
consistência, a umidade, etc.”
“A contextualização no ensino de cinética química”. Química nova escola, n. 11, maio 2000.
Sobre cinética química, julgue as afirmativas marcando V ou F:
( ) I. Estão entre as condições para que uma reação ocorra, o contato entre os reagentes e a afinidade química.
( ) II. Considerando a reação elementar H3O+ + OH– → 2 H2O, a velocidade dessa reação pode ser calculada pela
expressão: V = k . [H3O+] . [OH–] . [H2O].
( ) III. A elevação da temperatura aumenta a velocidade de reações químicas exotérmicas e endotérmicas, favorecendo
mais as reações endotérmicas, pois essas reações ocorrem com absorção de calor.
( ) IV. Os catalisadores são substâncias que aumentam a energia de ativação e, consequentemente, a velocidade das
reações químicas.
15. Ao realizar a reação de formação da água a partir dos gases hidrogênio (H 2) e oxigênio (O2) verificou-se que a
velocidade de consumo de oxigênio foi de 4mol/min. Determine para o mesmo intervalo de tempo:
Dados: 2H2(g) + O2(g) → 2H2O(l)
a) a velocidade de consumo do hidrogênio.
b) a velocidade de formação da água.
16. O air bag é um dispositivo de segurança utilizado em alguns veículos. Em caso de acidente, ele é inflado com gás
nitrogênio (N2), produzido em uma rápida reação química: 2NaN 3(s) → 2Na(s) + 3N2(g).
O tempo necessário para que um air bag encha completamente, atingindo um volume final de 54 litros é de um vigésimo
de segundo.
Sabendo-se que nas condições de pressão e temperatura de um air bag inflado, 1 mol de gás ocupa 20 litros,
a) determine a velocidade média de produção do N2 em litros/segundo e em mols por segundo.
b) quantos mols de nitrogênio (N2) são produzidos para inflar com 54 litros o air bag?
c) O gráfico abaixo se refere as quantidades de reagente e produtos da reação. Associe as curvas A, B e C com a
substâncias NaN3 ,Na e N2.
17. A reação química entre N2O e NO produz N2 e NO2. O mecanismo dessa reação está representado no diagrama:
a) Como se chama a situação representada por “N2O2? __________________
___________________________________________________________
b) A que corresponde o trecho marcado com a letra Y? __________________
___________________________________________________________
c) A que corresponde o trecho marcado com a letra X? __________________
___________________________________________________________
d) A reação em questão é endotérmica ou exotérmica? Justifique sua escolha.
_____________________________________________________________
_____________________________________________________________
18. É dado o mecanismo:
1ª etapa: O3 + NO2 → O2 + NO3 (etapa lenta)
2ª etapa: NO3 + NO2 →N2O5 (etapa rápida)
a) Escreva a equação global do mecanismo.
b) Qual das etapas é a “etapa determinante da velocidade” do processo global?
c) Quantas e quais são as moléculas que colidem na “etapa determinante da velocidade”?
d) Represente a equação da velocidade (lei cinética) da reação global.
19. Sabendo-se que o mecanismo da reação é
Etapa I 2NO + O2 → 2NO2 (lenta)
Etapa II 2SO2 + NO2 → 2NO + 2SO3 (rápida)
a) Escreva a equação global do processo
b) Que papel desempenha o NO?
c) Escreva a equação da velocidade da reação global.
d) Como o SO2 influi na velocidade da reação?
20. “Catalisadores são substâncias reagentes que iniciam reações químicas que, sem eles, não seriam possíveis”.
Aponte os erros conceituais presentes nessa frase.