Setor 3306
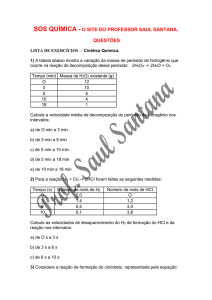
Aula 20 – Lei da velocidade das reações
Complemento.
As reações químicas podem ocorrer nas mais diferentes velocidades. Existem reações tão
lentas que levam milhares de anos para ocorrer, como a formação do petróleo a partir da
decomposição de matéria orgânica. Há também reações que ocorrem de maneira muito
rápida, liberando uma grande quantidade de energia em um pequeno intervalo de tempo,
uma explosão.
Muitas vezes é necessário acelerar uma reação química, para que essa seja aplicada em um
processo industrial. Em outras é necessário retardar uma reação, para que essa seja
controlável ou menos perigosa. Ou seja, é de grande importância alterar a velocidade de uma
reação química nas mais diversas situações.
São diversos os fatores que alteram a velocidade da reação química. Quase todos eles
influenciam na quantidade de choques eficazes entre as moléculas dos reagentes. Lembre-se
que um choque eficaz é aquele que ocorre entre as moléculas dos reagentes na posição
correta (geometria favorável) e com uma quantidade mínima de energia (a energia de
ativação).
Fatores que alteram a velocidade da reação:
Concentração dos reagentes – Quanto maior a concentração dos reagentes, maior a
velocidade da reação.
Aumentar a concentração dos reagentes significa aumentar a quantidade de moléculas das
substâncias em um mesmo espaço (volume). O aumento da quantidade de moléculas irá
provocar um aumento do número de choques e, consequentemente, um número de choques
eficazes, aumentando então a velocidade da reação.
Da mesma forma, quanto menor for a concentração dos reagentes, menor a velocidade da
reação.
Pressão – Quanto maior a pressão de um gás, maior a velocidade da reação.
Quando ocorre uma transformação isotérmica (com temperatura constante), um aumento da
pressão tem o mesmo efeito que o aumento da concentração dos reagentes. Isso porquê o
aumento da pressão será uma consequência ou do aumento da quantidade de moléculas ou
da diminuição do volume do sistema. Em ambos os casos ocorre um aumento da
concentração. Podemos observar isso com uma manipulação na equação do estado gasoso:
[ ]
Na equação observamos que a pressão de um gás é diretamente proporcional a sua
concentração. Assim, quanto maior a pressão de um gás, maior a sua concentração e,
portanto, maior a velocidade da reação química.
Temperatura – Quanto maior a temperatura do sistema, maior a velocidade da reação
química.
Quando aquecemos um sistema, o calor é transferido às moléculas dos reagentes e convertido
em energia cinética (as moléculas se movimentam com maior energia). Quando as moléculas
possuem uma maior energia, é mais fácil que essas alcancem a energia de ativação necessária
para formar o complexo ativado. Com uma maior quantidade de moléculas com energia igual a
energia de ativação, maior será a quantidade de choques efetivos e, portanto, maior a
velocidade da reação.
Além do que, o simples fato das moléculas se movimentarem, no mesmo espaço, com uma
maior velocidade resultará em uma maior quantidade de choques e, consequentemente, uma
maior quantidade de choques efetivos.
Da mesma forma, uma diminuição da temperatura diminui a energia cinética das moléculas e,
portanto, uma diminui a velocidade da reação.
É importante lembrar que o aumento da temperatura sempre provocará um aumento da
velocidade da reação química, independentemente dessa ser endotérmica ou exotérmica.
Superfície de contato nos reagentes sólidos – Quanto maior a superfície de contato, maior a
velocidade da reação química.
Caso um dos reagentes seja sólido, os choques entre as moléculas só ocorrerão na superfície
do sólido. Assim, quanto mais finamente dividido (quanto mais pulverizado) for o sólido, maior
será a superfície de contato e assim, maior a quantidade de choques entre as moléculas dos
reagentes, aumentando, consequentemente, a velocidade da reação química.
Catalisador – a presença de um catalisador diminui a energia de ativação do processo,
aumentando a velocidade da reação química.
A ação de um catalisador em uma reação química pode ocorrer de duas formas. O catalisador
pode criar um caminho alternativo ao processo, com uma menor energia de ativação e,
portanto, mais rápido. Ou ainda pode facilitar a ocorrência dos choques efetivos
enfraquecendo a ligação química dos reagentes, facilitando então a formação do complexo
ativado.
Um exemplo de reação catalisada é a decomposição da água oxigenada formando água e gás
oxigênio:
2 H2O2(aq) 2 H2O(l) + O2(g)
Essa reação, no escuro e em temperatura ambiente, ocorre de maneira muito lenta. O ânion
iodeto atua como um catalisador nesse processo, criando um caminho diferente composto por
duas etapas, ambas mais rápidas que a reação sem o catalisador:
H2O2(aq) + I-(aq) H2O(l) + IOIO-(aq) + H2O2(aq) H2O(l) + O2(g) + I-(aq)
2 H2O2(aq) 2 H2O(l) + O2(g)
Repare que o ânion iodeto é restaurado no final do processo. Essa é uma característica de
todos os catalisadores: sua quantidade é conservada no final do processo.
Lei da Velocidade das reações
A relação entre a velocidade de uma reação química e os fatores que nela influenciam é dada
por uma equação conhecida como Lei da Velocidade da Reação.
Para uma reação genérica
aA + bB cC
a lei da velocidade é:
v = k[A]x[B]y
onde x e y são expoentes denominados ordem dos reagentes.
A ordem dos reagentes é determinada empiricamente e não são necessariamente iguais aos
coeficientes estequiométricos. Um exemplo dessa determinação é apresentado no exercício
resolvido a seguir:
Exercício Resolvido
(PUC) A reação
2 NO(g) + 2 H2(g) N2(g) + 2 H2O(g)
foi estudada a 904oC. Os dados da tabela seguinte referem-se a essa reação
[NO] (mol/L)
0,420
0,210
0,105
0,210
0,210
[H2] (mol/L)
0,122
0,122
0,122
0,244
0,336
Velocidade (mol/L.s)
0,140
0,035
0,0087
0,070
0,105
A respeito dessa reação é correto afirmar que sua expressão da velocidade é:
a) v = k[NO][H2]
d) v = k [NO]4[H2]2
b) v = k[NO]2[H2]
e) v = k [NO]2[H2]2
c) v = k[H2]
Resolução
Vamos considerar a expressão da lei da velocidade como sendo:
v = k[NO]X[H2]y ,
onde x e y são as ordens para os reagentes NO e H2, respectivamente.
Para determinar o valor de x, devemos analisar dois experimentos onde a concentração de NO
é alterada e a concentração de H2 é mantida constante e verificar como essa alteração
influenciou na velocidade da reação.
Observe as informações dos experimentos 1 e 2. Neles, a concentração de NO é alterada e a
concentração de H2 é mantida constante.
(
[
[
(
( )
]
)
]
)
(
(
)
)
( )
Para determinar o valor de y, devemos analisar dois experimentos onde a concentração de H2
é alterada e a concentração de NO é mantida constante e verificar como essa alteração
influenciou na velocidade da reação.
Observe as informações dos experimentos 2 e 4. Neles, a concentração de H2 é alterada e a
concentração de NO é mantida constante.
(
[
[
(
( ⁄ )
]
)
]
)
(
(
)
)
( ⁄ )
Portanto, a expressão para a lei da velocidade é: v = k[NO]2[H2].
Dizemos que a ordem da reação para o reagente NO vale 2 e que a ordem da reação para o
reagente H2 vale 1. A ordem global da reação vale 3.
A variação da velocidade da reação em relação a concentração de hidrogênio é de primeira
ordem. Isso significa que, dobrando a concentração de H2, a reação ficará duas vezes mais
rápida. Triplicando a concentração de H2, a reação ficará três vezes mais rápida.
A variação da velocidade da reação em relação a concentração de monóxido de nitrogênio é
de ordem dois. Isso significa que, dobrando a concentração de NO, a reação ficará quatro
vezes mais rápida. Triplicando a concentração de NO, a reação ficará oito vezes mais rápida.
Reações elementares:
Existem reações químicas que ocorrem em uma única etapa, chamadas de reações
elementares. Nesse caso, as ordens dos reagentes são iguais aos coeficientes estequiométricos
da reação.
Para uma reação genérica
aA + dD eE (elementar)
a lei da velocidade é: v = k[A]a[D]d
Um exemplo de reação elementar é o processo que ocorre entre o monóxido de nitrogênio e o
gás cloro:
2 NO + Cl2 2 NOCl (elementar)
Para essa reação, a lei da velocidade é: v = k[NO]2[Cl]
Reações não-elementares:
Muitas reações químicas ocorrem em várias etapas, cada uma com uma “velocidade”
diferente. A etapa que apresenta a maior energia de ativação é a etapa mais lenta e,
consequentemente, a etapa determinante da velocidade do processo.
Considere a reação hipotética:
2A +B2C
que se desenvolve em duas etapas:
1a Etapa:
A + B D (rápida)
2a Etapa:
D + A 2 C (lenta)
Eq. Global:
2A + B 2 C
De acordo com o mecanismo, o intermediário D é produzido rapidamente na primeira etapa
do processo. Porém, a segunda etapa do processo é lenta, de tal maneira que o reagente A e o
intermediário D vão se “acumulando” até que sejam transformados nos produtos C. Assim, a
segunda etapa, a etapa lenta, é a determinante da velocidade da reação.
Em uma reação não-elementar, a velocidade do processo é determinada pela etapa lenta.
Como a segunda etapa é a determinante da velocidade da reação, a lei da velocidade é escrita
em função dela: v = k[D][A]
Um exemplo de processo que ocorre em duas etapas é a reação entre o NO2 e o CO.
NO2 + CO NO + CO2
As etapas são:
1a Etapa:
2 NO2 NO + NO3 (lenta)
2a Etapa:
NO3 + CO CO2 + NO2 (rápida)
Eq. Global:
NO2 + CO NO + CO2
Sendo a primeira etapa a determinante da velocidade da reação, a lei de velocidade é escrita
em função dessa: v = k[NO2]2
Exercício Resolvido:
Considere a seguinte reação hipotética, seu mecanismo e o diagrama de energia para o
processo:
2 X + Y2 X2Y2
1a Etapa:
X + Y2 XY + Y
2a Etapa:
X + Y XY
3a Etapa:
2 XY X2Y2
a) Qual a etapa determinante da velocidade da reação?
b) Qual a lei da velocidade para esse processo?
c) Qual a energia de ativação para a reação química?
Resolução
a) Observando o diagrama, verificamos que a terceira etapa é a que apresenta a maior energia
de ativação. Dessa maneira, a terceira etapa é a mais lenta e, portanto, a etapa determinante
da velocidade da reação.
b) A lei da velocidade da reação é escrita em função da etapa lenta: v = k[XY]2
c) A energia de ativação é a diferença de energia entre os reagentes e o complexo ativado de
maior energia:
Assim, a energia de ativação é 35 kJ.
Extra
(ITA) Considere uma reação química representada pela equação: Reagentes Produtos. A
figura abaixo mostra esquematicamente como varia a energia potencial (Ep) deste sistema
reagente em função do avanço da reação química. As letras a, b, c, d e e representam
diferenças de energia.
Com base nas informações apresentadas na figura é correto afirmar que
a) a energia de ativação da reação direta é a diferença de energia dada por c - a + d.
b) a variação de entalpia da reação é a diferença de energia dada por e - d.
c) a energia de ativação da reação direta é a diferença de energia dada por b + d.
d) a variação de entalpia da reação é a diferença de energia dada por e - (a + b).
e) a variação de entalpia da reação é a diferença de energia dada por e.
RESOLUÇÃO: alternativa A
A energia de ativação de uma reação química é a diferença de energia entre os reagentes e o
complexo ativado de maior energia do processo.
Assim, o valor da energia de ativação é (c - a) + d.
TAREFA COMPLEMENTAR:
Unidade III, série 3: exercícios 30, 31 e 32.