CINÉTICA QUÍMICA
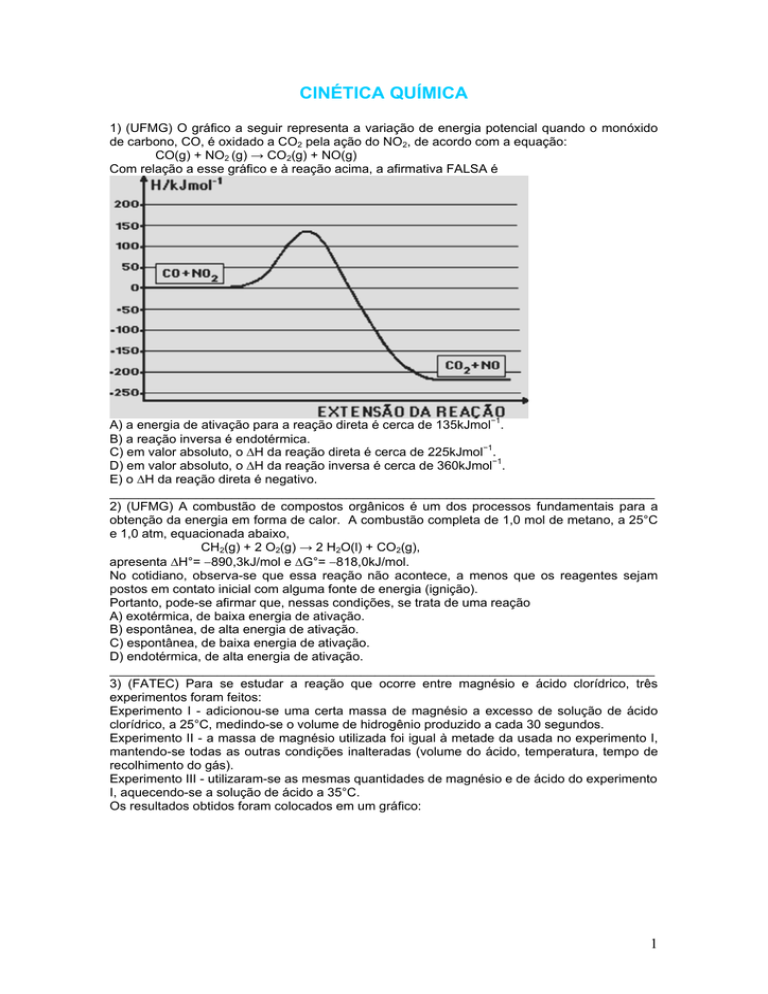
1) (UFMG) O gráfico a seguir representa a variação de energia potencial quando o monóxido
de carbono, CO, é oxidado a CO2 pela ação do NO2, de acordo com a equação:
CO(g) + NO2 (g) → CO2(g) + NO(g)
Com relação a esse gráfico e à reação acima, a afirmativa FALSA é
A) a energia de ativação para a reação direta é cerca de 135kJmol−1.
B) a reação inversa é endotérmica.
C) em valor absoluto, o ∆H da reação direta é cerca de 225kJmol−1.
D) em valor absoluto, o ∆H da reação inversa é cerca de 360kJmol−1.
E) o ∆H da reação direta é negativo.
____________________________________________________________________________
2) (UFMG) A combustão de compostos orgânicos é um dos processos fundamentais para a
obtenção da energia em forma de calor. A combustão completa de 1,0 mol de metano, a 25°C
e 1,0 atm, equacionada abaixo,
CH2(g) + 2 O2(g) → 2 H2O(l) + CO2(g),
apresenta ∆H°= −890,3kJ/mol e ∆G°= −818,0kJ/mol.
No cotidiano, observa-se que essa reação não acontece, a menos que os reagentes sejam
postos em contato inicial com alguma fonte de energia (ignição).
Portanto, pode-se afirmar que, nessas condições, se trata de uma reação
A) exotérmica, de baixa energia de ativação.
B) espontânea, de alta energia de ativação.
C) espontânea, de baixa energia de ativação.
D) endotérmica, de alta energia de ativação.
____________________________________________________________________________
3) (FATEC) Para se estudar a reação que ocorre entre magnésio e ácido clorídrico, três
experimentos foram feitos:
Experimento I - adicionou-se uma certa massa de magnésio a excesso de solução de ácido
clorídrico, a 25°C, medindo-se o volume de hidrogênio produzido a cada 30 segundos.
Experimento II - a massa de magnésio utilizada foi igual à metade da usada no experimento I,
mantendo-se todas as outras condições inalteradas (volume do ácido, temperatura, tempo de
recolhimento do gás).
Experimento III - utilizaram-se as mesmas quantidades de magnésio e de ácido do experimento
I, aquecendo-se a solução de ácido a 35°C.
Os resultados obtidos foram colocados em um gráfico:
1
As curvas que correspondem aos experimentos I, II e III são respectivamente,
A) B, A, C.
B) C, A, B.
C) C, B, A.
D) A, B, C.
E) A, C, B.
____________________________________________________________________________
4) (FUVEST) NaHSO4 + CH3COONa → CH3COOH + Na2SO4
A reação representada pela equação acima é realizada segundo dois procedimentos:
I. Triturando reagentes sólidos.
II. Misturando soluções aquosas concentradas dos reagentes.
Utilizando mesma quantidade de NaHSO4 e mesma quantidade de CH3COONa nesses
procedimentos, à mesma temperatura, a formação do ácido acético:
A) é mais rápida em II porque em solução a freqüência de colisões entre os reagentes é maior.
B) é mais rápida em I porque no estado sólido a concentração dos reagentes é maior.
C) ocorre em I e II com igual velocidade porque os reagentes são os mesmos.
D) é mais rápida em I porque o ácido acético é liberado na forma de vapor.
E) é mais rápida em II porque o ácido acético se dissolve na água.
____________________________________________________________________________
5) (FUVEST) A reação de persulfato com iodeto
S2O82− + 2 I− → 2 SO42− + I2
pode ser acompanhada pelo aparecimento da cor do iodo. Se no início da reação persulfato e
iodeto estiverem em proporção estequiométrica (1:2), as concentrações de persulfato e de
iodeto, em função do tempo de reação, serão representadas pelo gráfico:
__________________________________________________________________________
6) (FUVEST) Em solução aquosa ocorre a transformação:
H2O2 + 2 I− + 2 H+ → 2 H2O + I2
(Reagentes)
(Produtos)
Em quatro experimentos, mediu-se o tempo decorrido para a formação de mesma
concentração de I2, tendo-se na mistura de reação as seguintes concentrações iniciais de
reagentes:
2
Esses dados indicam que a velocidade da reação considerada depende apenas da
concentração de:
A) H2O2 e I−.
B) H2O2 e H+.
C) H2O2.
D) H+.
E) I−.
____________________________________________________________________________
7) (Mackenzie) Numa certa experiência, a síntese do cloreto de hidrogênio ocorre com o
consumo de 3,0 mols de gás hidrogênio por minuto. A velocidade de formação do cloreto de
hidrogênio é igual:
Dado: 1/2 H2 + 1/2 Cl2 → HCl
A) ao dobro da do consumo de gás cloro.
B) a 3,0 mols/min.
C) a 2,0 mols/min.
D) a 1,0 mol/min.
E) a 1,5 mol/min.
____________________________________________________________________________
8) (Mackenzie) O esquema mostra observações feitas por um aluno, quando uma chapa de
alumínio foi colocada em um tubo de ensaio, contendo solução aquosa de HCl.
Nessa experiência, ocorre o desprendimento de um gás e a formação de um sal. A respeito
dela é correto afirmar que:
A) a frio, a reação é forte e processa-se instantaneamente.
B) o sal formado é insolúvel.
C) o gás formado é o oxigênio.
D) a reação é acelerada quando o sistema é aquecido.
E) a velocidade da reação não se altera com o aumento de temperatura.
____________________________________________________________________________
9) (PUCCAMP) Para diminuir a poluição atmosférica muitos carros utilizam conversores
catalíticos que são dispositivos como "colméias" contendo catalisadores apropriados e por
onde fluem os gases produzidos na combustão. Ocorrem reações complexas com
transformações de substâncias tóxicas em não-tóxicas, como
cat .
2 CO + 2 NO ⎯⎯→ 2 CO2 + N2
2 CO + O2 ⎯⎯→ 2 CO2
cat .
2 NO2 ⎯⎯→ 2 O2 + N2
Das seguintes afirmações acerca dessas reações
I. são todas de catálise heterogênea.
II. os catalisadores são consumidos nas reações.
III. os catalisadores aumentam a superfície de contato entre os reagentes.
cat .
3
IV. baixas temperaturas provavelmente aumentam a eficácia dos conversores catalíticos.
Pode-se afirmar que SOMENTE
A) I está correta
B) II está correta
C) III está correta
D) I e III estão corretas
E) II e IV estão corretas
____________________________________________________________________________
10) (UEL) A decomposição do peróxido de hidrogênio pode ser representada pela equação:
H2O2(l) → H2O(l) + 1/2O2 (g) ∆H < 0
Das seguintes condições:
I. 25°C e ausência de luz
II. 25°C e presença de catalisador
III. 25°C e presença de luz
IV. 35°C e ausência de luz
V. 35°C e presença de catalisador
Aquela que favorece a CONSERVAÇÃO do peróxido de hidrogênio é
A) I
B) II
C) III D) IV E) V
____________________________________________________________________________
11) (UFC) O gráfico a seguir ilustra a cinética da reação:
2SO2(g) + O2(g) → 2SO3(g)
De acordo com o gráfico é correto afirmar.
A) No ponto A as concentrações de SO2 e SO3 são máximas no processo reacional.
B) A concentração de SO‚ é reduzida a 1/3 de sua concentração inicial, após 10s de reação.
C) Somente a concentração de SO2 é máxima no processo reacional, após 10s de reação.
D) O ponto A representa o estado de equilíbrio reacional e, portanto, após 10s não mais ocorre
a formação de SO3.
E) A meia-vida da reação corresponde ao ponto A e ocorre aos 10 segundos.
____________________________________________________________________________
12) (UFC) A legislação brasileira atual obriga todos os veículos a serem equipados com um
catalisador no sistema de exaustão dos gases provenientes da combustão da gasolina, para a
eliminação de poluentes. Os catalisadores são espécies que aumentam a velocidade de uma
reação química, promovendo um mecanismo alternativo de reação sem, entretanto,
participarem da reação propriamente dita.
Com relação às ações dos catalisadores, é correto afirmar que os mesmos diminuem:
A) a energia de ativação da reação.
B) a energia cinética média das moléculas dos reagentes.
C) as interações intermoleculares entre reagentes, facilitando a conversão em produtos.
D) a estabilidade dos produtos, fazendo com que estes se convertam em intermediários de
reação.
E) o conteúdo energético dos produtos, tornando-os menos estáveis e deslocando o sentido da
reação química.
____________________________________________________________________________
13) (UFF) Considere a reação:
M(g) + N(g) → O(g)
4
Observa-se, experimentalmente, que, dobrando-se a concentração de N, a velocidade de
formação de O quadruplica e, dobrando-se a concentração de M, a velocidade da reação não é
afetada.
A equação da velocidade v desta reação é:
A) v = K [M]2
B) v = K [N]2
C) v = K [M]
D) v = K [M] [N]
E) v = K [M] [N2
____________________________________________________________________________
14) (UFMG) A elevação de temperatura aumenta a velocidade das reações químicas porque
aumenta os fatores apresentados nas alternativas, EXCETO
A) A energia cinética média das moléculas.
B) A energia de ativação.
C) A freqüência das colisões efetivas.
D) O número de colisões por segundo entre as moléculas.
E) A velocidade média das moléculas.
____________________________________________________________________________
15) (UFMG) A diminuição da concentração de ozônio (O3) na estratosfera, que provoca o
chamado buraco na camada de ozônio, tem sido associada à presença de
clorofluorocarbonetos (CFC), usados em aerossóis e refrigerantes. As moléculas de CFC são
quebradas pela ação da radiação ultravioleta, produzindo átomos de cloro, que aceleram a
quebra das moléculas de ozônio, num processo que envolve duas etapas:
Cl + O3 → ClO + O2 (1ª etapa)
ClO + O → Cl+ O2 (2ª etapa)
Em relação ao processo descrito por essas etapas, a afirmativa FALSA é
A) a reação global é O + O3 → 2 O2.
B) cloro atômico atua como catalisador da reação global.
C) cloro atômico é oxidado na 1ª etapa.
D) o processo aumenta a quantidade de O‚ na estratosfera.
E) oxigênio atômico é oxidado na 2ª etapa.
____________________________________________________________________________
16) (UFPE) Você está cozinhando batatas e fazendo carne grelhada, tudo em fogo baixo, num
fogão a gás. Se você passar as duas bocas do fogão para fogo alto, o que acontecerá com o
tempo de preparo?
A) Diminuirá para os dois alimentos.
B) Diminuirá para a carne e aumentará para as batatas.
C) Não será afetado.
D) Diminuirá para as batatas e não será afetado para a carne.
E) Diminuirá para a carne e permanecerá o mesmo para as batatas.
____________________________________________________________________________
17) (UFPE) O gráfico a seguir representa a variação de concentração das espécies A, B e C
com o tempo:
Qual das alternativas a seguir contém a equação química que melhor descreve a reação
representada pelo gráfico?
A) 2A + B → C
B) A → 2B + C
C) B + 2C → A
D) 2B + C → A
E) B + C → A
__________________________________________________________________________
5
18) (UNESP) Sobre catalisadores, são feitas as quatro afirmações seguintes.
I - São substâncias que aumentam a velocidade de uma reação.
II - Reduzem a energia de ativação da reação.
III - As reações nas quais atuam não ocorreriam nas suas ausências.
IV - Enzimas são catalisadores biológicos.
Dentre estas afirmações, estão corretas, apenas:
A) I e II.
B) II e III.
C) I, II e III.
D) I, II e IV.
E) II, III e IV.
____________________________________________________________________________
19) (UFV) Considere a reação representada por:
A+B→C
A tabela abaixo mostra os tempos necessários para que a reação acima se complete com
várias concentrações INICIAIS dos reagentes.
Assinale a afirmativa CORRETA:
A) Aumentando-se a concentração de A, diminui-se a velocidade da reação.
B) Aumentando-se a concentração de B, aumenta-se a velocidade da reação.
C) Duplicando-se a concentração de A, duplica-se a velocidade da reação.
D) A concentração de A não afeta a velocidade da reação.
E) A concentração de B afeta a velocidade da reação.
____________________________________________________________________________
20) (UFV) Para a reação
CH3Br + Cl− → CH3Cl + Br−
as afirmativas a seguir estão corretas, EXCETO:
A) aumentando-se a concentração de CH3Br, aumenta-se a velocidade da reação.
B) aumentando-se a concentração de Cl−, aumenta-se a velocidade da reação.
C) aumentando-se a temperatura, aumenta-se a velocidade da reação.
D) aumentando-se as concentrações de Cl− e CH3Br, diminui-se a velocidade da reação.
E) utilizando-se um catalisador, aumenta-se a velocidade da reação.
____________________________________________________________________________
21) (UFSCar) Não se observa reação química visível com a simples mistura de vapor de
gasolina e ar atmosférico, à pressão e temperatura ambientes, porque:
A) a gasolina não reage com o oxigênio à pressão ambiente.
B) para que a reação seja iniciada, é necessário o fornecimento de energia adicional aos
reagentes.
C) a reação só ocorre na presença de catalisadores heterogêneos.
D) o nitrogênio do ar, por estar presente em maior quantidade no ar e ser pouco reativo, inibe a
reação.
E) a reação é endotérmica.
____________________________________________________________________________
22) (UFPI) O dióxido de nitrogênio – NO2(g) é um gás tóxico, pois sua inalação provoca
irritação nas vias respiratórias. Analise os resultados expressos no gráfico abaixo e a reação de
sua obtenção a partir do pentóxido de nitrogênio – N2O5(g) na temperatura de 308K e, em
seguida, marque a alternativa correta.
2 N2O5(g) → 4 NO2(g) + O2(g)
6
A) Nos momentos iniciais, a velocidade de formação do NO2(g) é maior que a do O2(g).
B) A velocidade de formação do NO2(g) é duas vezes a velocidade de formação do O2(g).
C) A velocidade de decomposição do N2O5(g) é a metade da velocidade de formação do O2g).
D) No tempo de 4 × 103 s, a velocidade de decomposição do N2O5(g) é maior que a de
formação do NO2(g).
E) No tempo de zero a 2 × 103 s, a velocidade de formação do O2(g) é maior do que a
formação do NO2(g).
____________________________________________________________________________
23) (UFPEL) No rótulo de um determinado alimento, lê-se:
Prazo de validade:
24 horas a 5° C
3 dias a - 5° C
10 dias a - 18° C
Essas informações revelam que existe relação entre a temperatura e a velocidade da
deterioração do alimento. A deterioração dos alimentos ocorre através de reações químicas,
que formam substâncias impróprias ao consumo humano e que também alteram suas
características organolépticas.
Como sugerido no rótulo, a temperatura é um dos fatores que alteram a velocidade das
reações químicas. A superfície de contato, a concentração das substâncias que constituem o
alimento, a energia de ativação dessas reações e a pressão, caso haja formação de
substâncias gasosas, são outros fatores que interferem na velocidade das reações químicas.
Em relação aos fatores que alteram a velocidade das reações químicas, podemos afirmar que,
em um sistema fechado,
I - se pulverizarmos uma substância sólida, ela reagirá mais lentamente.
II - quanto maior a temperatura, maior será a velocidade da reação.
III - quanto maior a concentração dos reagentes, maior será a velocidade da reação.
Está(ão) correta(s)
A) as afirmativas I e II.
B) as afirmativas II e III.
C) as afirmativas I e III.
D) as afirmativas I, II e III.
E) somente a afirmativa II.
____________________________________________________________________________
24) (UNIFOR) Um prego de ferro foi colocado em uma solução aquosa ácida e aconteceu a
reação representada pela equação:
+
2+
Fe(s) + 2H (aq) → Fe (aq) + H2(g)
Para tornar essa reação mais rápida, pode-se repetir o experimento fazendo o seguinte:
I. aquecer a solução de ácido
II. usar solução de ácido mais diluída
III. triturar o prego
A rapidez SOMENTE é aumentada quando se realiza
A) I
B) II
C) III
D) I e II
E) I e III
____________________________________________________________________________
25) (UNIFOR) Uma determinada reação química pode ocorrer com maior ou menor rapidez,
dependendo de vários fatores, entre eles,
7
I. o grau de subdivisão dos reagentes.
II. o valor da energia de ativação.
III. o valor da entalpia de reação.
IV. a temperatura do sistema em reação.
É correto o que se afirma SOMENTE em
A) I e II
B) I e III
C) II e III
D) I, II e IV
E) II, III e IV
____________________________________________________________________________
26) (FURG) As transformações químicas que ocorrem no estômago durante a ingestão de
alimentos, assim como muitas reações na natureza, ocorrem através de enzimas, que são
catalisadores biológicos.
Sobre catalisadores, é correto afirmar que
A) são consumidos à medida que a rapidez das reações aumenta.
B) são adicionados a um substrato mas não participam das reações.
C) participam das reações químicas, mas são regenerados ao final destas.
D) participam, mas não reagem quimicamente com os reagentes.
E) aumentam a rapidez das reações sem, no entanto, participarem destas.
____________________________________________________________________________
27) (FURG) Em relação à reação em fase gasosa
A + 2 B → C + 1/2 D
são feitas as seguintes afirmativas:
I) A ordem da reação é sempre um número inteiro e diferente de zero.
II) A ordem da reação com respeito ao reagente B, por exemplo, pode ser sempre prevista a
partir do coeficiente estequiométrico dessa substância na reação.
III) A velocidade ou taxa de reação é função da temperatura de reação.
Assinale a alternativa com a(s) afirmativa(s) correta(s).
A) II.
B) I e III.
C) II e III.
D) III.
E) I, II e III.
____________________________________________________________________________
28) (FURG) A velocidade da reação de decomposição de uma substância A quadruplica,
quando sua concentração é duplicada. Assinale a alternativa que contém a afirmação correta.
A) A reação é de 3ª ordem com respeito à A.
B) A reação é de 1ª ordem com respeito à A.
C) A reação é de 2ª ordem com respeito à A.
D) A reação é ordem indefinida com respeito à A.
E) A reação é de ordem zero com respeito à A.
____________________________________________________________________________
29) (ITA) Uma certa reação química é representada pela equação: 2A(g) + 2B(g) →C(g), onde
A , B e C significam as espécies químicas que são colocadas para reagir. Verificou-se
experimentalmente, numa certa temperatura, que a velocidade desta reação quadruplica com
duplicação da concentração da espécie A , mas não depende das concentrações das espécies
B e C . Assinale a opção que contém, respectivamente , a expressão correta da velocidade e o
valor correto da ordem da reação.
2
2
A)v = k[A] [B] e 4.
2
B)v = k[A] [B]2 e 3.
C)v = k[A]2[B]2 e 2.
D) v = k[A]2 e 4.
E) v = k[A]2 e 2.
____________________________________________________________________________
30) (PUCRS) Amostras de magnésio foram colocadas em soluções aquosas de ácido clorídrico
de diversas concentrações e temperaturas, havendo total consumo do metal e desprendimento
do hidrogênio gasoso. Observaram-se os seguintes resultados:
8
Pela análise dos dados contidos na tabela acima, é correto afirmar que
A) a velocidade média da reação na amostra I é maior que na amostra II.
B) a quantidade de hidrogênio desprendida na amostra II é maior do que na amostra IV.
C) a velocidade média da reação na amostra III é igual à da amostra IV.
D) a velocidade média de reação na amostra IV é a metade da velocidade média de reação na
amostra II.
E) a quantidade de hidrogênio desprendido na amostra III é menor do que na amostra IV.
____________________________________________________________________________
31) (PUCRS) A reação entre os gases representados na equação a seguir tem grande
importância na química ambiental.
2 CO(g) + O2(g) → 2CO2(g)
Essa reação apresenta uma lei de velocidade expressa por: v = K.[CO]2.[O2]
Se a concentração de CO(g) for duplicada e a concentração de oxigênio for reduzida à metade,
mantendo-se constantes todos os outros fatores, a velocidade da reação
A) duplica.
B) quadruplica.
C) reduz-se à metade.
D) permanece constante.
E) triplica.
____________________________________________________________________________
32) (PUCRS) Considere a reação elementar representada pela
Equação
3 O2(g) → 2 O3(g)
Ao triplicarmos a concentração do oxigênio, a velocidade da reação, em relação à velocidade
inicial, torna-se
A) duas vezes menor. B) três vezes maior.
C) oito vezes menor.
D) nove vezes maior.
E) vinte e sete vezes maior.
____________________________________________________________________________
33) (PUCRS) Analise as afirmativas abaixo.
I. Uma reação com energia de ativação 40 kJ é mais lenta que uma outra reação que
apresenta energia de ativação igual a 130 kJ.
II. A adição de um catalisador a uma reação química proporciona um novo “caminho” de
reação, no qual a energia de ativação é diminuída.
III. Um aumento de temperatura geralmente provoca um aumento na energia de ativação da
reação.
IV. A associação dos reagentes com energia igual à energia de ativação constitui o complexo
ativado.
Pela análise das afirmativas, conclui-se que somente estão corretas
A) I e II
B) I e III
C) II e IV
D) I, III e IV
E) II, III e IV
____________________________________________________________________________
34) (PUCRS) O óxido nítrico reage com hidrogênio, produzindo nitrogênio e vapor d´água de
acordo com a seguinte equação:
2NO(g) + 2H2(g) → N2(g) + 2H2O(g)
Acredita-se que essa reação ocorra em duas etapas:
1a etapa (lenta):
2NO(g) + H2 (g) → N2O(g) + H2O(g)
2a etapa (rápida):
N2O(g) + H2(g) → N2(g) + H2O(g)
Caso as concentrações de NO e H2 sejam duplicadas simultaneamente, efetuando a reação
em sistema fechado, a velocidade da reação ficará multiplicada por
A) 2
B) 3
C) 4
D) 6
E) 8
____________________________________________________________________________
9
35) (PUCRS) Analise as curvas abaixo, que representam uma reação química ocorrendo em
duas diferentes temperaturas, T1 e T2 , onde T1 é menor do que T2 , e Ea é a energia de
ativação, e as afirmativas.
I. Um aumento de temperatura aumenta a velocidade de reação, pois aumenta a energia de
ativação da reação.
II. Um aumento de temperatura provoca um aumento na velocidade da reação, pois aumenta a
fração de moléculas que irão colidir eficazmente.
III. Na temperatura T1 a velocidade de reação é maior, pois a energia das moléculas é também
maior.
IV. Na temperatura T2 a velocidade de reação é menor, pois diminui o número de moléculas
com energia mínima necessária para a reação ocorrer.
Pela análise do gráfico, está correto apenas o conteúdo de
A) I
B) II
C) I e III
(D) II e IV
E) II, III e IV
____________________________________________________________________________
36) (PUCRS) Uma forma de ingerirmos a vitamina C é através do consumo de sucos de frutas.
O suco deve ser consumido logo após ser preparado, pois essa vitamina sofre oxidação e
perde sua ação em pouco tempo. O gráfico abaixo apresenta a curva de decomposição da
vitamina C, presente no suco de acerola, em função do tempo.
Pela análise do gráfico, é correto afirmar que a velocidade média de decomposição da vitamina
C, em molar/min, nas duas primeiras horas após o preparo do suco, é de, aproximadamente,
B) 6,0 x 10-4
C) 3,0 x 10-2
D) 4,0 x 10-2
E) 7,0 x 10-2
A) 2,5 x 10-4
____________________________________________________________________________
1-D
2-B
3-A
4-A
5-B
6-A
7-A
8-D
9-A
10-A 11-E 12-A
13-B 14-B 15-E 16-E 17-C 18-D 19-C 20-D 21-B 22-A 23-B 24-E
25-D 26-C 27-D 28-C 29-E 30-D 31-A 32-E 33-C 34-E 35-B 36-B
____________________________________________________________________________
10