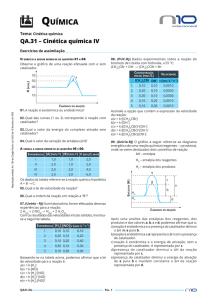
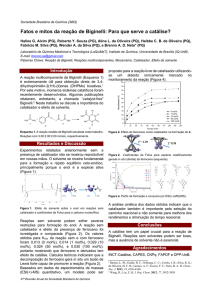
Título do Vídeo: Espuma colorida
Nome dos participantes: Cátia Freitas, Jacira Ramos, Joana Okica.
Professor responsável: Maria Manuel F. Q. Marques da Costa
Escola: Escola secundária Leal da Câmara
E-mail: [email protected]
Telemóvel: 965347759
Resumo (máximo de 150 palavras)
Com esta experiência pretendemos demonstrar como podemos reconhecer uma reacção exotérmica,
verificar a libertação de um gás e identificar esse gás. Pretendemos também demonstrar o efeito de
um catalisador na velocidade da reação.
A experiência consiste em decompor peróxido de hidrogénio em água e oxigénio. Adiciona-se um
produto emulsionante, detergente de loiça, para se poder visualizar a libertação do gás.
O efeito do catalisador será demonstrado realizando duas experiências (uma com iodeto de potássio
e outra sem este produto). Teremos ocasião de mostrar que as duas reações irão decorrer de forma
diversa.
Como a reacção é exotérmica, ao libertar calor, há lugar a um efeito visível da libertação de vapor de
água. Para proceder à identificação da presença de oxigénio libertado, será feito o teste habitual, com
um pavio incandescente.
Conceitos (máximo de 200 palavras)
Descrição e explicação sucinta dos principais conceitos necessários à compreensão da experiência
executada. Esta descrição poderá conter tabelas, figuras, esquemas e/ou gráficos.
Conceitos:
Reação química – transformação de uma(s) substância(s) noutra(s).
Catalisador – substância que, sem se consumir, altera a velocidade de uma reação química.
Reação exotérmica – reação química em que se liberta energia sob a forma de calor.
Comburente – substância que alimenta as reações de combustão.
Protocolo Experimental (máximo de 250 palavras)
Colocar cerca de 50 ml de peróxido de hidrogénio numa proveta de 250 ml e adicionar umas gotas de
corante alimentar e detergente de loiça, observar o que acontece à solução.
Colocar 150 mL de peróxido de hidrogénio numa proveta, acrescentar 10 mL de detergente de loiça,
adicionar umas gotas de corante alimentar e por fim introduzir 10 g de iodeto de potássio, observar o
que acontece.
A reacção é exotérmica e liberta oxigénio.
Para o comprovar que o gás libertado é oxigénio, utilizar fósforos acesos perto da espuma libertada e
verificar se a chama do fósforo aviva ou não.
Segurança:
Como o peróxido de hidrogénio é um reagente nocivo, muito irritante para a pele, usar luvas e óculos
de protecção.
Reagentes:
Peróxido de hidrogénio 110 Vol.
Iodeto de potássio
Detergente de loiça Fairy
Corante alimentar
Material:
3 provetas de 250 ml
3 gobelés de 50 ml
3 seringas de 10 ml
Procedimento:
Para comprovar o funcionamento de um catalisador, neste caso o iodeto de potássio, numa reação
de libertação de um gás, utilizando como reagente o peróxido de hidrogénio, realizar duas
experiências, numa em que não se utilizar o catalisador e outra em que é colocado o catalisador.
1. Sem catalisador:
Colocar cerca de 50 ml de peróxido de hidrogénio numa proveta de 250 ml e adicionar umas gotas de
corante alimentar e detergente de loiça. Observar o que acontece à solução.
Neste caso a reação é extremamente lenta, observa-se a libertação de um gás, que se visualiza
através da formação da espuma.
2. Com catalisador:
Colocar 150 mL de peróxido de hidrogénio numa proveta, acrescentar 10 mL de detergente de loiça,
adicionar umas gotas de corante alimentar e por fim introduzir 10 g de iodeto de potássio. Observar o
que acontece.
Observa-se uma libertação de gás muito mais rápida que a anterior.
Esta reação é extremamente exotérmica, de tal forma que consegue libertar vapor de água, que se
visualiza através da formação de alguma condensação do vapor de água, assim como pelo
aquecimento do meio ambiente.
Para comprovar que o gás libertado é oxigénio, utilizar fósforos acesos ou pavios incandescentes
perto da espuma libertada e verificar se a chama do fósforo ou do pavio se aviva ou não.
Aplicações (máximo de 100 palavras)
Os catalisadores são amplamente utilizados na industria assim como no nosso dia a dia.
Pretende-se constantemente acelerar ou retardar uma reação química. Por exemplo na indústria
alimentar, pretende-se que os alimentos se degradem o mais lentamente possível, logo é necessário
recorrer a catalisadores. A indústria de produção de amoníaco necessita de um catalisador para
acelerar a reação de síntese deste composto que é extremamente lenta, deixando de ser rentável se
não se utilizar um catalisador.
Conclusões (máximo de 100 palavras)
Esta experiência é bastante simples de se efetuar. Apresenta, no entanto uma dificuldade, que é o
facto de se utilizar um reagente que corrosivo e irritante à pele, por este facto convém ter muito
cuidado no seu manuseamento.
Através desta experiência consegue-se visualizar muito bem o efeito do catalisador, demonstrar uma
reação exotérmica e comprovar o gás que se liberta.
Para uma aula de demonstração esta experiência é ótima pois tem uma visibilidade fantástica,
permitindo ao professor explicar todos os processos. Para além de que é uma experiência lúdica, pois
o efeito visual é de agrado de todos, sobretudo dos mais jovens, o que os faz estar atentos e
questionarem o professor com questões muito pertinentes.