Inserir logotipo do
laboratório
Procedimentos Operacionais Padrão
POP.BIO- xxx
HDL DIRETO PLUS
INDICAÇÃO MÉDICA DO EXAME
Exame que se destina à determinação quantitativa do Colesterol HDL em soro e plasma humano, útil na
investigação das dislipidemias e na avaliação de risco de doenças coronarianas.
EXAMES CORRELATOS
São exames correlatos: eletroforese de lipídeos, colesterol total, colesterol LDL e triglicerídeos.
MÉTODO E PRINCÍPIO
Método: Enzimático.
Principio: A eliminação de quilomícrons, Colesterol-VLDL e Colesterol-LDL pelo colesterol esterase e pela
colesterol oxidase e subseqüentemente pela catalase. Medição específica do Colesterol HDL após a liberação
do Colesterol HDL por detergentes no Reagente 2.
AMOSTRA
Tipo: Soro ou plasma (heparina ou EDTA).
Volume ideal: Definir o volume mínimo a ser encaminhado para análise
Volume mínimo: Definir o volume mínimo a ser encaminhado para análise
Critérios para rejeição: Presença de hemólise intensa.
Fazer referência ao manual ou POP de coleta, separação e distribuição de material.
Acondicionamento: Sob refrigeração (2 - 8ºC), o colesterol no soro ou plasma é estável por cinco dias.
Congelado, esta estabilidade estende-se por vários meses.
Precauções de segurança: Conforme Manual de Biossegurança.
Preparo do Paciente: O paciente deve estar com peso e dieta estáveis por três semanas e em jejum de 12 a
14 horas (O jejum é imprescindível para a dosagem de colesterol HDL e para a determinação dos triglicérides e
frações do colesterol). A abstinência alcoólica é desejável nas 72 horas que antecedem o teste. Evitar
garroteamento por período superior a 2 minutos e colher em posição sentada com o paciente em repouso por 5
minutos.
PRODUTO UTILIZADO
HDL Direto
Katal Biotecnológica Ind. Com. Ltda.
Rua: Leiria, 1.160 - CEP 31255-100.
Belo Horizonte - MG. Brasil.
Registro ANVISA – 10377390190
1. Reagente 1: N,N-Bis (2-hidroxietil)-2-amino etano ácido sulfônico 100mmol/L pH 7,0; HDAOS N-(2-hidroxi-3sulfopropil)-3,5-dimetoxianiolina 0,7 mmol/L; Colesterol Esterase 800 U/L; Colesterol Oxidase 500 U/L;Catalase
300 KU/L.
2. Reagente 2: N,N-Bis (2-hidroxietil)-2-amino etano ácido sulfônico 100mmol/L pH 7,0; 4-Amino antipirina 4
mmol/L; Peroxidase 4 KU/L Azida Sódica 0,09% p/v.
3. Calibrador Colesterol HDL: Frasco contendo colesterol HDL humano liofilizado. A concentração está
impressa no rótulo do frasco. Conservar entre 2 - 8°C.
1/6
Inserir logotipo do
laboratório
Procedimentos Operacionais Padrão
POP.BIO- xxx
Nota: Depois de abertos os reagentes 1 e 2 são estáveis até a data de validade indicada no rótulo, se mantidos
entre 2 - 8ºC quando armazenados protegidos da luz, bem vedados e não sendo expostos a contaminações
química e microbiana.
Apresentações:
- 80 mL (27B): 1 x 60 mL Reagente 1
1 x 20 mL Reagente 2
- 320 mL (64B): 1 x 240 mL Reagente 1
1 x 80 mL Reagente 2
Precauções e cuidados especiais
Os cuidados habituais de segurança devem ser aplicados na manipulação do reagente. Fazer referência ao
manual ou POP de segurança.
Os reagentes não abertos, quando armazenados nas condições indicadas são estáveis até a data de expiração
impressa no rótulo. Durante o manuseio, os reagentes estão sujeitos à contaminação de natureza química e
microbiana que podem provocar redução da estabilidade. O laboratório deve estabelecer a estabilidade em suas
condições operacionais.
Os reagentes contêm azida sódica, que é tóxica. Deve-se tomar cuidado para evitar a ingestão e, no caso de
contato com os olhos, deve-se lavar imediatamente com grande quantidade de água e procurar auxílio médico.
A azida pode formar compostos altamente explosivos com tubulações de chumbo e cobre. Utilizar grandes
volumes de água para descartar o reagente. Fazer referência ao manual ou POP de segurança.
EQUIPAMENTOS
Procedimento manual
1. Fotômetro capaz de medir com exatidão a absorbância em 600 nm.
2. Pipetas para medir amostras e reagentes.
Procedimento automatizado
Indicar o nome, modelo e o local onde se encontra o equipamento analítico; fazer referência ao manual ou POP
para utilização do mesmo.
INSTRUMENTOS ESPECIAIS
Se realizado por procedimento manual é necessário o uso de:
Centrífuga
Banho-maria
Vidraria
Pipetas manuais ou automáticas
Destilador ou Deionizador
Equipamento compatível.
PROCEDIMENTO DE CALIBRAÇÃO
Para técnica manual:
A cada teste ou se utilizado método do Fator de calibração realizar a cada mudança de lote do reagente,
quando os controles estiverem inadequados.
2/6
Inserir logotipo do
laboratório
Procedimentos Operacionais Padrão
POP.BIO- xxx
Para automação:
A cada mudança de lote do reagente, quando os controles estiverem inadequados, após qualquer manutenção
corretiva do equipamento e quando a curva de calibração estiver vencida.
CONTROLE DE QUALIDADE
Materiais
Identificar os materiais para controle interno e externo da qualidade (fabricante, número de catálogo), instruções
de preparo e frequência da utilização dos mesmos.
Limites de tolerância
Descrever o procedimento para definição dos limites de tolerância, o sistema adotado para utilização do mapa
de Levey-Jennings e das regras de controle e as providências a serem tomadas diante de valores que
ultrapassem tais limites. Fazer referência ao manual ou POP para utilização dos materiais de controle.
Verificação de novo lote de controles e/ou reagentes
Descrever o procedimento de verificação de novos lotes de controles e de reagentes.
Gerenciamento dos dados
Definir como os dados relativos ao controle da qualidade são arquivados e gerenciados.
Fazer referência ao manual ou POP de garantia da qualidade
INSTRUÇÕES DE PREPARO
Preparo do Calibrador: Deixar o frasco do calibrador a temperatura ambiente por 10 minutos. Adicionar 1,0mL
de água destilada ao conteúdo do frasco. Aguardar 10 minutos e homogeneizar com movimentos circulares.
Estável por 03 dias entre 2 - 8°C e 30 dias a -20ºC. Recomendamos separar o calibrador em alíquotas antes do
congelamento. Após descongelar, homogeneizar antes da utilização. O material congelado deve ser degelado
uma única vez.
Nota: É fundamental que a água utilizada para a reconstituição do calibrador seja de boa qualidade, para evitar
a deteriorização do mesmo e alteração dos resultados analisados.
PROCEDIMENTO
Dosagem – soro ou plasma
Separar 2 tubos de ensaio e proceder como a seguir:
Amostra
Calibrador
Reagente 1
Teste
0,01mL
0,75mL
Calibrador
0,01mL
0,75mL
Homogeneizar bem e colocar no banho-maria a 37°C durante 5 minutos. Determinar as absorbâncias do teste e
do calibrador em 600 nm, acertando o zero com água deionizada. As absorbâncias encontradas serão A1.
Reagente 2
Teste
0,25mL
Calibrador
0,25mL
Homogeneizar bem e colocar no banho-maria a 37°C durante 5 minutos. Determinar as absorbâncias do teste e
do calibrador em 600 nm, acertando o zero com água deionizada. As absorbâncias encontradas serão A2.
3/6
Inserir logotipo do
laboratório
Procedimentos Operacionais Padrão
POP.BIO- xxx
Precauções e cuidados especiais
1. Para manusear e descartar reagentes e material biológico, aplicar as normas estabelecidas de segurança.
Fazer referência ao manual ou POP de segurança.
2. A limpeza e secagem adequadas do material são fatores fundamentais para a estabilidade dos reagentes e
obtenção de resultados corretos. Fazer referência ao manual ou POP de limpeza e verificação da qualidade
da limpeza dos materiais.
3. A água utilizada no laboratório deve ter a qualidade adequada a cada aplicação. Assim, para preparar
reagentes e usar nas medições, deve ter resistividade 1 megaohm ou condutividade 1 microsiemens e
concentração de silicatos 0,1 mg/L (água tipo II). Para o enxague da vidraria a água pode ser do tipo III,
com resistividade 0,1 megaohms ou condutividade 10 microsiemens. No enxague final utilizar água tipo
II. Quando a coluna deionizadora está com sua capacidade saturada ocorre a produção de água alcalina
com liberação de vários íons, silicatos e substâncias com grande poder de oxidação ou redução que
deterioram os reagentes em poucos dias ou mesmo horas, alterando os resultados de modo imprevisível.
Assim, é fundamental estabelecer um programa de controle da qualidade da água. Fazer referência ao
manual ou POP de água reagente.
4. Misturar bem as amostras lipêmicas antes de iniciar a dosagem.
CÁLCULOS
1. Colesterol HDL (mg/dL) = [Abs. Teste (A2 - A1Cor.*) Abs. Calibrador (A2 – A1Cor.)] x Concentração do
Calibrador
2. Fator de calibração = Concentração do Calibrador Abs. Calibrador (A2 – A1Cor.)
3. Colesterol HDL (mg/dL) = Abs. Teste (A2 - A1Cor.) x Fator
*Correção: A primeira leitura da absorbância (A1) deverá ser corrigida para o volume final da reação obtendo-se
A1Corrigido, antes do cálculo da concentração de HDL. A1Cor. = A1 x 0,75.
Exemplo:
Teste: A1 = 0,002
A1Cor. = 0,0015 A2 = 0,111
Calibrador: A1 = 0,002
A1Cor. = 0,0015 A2 = 0,037
Concentração do Calibrador: 20mg/dL
Colesterol HDL (mg/dL): [(0,111 – 0,0015) (0,037 – 0,0015)] x 20 = 61,7
Fator de Calibração: 20 (0,037 – 0,0015) = 563
Colesterol HDL (mg/dL): (0,111 – 0,0015) x 563 = 61,7
INTERFERENTES
O ensaio não é afetado por amostras ictéricas (bilirrubina <30 mg/dL), fatores reumatóides <1000IU/mL,
amostras hemolisadas (Hb <500mg/dL) e amostras lipêmicas (triglicérides <1200 mg/dL). Amostras lipêmicas
com uma concentração >1200 mg/dL devem ser diluídas 1 + 9 com NaCI 0.9% (p/v) antes de ensaiar. O
resultado obtido dever ser multiplicado por 10.
Substâncias que aumentam o nível de colesterol: cimetidinas, etanol e ácido nicotínico.
Resultados diminuídos: pacientes com diabetes, obesidade, sedentarismo, fumantes, CHD entre outros.
4/6
Inserir logotipo do
laboratório
Procedimentos Operacionais Padrão
POP.BIO- xxx
RESULTADOS
Valores de Referência
Recomenda-se que cada laboratório estabeleça sua própria faixa de referência na sua população atendida. Os
valores abaixo são fornecidos como orientação.
Soro ou plasma
De 2 a 9 anos
De 10 a 19 anos
> 20 anos
Desejável
≥ 40 mg/dL
≥ 35 mg/dL
≥ 40 mg/dL
VALORES POTENCIALMENTE CRÍTICOS
Determinado pelo laboratório. Incluir o procedimento a ser adotado diante de um resultado crítico.
LINEARIDADE
A reação é linear até 130 mg/dL. Para valores acima de 130 mg/dL, diluir a amostra com água destilada.
Multiplicar o resultado obtido pelo fator de diluição.
SENSIBILIDADE
Limite de detecção: 3 mg/dL
ESPECIFICIDADE
A comparação com método similar, que também utiliza a metodologia do ácido fosfotúngstico/cloreto de
magnésio, já validado, mostrou um coeficiente de correlação, r, igual a 0,989 a partir de amostras aleatórias
oriundas de pacientes de ambulatório. A equação de regressão obtida foi : Y = 0.979X + 0.029.
INTERPRETAÇÃO TÉCNICA
Amostras lipêmicas podem apresentar turbidez. Neste caso, diluir o soro 1:2 com NaCl 0,85% e repetir a
determinação. Multiplicar o resultado final por 2. Hemólise acentuada e bilirrubina acima de 10 mg/dl interferem
com o teste.
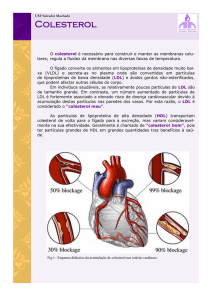
SIGNIFICADO CLÍNICO
O colesterol é o principal esterol do organismo, estando presente em todas as células como um componente
estrutural das membranas e das lipoproteínas (HDL, VLDL e principalmente, LDL). É também o precursor na
formação dos hormônios esteroides pelas gônadas e córtex adrenal. Cerca de 70 a 75% do colesterol
plasmático encontra-se na forma de éster e 25 a 30% existe como colesterol livre. A importância clínica dos
lipídeos está associada a sua contribuição para a coronariopatia (CHD) e para vários distúrbios lipoprotéicos.
Quando as concentrações de colesterol total e de colesterol LDL são altas, a incidência e prevalência de CHD
também são altas. Ao contrário do colesterol LDL, o aumento das concentrações de colesterol HDL mostrou ser
um protetor para a CHD tanto em estudos experimentais como clínicos. Pelo fato de a aterosclerose começar na
infância e poder levar décadas para manifestar-se clinicamente, a mensuração dos lipídeos e lipoproteínas
5/6
Inserir logotipo do
laboratório
Procedimentos Operacionais Padrão
POP.BIO- xxx
plasmáticas é um meio valioso de identificar indivíduos em risco para CHD e determinar a terapia mais
apropriada.
ANEXOS
Não aplicável.
REFERÊNCIAS BIBLIOGRÁFICAS
National Institutes of Health Consensus Development Conference Statement: Triglyceride, High Density
Lipoprotein and Coronary Heart Disease. Washington D.C. Feb 26-28, 1992.
Izawa S., Okada M., Matsui H., and Horita Y. J. Medicine and Pharmaceutical Sci., 1385 - 1388, 37 (1997).
Shih WJ, Bachorik PS, Haga JÁ, Myers GL, Stein EA; Clinical Chemistry, 2000; 46:3:351-364.
Third Report of the National Cholesterol Education Programme (NCEP) Expert Panel on Detection,
Evaluation and treatment of High Blood Cholesterol in Adults(Adult Treatment Panel III), JAMA Publication,
Vol 285, No. 19, P 2486-2497; 2001.
Jacobs, D. et al. In Labboratory and Test Handbook; Jacobs, D.S: Kasten, B.L., De Mott, W.R., Wolfson,
W.L., Eds; Lexi – Comp Inc: Hudson (Cleveland); 1990 P. 219.
Tietz, N.W., Fundamentals of Clinical Chemistry, 6nd Ed., pg. 426, Saunders Press, Phila. 2008.
Katal: Dados de Arquivo.
Função
Elaborado por:
Revisado por:
Aprovado por:
Revisão:
Nome e Assinatura
Data
00
6/6