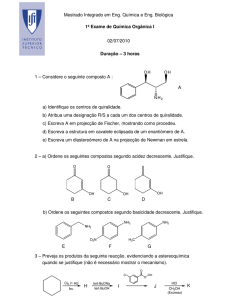
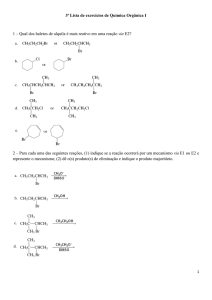
Nome: _______________________________________________
Data:
Nota: ________
03/07/2006
1. A natureza físico-química dos gases foi compreendida com modelos e estes são os que
mais se aproximam da realidade. Responda as seguintes questões considerando os
conceitos e parâmetros do estado gasoso.
1a. Defina cientificamente a pressão dos gases e utilize o modelo do gás real para explicar
o comportamento com bases nas interações intermoleculares e as conseqüências.
1b. Explicar o gráfico de fator de compressibilidade (Z) versus pressão nos intervalos de
baixa e de alta pressão e também em função de temperatura e natureza do gás.
1c. Para que lado o equilíbrio da reação 2 Ag(s) + Hg2Cl2(s) 2 Hg(l) + 2 AgCl(s) está
deslocado? Conhecendo-se os dados na tabela:
substância
ln Køf
Hg2Cl2(s)
85,01
AgCl(s)
44,28
Nome: _______________________________________________
Data:
Nota: ________
03/07/2006
2. O sistema químico é capaz de transformar a energia na medida em que transforma os
reagentes e troca energia com a vizinhança da reação, influenciando também, quando
adequado, a velocidade de reação. Responda as seguintes questões contextualizando os
conceitos e parâmetros da termodinâmica.
2a. Gás cloro, à pressão parcial de 50 kPa, é borbulhado em água a 298 K. Com os dados
a 298 K da tabela, determine, no equilíbrio, as atividades e estime a concentração
das espécies usando a lei da ação das massas das reações (νBø(B) = - RT ln Kø) :
a) cloro dissolvido, b) HClO, c) CL-, d) ClO-.
substância
Cl2(g) + aq Cl2(aq)
H+(aq) + Cl-(aq) = HCl(aq)
HClO(aq)
+
H (aq) + ClO-(aq)
H2O(l)
ø / kJ mol-1
6,904
-131,252
-79,580
-27,196
-236,647
2b Considere a reação A + 2B 3 D :
(1) Representar graficamente, concentração vs tempo, as curvas de mudança da
concentração das espécies (taxa de consumo e formação), quando a reação se inicia apenas com
A + B e então forma o produto D e escrever a taxas de reação (velocidade de reação) com base
na extensão de reação () a volume constante.(definir as variáveis utilizadas)
(2) Considere uma reação elementar e discuta sucintamente os conceitos de ordem e
molecularidade. A reação de 2ª. ordem em solução tem constantes de velocidade de 5,7 x 10-5
dm3 mol-1 s-1 a 298 K e 1,64 x 10-4 dm 3 mol-1 s-1 a 313 K. Calcule a energia de ativação (E) e o
fator pré-exponencial (A), mostre esquematicamente o gráfico de Arrhenius, e conclua
sucintamente sobre o papel desses parâmetros.
Nome: _______________________________________________
Data:
Nota: ________
03/07/2006
3) Uma solução tampão é preparada contendo 0,100 moles de NaHCO 3 e 0,100 moles
de Na2CO3 em 500 mL de solução. Calcular:
a) Qual é o pH da solução
b) Qual é a concentração de OHc) Quantos moles de NaOH devem ser adicionados a 1 L de solução para
aumentar o pH de uma unidade.
Ka1 = 1,7x10-4 ; Ka2 = 4,4x10-11
Nome: _______________________________________________
Data:
03/07/2006
4) Quantos gramas de Fe(OH)3 se desenvolveram em 2,0 litros de:
a) H2O
c) 0,10M NaOH
b) 0,010M Fe(NO3)3
d) 0,001M HCl
KPS = 2,5x10-39
Fe(OH)3
Nota: ________
Nome: _______________________________________________
Data:
Nota: ________
03/07/2006
5) O cromo pode ser obtido a partir do mineral cromita (FeCr2O4) pela redução do com carbono
em alta temperatura. Além do cromo, obtem-se ferro e monóxido de carbono.Pede-se:
a) escrever a equação balanceada da reação;
escrever na equação os estados de oxidação das espécies envolvidas no processo
redox;
b) escrever a configuração eletrônica do ferro e do cromo nos diferentes estados de
oxidação, de acordo com a reação que ocorre;
c) dar os números quânticos que representam o elétron de valência dos dois metais nos
respectivos estados de oxidação de acordo com item b;
d) cromo forma compostos com variadas colorações, como por exemplo no caso do cloreto
de cromo hexahidratado. Ele pode aparecer como três isômeros: [Cr(H2O)6]Cl3 violeta,
[CrCl(H2O)5]Cl2 . H2O azul esverdeado, [CrCl2(H2O)4]Cl . 2H2O verde. Justificar a
variação de cores.
Número atômicos : Cr = 24; Fe = 26
Nome: _______________________________________________
Data:
Nota: ________
03/07/2006
6) A forma mais estável do oxigênio é a molecular.
a) Como a Teoria de Lewis e a Teoria da Ligação de Valência explicam a formação do
oxigênio molecular? Represente a molécula evidenciando os princípios das duas teorias;
b) Quantos tipos de ligação há nesta molécula? Quais são? O que significam?
c) Oxigênio molecular é paramagnético. Essa propriedade não está de acordo com as teorias
descritas no item a. Justifique a afirmação.
d) A Teoria do Orbital Molecular é mais apropriada para explicar o comportamento
magnético do oxigênio molecular. Represente o Diagrama de Orbitais Moleculares para a
molécula que comprove a propriedade.
e) Pela TOM, numa ligação química qualquer, os elétrons podem ocupar orbitais ligantes,
antiligantes e não ligantes. O que significa cada um desse três orbitais?
Número atômico : O = 8
Nome: _______________________________________________
Data:
Nota: ________
03/07/2006
7) Os derivados de ácidos carboxílicos têm como reação característica, a Substituição
Nucleofílica no carbono acílico, segundo a qual, o ataque do Nucleófilo (Nu) ao carbono acílico,
gerando um intermediário tetraédrico, é sucedido pela regeneração da ligação dupla carbonooxigênio e expulsão do grupo de saída (ou grupo abandonador, L), como indicado abaixo:
H
C
O
Nu+
..
H3C
+ Nu :H
H3C
L
C
Nu
Nu
-
O
C
H3C
C
-
O
O
+ HL
H3C
+
L
H
L
a) Um dos fatores determinantes para a reatividade dos diversos derivados de ácidos
carboxílicos é a estabilidade do grupo abandonador. Qual a ordem de reatividade
esperada para o acetato de etila (1), acetamida (2) e cloreto de acetila (3)? Justifique.
O
O
C
C
H3C
O
OCH2CH3
acetato de etila (1)
H3C
C
NH2
acetamida (2)
H3C
Cl
cloreto de acetila (3)
b) Mostre a reação de formação do butanoato de metila, um componente do sabor das
maçãs, dando o nome IUPAC dos reagentes. Qual a função orgânica desse produto?
c) As proteínas são macromoléculas essenciais aos sistemas biológicos, formadas por
peptídeos, que, por sua vez, resultam da reação entre aminoácidos. Nesse processo, os
grupos carboxila e amina de dois aminoácidos reagem, formando uma ligação peptídica.
Que função orgânica é formada nessa reação? Mostre a formação do dipeptídeo resultante
da reação entre glicina (CH2(NH2)COOH) e alanina (CH3CH(NH2)COOH).
d) Desenhe o estereoisômero R desse peptídeo.
e) Represente a hidrólise ácida do acetato de etila, detalhando o mecanismo da reação.
Nome: _______________________________________________
Data:
Nota: ________
03/07/2006
8) Haletos de alquila sofrem reação de substituição nucleofílica com facilidade, já que os
haletos (especialmente cloreto, brometo e iodeto) são bons grupos de saída. A estrutura da
parte alquílica, entre outros, é determinante da molecularidade da reação, ou seja, da
participação ou não do nucleófilo na etapa lenta da reação.
a) Que tipo de reação é esperado usando (R)-2-bromobutano e KCN como reagentes?
b) Qual o produto formado nessa reação? Especifique sua estrutura e nome IUPAC.
c) Mostre o mecanismo da reação especificando a estereoquímica do substrato, do produto e
do estado de transição hipotético.
d) Represente a reação acima num diagrama de energia x caminho reacional supondo que o
conteúdo energético dos reagentes seja maior que dos produtos.
e) Qual o produto esperado pela reação do (R)-2-bromobutano em meio fortemente básico e
aquecimento?