TURMA DOS 30
01. A propanona (C3H6O) pode ser produzida a partir do 2propanol (C3H8O), utilizando-se um catalisador à base
de zinco e cobre, de acordo com a seguinte equação:
C3H8O(g)
C3H 6O(g) H 2(g)
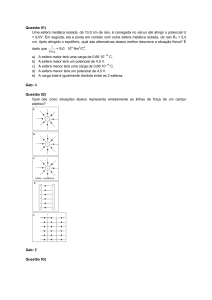
Assinale a alternativa cujo gráfico melhor representa a
variação das velocidades das reações direta e inversa
quando o 2-propanol reage para formar uma mistura em
equilíbrio com propanona e hidrogênio.
um recipiente de 1,0 litro de capacidade. Assim, quando
a mistura alcançar o equilíbrio, na temperatura do
experimento, a massa de N2O, em gramas, obtida será
igual a
a) 5,28.
b) 32,4.
c) 88,0.
d) 126,5.
e) 200,8.
Dados: Massas molares (g/mol): N = 14; O = 16
04. As fórmulas N2(g) e H2(g) representam duas substâncias
moleculares gasosas e diatômicas. Em determinadas
condições de temperatura e de pressão, são postos a
reagir 0,5 mol/litro de N2(g) e 1,5 mol/litro de H2(g),
conforme a equação:
a)
N 2(g) 3H 2(g)
[H 2(g) ]
d)
02. A uma temperatura elevada, 10 mol de PCl 5 (g) foram
adicionados a um recipiente, que, imediatamente, foi
fechado e mantido em temperatura constante.
Observou-se, então, que o PCl5 (g) se decompôs,
transformando-se em PCl3 (g) e Cl2 (g).
A quantidade de matéria de PCl5 (g), em mol, variou
com o tempo, até o sistema alcançar o equilíbrio, como
mostrado neste quadro:
T empo Quantidade de matéria
de P Cl5 /mol
t1
10
t2
6
t3
4
t4
4
c)
d)
1,5 1,02 0,72 0,54 0,54 0,54 0,54
Sobre essa reação, é correto afirmar que
a) o rendimento de NH3 no equilíbrio diminuiria se a
pressão sobre o sistema fosse aumentada.
b) a velocidade de consumo de N2 é o triplo da velocidade
de consumo de H2.
c) a substância NH3 desaparece com a mesma velocidade
com que a substância N2 aparece.
d) um aumento de temperatura aumentaria o rendimento
de NH3, em virtude de a reação inversa do equilíbrio ser
endotérmica.
e) ela é reversível e o rendimento do produto da reação
direta no equilíbrio é de 64%.
f) I.R.
c)
b)
2NH3(g) calor
A variação hipotética das concentrações desses
reagentes com o passar de tempo consta na tabela a
seguir:
Tempo em
0
20
40
60
80 100 120
segundos
[N 2(g) ]
0,5 0,34 0,24 0,18 0,18 0,18 0,18
b)
a)
Considerando-se essas informações, é CORRETO
afirmar que,
em qualquer instante após t1, a pressão do sistema é
maior que em t1.
em qualquer instante, as reações direta e inversa têm
velocidades iguais.
no equilíbrio, a velocidade da reação direta é igual a
zero.
no equilíbrio, a quantidade de matéria das três
substâncias é igual.
03. A uma certa temperatura, a constante de equilíbrio, KC,
para a reação representada abaixo, é igual a 9,0.
NO2(g) + NO(g)
N2O(g) + O2(g)
Suponha que 0,06 mol de cada um dos reagentes estão
misturados com 0,10 mol de cada um dos produtos, em
05. O acetato de etila pode ser obtido pela reação
CH3COOH + C2H5OH
a)
b)
c)
d)
e)
CH3COOC2H5 + H2O cuja
constante de equilíbrio, na temperatura de 100°C, é
igual a 4,0. Partindo de quantidades estequiométricas
de ácido acético e álcool etílico, a porcentagem de ácido
acético esterificado quando o sistema atingir o equilíbrio
a 100°C é, aproximadamente, igual a
33.
40.
50.
67.
80.
06. A obtenção industrial do estanho ocorre segundo a
reação
SnO2(s) + 2 H2(g) Sn(s) + 2H2O(g), a 750 ºC.
Sabendo que a pressão total no sistema é 0,5 atm e a
pressão parcial da água é de 0,3 atm, a constante de
equilíbrio Kp será
a) 1,25.
b) 2,25.
c) 3,75.
d) 4,25.
07. Uma reação levemente exotérmica, mas importante do
ponto de vista industrial, é a combinação do vapor
d’água com o monóxido de carbono. Esta reação
conduz a formação dos gases hidrogênio e dióxido de
carbono. Considerando a temperatura de 800 ºC, a
constante de equilíbrio (Kc) para essa reação será igual
Turma dos 30 - Química - Sônia - 05-06-2011
TURMA DOS 30
a)
b)
c)
d)
e)
a unidade. Para um sistema a esta temperatura e que
contem as concentrações iniciais dos gases de vapor
d’água e monóxido de carbono de 3,0 e 2,0 mol L –1,
respectivamente, é correto afirmar:
que no equilíbrio [H2] = [CO2] = 1,2 mol L–1.
o aumento na pressão fará com que o equilíbrio se
desloque no sentido de formação do gás hidrogênio.
Kc = Kp (RT)2.
a diminuição da temperatura não afetara a reação.
a temperatura de 800 ºC, o processo e espontâneo,
portanto, G > 0.
08. Considerando a reação abaixo, feita em um recipiente
fechado, assinale o que for correto.
2NO2(g) 7H 2(g)
2NH3(g) 4H 2 O(l)
01. A
expressão para a constante de equilíbrio é
[ NH3 ]2
.
Kc
[ NO2 ]2 [H 2 ]7
02. Uma análise mostrou que, após o equilíbrio ser atingido,
existem 3 mols de NO2(g), 12 mols de H2(g), 6 mols de
NH3(g) e 8 mols de H2O(l) em um recipiente de
capacidade de 12 litros. Considerando essas
informações, pode-se dizer que o Kc é 4,0.
04. O valor de Kc independe da temperatura do sistema,
pois tem relação apenas com a pressão.
08. Se, após atingido o equilíbrio, adicionarmos mais H2(g)
ao sistema, o valor de Kc diminui (considere
temperatura constante).
16. Se, após atingido o equilíbrio, retirarmos NO2(g), será
formado mais H2(g) (considere temperatura constante).
09. Considerando as reações em equilíbrio abaixo, contidas
em recipientes fechados de um litro, nas CNTP, e que
todas as substâncias gasosas obedecem à Lei dos
Gases Ideais, assinale o que for correto. (Dados: R =
0,082 l.atm.mol–1.K–1.)
CO2(g) + H2(g)
(I)
CO(g) + H2O(l)
N2(g) + 3H2(g)
HCN(aq) + H2O(l)
2NH3(g)
H3
(II)
O+(aq)
+
CN–(aq)
(III)
01. A expressão da constante de equilíbrio para a reação (I)
(PCO )(PH2 )
é Kp
.
(PCO 2 )
02. Considerando Kp = 1000 para a reação (II), tendo no
equilíbrio 0,4 atm de N2(g) e 0,1 atm de H2(g), a pressão
de NH3(g) é 0,4 atm .
04. Ao se adicionar mais HCN(aq) ao sistema representado
pela reação (III), o equilíbrio desloca-se para o lado dos
produtos.
08. O valor de Kp para a reação (I) que possui, no equilíbrio,
2 mols de CO2(g), 2 mols de H2(g), 4 mols de CO(g) e 4
mols de H2O(l) é (RT)–1.
16. A expressão da constante de equilíbrio para a reação
[CN ][H 3O ]
(III) é K e
.
[HCN]
10. O ácido acetilsalicílico – aspirina (HAsP) – é um ácido
orgânico fraco e dissocia-se em solução aquosa de
acordo com a equação:
HasP(aq)
H+(aq) + AsP-(aq)
Numa solução aquosa de concentração inicial de HAsP
igual a 1,0 mol/L, o ácido encontra-se 1,8% dissociado.
De acordo com esses dados, a constante de
dissociação do ácido é
a) 1,8 10−2.
b) 3,2 10−4.
c) 1,8.
d) 3,2 10−2.
11. Na dissolução de bicarbonato de sódio em água, ocorre
a hidrólise apenas do ânion, resultando numa solução
com
a) pH = 7, pois NaHCO3 é um sal de ácido e base fortes.
b) pH<7, pois o NaHCO3 é um sal de ácido forte e base
fraca.
c) pH>7, pois o NaHCO3 é um sal de ácido fraco e base
forte.
d) pH<7, pois o NaHCO3 é um sal de ácido e base fracos.
e) pH>7, pois o NaHCO3 é um sal de base fraca e ácido
forte.
12. Na camiseta de um estudante universitário estava
escrito a seguinte frase: “Está com problemas? Chame
um químico! Trabalhamos com soluções.” Realmente,
em seu cotidiano, o químico freqüentemente necessita
em seus experimentos da utilização de alguma solução.
Para preparar uma solução de CaCl2, um estudante
adotou o seguinte procedimento: pesou 160 g do sal e
transferiu-o para um balão volumétrico de 250 mL,
completando, em seguida, o volume com água
destilada. Considerando as informações descritas no
texto, julgue as afirmativas posteriores.
Dados:
Solubilidade do CaCl2 em água a 20 ºC = 72 g
CaCl2/100g de H2O
Massa molar do CaCl2 = 111 g.mol1
I. A solução apresentará pH básico.
II. A 20 ºC, após agitação contínua do balão, obtém-se um
sistema homogêneo.
III. A concentração de íons Ca2+ na solução é menor que
250 g/L.
Assinale a alternativa CORRETA:
a) Apenas as afirmativas I e II são verdadeiras.
b) Apenas as afirmativas I e III são verdadeiras.
c) Apenas as afirmativas II e III são verdadeiras.
d) Apenas a afirmativa II é verdadeira.
13. O uso de indicadores é útil para a determinação do
ponto final de titulações ácido-base, pois quando
colocados em soluções ácidas ou alcalinas passam a ter
cores diferentes. Observe a tabela, na qual se descreve
a cor da solução com esses indicadores, de acordo com
as faixas de pH.
De acordo com a tabela, se
a) a solução com fenolftaleína estiver incolor, o pH será
necessariamente ácido.
b) a solução com vermelho de metila estiver amarela seu
pH será necessariamente alcalino.
c) uma solução com vermelho de metila e outra com
fenolftaleína estiverem com pH menor que 4,8 e pH
igual a 6,5, respectivamente, suas cores serão as
mesmas.
d) uma solução com azul de bromotimol e outra com
vermelho de metila estiverem com pH igual a 8,0,
ambas serão amarelas.
e) três soluções diferentes, estiverem cada uma delas com
um indicador da tabela, em pH maior que 9,6 elas serão
coloridas.
Turma dos 30 - Química - Sônia - 05-06-2011
TURMA DOS 30
H3C
O
14. Assinale a alternativa correta.
a) No PCl5, existem 5 ligações covalentes P-Cl e o fósforo
apresenta hibridização tipo sp3d.
b) O cloro-metano possui menor momento dipolar do que o
tetracloreto de carbono.
c) A ligação química formada entre um átomo da família
IIA e um átomo da família VIIA é do tipo covalente.
d) A ligação metálica não ocorre entre metais de famílias
diferentes.
e) A molécula de NF3 possui geometria plana triangular.
15. Sobre as moléculas NH3, BF3 e CH4, podemos afirmar
que:
1. por se tratarem de moléculas heteroatômicas
assimétricas, todas são polares.
2. a molécula BF3 deve ser plana, pois o elemento B
apresenta uma hibridização do tipo sp2.
3. as moléculas NH3 e CH4 apresentam pontes de
hidrogênio devido à presença de H em sua estrutura.
Está(ão) correta(s) apenas:
a) 1
b) 2
c) 3
d) 1 e 3
e) 2 e 3
16. Bactérias são microorganismos existentes em quase
tudo ao nosso redor. No início do século XIX, os
médicos enfrentavam um grande desafio. Cirurgias, por
menores que fossem, eram extremamente perigosas
para o paciente, pois o local da incisão poderia ser alvo
de infecção causada por bactérias. Em 1867, um
médico descobriu que soluções aquosas de fenol
matavam bactérias. Iniciava-se assim o uso de antisépticos, substâncias capazes de matar bactérias
quando aplicadas a uma superfície. Um exemplo de
anti-séptico é o composto cuja estrutura química está
representada abaixo.
H3C
Com base na estrutura química desse anti-séptico, é
correto afirmar que essa substância possui
um carbono assimétrico.
três átomos de carbono com hibridização sp3.
fórmula molecular C9H10O.
um radical isopropil ligado ao anel aromático.
três ligações e onze ligações .
17. Em um estudo para a busca de compostos com
atividade inseticida foram isoladas do fungo Aspergillus
versicolor as substâncias I e II abaixo. Entretanto,
somente a substância II apresentou atividade inseticida,
sendo a substância I inativa, sob as condições de
ensaio empregadas.
H3C
O
O
II
É CORRETO afirmar que I e II:
a) possuem o mesmo número de ligações .
b) são isômeros constitucionais.
c) possuem três átomos de carbono com hibridação sp3.
d) possuem a mesma fórmula molecular.
18. O geraniol possui um odor semelhante ao da rosa,
sendo, por isso, usado em perfumes. Também é usado
para produzir sabores artificiais de pêra, amora, melão,
maçã vermelha, lima, laranja, limão, melancia e abacaxi.
Pesquisas o evidenciam como um eficiente repelente de
insetos. Ele também é produzido por glândulas olfativas
de abelhas para ajudar a marcar as flores com néctar e
localizar as entradas para suas colméias. A seguir,
temos a estrutura do geraniol, com seus átomos
numerados de 1 a 10.
1
2
3
4
5
CH3
C
CH
CH2
CH2
6
C
CH
H
8
C
OH
10 H
CH3
Assinale a alternativa que contém a medida correta dos
ângulos reais formados pelas ligações entre os átomos
2-3-4, 4-5-6 e 9-8-10, respectivamente, da estrutura do
geraniol.
120º, 109º28’ e 109º28’.
120º, 109º28’ e 180º.
180º, 120º e 109º28’.
109º28’, 180º e 180º.
entre a metila e o anel está mais próximo do carbono do
anel.
19. A vitamina C, também chamada de ácido ascórbico, é a
mais conhecida das vitaminas. Ela está presente
principalmente nos vegetais frescos, sendo mais
abundante nas frutas cítricas (a acerola é uma das que
possui maior teor de vitamina C). Com base na fórmula
estrutural da vitamina C (ao lado), analise as seguintes
afirmações:
CH2OH
H
C
OH
O
HO
O
CH2OH
O
OH
O número de carbono com hibridização do tipo sp3 é
igual ao número de carbono com hibridização do tipo
sp2.
II. O anel da molécula apresenta 5 orbitais moleculares
e 1 orbital .
III. O carbono da função orgânica éster possui hibridização
de tipo sp3.
Dentre as afirmativas acima, está(ão) CORRETA(S):
I.
I
7
HO
O
O
9
CH3
a)
b)
c)
d)
CH3
a)
b)
c)
d)
e)
CH2OH
O
CH3
OH
HO
O
HO
Turma dos 30 - Química - Sônia - 05-06-2011
TURMA DOS 30
a)
b)
c)
d)
e)
I, II e III .
I e III.
I e II.
III.
II e III.
20. No hidrocarboneto de fórmula estrutural representada
abaixo, os átomos de carbono estão numerados de 1 a
7.
H
H H H
H
H
C
7
H
I.
II.
III.
IV.
a)
b)
c)
d)
C
C
6
5
C4
H
C
3
C
2
C1
b)
H
H
Sobre esse hidrocarboneto são feitas as seguintes
afirmativas:
O total de ligações (pi) na estrutura é igual a 3.
O átomo de carbono 2 forma 3 ligações (pi) e 1
ligação (sigma).
O átomo de carbono 5 forma 3 ligações (sigma) e 1
ligação (pi).
O átomo de carbono 1 forma 4 ligações (sigma).
São CORRETAS apenas as afirmativas:
I, III e IV.
II e IV.
I e II.
I, II e IV.
Textos para as questões 21 e 22
21.
O gráfico abaixo representa a modificação que
acontece nas concentrações dos reagentes e produto,
após uma perturbação do equilíbrio no tempo t1
a)
b)
c)
d)
a)
De acordo com o gráfico, essa perturbação poderia ser
causada por
aumento da pressão total.
adição de NH3(g).
aumento da temperatura.
adição de H2(g).
Uma das principais descobertas que impulsionou a
produção de alimentos foi o processo industrial de
Haber-Bosch da produção de amônia, que ocorreu há
cerca de 100 anos, de acordo com a reação (1):
N 2 (g ) 3H 2 (g )
(1)
2NH 3 (g )
H º 92kJ / mol, Gº 16kJ / mol e
Kc 5,0 108 (L / mol) 2 .
22. A tabela abaixo apresenta os efeitos da temperatura e
da pressão na produção de amônia pelo método de
Haber-Bosch:
c)
d)
As condições econômicas aceitáveis, para se produzir
amônia industrialmente, são: pressão acima de 100 atm,
temperatura em torno de 450°C e uso de um
catalisador.
Com base em todas essas informações, pode-se
afirmar:
A diminuição da pressão de 1000 atm para 100 atm
diminui a produção de amônia porque o processo é
endotérmico.
A temperatura constante, o aumento da pressão de 10
atm para 100 atm aumenta a produção de amônia
porque o processo é endotérmico.
A pressão constante, o aumento da temperatura de
200°C para cerca de 450°C diminui a quantidade de
amônia, embora aumente a velocidade da reação.
A diminuição da temperatura de 600°C para cerca de
450°C aumenta a quantidade de amônia, embora
aumente a velocidade da reação.
Texto para a questão 23
Não produzir qualquer tipo de resíduo ou poluente é o
principal atributo em favor do hidrogênio como
combustível para gerar energia elétrica. Ele faz
funcionar células de combustível, equipamentos que
produzem eletricidade sem danos ambientais. Como
uma das fontes de hidrogênio é a água, uma das
alternativas, em consonância com a preocupação
ambiental, é o reuso da água como produção de energia
renovável, utilizando esgotos e efluentes industriais.
O grupo de professores da Escola de Engenharia de
São Carlos/USP desenvolveu um método para produzir
hidrogênio em um reator de fluxo contínuo,
constantemente alimentado com rejeitos que seriam,
muitas vezes, descartados sem tratamento em rios e
lagoas. No sistema, bactérias anaeróbicas do gênero
Clostridium, que não precisam de oxigênio para viver,
aderem a partículas de polietileno dentro de um reator.
Nos automóveis, movidos a células de combustível, o
consumo de hidrogênio varia de 1,0 a 10,0g/km rodado,
segundo um professor do grupo. (OLIVEIRA, 2009, p.
100).
23. O método para produzir hidrogênio, a partir de rejeitos
descartados, sem tratamento, em rios e lagoas, utiliza
bactérias anaeróbicas, do gênero Clostridium, para
fermentar material orgânico.
Durante a fermentação, são produzidos hidrogênio,
H2(g), metano, CH4(g), sulfeto de hidrogênio, H2S(g), e
dióxido de carbono, CO2(g), além de outros produtos.
A partir dessas informações, é correto afirmar:
01. O hidrogênio, o metano e o sulfeto de hidrogênio
resultam de oxidação de matéria orgânica durante a
fermentação.
02. Um mol de H2S(g) é ionizado completamente a S2–(aq),
em meio aquoso, de acordo com o equilíbrio químico
2–
+
representado H2S(aq)
S (aq) + 2H3O (aq).
03. O hidrogênio produzido na fermentação anaeróbica de
rejeitos descartados, sem tratamento, é sustentável e
mais econômico do que o obtido na eletrólise da água.
04. O metano reage com a água, à temperatura ambiente,
de acordo com a equação química CH4(g) + H2O(l)
CO(g) + 3H2(g).
05. O CO2(g) resulta da redução de matéria orgânica rica
em hidrocarbonetos de cadeia aberta.
Fonte: MASTERTON, William L., Hurley Cecile N. Chemistry:
Principles & Reactions. Second Edition,
By Saunders College Publishing, 1993, USA.
Turma dos 30 - Química - Sônia - 05-06-2011
TURMA DOS 30
GABARITO:
01) Gab: D
02) Gab: A
03) Gab: A
04) Gab: E
05) Gab: D
06) Gab: B
07) Gab: A
08) Gab: 01-02-16
09) Gab: 30
10) Gab: B
11) Gab: C
12) Gab: C
13) Gab: E
14) Gab: A
15) Gab: B
16) Gab: D
17) Gab: A
18) Gab: A
19) Gab: C
20) Gab: A
21) Gab: C
22) Gab: D
23) Gab: 03
Turma dos 30 - Química - Sônia - 05-06-2011