Histórico de Refrigeração
Refrigeração foi usada desde cedo nas civilizações antigas
Civilização chinesa (séculos antes de Cristo)
– usava gelo natural colhido nas superfícies dos rios e lagos congelados
– gelo era conservado em poços cavados na terra e cobertos com palha
Histórico de Refrigeração
Civilizações Grega e Romana
– aproveitavam o gelo colhido no alto das montanhas (utilizava trabalho escravo) para o
preparo de bebidas e alimentos gelados
Histórico de Refrigeração
Civilização Egípcia
– devido situação geográfica e ao clima, não dispunham de gelo natural
– refrescava a água por evaporação, usando vasos de barro, semelhantes às moringas
(comuns no interior do Brasil)
O barro é um material poroso e por isto permite a passagem de uma pequena quantidade de
água contida no interior da moringa para a superficie externa da moringa. A evaporação desta
água para o ambiente faz baixar a temperatura da água restante na moringa, pois a energia
necessária à evaporação é obtida da água contida na moringa
durante muito séculos única utilidade para o gelo foi refrigerar bebidas e alimentos para
melhorar seu paladar
(Romanos vendiam sorvete em Roma, no verão)
Microscópio
– inventado final século XVII
– permitiu identificar a existência de microorganismos (micróbios, bactérias) invisíveis à vista
nua
– micróbios existem em quantidades enormes, espalhados por todas as partes, água,
alimentos e organismos vivos
Louis Pasteur
– identificou que alguns tipos de bactérias são responsáveis pela putrefação dos alimentos e
por muitos tipos de doenças e epidemias
– reprodução de bactérias podia ser impedida (ou limitada) pela aplicação do frio no ambiente
em que elas proliferavam
– suas constatações provocaram
(século XVIII) grande expansão da indústria do gelo
Antes da descoberta da capacidade inibidora do crescimento das bactérias pelo gelo os
– alimentos eram deixados no seu estado natural, estragando-se rapidamente
– para conservar por longo tempo era necessário
• salgação
• defumação
• uso de condimentos
Esses tratamentos (salgamento, defumação e condimentação) diminuíam a qualidade do alimento
e modificavam o seu sabor
Uso do Gelo
• possibilidade de conservar alimentos frescos, com todas as suas qualidades, durante um
período longo de tempo
O uso do gelo natural
durante muito tempo trouxe inconvenientes que prejudicaram o desenvolvimento da
refrigeração
Gelo natural
– dependência direta da natureza para obtenção
– só se formava no inverno e nas regiões de clima bastante frio
– fornecimento bastante irregular
– países quentes, sujeita a transporte demorado
• maior parte se perdia por derretimento
• estocagem era bastante difícil, só por períodos curtos
Necessidade
– meios e processos que permitissem a obtenção artificial de gelo artificial
– independência da natureza
1834
– inventado o primeiro sistema mecânico de fabricação de gelo artificial
– base dos atuais sistemas de refrigeração
1855
– na Alemana outro tipo de mecanismo para a fabricação do gelo artificial
• baseado no princípio da absorção
• descoberto em 1824 pelo físico e químico inglês Michael Faraday
Durante cerca de meio século
– os aperfeiçoamentos nos processos de fabricação de gelo artificial foram se acumulando
– maiores rendimentos
– melhores condições de trabalho
– produção fez poucos progressos, por causa da desconfiança do consumidor contra o gelo
artificial
• apesar das vantagens da refrigeração artificial era crença geral que o gelo produzido
pelo homem era prejudicial à saúde humana
–por causa da descrença o consumo de gelo artificial era pequeno
– em 1890, o inverno nos Estados Unidos, foi muito fraco e não houve bastante gelo natural
neste ano
– população teve que usar gelo artificial
• quebra do tabú
• gelo artificial era melhor que o produto natural
– feito com água mais pura
– ser produzido à vontade, conforme necessidade de consumo
Gelo natural levou a criação das primeiras geladeiras(princípio do século XIX)
Utilizavam placas de cortiça
– dentro era colocadas pedras de gelo e os alimentos a conservar
A fusão do gelo absorvia calor dos alimentos
– reduziando a temperatura no interior da geladeira
Gelo Artificial
aceito pelo consumidor
– demanda cresceu vertiginosamente
fábricas de gelo (artificial)
– passaram a surgir por todas as partes
Fábrica de gelo
–fabricação do gelo era feita em instalações especiais
– não sendo possível a produção do gelo na casa dos consumidores
– geleiro
• carroça isolada
• percorria os bairros
• entregava nas casas dos consumidores, periodicamente, as pedras de gelo para as
geladeiras
Eletricidade
– início século XX
– substituição dos candeeiros de óleo e de querosene e dos lampiões de gases, pelas
lâmpadas elétricas
– disponível para movimentar pequenas máquinas e motores
–permitiu a produção de gelo (pequena escala) na residência dos usuários
– primeiro refrigerador doméstico surgiu em 1913
• aceitação mínima
• operação manual
• exigia atenção constante
• baixo rendimento
1918
– apareceu primeiro refrigerador automático
– movido a eletricidade
– fabricado pela Kelvinator Company
– a partir de 1920
• evolução intensa com produção sempre crescente de refrigeradores mecânicos
Sistema
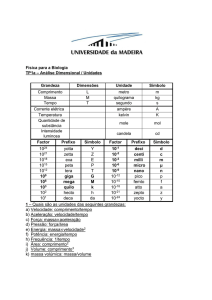
Definições Importantes
– quantidade de matéria (fixa) separada do Universo para estudo
a fronteira do sistema pode ser
• real ou imaginária
• fixa ou móvel
Vizinhança
– ou meio ambiete é o restante do Universo
• Universo = sistema + vizinhança
Temperatura
– grandeza que define o campo da Termodinâmica
– grandeza física que permite identificar os corpos que nós identificamos (fisiolosicamente)
como quentes e frios
– grandeza física que estabelece a direção na qual a energia térmica se desloca
Corpos em temperaturas diferentes
– postos em contato térmico transferem calor (energia térmica) entre sí
– do corpo mais quente para o mais frio
– até ser atingido o equilíbrio térmico
Equilíbrio Térmico
– corpos (ou sistemas) que estão à mesma temperatura
– sistemas que não podem trocar calor entre sí
Termômetro
– dispositivo ou equipamento que permite identifica “o” estado térmico em que um sistema se
encontra
Escala Termométrica
– Conjunto de regras (arbitrárias) que permite associar números (de forma biunívoca) à
estados térmicos
Escala Celsius, 0C
– inventada em 1742 pelo sueco Anders Celsius (1701 - 1744)
Escala Fahrenheit, 0F
– Fahrenheit, inventada por Gabriel Fahrenheit (1686 - 1736), utilizada pelos países de língua
inglesa
Escala Kelvin, K
– escala absoluta proposta por Lord Kelvin ( Willian Thomson, 1824 - 1907)
– a escala absoluta relacinada à escala Fahrenheit é chamada de escala Rankine e
designada por R
Conversão entre as escalas
Lei Zero da Termodinâmica
– estabelece que se pode determinar (identificar) um estado térmico (temperatura) utilizando
um termômetro
Fase
– matéria pode existir nas três fases
•
•
•
•
sólida
líquida
gasosa
Plasma
Temperatura e Pressão
combinações de mais de uma fase é possível
1. Vaporização
Possíveis mudança de fase
evaporação
2. Condensação
liquefação
3. Fusão
4. Solidificação
5. Sublimação
6. Sublimação
Transmissão de calor
pode ocorrer segundo três processos diferentes
– Condução
– Convecção
– Radiação
Condução
– processo de transmissão de calor em que a energia térmica passa de um local para outro
através das partículas existentes no corpo
• na região mais quente as partículas têm mais energia e transmite parte da energia, de
molécula para molécula, até o extremo oposto espalhando a energia pelo corpo inteiro
Convecção
– processo de transmissão de calor com formação de correntes em que as moléculas de
matéria sobem e descem
• convecção só ocorre em fluidos (líquidos e gases)
• convecção natural, ocasionada por diferença de densidades devido à diferença de
temperaturas entre as massas do fluido
• convecção forçada, ocasionada por bombas ou ventiladores
Verão
– ar resfriado deve ser introduzido nas salas pela parte superior para que, devido a sua
densidade, desça e provoque a circulação de ar
Inverno
– ar quente introduzido pela parte inferior da sala. Se ocorresse o contrário, o ar frio (mais
denso) continuaria embaixo e o ar quente (menos denso) continuaria em cima, não havendo
circulação
Refrigeradores
– evaporador é sempre instalado na parte superior, para que o ar resfriado desça, dando lugar
ao ar mais quente, que sobe ao receber calor dos alimentos e da abertura de portas
– as prateleiras são gradeadas para possibilitar a convecção do ar no interior do refrigerador
Radiação
– processo de transmissão de calor no vácuo ou num meio material
• materiais diatérmicos
– permite a propagação do calor por eles
• materiais atérmicos
– não permite a propagação do calor por eles
Ar atmosférico
meio diatérmico
Parede de tijolos
meio atérmico
Importante
–toda energia radiante, como ondas de rádio, radiações infravermelhas, luz visível, luz
ultravioleta, raios X e outras, podem converter-se em energia térmica por absorção
– só as radiações infravermelhas são chamadas de radiações térmicas
– a energia radiante não aquece o meio em que se propaga, mas só o meio que a absorve
calor luminoso
Termos não muito comuns, mas utilizados
– fonte térmica que emite calor acompanhado de luz
sol, chama, arco voltáico, lâmpada incandescente, etc
calor obscuro
– fonte térmica que emite calor não acompanhada de luz
forno de assar, ferro de passar roupa, etc
corpos de cores escuras
são bons absorventes e bons emissores de calor
corpos de cores claras
são maus absorventes e maus emissores de calor, porém bons refletores
condensadores utilizados nos refrigeradores domésticos são pintados com tinta escura para
facilitar a emissão do calor pela radiação para o ambiente
Quantidade de Calor
kcal
– quilocaloria
– quantidade de calor necessária para elevar a temperatura de um quilograma de água
destilada de 1ºC
kcal
– Uma quilocaloria é a quantidade de calor necessária para elevar de 14,5ºC a 15,5ºC a
temperatura de um quilograma de água pura a pressão normal
– caloria quantidade de calor necessária para elevar de 14,5ºC a 15,5ºC a temperatura de um
grama de água pura a pressão normal
BTU
– British Thermal Unit
– BTU é a quantidade de calor necessária para aquecer 1lb (1 libra-massa = 435,6g) de água
pura de 58,5ºF a 59,5ºF, sob pressão normal
1 BTU = 3,96 Kcal
1 BTU ~ 4 Kcal
Capacidade Térmica - C
A capacidade térmica (C) permite responder a duas questões básicas da calorimetria
– Quanto calor (Q=?) é necessário para se obter uma certa variação de temperatura, ΔT
– Qual a variação de temperatura (ΔT=?) que ocorre quando se fornece uma certa quantidade
de calor ao corpo, Q
Calor Específico - c
– porque nos interessa obter uma quantidade que não dependa do sistema (quantidade de
massa) define-se o calor específico, c
c
Calor Específico
C
m
c
Q
m T
Q m c T
indica a quantidade de calor que se deve fornecer a unidade de massa do sistema para que
ela tenha um aumento de temperarura de 1 grau
Q
c
Calor sensível
Q m c T
– aquele percebido pela variação da temperatura
Calor Latente
Q m L
m T
– aquele que não é percebido pela variação na temperatura do sistema, mas sim pela
mudança de fase que provoca
Quantidade total de calor transferido
Q Qs QL
Q m c T m L
Princípio da Conservação da Energia
aplicado à calorimetria
Num sistema termicamente isolado, a soma das quantidades de calor recebido é igual a soma
das quantidades de calor cedido
Equação Fundamental da Calorimetria
Q 0
Q Q
r
j
j
c
Equivalente Mecânico da Caloria
– Energia térmica (calor) e energia mecânica (trabalho) eram grandezas diferentes
– Estudadas em campos diferentes
• Mecânica
• Calorimetria
Até que se mostrou que se tratavam da mesma grandeza física: ENERGIA
Equivalente Mecânico da Caloria
W J Q
Joule caloria -1a Lei da Termodinâmica para um ciclo
Definições Importantes
Utilizando-se o mesmo sistema de unidades tanto para o calor quanto para o trabalho (tudo
medido em Joule)
J 4186
1a Lei da Termodinâmica para um ciclo
W Q
W Q
j
1a
Lei da Termodinâmica
– para um sistema
Convenção de sinais
i
J
kcal
sistema
1a Lei da Termodinâmica
Definições Importantes
– Volume de Controle (vc)
Fazendo o Balanço de Energia
Q m u
i
i
1
1
pi vi vi2 gzi W me ue pe ve ve2 gze Evc
2
2
um fluxo entrada e um fluxo saída
Q mi ui pi vi Ei ,cin Ei , pot W me he Ee,cin Ee, pot Evc
Rescrevendo a 1a Lei (1 fluxo)
Regime Permanente
Débito de massa
ou simplesmente débito
dm
m
Av
dt
kg
s
1a Lei (1 fluxo + regime permanente)
1a Lei da Termodinâmica
• 1 fluxo
• regime permanente
Efeito Refrigerante
Q W m he hi
mede a quantidade de calor retirado do sistema. Nos refrigeradores mede a quantidade de calor
por hora retirado do espaço que se está refrigerando
Diagrama de Mollier
Diagrama cujas coordenadas são Pressão e Entalpia
P h