COLÉGIO MACHADO DE ASSIS
Disciplina: QUÍMICA
Professor: DIETER
Turma: 2º ANO ___________
Aluno (a):
Data:
/
/
Nº:
( X ) ESTUDO DE RECUPERAÇÃO DO 3º TRIMESTRE 2013
A avaliação deverá ser feita à caneta, sem rasuras e sem uso de corretivos. A interpretação das questões é parte da avaliação.
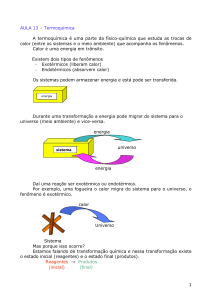
1 – Observa-se que, quando dissolvemos Etanol (álcool comum) em água, há aumento de temperatura da solução.
Daí pode-se afirmar corretamente que:
a) A dissolução do Etanol em água é Endotérmica.
b) O Etanol reage quimicamente com a água, havendo devido a esta reação, liberação de calor.
c) A Variação de Entalpia (∆H) do processo de dissolução do Etanol em água tem sinal negativo.
d) A Entalpia da solução formada é maior que a Entalpia do Etanol somada a da água antes de ser feita a
mistura das duas substâncias.
e) Na verdade não há liberação nem absorção de calor pois este aumento de temperatura da solução é apenas
uma sensação que temos, mas não é real.
2 – Exemplifica um processo Endotérmico:
a) A queima da parafina de uma vela.
b) A dissolução do ácido sulfúrico em água.
c) A combustão do álcool hidratado nos motores dos carros.
d) A evaporação da água de uma piscina pela ação do calor do sol.
e) A formação de um iceberg a partir da água do mar.
3 – Dada a equação termoquímica: Srômbico + O2(g) → SO2(g) ∆H = -72kcal , então na produção de 160g de SO2
temos:
a) Liberação de 72 kcal, pois a reação é exotérmica.
b) Absorção de 72 kcal, pois a reação é endotérmica.
c) Não há troca de calor, pois a reação é atérmica.
d) Desprendimento de 180 kcal, pois a reação é exotérmica.
e) Absorção de 180 kcal, pois a reação é endotérmica.
4 – Quando meio mol de Etanol líquido sofre combustão total, sob pressão constante, produzindo CO2 e H2O
gasosos, a energia liberada é de 148 kcal. Na combustão de 3 mols de Etanol, nas mesmas condições, a Entalpia
dos produtos, em relação à dos reagentes, é:
a) 74 kcal menor.
b) 444 kcal menor.
c) 888 kcal menor.
d) 444 kcal maior.
e) 888 kcal maior.
5 – Como ficaria a equação termoquímica abaixo, se fosse reescrita em termos de ∆H por mol de Carbono
consumido?
Equação Termoquímica = 3 C(s) + 2 Fe2O3(s) → 4 Fe(s) + 3 CO2(g) ∆H = + 110,8 kcal
Equação Termoquímica reescrita = _____________________________________________________________
6 – Observando-se a equação termoquímica abaixo, qual a Variação de Entalpia observada na SUBLIMAÇÃO de 5
mols de Iodo (I2)?
Equação: I2(g) → I2(s) ∆H = - 15 kcal
a)
b)
c)
d)
e)
∆H = -15 kcal
∆H = +15 kcal
∆H = -75 kcal
∆H = +75 kcal
∆H = +5 kcal
7 – (MACK-SP) É comum sentir arrepios de frio ao sair do mar ou piscina, mesmo em dias quentes. Esta sensação
ocorre, pois a água, que possui calor específico alto:
a) Absorve calor do nosso corpo, ao evaporar.
b) Libera calor ao passar de líquido para vapor.
c) Absorve calor do sol e se liquefaz sobre a nossa pele.
d) Absorve calor do nosso corpo, sublimando.
e) Libera calor para o nosso corpo, que imediatamente sofre resfriamento.
8 – (UNESP) Considere a equação a seguir:
2 H2(g) + O2(g) → 2 H2O(ℓ) ΔH = - 572 kJ .
É correto afirmar que a reação é:
a)
b)
c)
d)
e)
Exotérmica, liberando 286 kJ por mol de oxigênio consumido.
Exotérmica, liberando 572 kJ para dois mols de água produzida.
Endotérmica, consumindo 572 kJ para dois mols de água produzida.
Endotérmica, liberando 572 kJ para dois mols de oxigênio consumido.
Endotérmica, consumindo 286 kJ por mol de água produzida.
9 – (UFRRJ) Ao se misturar 20 mL de água com 10 mL de ácido sulfúrico concentrado, a temperatura sobe de 25°C
para 80°C logo após a adição do ácido. Isso ocorre devido à:
a) Dissociação do ácido na água ser endotérmica.
b) Dissociação do ácido na água ser exotérmica.
c) Precipitação ser endotérmica.
d) Precipitação ser exotérmica.
e) Formação de gases.
10 – (UFES) O hidrogênio, H2(g) , é usado como combustível em foguetes. O hidrogênio queima na presença do
oxigênio, O2(g) , produzindo vapor de água, segundo a equação: 2 H2(g) + O2(g) → 2 H2O(ℓ) ΔH = - 484 kJ. A
Variação de Entalpia observada na queima de um grama de hidrogênio, é: Dado: m.a.: H=1
a) –242 kJ
b) –121 kJ
c) +242 kJ
d) +121 kJ
e) –60,5 kJ
11 – (UFMG) Uma certa quantidade de água é colocada em um congelador, cuja temperatura é de –20°C. Após estar
formado e em equilíbrio térmico com o congelador, o gelo é transferido para outro congelador, cuja temperatura é –
5°C. Considerando-se essa situação, é correto afirmar que, do momento em que é transferido para o segundo
congelador até atingir o equilíbrio térmico no novo ambiente, o gelo:
a) Se funde.
b) Transfere calor para o congelador.
c) Aquece-se.
d) Permanece na mesma temperatura inicial.
e) Sublima.
12 – (Unesp-Modificada) Ozonizador é um aparelho vendido no comércio para ser utilizado no tratamento da água.
Nesse aparelho é produzido ozônio (O3) a partir do oxigênio (O2) do ar, que mata os microorganismos presentes na
água. A reação pode se representada pela equação: 3 O2(g) → 2 O3(g) ΔH = +284 kJ. Com base nessa equação, e
considerando a transformação de 1280g de O2(g) em O3(g), a variação de entalpia (ΔH) observada nesta reação é de
quanto? (Demonstre sua resposta com todos os cálculos necessários) Dado: m.a.: O=16
13 – (UFMG-modificada) A energia que um ciclista gasta ao pedalar uma bicicleta é cerca de 1800 kJ/hora acima de
suas necessidades metabólicas normais. A sacarose (C12H22O11), fornece aproximadamente 5400 kJ/mol de energia.
Qual a massa de sacarose que esse ciclista deve ingerir a fim de obter a energia extra necessária para pedalar duas
horas?
(Demonstre sua resposta com todos os cálculos necessários). Dados: m.a.: C=12 H=1 O=16
14 – (UFFRJ) O índice de nutrição alimentar de um país é medido pela quantidade de proteína (nitrogênio) ingerida
por um indivíduo. Entretanto, para a produção de energia diária, os carboidratos são bons alimentos (fonte) e, a
utilização da glicose pelas células implica sua oxidação por meio de uma série de reações que podem ser assim
resumidas:
C6H12O6 + 6 O2 → 6 CO2 + 6 H2O + calor
Essa reação pode ser classificada como:
a) Simples Troca
b) Endotérmica
c) Adição
d) Substituição
e) Exotérmica
15 – Sobre as reações químicas de combustão (popularmente conhecidas como queimas) é falso afirmar-se que:
a) Liberam calor durante sua ocorrência.
b) A Entalpia de seus reagentes sempre é maior que de seus produtos.
c) A Entalpia de seus produtos sempre é maior que de seus reagentes.
d) A Variação de Entalpia observada nestas reações sempre é identificada com um sinal negativo.
e) O meio no qual acontecem estas reações sofre aquecimento.