I Lista de Exercícios – Química 2013
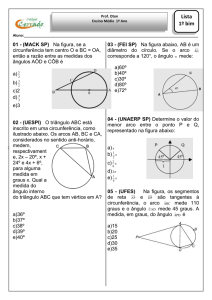
01 - (IFSP/2013)
O número de elétrons da camada de valência do átomo de cálcio (Z = 20), no estado fundamental,
é
a)
b)
c)
d)
e)
1.
2.
6.
8.
10.
02 - (FM Petrópolis RJ/2013)
O chumbo é um metal pesado que pode contaminar o ar, o solo, os rios e alimentos. A absorção de
quantidades pequenas de chumbo por longos períodos pode levar a uma toxicidade crônica, que se
manifesta de várias formas, especialmente afetando o sistema nervoso, sendo as crianças as
principais vítimas.
Sendo o número atômico (Z) do chumbo igual a 82, o íon plumboso (Pb +2) possui os elétrons mais
energéticos no subnível
a)
b)
c)
d)
e)
6p2
6s2
6p4
5d10
4f14
03 - (UCS RS/2012)
Os dias dos carros com luzes azuis estão contados, pois, desde 1º de janeiro de 2009, as lâmpadas
de xenônio (Xe), não podem mais ser instaladas em faróis convencionais. Mesmo que as lâmpadas
azuis possibilitem três vezes mais luminosidade do que as convencionais, elas não se adaptam
adequadamente aos refletores feitos para o uso com lâmpadas convencionais, podendo causar
ofuscamento à visão dos motoristas que trafegam em sentido contrário e possibilitando, assim, a
ocorrência de acidentes.
Quantos elétrons o gás xenônio apresenta na camada de valência?
a)
b)
c)
d)
e)
2
6
8
10
18
04 - (ESCS DF/2012)
“Os pesquisadores alertam que os metais dos quais as panelas são feitas podem causar
intoxicações, anemia, distúrbios gástricos e até expor os usuários a substâncias cancerígenas.
Pesquisas mostram que o excesso de alumínio no corpo pode induzir a estados de demência,
panelas deste metal devem ser utilizadas para cozimentos rápidos. O cobre em excesso pode
originar leucemia e câncer do intestino, embora sua falta possa levar a doenças respiratórias, as
panelas deste metal devem ser revestidas com uma camada protetora de titânio. Até mesmo
1
I Lista de Exercícios – Química 2013
revestimentos de níquel ou de material antiaderente apresentam riscos para saúde. De um modo
geral, as panelas de ferro fundido são as melhores para a saúde, pois liberam o nutriente na
comida e ajudam a suprir as necessidades do organismo, mas não são boas para quem tem
colesterol alto. As panelas de INOX são bastante seguras, porque o material não se oxida e não
libera o metal na comida, dizem alguns pesquisadores.”
(Adaptado de O Globo, 14/10/2011)
Dos metais de transição citados no texto, o que mais facilmente forma cátions é o:
a)
b)
c)
d)
e)
alumínio;
cobre;
ferro;
níquel;
titânio.
05 - (PUC RJ/2012)
Os átomos de um elemento químico possuem a seguinte distribuição de elétrons em subníveis e
níveis, em torno do núcleo:
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p3
A localização do elemento (período e grupo) na tabela periódica é:
a)
b)
c)
d)
e)
terceiro período, grupo 9 ou 8B.
quarto período, grupo 13 ou 13A.
quarto período, grupo 10 ou 7B.
quinto período, grupo 13 ou 3A.
quinto período, grupo 15 ou 5A.
06 - (FCM MG/2012)
Observe as duas configurações eletrônicas abaixo:
I. 1s2 2s2 2p6 3s1
II. 1s2 2s2 2p6 6s1
Assinale a alternativa INCORRETA:
a)
b)
C)
d)
a configuração I representa o átomo de sódio em seu estado fundamental.
as configurações I e II representam átomos de elementos químicos diferentes.
é necessário fornecer energia para obter a configuração II, a partir da configuração I.
é necessário fornecer menos energia para remover um elétron da configuração II do que da I.
07 - (FAVIP PE/2012)
O cálcio é o elemento da rigidez e da construção: é o cátion dos ossos do nosso esqueleto, das
conchas dos moluscos, do concreto, da argamassa e da pedra calcária das nossas construções.
Sabendo que o átomo de cálcio tem número atômico 20 e número de massa 40, é correto afirmar
que o cátion Ca2+ tem:
2
I Lista de Exercícios – Química 2013
a)
b)
c)
d)
e)
18 prótons.
18 nêutrons.
20 elétrons.
configuração eletrônica igual à do íon K+ (Z = 19).
configuração eletrônica 1s2 2s2 2p6 3s2 3p6 4s2.
08 - (IFSP/2013)
Considere a tabela abaixo, que fornece características de cinco átomos (I, II, III, IV e V).
Número de elétrons
Átomo
Número
atômico
Número
de massa
I
11
23
de valência
1
II
11
24
1
III
IV
19
20
40
40
1
2
V
40
90
2
na camada
São isótopos entre si os átomos
a)
b)
c)
d)
e)
I e I I.
I I. e III.
I, I I. e III.
III e IV.
IV e V.
09 - (MACK SP/2013)
Sabendo-se que dois elementos químicos
6X 8
3X 3 A
e
3x 20
2x 8 B
são isóbaros, é correto afirmar que o
número de nêutrons de A e o número atômico de B são, respectivamente,
a)
b)
c)
d)
e)
15 e 32.
32 e 16.
15 e 17.
20 e 18.
17 e 16.
10 - (UEPG PR/2013)
Considerando os elementos químicos representados por
correto.
01.
02.
04.
08.
19A
42
,
40
19B
e
21C
42
, assinale o que for
Os elementos A e B são isótopos.
Os elementos A e C são isóbaros.
Os elementos B e C são isótonos.
O elemento A é o que possui maior número de nêutrons no núcleo.
11 - (UERJ/2013)
A descoberta dos isótopos foi de grande importância para o conhecimento da estrutura atômica da
matéria.
3
I Lista de Exercícios – Química 2013
Sabe-se, hoje, que os isótopos 54Fe e 56Fe têm, respectivamente, 28 e 30 nêutrons.
A razão entre as cargas elétricas dos núcleos dos isótopos 54Fe e 56Fe é igual a:
a)
b)
c)
d)
0,5
1,0
1,5
2,0
12 - (FGV SP/2012)
A tabela seguinte apresenta dados referentes às espécies K, K+, Ca2+ e S2–.
Em relação a essas espécies, são feitas as seguintes afirmações:
I.
II.
III.
IV.
K+ e Ca2+ são isótonos;
K e Ca2+ são isóbaros;
K+ tem mais prótons que K;
K+ e S2– têm o mesmo número de elétrons.
É correto apenas o que se afirma em
a)
b)
c)
d)
e)
I e II.
I e III.
I e IV.
II e III.
II e IV.
13 - (UDESC SC/2012)
Assinale a alternativa correta. Os isótopos são átomos:
a)
b)
c)
d)
e)
de um mesmo elemento químico, apresentam propriedades químicas praticamente idênticas,
mas têm um número diferente de nêutrons no seu núcleo.
que têm o mesmo número de prótons e um número diferente de nêutrons no seu núcleo,
apresentando propriedades químicas totalmente distintas.
de um mesmo elemento químico, apresentam propriedades químicas idênticas, mas têm um
número diferente de prótons no seu núcleo.
de elementos químicos diferentes, com o mesmo número de nêutrons no seu núcleo e
apresentam propriedades químicas semelhantes.
de elementos químicos diferentes, apresentam propriedades químicas distintas, mas têm o
mesmo número de nêutrons no seu núcleo.
14 - (UEM PR/2012)
Considerando os elementos químicos Mendelévio, Férmio e Einstênio, conforme abaixo, assinale o
que for correto.
4
I Lista de Exercícios – Química 2013
258
101 M d
01.
02.
04.
08.
16.
257
100 Fm
252
99 Es
O íon Md1+ é isótopo do elemento Fm.
O elemento Es é isótono do elemento Md.
O íon Es2–possui 101 elétrons.
O elemento Fm é isóbaro do íon Es1–.
O elemento Md possui massa maior do que o elemento Fm devido ao maior número de
nêutrons do Md.
15 - (IME RJ/2013)
Os trabalhos de Joseph John Thomson e Ernest Rutherford resultaram em importantes
contribuições na história da evolução dos modelos atômicos e no estudo de fenômenos
relacionados à matéria. Das alternativas abaixo, aquela que apresenta corretamente o autor e uma
de suas contribuições é:
a)
b)
c)
d)
e)
Thomson - Concluiu que o átomo e suas partículas formam um modelo semelhante ao
sistema solar.
Thomson - Constatou a indivisibilidade do átomo.
Rutherford - Pela primeira vez, constatou a natureza elétrica da matéria.
Thomson - A partir de experimentos com raios catódicos, comprovou a existência de
partículas subatômicas.
Rutherford - Reconheceu a existência das partículas nucleares sem carga elétrica,
denominadas nêutrons.
16 - (UFG GO/2013)
Em um determinado momento histórico, o modelo atômico vigente e que explicava parte da
constituição da matéria considerava que o átomo era composto de um núcleo com carga positiva.
Ao redor deste, haviam partículas negativas uniformemente distribuídas. A experiência
investigativa que levou à proposição desse modelo foi aquela na qual
a)
b)
c)
d)
e)
realizou-se uma série de descargas elétricas em tubos de gases rarefeitos.
determinou-se as leis ponderais das combinações químicas.
analisou-se espectros atômicos com emissão de luz com cores características para cada
elemento.
caracterizou-se estudos sobre radioatividade e dispersão e reflexão de partículas alfa.
providenciou-se a resolução de uma equação para determinação dos níveis de energia da
camada eletrônica.
17 - (ITA SP/2013)
Um átomo A com n elétrons, após (n – 1) sucessivas ionizações, foi novamente ionizado de acordo
com a equação A(n – 1)+ An+ + 1e–. Sabendo o valor experimental da energia de ionização deste
processo, pode-se conhecer o átomo A utilizando o modelo proposto por
a)
b)
c)
d)
E. Rutherford.
J. Dalton.
J. Thomson.
N. Bohr.
5
I Lista de Exercícios – Química 2013
e)
R. Mulliken.
18 - (UFGD MS/2013)
Até algum tempo atrás, adolescentes colecionavam figurinhas que brilhavam no escuro. Essas
figuras apresentam em sua composição uma substância chamada sulfeto de zinco (ZnS). Este
fenômeno ocorre porque alguns elétrons que compõe os átomos desta substância absorvem
energia luminosa e “saltam” para níveis de energia mais externos. No escuro, estes elétrons
retornam aos seus níveis de origem liberando energia luminosa e fazendo a figurinha brilhar. Este
fenômeno pode ser explicado considerando o modelo atômico proposto por
a)
b)
c)
d)
e)
Thomson.
Dalton.
Lavoisier.
Bohr.
Linus Pauling.
19 - (UFRN/2013)
O Diodo Emissor de Luz (LED) é um dispositivo eletrônico capaz de emitir luz visível e tem sido
utilizado nas mais variadas aplicações. A mais recente é sua utilização na iluminação de ambientes
devido ao seu baixo consumo de energia e à sua grande durabilidade.
Atualmente, dispomos de tecnologia capaz de produzir tais dispositivos para emissão de luz em
diversas cores, como, por exemplo, a cor vermelha de comprimento de onda, V, igual a 629 nm, e
a cor azul, de comprimento de onda, A, igual a 469 nm.
A energia, E, dos fótons emitidos por cada um dos LEDs é determinada a partir da equação de
Einstein E = hf onde h é a constante de Planck, e f é a frequência do fóton emitido.
Sabendo ainda que c = f, onde c é a velocidade da luz no vácuo e , o comprimento de onda do
fóton, é correto afirmar que
a)
b)
c)
d)
o fóton correspondente à cor vermelha tem menos energia que o fóton correspondente à cor
azul, pois sua frequência é menor que a do fóton de cor azul.
o fóton correspondente à cor vermelha tem mais energia que o fóton correspondente à cor
azul, pois sua frequência é maior que a do fóton de cor azul.
o fóton correspondente à cor azul tem menos energia que o fóton correspondente à cor
vermelha, pois seu comprimento de onda é maior que o do fóton de cor vermelha.
o fóton correspondente à cor vermelha tem mais energia que o fóton correspondente à cor
azul, pois seu comprimento de onda é menor que a do fóton de cor azul.
20 - (PUC RS/2012)
Leia o texto a seguir.
A aceitação histórica da ideia de que a matéria é composta de átomos foi lenta e gradual. Na
Grécia antiga, Leucipo e Demócrito são lembrados por terem introduzido o conceito de átomo, mas
suas propostas foram rejeitadas por outros filósofos e caíram no esquecimento. No final do século
XVIII e início do século XIX, quando as ideias de Lavoisier ganhavam aceitação generalizada, surgiu
a primeira teoria atômica moderna, proposta por _______. Essa teoria postulava que os elementos
eram constituídos de um único tipo de átomo, enquanto que as substâncias compostas eram
combinações de diferentes átomos segundo proporções determinadas. Quase cem anos depois,
6
I Lista de Exercícios – Química 2013
estudos com raios catódicos levaram J. J. Thomson à descoberta do _______, uma partícula de
massa muito pequena e carga elétrica _______, presente em todos os materiais conhecidos.
Alguns anos depois, por meio de experimentos em que uma fina folha de ouro foi bombardeada
com partículas alfa, Rutherford chegou à conclusão de que o átomo possui em seu centro um
_______ pequeno, porém de massa considerável.
As palavras que preenchem as lacunas correta e respectivamente estão reunidas em
a)
b)
c)
d)
e)
Dalton – elétron – negativa – núcleo
Bohr – cátion – positiva – elétron
Dalton – nêutron – neutra – próton
Bohr – fóton – negativa – ânion
Dalton – próton – positiva – núcleo
21 - (UEM PR/2012)
No que diz respeito à estrutura do átomo e ao desenvolvimento da ciência das partículas
elementares, assinale o que for correto.
01. Um átomo é formado por uma eletrosfera, onde se encontram os elétrons, e por um núcleo,
onde se encontram os prótons e nêutrons.
02. Os prótons são formados por partículas menores chamadas de quarks.
04. Os prótons e nêutrons são classificados como bárions que, por sua vez, pertencem à classe
dos hádrons.
08. O elétron faz parte de um grupo de partículas denominado léptons.
16. O elétron é formado por partículas mais leves, que possuem carga negativa e são chamadas
de neutrinos.
22 - (UFG GO/2012)
Leia o poema apresentado a seguir.
Pudim de passas
Campo de futebol
Bolinhas se chocando
Os planetas do sistema solar
Átomos
Às vezes
São essas coisas
Em química escolar
LEAL, Murilo Cruz. Soneto de hidrogênio. São João del Rei: Editora UFSJ, 2011.
O poema faz parte de um livro publicado em homenagem ao Ano Internacional da Química. A
composição metafórica presente nesse poema remete
a)
b)
c)
d)
e)
aos modelos atômicos propostos por Thomson, Dalton e Rutherford.
às teorias explicativas para as leis ponderais de Dalton, Proust e Lavoisier.
aos aspectos dos conteúdos de cinética química no contexto escolar.
às relações de comparação entre núcleo/eletrosfera e bolinha/campo de futebol.
às diferentes dimensões representacionais do sistema solar.
7
I Lista de Exercícios – Química 2013
23 - (UNICAMP SP/2012)
Glow sticks ou light sticks são pequenos tubos plásticos utilizados em festas por causa da luz que
eles emitem. Ao serem pressionados, ocorre uma mistura de peróxido de hidrogênio com um éster
orgânico e um corante. Com o tempo, o peróxido e o éster vão reagindo, liberando energia que
excita o corante, que está em excesso. O corante excitado, ao voltar para a condição não excitada,
emite luz. Quanto maior a quantidade de moléculas excitadas, mais intensa é a luz emitida. Esse
processo é contínuo, enquanto o dispositivo funciona. Com base no conhecimento químico, é
possível afirmar que o funcionamento do dispositivo, numa temperatura mais baixa, mostrará uma
luz
a)
b)
c)
d)
mais intensa e de menor duração que numa temperatura mais alta.
mais intensa e de maior duração que numa temperatura mais alta.
menos intensa e de maior duração que numa temperatura mais alta.
menos intensa e de menor duração que numa temperatura mais alta.
24 - (UEMA/2012)
Ao longo da história da evolução do estudo do átomo, diversos modelos atômicos foram propostos
até a obtenção do atual. Com relação ao modelo de Thomson, pode-se afirmar que
a)
b)
c)
d)
e)
os elétrons têm caráter corpuscular e de onda, simultaneamente.
toda matéria é formada por partículas extremamente pequenas.
no centro do átomo existe um núcleo muito pequeno e denso, cercado por elétrons.
o elétron se movimenta ao redor do núcleo em órbitas circulares.
o átomo é constituído de cargas positivas e negativas.
25 - (UPE PE/2012)
Um laboratório brasileiro desenvolveu uma técnica destinada à identificação da origem de “balas
perdidas”, comuns nos confrontos entre policiais e bandidos. Trata-se de uma munição especial,
fabricada com a adição de corantes fluorescentes, visíveis apenas sob luz ultravioleta. Ao se
disparar a arma carregada com essa munição, são liberados os pigmentos no atirador, no alvo e em
tudo o que atravessar, permitindo rastrear a trajetória do tiro.
Adaptado de MOUTINHO, Sofia. À caça de evidências. Ciência Hoje, maio, 24-31, 2011.
Qual dos modelos atômicos a seguir oferece melhores fundamentos para a escolha de um
equipamento a ser utilizado na busca por evidências dos vestígios desse tipo de bala?
a)
b)
c)
d)
e)
Modelo de Dalton.
Modelo de Thompson.
Modelo de Rutherford-Bohr.
Modelo de Dalton-Thompson.
Modelo de Rutherford- Thompson.
26 - (MACK SP/2012)
Comemora-se, neste ano de 2011, o centenário do modelo atômico proposto pelo físico
neozelandês Ernest Rutherford (1871-1937), prêmio Nobel da Química em 1908. Em 1911,
Rutherford, bombardeou uma finíssima lâmina de ouro com partículas alfa, oriundas de uma
amostra contendo o elemento químico polônio. De acordo com o seu experimento, Rutherford
concluiu que
8
I Lista de Exercícios – Química 2013
a)
b)
c)
d)
e)
o átomo é uma partícula maciça e indestrutível.
existe, no centro do átomo, um núcleo pequeno, denso e negativamente carregado.
os elétrons estão mergulhados em uma massa homogênea de carga positiva.
a maioria das partículas alfa sofria um desvio ao atravessar a lâmina de ouro.
existem, no átomo, mais espaços vazios do que preenchidos.
27 - (UEFS BA/2012)
Alguns seres vivos possuem um interessante mecanismo, a exemplo das reações que utilizam a
energia proveniente dos alimentos para excitar elétrons de átomos em determinadas moléculas.
Esse fenômeno é conhecido como bioluminescência e ocorre nos vagalumes, em algumas espécies
de fungos e de cogumelos, e de cnidários.
Os fenômenos da bioluminescência, da emissão de luz dos lasers e dos luminosos de neônio têm
como fundamento os postulados do modelo atômico proposto por N.Böhr, e ocorre quando o
elétron, no átomo,
a)
b)
c)
d)
e)
se desloca de um nível de menor energia para outro de maior energia e libera radiação na
região do infravermelho.
libera energia na forma de ondas eletromagnéticas, ao retornar de uma órbita estacionária
para outra interna.
permanece entre níveis de energia e passa a emitir energia luminosa, quando excitado.
se movimenta em órbitas estacionárias e emite luz ultravioleta.
se move livremente ao redor do núcleo em trajetórias elípticas.
28 - (UCS RS/2012)
Pesquisadores norte-americanos conseguiram sintetizar um elemento químico por meio de um
experimento em um acelerador de partículas, a partir de átomos de cálcio (Ca), de número de
massa 48, e de átomos de plutônio (Pu), de número de massa 244. Em decorrência dos choques
efetivos entre os núcleos de cada um dos átomos citados, surgiu um novo elemento químico.
Sabendo que nesses choques foram perdidos apenas 3 nêutrons, os números de prótons, nêutrons
e elétrons de um átomo neutro desse novo elemento químico são, respectivamente,
a)
b)
c)
d)
e)
111, 175 e 111.
111, 292 e 111.
112, 289 e 112.
114, 175 e 114.
114, 178 e 114.
29 - (UERJ/2012)
Segundo pesquisas recentes, há uma bactéria que parece ser capaz de substituir o fósforo por
arsênio em seu DNA.
Uma semelhança entre as estruturas atômicas desses elementos químicos que possibilita essa
substituição é:
a)
b)
c)
número de elétrons
soma das partículas nucleares
quantidade de níveis eletrônicos
9
I Lista de Exercícios – Química 2013
d)
configuração da camada de valência
30 - (UNEMAT MT/2012)
Assinale abaixo a alternativa que representa, de forma correta, as quantidades de prótons,
nêutrons e elétrons, respectivamente, do íon
a)
b)
c)
d)
e)
138
2
56 Ba
56, 54 e 82
56, 82 e 54
54, 82 e 56
56, 138 e 56
54, 82 e 138
31 - (UDESC SC/2012)
Os íons Mg+2 e F–1, originados dos átomos no estado fundamental dos elementos químicos
magnésio e flúor, respectivamente, têm em comum o fato de que ambos:
a)
b)
c)
d)
e)
possuem o mesmo número de elétrons.
foram produzidos pelo ganho de elétrons, a partir do átomo de cada elemento químico, no
estado fundamental.
foram produzidos pela perda de elétrons, a partir do átomo de cada elemento químico, no
estado fundamental.
possuem o mesmo número de prótons.
possuem o mesmo número de nêutrons.
32 - (UFRN/2013)
Um balão de ar quente é constituído por um saco de tecido sintético, chamado envelope, o qual é
capaz de conter ar aquecido. Embaixo do envelope, há um cesto de vime, para o transporte de
passageiros, e uma fonte de calor, conforme ilustra a figura a seguir.
Para que o balão suba, aquece-se o ar no interior do envelope e, com isso, inicia-se a flutuação do
balão. Essa flutuação ocorre porque, com o aquecimento do ar no interior do envelope,
a)
b)
c)
d)
a densidade do ar diminui, tornando o peso do balão menor que o empuxo.
a pressão externa do ar sobre o balão aumenta, tornando seu peso menor que o empuxo.
a densidade do ar diminui, tornando o peso do balão maior que o empuxo.
a pressão externa do ar sobre o balão aumenta, tornando seu peso maior que o empuxo.
10
I Lista de Exercícios – Química 2013
33 - (IFSP/2013)
A mudança de fase denominada sublimação ocorre quando
a)
b)
c)
d)
e)
o gelo seco é exposto ao ar ambiente.
o gelo comum é retirado do congelador.
um prego se enferruja com a exposição ao ar úmido.
uma porção de açúcar comum é aquecida até carbonizar-se.
uma estátua de mármore é corroída pela chuva ácida.
34 - (UFGD MS/2013)
As propriedades físicas e químicas das substâncias estão diretamente ligadas às fases de agregação
da matéria.
Analisando-se esse quadro, qual das alternativas descreve, respectivamente, a fase de agregação
de cada substância quando expostas à temperatura de 30 ºC?
a)
b)
c)
d)
e)
Sólido, líquido, gasoso e líquido.
Líquido, sólido, líquido e gasoso.
Líquido, gasoso, líquido e sólido.
Gasoso, líquido, gasoso e sólido.
Sólido, gasoso, líquido e gasoso.
35 - (UNEB BA/2013)
Dados coletados pela sonda Cassini, da Nasa, enquanto passava repetidamente por Titã, a maior
lua de Saturno, oferecem a melhor evidência de que o enfumaçado satélite tem um grande oceano
em forma líquida, que está há 100,0km abaixo da superfície se movendo sob sua espessa camada
de gelo, onde foi detectada presença de amônia. A flexão de maré da camada gelada de Titã não
forneceria calor suficiente para manter a superfície do oceano líquida. Mas a energia liberada pelo
decaimento de elementos radioativos no núcleo da lua ajudariam a evitar que congelasse.
Essa flexão de maré, porém, poderia servir de explicação para a presença de metano na atmosfera
de Titã, mesmo que o gás seja normalmente transformado por reações químicas produzidas pela
luz do Sol, depósitos de gelo rico em metano nas porções superiores da crosta de Titã seriam
aquecidos o suficiente pela flexão para liberarem o gás, assim reabastecendo as concentrações
atmosféricas do gás dessa lua. Em seguida, cairia na forma líquida sobre lagos e oceanos de
metano na superfície. (PERKINS, 2012).
PERKINS, Sid. Evidência de maré sob a gelada crosta de Titã.
Scientific American Brasil. Disponível em:
<http://www.2.uol.com.br/sciam/noticias/evidencia_de_mare_sob_
a_gelada_crosta_de_Tita_htlm >. Acesso em: 02 out. 2012.
11
I Lista de Exercícios – Química 2013
De acordo com o modelo de estrutura interflexível de Titã proposto por pesquisadores de algumas
Universidades, com base nos dados da tabela e considerando-se que a pressão da atmosfera da
maior lua de Saturno é igual a 1,0atm, é correto afirmar:
01. Nos depósitos de gelo ricos em metano nas porções superiores da crosta de Titã, as
interações intermoleculares entre essa substância química e a água sólida são de natureza
dipolo permanente-dipolo induzido.
02. A presença de amônia em lagos e oceanos de metano sugere, que na lua de Saturno, essa
substância química se encontra na fase líquida.
03. A energia absorvida no decaimento de radionuclídeos, do núcleo de Titã, ajuda a manter a
superfície líquida do oceano da lua de Saturno.
04. As precipitações de metano líquido ocorrem quando a pressão de vapor de metano na
atmosfera de Titã atinge a pressão máxima a –182ºC, na superfície da lua.
05. A camada de metano sólido na superfície da lua de saturno está à temperatura de 0ºC.
36 - (UFT TO/2012)
Os gráficos seguintes correspondem a diagramas de mudança de estado físico. (TE = temperatura
de ebulição, TF = temperatura de fusão).
12
I Lista de Exercícios – Química 2013
Na análise destes gráficos podemos afirmar:
a)
b)
c)
d)
e)
Os gráficos A e C correspondem aos diagramas de misturas.
Os gráficos A, B e C correspondem aos diagramas de substâncias simples.
Os gráficos B e C correspondem aos diagramas de misturas de substâncias.
Os gráficos B e C correspondem aos diagramas de mistura eutéticas.
Os gráficos B e C correspondem aos diagramas de misturas azeotrópicas.
37 - (UCS RS/2012)
Considere as densidades, a 20 ºC, para os respectivos materiais listados abaixo.
Ao serem adicionados pedaços de cada um desses materiais à água, observa-se a flutuação de
a)
b)
c)
d)
e)
apenas I, II e III.
apenas I, III e IV.
apenas I e III.
apenas II e IV.
todos.
38 - (UECE/2012)
Um professor de química escreveu no quadro branco, deliberadamente, as frases abaixo, que
podem ser conceitos incompletos ou equivocados, para testar a atenção de seus alunos. Marque a
única opção verdadeira.
a)
b)
c)
d)
Toda porção de matéria que possui volume definido pode ser considerada um corpo.
A densidade relativa é um número puro e não pode ser expressa em gramas por mililitros.
O método mais barato para separar uma mistura de petróleo e água do mar é a destilação
fracionada.
Na ebulição de um líquido há mudança de estado físico e, consequentemente, sua
composição e suas características químicas também mudam.
39 - (UEM PR/2012)
13
I Lista de Exercícios – Química 2013
Uma indústria de reciclagem de plásticos utiliza 3 recipientes, de 30.000 litros cada, contendo em
cada recipiente líquidos com densidades diferentes para separar os plásticos que são coletados.
Um desses recipientes contém uma solução com o dobro de volume de água em relação ao volume
de etanol; o outro contém água pura e o terceiro uma solução aquosa de cloreto de sódio a 10% (%
em massa). Sabendo-se que os plásticos reciclados por essa indústria apresentam as densidades
descritas no quadro abaixo, assinale o que for correto.
Plástico
Polipropileno
Densidade (g/mL)
0,90
Polietilen o
Poliestireno
Poli(cloreto de vinila)
0,95
1,05
1,25
Considere:
- Densidade da água pura = 1,0 g/mL;
- densidade do etanol = 0,78 g/mL;
- que a mistura de água e etanol apresenta volume final aditivo em relação aos volumes iniciais
utilizados;
- que o volume da solução de cloreto de sódio seja o mesmo da água pura utilizada para sua
preparação;
- densidade do NaCl = 2,1 g/mL.
01. A separação do plástico de embalagens em forma de garrafas deve ser feita com a prévia
trituração dessas embalagens.
02. No recipiente contendo água é possível separar polipropileno de polietileno.
04. Uma carga de material para reciclagem que apresenta somente 3 tipos de plástico, dentre os
listados acima, poderá ser separada utilizando-se somente 2 dos 3 recipientes.
08. O recipiente contendo a solução aquosa de NaCl é utilizado para separar o PVC dos outros 3
plásticos.
16. Na solução de etanol em água, o polipropileno afunda enquanto todos os outros plásticos
ficam flutuando na superfície do líquido.
40 - (UFPR/2012)
Boiar no Mar Morto: luxo sem igual
É no ponto mais baixo da Terra que a Jordânia guarda seu maior segredo: o Mar Morto. Boiar nas
águas salgadas do lago formado numa depressão, a 400 metros abaixo do nível do mar, é a
experiência mais inusitada e necessária dessa jornada, mas pode estar com os anos contados. A
superfície do Mar Morto tem encolhido cerca de 1 metro por ano e pode sumir completamente até
2050.
(Camila Anauate. O Estado de São Paulo. Disponível em
<http://www.estadao.com.br/noticias/suplementos,boiar-no-marmorto-luxo-semigual, 175377,0.htm>. Acessado em 08/08/2011)
A alta concentração salina altera uma propriedade da água pura, tornando fácil boiar no Mar
Morto. Assinale a alternativa correspondente a essa alteração.
a)
b)
Aumento da tensão superficial.
Aumento da densidade.
14
I Lista de Exercícios – Química 2013
c)
d)
e)
Aumento da pressão de vapor.
Aumento da temperatura de ebulição.
Aumento da viscosidade.
41 - (IFSP/2013)
O aspirador de pó é um eletrodoméstico que permite separar misturas do tipo sólido-gás por
a)
b)
c)
d)
e)
centrifugação.
filtração.
destilação.
decantação.
levigação.
42 - (UEM PR/2013)
Sobre misturas homogêneas e heterogêneas e seus processos de separação, assinale a(s)
alternativa(s) correta(s).
01. A levigação e a peneiração são técnicas de separação de misturas sólidas, utilizando,
respectivamente, diferenças entre a densidade e o tamanho dos sólidos a serem separados.
02. A filtração pode ser utilizada para a separação de uma mistura heterogênea de um sólido em
um líquido, ou de um sólido em um gás.
04. Por meio da flotação, podem-se separar dois sólidos com densidades diferentes, utilizando-se
um líquido com densidade intermediária aos dois sólidos, sem que haja solubilização dos
sólidos no líquido.
08. A centrifugação pode ser utilizada para a separação de dois líquidos solúveis entre si, mas que
tenham densidades diferentes.
16. A retenção de substâncias gasosas na superfície de materiais com alta área superficial, como
o carvão, é um processo de separação chamado adsorção.
43 - (UERJ/2013)
Observe os diagramas de mudança de fases das substâncias puras A e B, submetidas às mesmas
condições experimentais.
15
I Lista de Exercícios – Química 2013
Indique a substância que se funde mais rapidamente. Nomeie, também, o processo mais adequado
para separar uma mistura homogênea contendo volumes iguais dessas substâncias, inicialmente à
temperatura ambiente, justificando sua resposta.
44 - (UFPR/2013)
A separação de misturas é uma das principais operações realizadas em pequena escala em
laboratórios, e em grande escala em indústrias nos diversos setores. Para separar de maneira
eficiente as misturas querosene e água (1), álcool e água (2) e hidróxido de sódio e água (3), os
procedimentos corretos, na ordem 1, 2, 3, são:
a)
b)
c)
d)
e)
decantação, destilação e destilação.
filtração, sifonação e precipitação.
decantação, destilação e filtração.
destilação, decantação e decantação.
destilação, sifonação e filtração.
45 - (UPE PE/2013)
O fluxograma de obtenção do soro de leite a partir da produção de queijo coalho, utilizando leite
de búfula in natura, é mostrado a seguir:
Fonte: LIRA, H. L. et al . Ciênc. Tecnol. Aliment., 29,1, 33-37, 2009.
Utilizando-se de um processo que segue o fluxograma acima mostrado, tem-se que a
a)
b)
c)
d)
e)
adição de cloreto de cálcio é necessária em função da inexistência de íons Ca++ na
matériaprima.
agitação da coalhada é um procedimento que quebra as cadeias polipeptídicas e libera o soro
do leite.
desnaturação da mistura natural proteica ocorre depois do corte da coalhada e da mexedura.
destilação das impurezas voláteis é uma operação necessária após o início do tratamento do
leite cru.
filtração e a decantação são dois métodos muito importantes para a apresentação física do
principal produto.
46 - (IFGO/2012)
16
I Lista de Exercícios – Química 2013
Considere uma mistura de parafina (hidrocarbonetos de cadeia longa) finamente dividida e açúcar
(sacarose – C12H22O11) refinado. Indique a alternativa que representa os processos de separação, na
sequência indicada, mais adequados a essa mistura.
a)
b)
c)
d)
e)
Dissolução em água, filtração, evaporação.
Filtração, evaporação, combustão.
Dissolução em água, floculação, decantação.
Destilação fracionada a 50 ºC.
Combustão, destilação.
47 - (UEM PR/2012)
As três misturas descritas a seguir foram submetidas a um processo de filtragem em papel de filtro
seguido de um processo de destilação simples até a evaporação de todo o líquido. Assinale a(s)
alternativa(s) correta(s) a respeito dos resultados obtidos:
(A) Iodo dissolvido em tetracloreto de carbono (solução saturada heterogênea)
(B) Limalha de ferro e etanol
(C) Solução de água e etanol misturada com areia.
01. Todo o iodo presente na solução (A) foi recolhido no papel de filtro.
02. O processo de destilação é desnecessário para separar os componentes da mistura (B).
04. Todos os componentes da mistura (C) não podem ser totalmente separados através dos dois
processos de separação, pois a água e o etanol formam uma mistura eutética.
08. Em (A), o iodo também poderia ser separado do tetracloreto de carbono através de sua
sublimação.
16. As misturas (B) e (C) não apresentam resíduo no balão de destilação, após a finalização do
processo.
48 - (MACK SP/2012)
Durante a realização de uma aula prática, a respeito da separação de misturas, o professor trouxe
aos alunos três frascos A, B e C, contendo as seguintes misturas binárias:
A: Líquida homogênea, cujos pontos de ebulição diferem em 25ºC.
B: Sólida heterogênea, composta por naftalina (naftaleno) moída e areia.
C: Sólido-líquida homogênea, composta por NaCl e água.
Assinale a alternativa que contém, respectivamente, os processos utilizados para a separação
inequívoca dos componentes das misturas A, B e C.
a)
b)
c)
d)
e)
destilação simples, sublimação e filtração.
evaporação, catação e destilação fracionada.
destilação fracionada, separação magnética e destilação simples.
destilação fracionada, sublimação e destilação simples.
destilação simples, evaporação e destilação fracionada.
49 - (UFU MG/2012)
A destilação também era utilizada em manufaturas como, por exemplo, na preparação de
perfumes, artes para a qual os árabes muito contribuíram. Havia grandes centros onde eram
17
I Lista de Exercícios – Química 2013
extraídos os aromas de rosas, violetas, jasmins e de outros materiais. Para isso, as flores eram
maceradas em água e, em seguida, esse material era destilado. Tal processo não era utilizado na
Antiguidade, predominando então o método de extração de essências pela infusão de flores em
óleos ou gorduras.
BELTRAN, M.H.R. Destilação: a arte de extrair virtudes.
Revista Química Nova na Escola, nº 4, novembro, 1996, p. 26.
Imagem representando o processo de destilação,
extraída da obra de Hieronymus Brunschwig (Liber de arte distillandi, 1512)
A destilação, incorporada como um procedimento químico no século XVIII,
a)
b)
c)
d)
era utilizada, na antiguidade, como principal método de extração das essências após se fazer
uma mistura heterogênea.
é uma técnica ideal para extração de essências de rosas que, ao serem maceradas, tornam-se
sistemas homogêneos com a água.
é uma técnica de separação que requer aquecimento da mistura homogênea ao longo do
procedimento.
possui uma etapa de resfriamento e, em seguida, de condensação da água onde estarão
dissolvidas essências oleosas.
50 - (UNICAMP SP/2012)
Em algumas extrações de ouro, sedimentos de fundo de rio e água são colocados em uma bateia,
recipiente cônico que se assemelha a um funil sem o buraco. Movimentos circulares da bateia
permitem que o ouro metálico se deposite sob o material sólido ali presente. Esse depósito, que
contém principalmente ouro, é posto em contato com mercúrio metálico; o amálgama formado é
separado e aquecido com um maçarico, separando-se o ouro líquido do mercúrio gasoso. Numa
região próxima dali, o mercúrio gasoso se transforma em líquido e acaba indo para o leito dos rios.
Os três segmentos acima grifados se referem, respectivamente, às seguintes propriedades:
a)
b)
c)
d)
peso, temperatura de gaseificação e temperatura de liquefação.
densidade, temperatura de sublimação e temperatura de fusão.
peso, temperatura de ebulição e temperatura de fusão.
densidade, temperatura de ebulição e temperatura de liquefação.
51 - (UEFS BA/2012)
18
I Lista de Exercícios – Química 2013
Empresa de exploração de petróleo responsável pelo vazamento de óleo em um poço, no Campo
de Frade, na Bacia de Campos, RJ, está impedida de perfurar em território nacional. O petróleo
vazou de um poço na camada de pré-sal, por fissuras no leito do mar e se espalhou por 12,0km 2,
formando uma grande mancha de 360 mil litros. A empresa utilizou jatos de água para dispersar
ainda mais óleo, sem, contudo, aglomerá-lo, para queimá-lo, como é feito usualmente em grandes
acidentes com derramamento de petróleo.
Considerando-se essas informações e os processos de separação da água do mar, nos grandes
acidentes com vazamento de óleo, é correto afirmar:
a)
b)
c)
d)
e)
A separação do óleo espalhado na superfície do mar por meio de boias e, em seguida, por
bombeamento para barcos, para retirá-lo da água, é o melhor método de separação nessas
circunstâncias.
Os jatos de água para dispersar o óleo sobre a água é uma das técnicas mais eficientes
utilizadas para separação do petróleo da água do mar.
A queima do óleo resolve o problema do espalhamento do petróleo de forma definitiva
porque retira completamente o petróleo da superfície do mar sem produzir impacto
ambiental.
O petróleo escapa das fissuras do poço porque a pressão no leito do mar é superior ao do
óleo no interior do poço.
As rochas da camada do pré-sal não possuem resistência mecânica suficiente para manter o
petróleo completamente no interior do poço.
52 - (ASCES PE/2012)
Um erlenmeyer contém um sistema heterogêneo bifásico formado por água, acetona e
tetracloreto de carbono. Sabendo que acetona e água são miscíveis entre si, que o tetracloreto de
carbono é imiscível em água e em acetona, e que a acetona é um líquido mais volátil que a água,
assinale os métodos mais adequados para separar esses três líquidos.
a)
b)
c)
d)
e)
Decantação e fusão fracionada.
Filtração e decantação.
Centrifugação e decantação.
Decantação e destilação fracionada.
Filtração e destilação fracionada.
53 - (UEFS BA/2012)
Um dos desafios da Química tem sido a obtenção de substâncias químicas puras a partir de
misturas. Para esse fim, os químicos desenvolveram técnicas de separação e de purificação de
componentes dessas misturas até transformá-los em substâncias puras.
19
I Lista de Exercícios – Química 2013
Assim, considerando-se uma mistura em pó dos materiais representados na tabela I, é possível
separar inicialmente os seus componentes, utilizando-se da ajuda de líquidos inertes nos quais são
insolúveis, como os representados na tabela II.
A partir dessas informações, dos dados das tabelas I e II e da mistura formada pelos materiais da
tabela I, é correto afirmar:
a)
b)
c)
d)
e)
O processo de separação inicial dos componentes da mistura em pó tem como base a
diferença de densidade e a miscibilidade entre eles.
A adição inicial de tetracloreto de carbono à mistura em pó permite a separação imediata dos
polímeros.
O processo de separação consiste na adição de água à mistura em pó, seguida de filtração e
de adição de etanol à fase líquida filtrada.
A técnica utilizada nas etapas iniciais de separação dos componentes da mistura em pó é a
flotação.
A dissolução fracionada permite a separação dos componentes da mistura sólida, após a
adição incial de etanol.
54 - (UFGD MS/2012)
Uma das principais operações realizadas em um laboratório de química é a separação de
substâncias químicas envolvidas em misturas. Considere uma mistura formada pelo sistema (H 2O(l)
+ Areia(s) + NaCl(l)). A sequência recomendada de operações que um químico deverá realizar a fim
de separar totalmente os componentes desta mistura é?
a)
b)
c)
d)
e)
Destilação; peneiração; filtração.
Decantação; filtração; sublimação.
Centrifugação; filtração; destilação simples.
Centrifugação; destilação; evaporação.
Filtração; centrifugação; sublimação.
55 - (ITA SP/2012)
A figura representa a curva de aquecimento de uma amostra, em que S, L e G significam,
respectivamente, sólido, líquido e gasoso. Com base nas informações da figura é CORRETO afirmar
que a amostra consiste em uma
a)
b)
c)
d)
e)
substância pura.
mistura coloidal.
mistura heterogênea.
mistura homogênea azeotrópica.
mistura homogênea eutética.
20
I Lista de Exercícios – Química 2013
56 - (FAMECA SP/2012)
Uma liga de solda utilizada em circuitos eletrônicos contém 63% de Sn e 37% de Pb (porcentagens
em massa). Essa liga é uma mistura eutética, ou seja , uma mistura
a)
b)
c)
d)
e)
heterogênea, na qual Pb e Sn podem ser distinguidos visualmente.
em que a temperatura mantém-se constante durante a fusão.
que pode ser separada por centrifugação.
volátil nas condições do ambiente.
má condutora de eletricidade.
57 - (FGV SP/2013)
Em um experimento na aula de laboratório de química, um grupo de alunos misturou em um
recipiente aberto, à temperatura ambiente, quatro substâncias diferentes:
Nas anotações dos alunos, consta a informação correta de que o número de fases formadas no
recipiente e sua ordem crescente de densidade foram, respectivamente:
a)
b)
c)
d)
e)
2; mistura de água e etanol; mistura de grafite e polietileno.
3; polietileno; mistura de água e etanol; grafite.
3; mistura de polietileno e etanol; água; grafite.
4; etanol; polietileno; água; grafite.
4; grafite; água; polietileno; etanol.
58 - (FGV SP/2013)
A química é responsável pela melhora em nossa qualidade de vida e está inserida em nosso
cotidiano de muitas formas em substâncias e misturas que constituem diversos materiais.
Assinale a alternativa que apresenta, respectivamente, substância simples, substância composta,
mistura homogênea e mistura heterogênea.
a)
b)
c)
d)
e)
Água, granito, alumínio, aço.
Água, aço, alumínio, granito.
Alumínio, aço, água, granito.
Alumínio, água, aço, granito.
Alumínio, água, granito, aço.
59 - (UEPG PR/2013)
Dados os sistemas abaixo e considerando que apenas o sistema 1 apresenta pontos de fusão e
ebulição constantes durante a mudança de estado, assinale o que for correto.
21
I Lista de Exercícios – Química 2013
01. O sistema 1 é composto de substância pura.
02. Os sistemas 2 e 4 são denominados sistemas heterogêneos.
04. Os sistemas 2, 3 e 4 consistem de misturas, sendo que os sistemas 2 e 4 são misturas
heterogêneas e o sistema 3 é uma mistura homogênea.
08. Os sistemas 3 e 4 podem ser totalmente separados por filtração simples.
16. O sistema 2 pode ser separado por decantação, utilizando-se, por exemplo, um funil de
decantação.
60 - (UEPG PR/2012)
Considerando as amostras abaixo, em sistemas isolados, assinale o que for correto.
Vinagre
Acetona
Grafite
Gasolina comum
Água potável
Gás carbônico
Ar atmosférico não poluído Hidrogênio gasoso
01.
02.
04.
08.
Gás carbônico e acetona são substâncias compostas.
Vinagre, gasolina comum e ar atmosférico não poluído são exemplos de misturas.
Hidrogênio gasoso é uma substância simples.
Água potável, grafite e gás carbônico são misturas homogêneas.
61 - (UEM PR/2012)
Considerando que as matérias descritas na tabela abaixo estão em um ambiente a 25 ºC, assinale o
que for correto.
01. A mistura entre cimento e areia é heterogênea, enquanto o concreto formado entre ambos,
após a reação com água, é uma mistura homogênea.
02. O etanol forma misturas homogêneas tanto com a água quanto com a gasolina, portanto
pode-se concluir que água e gasolina também formam misturas homogêneas.
22
I Lista de Exercícios – Química 2013
04. Todas as misturas (A, B, C, D e E) são formadas por substâncias compostas.
08. As misturas A e D são homogêneas em qualquer proporção em que estejam as matérias I e II.
16. As misturas A e C podem ter tanto a matéria I como a matéria II atuando como solventes em
uma mistura homogênea.
62 - (FAVIP PE/2012)
Um estudante de química, para entender melhor o que acabara de estudar sobre solubilidade, foi
para um laboratório, onde rotulou três erlenmeyers como 1, 2 e 3 e neles colocou as seguintes
substâncias:
Erlenmeyer 1: tetracloreto de carbono e heptano
Erlenmeyer 2: cloreto de hidrogênio gasoso e água.
Erlenmeyer 3: benzeno e água.
Considerando os sistemas acima, três afirmações foram feitas:
1.
2.
3.
Só o erlenmeyer 1 apresenta uma mistura homogênea.
Os erlenmeyers 2 e 3 apresentam duas fases.
Apenas os erlenmeyers 1 e 2 apresentam mistura homogênea.
Está(ão) correta(s) apenas:
a)
b)
c)
d)
e)
1
2
3
1e3
2e3
63 - (UCS RS/2013)
Os elementos químicos considerados essenciais aos organismos vivos são aqueles cuja falta causa
algum tipo de disfunção e cuja adição restaura a saúde do organismo. Dos elementos que
precisamos em grandes quantidades, sete são metais (Na, K, Mg, Ca, Fe, Cu e Zn) e outros sete são
não metais (H, C, N, O, P, S e Cl).
Considerando os elementos químicos citados acima, assinale a alternativa correta.
a)
b)
c)
d)
e)
C, N, O, P, S e Cl são elementos representativos que possuem seu elétron de valência em
orbital d.
Fe, Cu e Zn são elementos de transição interna pertencentes ao quarto período da tabela
periódica.
Na e K, metais alcalinos, Mg e Ca, metais alcalinos terrosos, pertencem ao grupo dos
elementos representativos.
O elemento H apresenta número atômico e número de massa iguais a 2.
Todos os elementos listados acima, por serem essenciais, são representativos.
64 - (UDESC SC/2013)
Os elementos químicos situados entre as colunas 3 a 12 na tabela periódica:
23
I Lista de Exercícios – Química 2013
a)
b)
c)
d)
e)
apresentam o subnível d completo.
tendem a ganhar elétrons, quando participam de ligações químicas.
são encontrados na natureza somente em estado sólido.
são denominados metais de transição.
aumentam o raio atômico de acordo com o número da coluna.
65 - (UEPG PR/2013)
Sobre a classificação periódica do elemento químico com número atômico 56, assinale o que for
correto.
01.
02.
04.
08.
Pertence à família 2A.
Se encontra no quarto período.
É um metal alcalino.
Sua distribuição eletrônica por camadas é K = 2 L = 8 M = 18 N = 18 O = 8 P = 2.
66 - (FUVEST SP/2013)
Um aluno estava analisando a Tabela Periódica e encontrou vários conjuntos de três elementos
químicos que apresentavam propriedades semelhantes.
Assinale a alternativa na qual os conjuntos de três elementos ou substâncias elementares estão
corretamente associados às propriedades indicadas no quadro abaixo.
a)
b)
c)
d)
e)
M esmo estado
Números
Re atividades físico à
atômi cos
semelhantes temperatura
con sec utivos
ambiente
Pt, Au, Hg
H , He, Li
Cl , Br , I
2
2 2 2
Cl, Br,I
O , F , Ne
Ne, Ar, Kr
2 2
Li, Na, K
O , F , Ne
Pt, Au, Hg
2 2
Ne, Ar, Kr
M g, Ca, Sr
Cl , Br , I
2 2 2
Pt, Au, Hg
Li, Na, K
Ne, Ar, Kr
67 - (PUC RJ/2013)
Cristais de NaF e MgF2 dissolvidos em água se dissociam nos íons F–, Na+ e Mg2+.
Uma característica desses íons é que eles possuem em comum:
a)
b)
c)
d)
e)
o mesmo número de prótons no núcleo.
a localização no mesmo período da tabela periódica dos elementos.
o mesmo número de elétrons na eletrosfera.
a localização no mesmo grupo da tabela periódica dos elementos.
o mesmo número de nêutrons no núcleo dos seus isótopos mais estáveis.
24
I Lista de Exercícios – Química 2013
68 - (UNIRG TO/2012)
Os elementos das famílias Metais alcalinos, família do Oxigênio e Halogênio, possuem camada de
valência com distribuição eletrônica respectivamente:
a)
b)
c)
d)
s1 ; s2 – p4 ; s2 – p5
s2 ; s2 – p3 ; s2 – p5
s1 ; s2 – p4 ; s2 – p6
s2 ; s2 – p5 ; s2 – d3
69 - (UEM PR/2012)
Um professor entregou uma substância pura a seu aluno, a fim de que a identificasse. As únicas
informações disponíveis são que a substância poderia ser simples ou composta e que apresentava,
na camada de valência 5 elétrons em um orbital d, além da possibilidade de apresentar elétrons
em outros orbitais. Sem fazer uma análise da substância, somente observando-a visualmente,
assinale o que for correto quanto à conclusão a que o aluno poderia chegar.
01.
02.
04.
08.
16.
Se a substância fosse um metal, poderia ser um metal da família do manganês.
Se a substância fosse um sal, poderia ser um sal de Fe 3+.
Se a substância fosse um metal, poderia ser o nióbio.
Se a substância fosse um sal, poderia ser um sal de Co 2+.
Com certeza, essa substância teria um elemento do período 4 ou 5 ou 6 ou 7 da tabela
periódica.
70 - (UECE/2012)
A tabela periódica já era objeto das preocupações dos antigos químicos a partir de Robert Boyle
(1627-1691), pela necessidade de se organizar preciosas informações sobre os elementos químicos.
Pesquisando a tabela periódica e fazendo a distribuição eletrônica dos elementos, pode-se
constatar que
a)
b)
c)
d)
o íon brometo é muito menor do que o átomo de bromo.
íons formados a partir do manganês e do ferro apresentam a configuração de gás nobre.
quando o átomo do rubídio perde um elétron, libera energia.
a carga nuclear efetiva do cádmio é maior que a do zircônio.
71 - (IFGO/2012)
Cinco estudantes de química decidiram que iriam se comunicar através de códigos. Para assinar
cada uma das mensagens, eles convencionaram que não utilizariam seus nomes, mas sim o
símbolo do elemento químico que correspondesse às duas letras iniciais de seus nomes. Nas
mensagens, descreveram algumas características desses elementos.
I.
II.
III.
IV.
V.
É o segundo elemento mais abundante na crosta terrestre. Na forma de óxido, está presente
na areia. É empregado em componentes de computadores.
Reage com água, desprendendo hidrogênio. Combina-se com cloro, formando o principal
constituinte do sal de cozinha.
É produzido, a partir da bauxita, por um processo que consome muita energia elétrica.
Entretanto, parte do que é produzido, após utilização, é reciclado.
É o principal constituinte do aço. Reage com água e oxigênio, formando um óxido hidratado.
Na forma de cátion, compõe o mármore e a cal.
25
I Lista de Exercícios – Química 2013
Os nomes dos estudantes, na ordem em que estão apresentadas as mensagens, podem ser:
a)
b)
c)
d)
e)
Silvana, Cristóvão, Alberto, Nair, Fernando.
Silvana, Nair, Alberto, Fernando, Carlos.
Silvio, Carlos, Alberto, Fernando, Nair.
Nair, Alberto, Felipe, Silvana, Carlos.
Antônio, Fernando, Silvana, Carlos, Nair.
72 - (UDESC SC/2012)
No Ano Internacional da Química, homenageia-se a cientista Marie Curie, primeira mulher a ganhar
um Premio Nobel; ela descobriu o elemento químico rádio, um elemento alcalino-terroso. Em
relação aos elementos da família dos alcalino-terrosos, é incorreto afirmar que:
a)
b)
c)
d)
e)
apresentam baixas energias de ionização.
têm configurações eletrônicas terminadas em ns2.
são metais não reativos.
o magnésio e o cálcio são elementos desta família.
são tipicamente encontrados na forma de cátion com carga 2+.
73 - (UDESC SC/2013)
Assinale a alternativa correta em relação aos seguintes elementos químicos: flúor, iodo, lítio e
rubídio.
a)
b)
c)
d)
e)
Flúor é o elemento mais eletronegativo, e iodo apresenta o maior raio atômico.
Rubídio tem a maior energia de ionização, e flúor tem a menor energia de ionização.
Rubídio tem a menor energia de ionização, e iodo apresenta o maior raio atômico.
Lítio e flúor têm os menores raios atômicos, e iodo e flúor têm as menores energias de
ionização.
Flúor é o elemento mais eletronegativo, e rubídio apresenta o maior raio atômico.
74 - (UECE/2013)
Para que sua produtividade seja maior, cada lavoura necessita de diferentes nutrientes,
dependendo do tipo de solo que será cultivado. O quadro a seguir apresenta algumas das
principais culturas nacionais e os nutrientes que, conforme o solo utilizado, influenciam no
desenvolvimento dos vegetais.
Feijão
Nutrientes mais importantes para
a planta conforme o tipo de solo
nitrogênio , fósforo e potássio
M ilho
Arroz
nitrogênio e zinco
fósforo, nitrogênio e zinco
Cultura
Com relação a esses nutrientes, assinale a afirmação correta.
a)
b)
c)
Nitrogênio possui raio atômico entre fósforo e potássio.
Fósforo e potássio estão no mesmo período da tabela periódica.
A relação entre seus raios atômicos é N < P < Zn < K.
26
I Lista de Exercícios – Química 2013
d)
Potássio e zinco estão em períodos diferentes.
75 - (MACK SP/2013)
Abaixo são fornecidas as distribuições eletrônicas das camadas de valência dos átomos neutros X, Y
e Z em seus estados fundamentais.
X: 2s2 ; 2p5
Y: 6s1
Z: 4s2 ; 4p5
A partir dessas informações, é correto afirmar que
a)
b)
c)
d)
e)
o elemento Y é um metal alcalino-terroso.
os elementos X e Z pertencem ao mesmo período, todavia X é mais eletronegativo do que Z.
o elemento X apresenta maior afinidade eletrônica do que o elemento Y.
o elemento Z apresenta maior raio atômico do que Y.
X, Y e Z são elementos de transição.
76 - (UEM PR/2013)
Considere os quatro elementos químicos seguintes e as configurações eletrônicas de seus dois
níveis mais energéticos.
I.
II.
III.
IV.
2s22p63s23p5
3s23p64s23d6
3s23p64s23d8
4s24p65s1
Com base nessas informações, assinale o que for correto.
01.
02.
04.
08.
16.
O elemento I é um halogênio.
Os elementos II e III pertencem a uma mesma família.
O elemento IV possui número atômico 37.
O elemento I é mais eletronegativo do que o átomo de oxigênio.
Quando o elemento II ganha dois elétrons, o íon formado passa a ter a distribuição eletrônica
do elemento III. No entanto, quando III perde dois elétrons, o íon formado não possui a
mesma distribuição eletrônica de II.
77 - (UEM PR/2013)
Tendo como base a reação química entre o átomo de sódio e o átomo de cloro para formar os íons
Na+ e Cl–, assinale a(s) alternativa(s) correta(s).
01. Supondo que o raio atômico do sódio seja X e o raio atômico do cloro seja Y, a distância da
ligação química entre Na+ e Cl– no cloreto de sódio será obrigatoriamente X+Y.
02. O átomo de sódio é maior do que o átomo de cloro, no entanto o íon sódio é menor do que o
íon cloro.
04. A regra do octeto é respeitada nos íons sódio e cloro do NaCl, mas não é respeitada para o
boro no BF3.
08. Sais formados entre metais alcalinos e halogênios apresentarão, para ambos os íons, uma
camada de valência do tipo s2p6, exceto o Li+.
27
I Lista de Exercícios – Química 2013
16. A quantidade de energia envolvida na segunda ionização do sódio é de valor
aproximadamente igual ao envolvido na primeira ionização.
78 - (UEPG PR/2013)
Considerando os átomos abaixo com seus respectivos números atômicos, assinale o que for
correto.
O (Z = 8); Mg (Z = 12); P (Z = 15); Sr (Z = 38)
01.
02.
04.
08.
16.
Átomos de Mg apresentam maior potencial de ionização do que os átomos de Sr.
Átomos de O são mais eletronegativos do que os átomos de P.
Átomos de P têm maior raio atômico do que os átomos de Mg.
Átomos de Mg e Sr apresentam caráter metálico mais elevado do que os demais.
Átomos de O têm raio atômico menor do que seus ânions O 2–.
79 - (IME RJ/2013)
Dados os íons: 16S2–; 19K+; 56Ba2+, indique qual das relações abaixo apresenta os íons isoeletrônicos
ordem correta de raio iônico.
a)
b)
c)
d)
e)
K+ > S2–
Ba2+ = S2–
Ba2+ > S2–
K+ < S2–
Ba2+ < S2–
80 - (UFG GO/2013)
A tabela a seguir apresenta os valores de raio atômico e raio iônico para alguns átomos e íons.
De acordo com os dados apresentados, a porcentagem aproximada de diminuição do diâmetro do
íon Mg2+ bem como a explicação para o fato são, respectivamente,
a)
b)
c)
d)
e)
35% em relação ao diâmetro do íon Na+, pois há um próton a mais em seu núcleo,
aumentando a atração núcleo-eletrosfera.
65% em relação ao diâmetro do íon Na+, pois o íon Mg2+ tem carga efetiva e raio iônico
maiores.
65% em relação ao diâmetro do átomo de Mg, pois nem todo cátion tem o raio iônico maior
do que o raio atômico do átomo do qual é derivado.
35% em relação ao diâmetro do átomo de Na, pois o íon Mg 2+ tem maior carga efetiva e
menor raio iônico.
65% em relação ao diâmetro do íon íon Na+, pois este tem maior carga efetiva e menor raio
iônico.
28
I Lista de Exercícios – Química 2013
81 - (UFRN/2013)
O efeito fotoelétrico está presente no cotidiano, por exemplo, no mecanismo que permite o
funcionamento das portas dos shoppings e nos sistemas de iluminação pública, por meio dos quais
as lâmpadas acendem e apagam. Esse efeito acontece porque, nas células fotoelétricas, os metais
emitem elétrons quando são iluminados em determinadas condições. O potássio e o sódio são
usados na produção de determinadas células fotoelétricas pela relativa facilidade de seus átomos
emitirem elétrons quando ganham energia. Segundo sua posição na Tabela Periódica, o uso desses
metais está relacionado com
a)
b)
c)
d)
o baixo valor do potencial de ionização dos átomos desses metais.
o alto valor da afinidade eletrônica dos átomos desses metais.
o alto valor da eletronegatividade dos átomos desses metais.
o alto valor do potencial de ionização dos átomos desses metais.
82 - (UEG GO/2012)
O sal de cozinha é composto por cloreto de sódio e por pequenas concentrações de iodeto de
potássio. Pequenas quantidades do íon iodeto ajudam a prevenir o alargamento da glândula
tireóidea que atua sobre a taxa metabólica basal no organismo humano. Em relação ao exposto, é
CORRETO afirmar:
a)
b)
c)
d)
o íon I- tem raio iônico maior que o íon Cl-.
os íons Na+ e K+ pertencem ao mesmo período da Tabela Periódica.
o íon K+ sob influência dos hormônios T3 e T4 diminuem a quantidade de cálcio.
o íon I- sob influência dos hormônios T3 e T4 aumentam a quantidade de cálcio.
83 - (IFGO/2012)
O Rubídio é um metal alcalino, o qual apresenta coloração branca prateada brilhante que perde o
brilho rapidamente em contato com o ar. O silício é o segundo elemento mais abundante da crosta
terrestre. O rubídio pode ser utilizado em células fotoelétricas e o silício na fabricação de artefatos
microeletrônicos.
Comparando esses dois elementos, é correto afirmar que:
a)
b)
c)
d)
e)
O silício possui maior raio atômico.
O silício apresenta maior afinidade eletrônica.
O rubídio possui maior energia de ionização.
O silício é menos eletronegativo.
O rubídio apresenta menor tendência a perder elétrons.
84 - (UEM PR/2012)
Assinale o que for correto.
01. Um cátion terá raio atômico sempre menor do que seu átomo correspondente.
02. Um ânion terá energia de ionização sempre menor do que seu átomo correspondente.
04. Para os elementos da família 15 (ou 5A), as afinidades eletrônicas são muito baixas, pois a
adição de elétrons deve ser feita em orbitais do tipo p preenchido com 3 elétrons.
29
I Lista de Exercícios – Química 2013
08. Um átomo que apresenta baixa eletronegatividade normalmente apresenta alta afinidade
eletrônica.
16. Na família 1A, com exceção do H, o ponto de fusão e de ebulição dos metais formados por
esses elementos diminui de cima para baixo.
85 - (UDESC SC/2012)
Use seu conhecimento sobre Propriedades Periódicas para analisar os elementos flúor e rubídio.
Dentre os elementos listados acima:
a)
b)
c)
d)
e)
o flúor apresenta o menor raio atômico e a menor energia de ionização.
o rubídio apresenta o maior raio atômico e a maior energia de ionização.
o flúor apresenta o menor raio atômico e possui baixa afinidade eletrônica.
o rubídio apresenta o maior raio atômico e possui elevada afinidade eletrônica.
o flúor apresenta o menor raio atômico e a maior energia de ionização.
86 - (UFG GO/2012)
A energia necessária para que seja formado um íon pela remoção de elétrons é denominada
energia de ionização (E.I.). A tabela a seguir apresenta os valores de todas as energias de ionização
do cálcio.
De acordo com os dados apresentados, conclui-se que, para o átomo de cálcio,
a)
b)
c)
d)
e)
os níveis de energia variam de forma descontínua.
a energia de ionização aumenta à medida que aumenta a distância do núcleo.
a remoção do segundo elétron aumenta o número de níveis energéticos.
a energia de ionização aumenta em proporção constante.
a remoção do elétron mais afastado do núcleo demanda maior energia.
87 - (UFU MG/2012)
Atualmente, algumas tatuagens são consideradas como verdadeiras obras de arte ambulantes. As
tatuagens podem apresentar diferentes cores, formas e significados, servindo inclusive para
identificar os membros de uma tribo ou sociedade. Alguns compostos químicos são os
responsáveis pelas diferentes cores das tatuagens, como por exemplo, os óxidos de titânio
(branco) ou de ferro (castanho, rosa e amarelo) e diversos sais, como os de crômio (verde), cádmio
(amarelo ou vermelho) cobalto (azul).
30
I Lista de Exercícios – Química 2013
Fonte: Tatuagens.
Os elementos químicos representados na tatuagem que aparece na figura acima
a)
b)
c)
d)
devem ser lipossolúveis para aumentar sua fixação na pele.
possuem caráter metálico maior que o do oxigênio.
são classificados como representativos e estão localizados entre as colunas 1 e 12 da tabela
periódica.
são metálicos e, respectivamente, um actinídio, um representativo e um de transição.
88 - (UFJF MG/2012)
Com base nos dados da Tabela Periódica, assinale a alternativa INCORRETA.
a)
b)
c)
d)
e)
O elemento estrôncio possui 02 (dois) elétrons na sua camada de valência.
Elementos do grupo 17 têm a tendência de formar ânions, enquanto os elementos do grupo
01 têm a tendência de formar cátions.
O elemento que possui 52 prótons pertence ao 5º período.
O fósforo possui, na sua camada de valência, a configuração 3s2 3p5.
O elemento do grupo 02 e período 06 possui maior raio atômico do que o elemento do grupo
14 e período 04.
89 - (UEMA/2012)
Ao se estudar a correlação periódica dos elementos químicos, identifica-se um elemento que
apresenta alto potencial de ionização e alta afinidade eletrônica. Esse elemento é um
a)
b)
c)
d)
e)
não-metal.
metal.
semimetal.
metal de transição.
alcalino terroso.
90 - (UFPR/2012)
A maioria dos elementos da tabela periódica apresenta-se como metais quando cristalizados na
sua substância pura. Suas propriedades químicas são alvos tanto da pesquisa quanto da aplicação
industrial. Por pertencerem a uma mesma classe, os metais possuem características similares.
Sobre as características dos metais, considere as seguintes afirmativas:
1.
2.
3.
4.
Metais apresentam alta condutividade térmica e elétrica.
Metais possuem altos valores de eletronegatividade.
Metais apresentam baixa energia de ionização.
Metais reagem espontaneamente com oxigênio.
31
I Lista de Exercícios – Química 2013
Assinale a alternativa correta.
a)
b)
c)
d)
e)
Somente a afirmativa 3 é verdadeira.
Somente as afirmativas 1 e 2 são verdadeiras.
Somente as afirmativas 2 e 4 são verdadeiras.
Somente as afirmativas 1, 3 e 4 são verdadeiras.
As afirmativas 1, 2, 3 e 4 são verdadeiras.
91 - (UECE/2012)
Sobre a classificação periódica dos elementos, que é o instrumento de manuseio indispensável às
atividades dos químicos, é correto afirmar-se que
a)
b)
c)
d)
a lei de recorrência, lei das oitavas, foi elaborada primitivamente por Mendeleiev.
a diferença de eletronegatividades possibilita prever o tipo de ligação entre dois elementos da
tabela.
o átomo de hélio tem raio atômico duas vezes maior que o átomo de hidrogênio.
a afinidade eletrônica do neônio é positiva porque o elétron adquirido ocuparia um orbital 3s
de energia mais elevada.
92 - (FMJ SP/2012)
Na região da cidade de Bonito, no Mato Grosso do Sul, a ocorrência do solo calcáreo, contendo
carbonato de magnésio e cálcio, faz com que a água dos rios tenha o aspecto cristalino, que é uma
atração turística conhecida mundialmente.
Em relação ao cálcio e ao magnésio, são feitas as seguintes afirmações:
I.
II.
III.
IV.
o raio do íon Ca2+ é maior que o do Mg2+;
a primeira energia de ionização do Mg é maior do que a do Ca;
o íon Ca2+ tem maior número de prótons que o átomo de Ca;
o raio do íon Mg2+ é maior que o do átomo de Mg.
É correto apenas o que se afirma em
a)
b)
c)
d)
e)
I e II.
I e III.
I e IV.
II e IV.
III e IV.
TEXTO: 1 - Comum às questões: 93, 94
O elemento ouro apresenta vários isótopos, sendo o 197Au estável e os demais, radioativos. Entre
os radioativos está o 198Au, utilizado em diagnóstico médico, que decai com emissão –.
93 - (FAMECA SP/2012)
32
I Lista de Exercícios – Química 2013
Quando o isótopo radioativo do ouro mencionado no texto sofre decaimento, há formação de
isótopo do elemento
a)
b)
c)
d)
e)
mercúrio.
prata.
platina.
cobre.
cádmio.
94 - (FAMECA SP/2012)
O número de nêutrons e o número de elétrons do isótopo estável do ouro no estado fundamental
são, respectivamente,
a)
b)
c)
d)
e)
197 e 79.
79 e 197.
197 e 118.
118 e 197.
118 e 79.
TEXTO: 2 - Comum à questão: 95
Cataratas de sangue
As Blood Falls não receberam esse nome à toa. Elas emergem da geleira Taylor, na Antártica, e
desembocam no lago congelado Booney. A coloração avermelhada é resultado de ferro na água
(na forma de íons férricos), que oxida em contato com a atmosfera. Quanto à origem das cataratas,
trata-se de um reservatório subterrâneo de água do mar, preso debaixo do gelo quando um fiorde
ficou isolado entre 1,5 e 2 milhões de anos atrás. Esse reservatório tem algumas características
peculiares, como salinidade altíssima, sulfato abundante e falta de oxigênio. Apesar de tudo isso, a
água contém vida microbiana. Os micróbios provavelmente utilizam o sulfato e íons férricos para
metabolizar a pouca matéria orgânica que existe no seu mundo frio e escuro. Essas cataratas se
localizam na região dos McMurdoDryValleys, uma área de deserto frio, cercada por montanhas e
atingidas por ventos “katabatic”, formados pela descida de ar denso e frio. Estes ventos atingem
até 320 km/h e evaporam toda a água, neve e gelo em seu caminho.
(Adaptado: Revista BBC Knowledge, junho de 2011, p. 17)
95 - (PUC Camp SP/2012)
Os ventos evaporam somente a água no estado líquido. A neve é
a)
b)
c)
d)
e)
fundida.
solidificada.
sublimada.
decomposta.
condensada.
TEXTO: 3 - Comum à questão: 96
33
I Lista de Exercícios – Química 2013
A água para consumo humano deve ser inodora, insípida, incolor e agradável ao paladar com
uma certa quantidade de oxigênio dissolvido. Não deve ter acidez e nem micro-organismos
patogênicos.
As etapas do tratamento de água da cidade de Barretos, SP, estão indicadas na figura.
(www.novoguiabarretos.com. Adaptado.)
96 - (Fac. de Ciências da Saúde de Barretos SP/2013)
Tendo em vista os diferentes processos envolvidos na obtenção de água tratada, é correto afirmar
que ocorrem transformações químicas nas etapas de
a)
b)
c)
d)
e)
coagulação e decantação.
coagulação e cloração.
decantação e filtração.
filtração e cloração.
floculação e decantação.
TEXTO: 4 - Comum à questão: 97
O magnésio é um mineral essencial para o corpo humano, necessário para processos biológicos
tais como a produção de ATP e a contração muscular. É muito consumido por pessoas que desejam
evitar cãibra muscular, manter o bom funcionamento de músculos e nervos, a densidade óssea e
aliviar contusões. A vitamina B6 aumenta a quantidade de magnésio absorvida pelas células.
Existem à venda suplementos alimentares cuja composição inclui esses dois nutrientes.
97 - (Fac. de Ciências da Saúde de Barretos SP/2013)
O magnésio é um metal alcalino terroso que não ocorre livre na natureza, mas sempre se
apresenta em combinação com diversos elementos, em vários minerais, como Mg 2+.
Possui o mesmo número de elétrons que o cátion Mg2+ o átomo neutro de
a)
b)
c)
d)
alumínio.
cálcio.
neônio.
sódio.
34
I Lista de Exercícios – Química 2013
e)
argônio.
TEXTO: 5 - Comum à questão: 98
No Brasil, é obrigatória, por lei, a adição do elemento químico iodo ao sal de cozinha, como
forma de prevenir doenças da glândula tireoide. A legislação sanitária estabelece ainda que um sal
adequado para o consumo humano deve conter entre 20 e 60 miligramas de iodo para cada
quilograma de produto.
Para cumprir a legislação, as indústrias do sal acrescentam ao seu produto o composto iônico
iodato de potássio, KIO3.
98 - (Fac. Santa Marcelina SP/2012)
O número total de elétrons do íon potássio no iodato de potássio é
a)
b)
c)
d)
e)
18.
19.
20.
39.
40.
TEXTO: 6 - Comum à questão: 99
Os soros fisiológico e glicosado são soluções aquosas de NaCl e glicose (C 6H12O6),
respectivamente. O soro fisiológico é empregado principalmente para a reposição de água e sais
minerais perdidos pelo organismo. Já o soro glicosado, além de sua função hidratante, atua como
fonte de energia para o organismo por meio do metabolismo da glicose. Esses soros, quando
injetados nas veias de pacientes, devem apresentar pressão osmótica similar à do sangue, para não
danificarem os glóbulos vermelhos.
99 - (ESCS DF/2013)
Com relação aos íons presentes no soro fisiológico e aos átomos neutros que dão origem a esses
íons, assinale a opção correta.
a)
b)
c)
d)
e)
Os isótopos 23Na e 35Cl possuem 11 e 17 nêutrons, respectivamente.
Os íons Na+ possuem raio atômico superior ao dos átomos neutros de sódio.
Os íons Na+ apresentam a mesma configuração eletrônica dos átomos de argônio.
A distribuição eletrônica dos elétrons de valência do átomo de sódio no estado fundamental
de energia é 3s1, e a do átomo de cloro, 3s2, 3p5.
O cloro possui raio atômico maior que o do sódio.
TEXTO: 7 - Comum à questão: 100
O etanol é uma solução tipicamente brasileira que está ganhando o mundo. Além de seu uso em
diversos setores industriais, o etanol é um combustível de alto desempenho para aplicação em
motores de combustão interna.
35
I Lista de Exercícios – Química 2013
A produção industrial de etanol baseia-se quase que exclusivamente na fermentação. A
fermentação alcoólica é um processo biológico de conversão de monossacarídeos em energia
celular, etanol e gás carbônico. A grande maioria dos micro-organismos é capaz de metabolizar
apenas monossacarídeos, como a glicose e a frutose.
Diversas estratégias foram desenvolvidas pelos organismos para o aproveitamento dessa fonte de
energia, incluindo a produção direta de enzimas glicolíticas por fungos e bactérias, ou a
combinação de ácidos e ação mecânica.
A quebra das ligações glicosídicas é feita por uma reação de hidrólise e no caso específico da
reação representada pela equação química (C6H10O5)n(s) + nH2O(l) nC6H12O6(aq), chamada de
celulólise, e para que ocorra de maneira eficiente, deve ser catalisada pela ação de algum
coadjuvante externo, normalmente uma solução aquosa de ácido ou um coquetel enzimático.
As frações mais recalcitrantes desse processo são hidrolisadas em um segundo estágio mais severo,
tipicamente a 215ºC sob ação do ácido sulfúrico a 0,4% durante cerca de três minutos, o que gera,
principalmente, hexoses. Já a hidrólise na presença de solução aquosa de ácido menos diluída,
produz uma alta concentração de monossacarídeos, cerca de 90%, e é altamente adaptável a
diferentes fontes de biomassa, além de gerar poucos subprodutos inibidores da fermentação.
(SELEGHIM; POLIKARPOV, 2012, p. 40-45).
SELEGHIM, Paulo ; POLIKARPOV Igor. Desafios para transformar
conceitos em realidade. Scientific American Brasil.
São Paulo: Duetto, ano 1, n. 10, 2012.
100 - (UNEB BA/2013)
O veículo flex ou veículo de combustível duplo funciona com mais de um tipo de combustível,
misturado no mesmo tanque e queimado na câmara de combustão simultaneamente.
Considerando-se que as densidades da gasolina e do etanol são, respectivamente, 0,76kg/L e
0,79g/cm3 a 20ºC, que os coeficientes de dilatação volumétrica da gasolina e do etanol são iguais a
1,210–3 C–1 e que calor de vaporização do etanol é de 0,744MJ/L, analise as afirmativas e marque
com V as verdadeiras e com F, as falsas.
( )
( )
( )
( )
A densidade da gasolina permanece constante no intervalo térmico entre 25ºC e 68,7ºC, nas
condições normais de pressão.
A densidade da mistura de massas iguais de gasolina e de etanol, a 20ºC, é,
aproximadamente, 7,7102kg/m3.
Um carro com tanque de capacidade 60 litros pode ser abastecido com 50,0 litros de gasolina
a 20ºC e estacionado ao Sol até atingir a temperatura de 35ºC, sem que o combustível
transborde.
O volume de 1,0m3 de etanol necessita de 7,44106J de energia para que vaporize.
A alternativa que indica a sequência correta, de cima para baixo, é a
01.
02.
03.
04.
05.
VVVF
VVFV
FFFV
FVVF
FFVF
GABARITO:
36
I Lista de Exercícios – Química 2013
1) Gab: B
2) Gab: D
3) Gab: C
4) Gab: E
5) Gab: E
6) Gab: B
7) Gab: D
8) Gab: A
9) Gab: E
10) Gab: 15
11) Gab: B
12) Gab: C
13) Gab: A
14) Gab: 04
15) Gab: D
16) Gab: D
17) Gab: D
18) Gab: D
19) Gab: A
20) Gab: A
21) Gab: 15
22) Gab: A
23) Gab: C
24) Gab: E
37
I Lista de Exercícios – Química 2013
25) Gab: C
26) Gab: E
27) Gab: B
28) Gab: D
29) Gab: D
30) Gab: B
31) Gab: A
32) Gab: A
33) Gab: A
34) Gab: C
35) Gab: 01
36) Gab: C
37) Gab: D
38) Gab: B
39) Gab: 13
40) Gab: B
41) Gab: B
42) Gab: 23
43) Gab: Substância A
Destilação, pois seus pontos de ebulição são distintos.
44) Gab: A
45) Gab: E
46) Gab: A
47) Gab: 18
38
I Lista de Exercícios – Química 2013
48) Gab: D
49) Gab: C
50) Gab: D
51) Gab: A
52) Gab: D
53) Gab: D
54) Gab: C
55) Gab: A
56) Gab: B
57) Gab: B
58) Gab: D
59) Gab: 23
60) Gab: 07
61) Gab: 24
62) Gab: C
63) Gab: C
64) Gab: D
65) Gab: 09
66) Gab: E
67) Gab: C
68) Gab: A
69) Gab: 19
70) Gab: D
71) Gab: B
39
I Lista de Exercícios – Química 2013
72) Gab: C
73) Gab: E
74) Gab: C
75) Gab: C
76) Gab: 21
77) Gab: 14
78) Gab: 27
79) Gab: D
80) Gab: A
81) Gab: A
82) Gab: A
83) Gab: B
84) Gab: 23
85) Gab: E
86) Gab: A
87) Gab: B
88) Gab: D
89) Gab: A
90) Gab: D
91) Gab: B
92) Gab: A
93) Gab: A
94) Gab: E
95) Gab: C
40
I Lista de Exercícios – Química 2013
96) Gab: B
97) Gab: C
98) Gab: A
99) Gab: D
100) Gab: 04
41