Capítulo 6
Introdução à
Estereoquímica
slide 1
© 2010 Pearson Prentice Hall. Todos os direitos reservados.
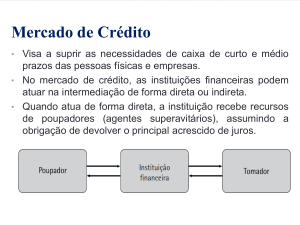
Estereoquímica
Introdução
ISÔMEROS
ISÔMEROS CONSTITUCIONAIS
ESTEREOISÔMEROS
ISÔMEROS cis/trans ou E/Z
slide 2
ISÔMEROS QUE CONTÉM
CENTROS QUIRAIS
© 2010 Pearson Prentice Hall. Todos os direitos reservados.
Estereoquímica
Introdução
QUIRALIDADE: imagens especulares não-superponíveis
Cristais de quartzo
slide 3
Quiral do grego,
cheir = mão
© 2010 Pearson Prentice Hall. Todos os direitos reservados.
Estereoquímica
Introdução
(c)
(d)
(a)
(b)
(a) Convolvulus arvensis (b) Lonicera sempervirens
(c) Liguus virgineus (d) Bacillus subtilis.
slide 4
© 2010 Pearson Prentice Hall. Todos os direitos reservados.
Estereoquímica
O Polarímetro e a luz polarizada
Luz normal: composta por ondas
eletromagnéticas que oscilam em
todas as direções.
Luz plano-polarizada: oscila em
apenas uma direção. É obtida a
partir da luz comum - prisma de
Nicol.
slide 5
© 2010 Pearson Prentice Hall. Todos os direitos reservados.
Estereoquímica
O Polarímetro e a luz polarizada
Polarímetro: aparelho para medida do desvio da
luz polarizada.
Moléculas quirais: capacidade de desviar o plano da luz polarizada.
desvio para direita dextrógira (+)
desvio para esquerda levógira (-)
slide 6
© 2010 Pearson Prentice Hall. Todos os direitos reservados.
Estereoquímica
O Polarímetro e a luz polarizada
A rotação depende:
- da natureza da amostra;
- do comprimento do tubo;
- da concentração da amostra;
- da temperatura;
- do solvente;
- da fonte de luz utilizada.
slide 7
© 2010 Pearson Prentice Hall. Todos os direitos reservados.
Estereoquímica
O Polarímetro e a luz polarizada
Rotação específica: rotação causada por uma solução
(1 g.cm-3) em tubo de 1 dm, a uma certa temperatura
(em C) e comprimento de onda específicos.
= rotação observada (º)
l = comprimento do tubo da amostra (dm)
c = concentração (g.cm-3)
[ ]
T
D
l.c
- é propriedade física de isômero opticamente ativo.
- D é a rotação específica quando se utiliza a linha D
( = 589,3 nm) do sódio.
slide 8
© 2010 Pearson Prentice Hall. Todos os direitos reservados.
Estereoquímica
A descoberta da quiralidade em moléculas
Em 1848, Louis Pasteur, observou que dois tipos de
cristais do ácido tartárico eram depositados em barris
de vinho durante a fermentação.
(a)
slide 9
(b)
© 2010 Pearson Prentice Hall. Todos os direitos reservados.
Estereoquímica
A descoberta da quiralidade em moléculas
Pasteur observou que uma solução contendo os dois
isômeros do tartarato na mesma concentração era
opticamente inativa.
Mistura racêmica (racemato):
- proporções iguais dos enantiômeros
- não altera o plano de polarização da luz
- usa-se o símbolo ()
slide 10
© 2010 Pearson Prentice Hall. Todos os direitos reservados.
Estereoquímica
Enantiômeros
Le Bel e Van’t Hoff mostraram que em carbono
assimétrico tetraédrico os quatro grupos podem
arranjar-se em torno dele de duas formas distintas:
CO 2H
H
OH
H3 C
(I)
CO 2H
HO
H
CH 3
(II)
são imagens especulares, não superponíveis.
slide 11
© 2010 Pearson Prentice Hall. Todos os direitos reservados.
Estereoquímica
Enantiômeros
Mesmas propriedades físicas:
- temperatura de fusão
- temperatura de ebulição
- densidade,
- índice de refração, etc.
Diferentes propriedades biológicas.
Diferentes propriedades ópticas
• diferente interação com a luz polarizada.
slide 12
© 2010 Pearson Prentice Hall. Todos os direitos reservados.
Estereoquímica
A importância da Quiralidade nas moléculas
H
H2N
CO2H
CH2CONH2
(R)-asparagina
(sabor amargo)
O
(S)-carvona
(odor de menta)
slide 13
CO2H
H
H2NOCH2C
NH2
(S)-asparagina
(sabor doce)
O
(R)-carvona
(odor de alcavaria)
© 2010 Pearson Prentice Hall. Todos os direitos reservados.
Estereoquímica
A importância da Quiralidade nas moléculas
O
O
N
O
O
O
N
H
O
N
N
H
(R)-talidomida
(sedativo)
HO
Cl
N
N
N
(2R,3R)-paclobutrazol
(fungicida)
slide 14
N
O O
(S)-talidomida
(teratogênico)
N
N
OH
Cl
(2S,3S)-paclobutrazol
(regulador do crescimento
de plantas)
© 2010 Pearson Prentice Hall. Todos os direitos reservados.
Estereoquímica
Estereoisômero com um carbono
assimétrico
• Configuração absoluta: ordem de arranjo dos grupos
em torno do átomo assimétrico
H
F
F
C
C
Cl
Cl
Br
H
Br
II
I
Enantiômeros
slide 15
© 2010 Pearson Prentice Hall. Todos os direitos reservados.
Estereoquímica
Representação de enantiômeros
Fórmulas em perspectiva
Projeções de Fischer
Cl
C
Br
I
slide 16
F
F
F
H
Cl
H
Br
Projeção de Fischer
H
C
F
Cl
H
Cl
Br
Br
II
Projeção de Fischer
© 2010 Pearson Prentice Hall. Todos os direitos reservados.
Estereoquímica
Projeções de Fischer
Carboidratos
H
CHO
OH
H
H
OH
H
OH
H
OH
H
OH
CH2OH
Ribose
slide 17
CHO
H
CH2OH
2-Desoxirribose
© 2010 Pearson Prentice Hall. Todos os direitos reservados.
Estereoquímica
Configuração absoluta
Sistema R/S: Regra de Cahn, Ingold e Prelog
Etapas para a determinação da configuração R ou S:
1) numerar os átomos (ou grupos) ligados ao carbono
assimétrico em ordem de prioridade
• maior número atômico, maior prioridade (1);
2) escrever a estrutura da molécula, orientando o grupo
de menor prioridade (4) para trás;
slide 18
© 2010 Pearson Prentice Hall. Todos os direitos reservados.
Estereoquímica
Configuração absoluta
Sistema R/S: Regra de Cahn, Ingold e Prelog
Etapas para a determinação da configuração R ou S:
3) traçar uma seta do grupo de prioridade 1, passando
pelo 2 e, então, pelo 3.
Sentido
horário R
(do latim
rectus, direito)
slide 19
1
1
4
3
4
2
2
Sentido antihorário S (do
3 latim sinister,
esquerdo)
© 2010 Pearson Prentice Hall. Todos os direitos reservados.
Estereoquímica
Configuração absoluta
Sistema R,S a partir de fórmulas de Fischer:
1) Se o grupo de menor prioridade estiver na posição
vertical, é só observar o sentido das setas, partindo
do grupo 1 até o 3.
4
H
2
D3
F
Cl
1
slide 20
H
F
2
D
Cl
4
H
F
D3
Cl
1
© 2010 Pearson Prentice Hall. Todos os direitos reservados.
Estereoquímica
Configuração absoluta
Sistema R,S a partir de fórmulas de Fischer:
2) Se o grupo de menor prioridade estiver na horizontal,
mantém-se fixa a posição de qualquer um dos grupos
(exceto do 4) e trocam-se as posições dos outros.
4
2
H
Cl
4
H
F
I
1
A
slide 21
3
3
1
F
I
Cl
2
B
© 2010 Pearson Prentice Hall. Todos os direitos reservados.
Estereoquímica
Configuração absoluta
Sistema R,S a partir de fórmulas de Fischer:
Atribuição de prioridades
A prioridade dos grupos é dada segundo o número atômico
(e número de massa) dos átomos diretamente ligados ao
carbono assimétrico.
1
OH
2
CH2Br
H2N
3
Configuração S
4H
slide 22
© 2010 Pearson Prentice Hall. Todos os direitos reservados.
Estereoquímica
Configuração absoluta
Sistema R,S a partir de fórmulas de Fischer:
Atribuição de prioridades
Em caso de empate nos átomos diretamente ligados ao
carbono assimétrico, compara-se os átomos ligados a eles,
utilizando os mesmos critérios.
1
OH
3
H3C
CH2Br
2
H
4
(R)-1-bromopropan-2-ol
slide 23
H
C Br (Br,H,H)
H
H
C H (H,H,H)
H
© 2010 Pearson Prentice Hall. Todos os direitos reservados.
Estereoquímica
Configuração absoluta
Sistema R,S a partir de fórmulas de Fischer:
Atribuição de prioridades
Grupos com ligações duplas e triplas são “desdobrados” em
duas ou três ligações simples.
H
H
C
O
equivale a
H
C CH2
C CH
slide 24
equivale a
equivale a
C
O
O
C
H
H
C
C
C
C
C
C
C
C
C
C
H
H
© 2010 Pearson Prentice Hall. Todos os direitos reservados.
Estereoquímica
Configuração absoluta
Sistema R,S a partir de fórmulas de Fischer:
Atribuição de prioridades
CH3
C
C
C
CH2
>
C
C
CH2
C
H
H CH3
Maior prioridade
OH
C
C
CH2
H
C
O
OH
H
Menor prioridade
slide 25
C
<
C
C
H
O
C
C
O
H
C
© 2010 Pearson Prentice Hall. Todos os direitos reservados.
Estereoquímica
Configuração absoluta
Não existe correlação entre a configuração R/S e o
sentido do desvio da luz polarizada (dextrógiro ou
levógiro):
H
H3C
H
CH2Cl
ClH 2C
CH2CH3
(R)-1-cloro-2-metilbutano
25°
[]D = -1,64°
slide 26
CO2H
CH3
H
CH2CH3
CH3
(S)-1-cloro-2-metilbutano
25°
[]D = +1,64°
OH
(R)-Ácido lático
25°
[]D = +2,60°
CO2H
HO
H
CH3
(S)-Ácido lático
25°
[]D = -2,60°
© 2010 Pearson Prentice Hall. Todos os direitos reservados.
Estereoquímica
Estereoisômeros com mais de um
centro assimétrico
REGRA GERAL: NÚMERO MÁXIMO DE ESTEREOISÔMEROS É 2N,
ONDE N = NÚMERO DE CARBONOS ASSIMÉTRICOS.
1
H3C
slide 27
H
H
2
C
3C
Br
Cl
4
CH3
© 2010 Pearson Prentice Hall. Todos os direitos reservados.
Estereoquímica
Estereoisômeros com dois centros
assimétricos diferentes
CH3
CH3
CH3
H
Cl
Cl
H
H
Cl
Cl
H
H
Br
Br
H
Br
H
H
Br
CH3
CH3
CH3
CH3
(I)
(II)
(III)
(IV)
I e II, III e IV: Enantiômeros.
I e IV, I e III, II e IV, II e III:
Diastereoisômeros
slide 28
CH3
não são imagens
especulares
© 2010 Pearson Prentice Hall. Todos os direitos reservados.
Estereoquímica
Estereoisômeros com dois centros
assimétricos iguais
CO2H
CO2H
CO2H
H
OH
HO
H
H
H
OH
HO
H
HO
CO2H
V
CO2H
VI
CO2H
OH
HO
H
H
CO2H
VII
Iguais
OH
H
OH
CO2H
180º
HO
Diferentes
CO2H
slide 29
OH
CO2H
VIII
CO2H
H
H
H
H
180º
OH
CO2H
VII e VIII: Enantiômeros
V e VI: Compostos meso
V e VII, V e VIII: Diastereoisômeros
© 2010 Pearson Prentice Hall. Todos os direitos reservados.
Estereoquímica
Compostos meso
contêm carbonos assimétricos, mas imagens
especulares sobreponíveis :
não são enantiômeros;
mesmo composto.
possui dois ou mais carbonos assimétricos;
possui plano de simetria;
são opticamente inativos.
slide 30
© 2010 Pearson Prentice Hall. Todos os direitos reservados.
Estereoquímica
Outras designações em estereoquímica
Convenção de Fischer-Rosanoff (designação D-L):
carboidratos e aminoácidos
D: grupo hidroxila ou amino à direita
L: grupo hidroxila ou amino à esquerda
CHO
H
OH
CH2OH
slide 31
CHO
HO
H
CH2OH
D-Gliceraldeído
L-Gliceraldeído
[]D25°= +8,7° (em água)
[]D25°= -8,7° (em água)
© 2010 Pearson Prentice Hall. Todos os direitos reservados.
Estereoquímica
Outras designações em estereoquímica
H
OH
HO
HO
H
H
CHO
H
H
OH
HO
H
OH
H
OH
HO
H
H
OH
HO
H
H
OH
HO
H
H
OH
HO
H
H
OH
HO
H
D-glicose
L-glicose
CO2H
CO2H
H2N
H
CH3
L-alanina
CH2OH
CH2OH
CH2OH
slide 32
CHO
CHO
CHO
H
NH2
CH3
D-alanina
D-alose
CH2OH
L-alose
CO2H
CO2H
H2N
H
CH2SH
L-cisteína
H
NH2
CH2SH
D-cisteína
© 2010 Pearson Prentice Hall. Todos os direitos reservados.