Equilíbrios em Fase Aquosa
Prof.: Élcio
Renato Zanca – 14244
Tauan Antunes – 14247
• O Efeito do Íon Comum
• Soluções Tamponadas
Composição e Ação dos Tampões
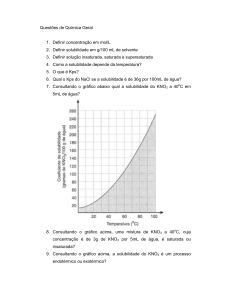
Capacidade de Tamponamento e pH
Adição de Ácidos ou Bases Fortes à Solução Tampão
• Titulações Ácido-Base
Titulação de Ácido Forte / Base Forte
Titulação de Ácido Fraco / Base Forte
Curvas de Titulação de Ácidos Fracos
Titulação de Ácido Polipróticos
• Equilíbrios de Solubilidade
A Constante do Produto de Solubilidade, Kps
Solubilidade e Kps
• Fatores que Afetam a Solubilidade
Solubilidade e pH
Anfoterismo
• Precipitação e Separação de Íons
Precipitação Seletiva de Íons
• Análise Qualitativa para Elementos Metálico
Efeito do Íon Comum
A dissociação de um eletrólito fraco diminui pela
adição de eletrólito forte à solução, que tem um íon
em comum com ele.
NaC2H3O2
Na+ + C2H3O2-
HC2H3O2
H+ + C2H3O2-
A adição de
a [H+]
C2H3O2 desloca o equilíbrio e reduz
Soluções Tamponadas
Soluções com um par ácido-base conjugado fraco, que podem
resistir a variações drásticas de pH com adição de ácidos ou
bases fortes.
Composição e Ação dos Tampões
•Ácido fraco + sal do ácido ou base fraca + sal da base
•Resistência à mudança de pH
•Neutraliza íons OH- e íons H+
Soluções Tamponadas
Capacidade de Tamponamento e pH
•A capacidade de tamponamento é medida pela quantidade de
ácido ou base que o tampão pode neutralizar antes que o pH se
modifique drasticamente.
•Pode ser calculado pela constante Ka
•Equação de Henderson-Hasselbach
pH = pKa + log ( [base] / [ácido] )
Soluções Tamponadas
Adição de Ácidos Fortes ou Bases Fortes à Solução Tampão
Titulações Ácido-Base
Titulação de Ácido Forte por Base Forte
Titulações Ácido-Base
Titulação de Ácido Fraco por Base Forte
Titulações Ácido-Base
Curvas de Titulação de Ácidos Fracos ou de Bases Fracas
Titulações Ácido-Base
Titulações de Ácidos Polipróticos
Equilíbrios de Solubilidade
A Constante do Produto de Solubilidade, Kps
BaSO4(s)
Ba+2(aq) + SO4-2(aq)
Kps = [Ba+2] [SO4-2]
Equilíbrios de Solubilidade
Solubilidade e Produto de Solubilidade (Kps)
•Diferenças
•Exemplo: Mg(OH)2
Fatores que Afetam a Solubilidade
Solubilidade e pH
•A solubilidade de quase qualquer
composto iônico é alterada, se a
solução for suficientemente ácida
ou alcalina.
•A solubilidade de sais pouco
solúveis, com ânions básicos,
aumenta com o aumento da
concentração de H+.
•A solubilidade dos sais de metais
também é afetada pela presença de
certas bases de Lewis que reagem com
os íons metálicos e formam íons
complexos estáveis.
Fatores que Afetam a Solubilidade
Anfoterismo
Substâncias Anfóteras são substâncias que podem apresentar
comportamento como ácidos ou como bases.
Precipitação e Separação de Íons
Ex.: Mistura de BaCl2 e Na2SO4
BaSO4 se Q ( Q = [Ba+2] [SO4-2] ) > Kps
Relações possíveis entre Q e Kps:
Se Q > Kps, a precipitação avança até Q = Kps
Se Q = Kps, a solução está saturada
Se Q < Kps, o sólido se dissolve até Q = Kps
Precipitação e Separação de Íons
Precipitação Seletiva de Íons
Ex.: Solução de Ag+ e Cu+2
Juntando HCl
AgCl e Cu+2 ficará em solução
Análise Qualitativa dos Elementos Metálicos
•Análise Qualitativa
•Análise Quantitativa
Referências Bibliográficas
http://www.iq.usp.br/wwwdocentes/wdolivei/equilibrio.ppt
Acesso em 06/05/07
Brown, Theodore L., LeMay, H. Eugene, Bursten, Bruce
E. e Burdge, Julia R.
Química: A Ciência Central. Copyright: 2005. 9ª
edição.