EQUILÍBRIO AQUOSO – EFEITO DO ÍON COMUM
• A solubilidade de um ácido fraco, base fraca ou ainda um sal
parcialmente solúvel diminui quando um íon comum é adicionado.
• Considere o equilíbrio estabelecido quando o ácido acético,
CH3COOH é adicionado à água.
• No equilíbrio, H+ e CH3COO- estão se movimentando
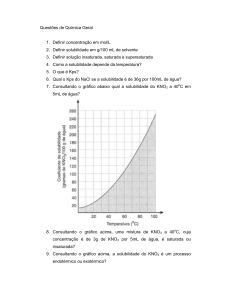
constantemente para dentro e para fora da solução, mas as
concentrações dos íons são constantes e iguais.
• Considere a adição de CH3COO-, que é um íon comum. (A fonte de
acetato poderia ser um eletrólito forte como o CH3COONa.)
• Conseqüentemente, a [CH3COO-] aumenta e o sistema não está
mais em equilíbrio.
• Então, a [H+] deve diminuir.
EXERCÍCIOS
1. Qual é o pH de uma solução preparada pela adição de 0,30 mol de
ácido acético (CH3COOH) e 0,30 mol de acetato de sódio
(CH3COONa) em quantidade suficiente de água para perfazer 1,0 L
de solução? Dados: Ka = 1,8 x 10-5
2. Calcule a concentração de íons fluoreto e o pH de uma solução de
0,2 mol de HF e 0,10 mol de HCl. Dados: Ka = 6,8 x 10-4
EQUILÍBRIO AQUOSO – SOLUÇÃO TAMPÃO
Composição e ação das soluções-tampão
• Um tampão consiste em uma mistura de ácido fraco (HX) e sua
base conjugada (X-):
HX(aq)
H+(aq) + X-(aq)
• A expressão Ka é
+
-
[H ][ X ]
Ka =
[HX]
∴
K a [ HX ]
+
[H ] =
[X −]
EQUILÍBRIO AQUOSO – SOLUÇÃO TAMPÃO
• Um tampão resiste a uma variação de pH quando uma pequena
quantidade de OH- ou H+ é adicionada.
EQUILÍBRIO AQUOSO – SOLUÇÃO TAMPÃO
Capacidade de tampão e pH
• A capacidade do tampão é a quantidade de ácido ou base
neutralizada pelo tampão antes que haja uma alteração
significativa no pH.
• A capacidade do tampão depende da composição do tampão.
• Quanto maiores são as quantidades de pares ácido-base
conjugados, maior é a capacidade do tampão.
• O pH do tampão depende da Ka.
+
[HX ]
− log[H ] = − log K a − log
[X −]
+
−
[X ]
[ SAL]
∴ pH = pKa + log
⇒ pH = pKa + log
[ HX ]
[ ÁCIDO]
EQUILÍBRIOS AQUOSOS – SOLUÇÕES-TAMPÃO
CÁLCULO ADIÇÃO ÁCIDO FORTE - BASE FORTE
EXERCÍCIOS
1. Qual é o pH de um tampão de 0,12 mol/L de ácido lático (HC3H5O3)
e 0,10 mol/L de lactato de sódio (NaC3H5O3)? Para o ácido lático,
Ka = 1,4 x 10-4.
EQUILÍBRIOS AQUOSOS – TITULAÇÃO
• Um gráfico de pH versus volume de
ácido (ou base) adicionado é chamado
de curva de titulação.
• Considere a adição de uma base forte
(por exemplo, NaOH) a uma solução de
um ácido forte (por exemplo, HCl).
– Antes de qualquer base ser
adicionada, o pH < 7.
– Quando a base é adicionada, antes
do ponto de equivalência, o pH < 7.
– No ponto de equivalência, a
quantidade de base adicionada é
estequiometricamente equivalente
à quantidade de ácido
originalmente presente. Portanto, o
pH é determinado pela solução de
sal. Portanto, pH = 7.
ÁCIDO FORTE-BASE FORTE
EQUILÍBRIOS AQUOSOS – TITULAÇÃO
ÁCIDO FORTE-BASE FORTE
EQUILÍBRIOS AQUOSOS – TITULAÇÃO ÁCIDO FORTE-BASE FORTE
• Considere a adição de uma base forte (por exemplo, NaOH) a uma
solução de um ácido forte (por exemplo, HCl).
• Sabemos que o pH no ponto de equivalência é 7,00.
• Para detectar o ponto equivalência, usamos um indicador que
muda de cor quando próximo a 7,00.
• O ponto de equivalência em uma titulação é o ponto no qual o
ácido e a base estão presentes em quantidades estequiométricas.
• O ponto final em uma titulação é o ponto observado.
• A diferença entre o ponto de equivalência e o ponto final é
chamada de erro de titulação.
• A forma de uma curva de titulação de base forte-ácido forte é
muito parecida com a forma de uma curva de titulação ácido
forte-base forte.
EQUILÍBRIOS AQUOSOS – TITULAÇÃO
ÁCIDO FRACO-BASE FORTE
EQUILÍBRIOS AQUOSOS – TITULAÇÃO
EQUILÍBRIOS AQUOSOS – SOLUBILIDADE
A constante do produto de solubilidade, Kps
•
Considere:
BaSO4(s)
Ba2+(aq) + SO42-(aq)
para o qual
K ps = [Ba 2+ ][SO 24- ]
• Kps é o produto de solubilidade. (O BaSO4 é ignorado, uma vez que é um sólido
puro, logo, sua concentração é constante.)
• Para converter solubilidade em Kps
• a solubilidade precisa ser convertida em solubilidade molar (através da massa
molar);
• a solubilidade é convertida na concentração em quantidade de matéria de íons
no equilíbrio (cálculo do equilíbrio),
• Kps é o produto da concentração de íons no equilíbrio.
EXERCÍCIOS
1. Escreva a expressão para a constante do produto de
solubilidade para as reações abaixo
a) b) AgCl (s)
Ag+(aq) +
Cl-(aq)
b) CaF2 (s)
c) Mg(OH)2 (s)
d) Ag(OH)3 (s)
Ca2+
2F-(aq)
(aq) +
Mg2+ (aq)
Ag+ (aq)
+
+
2OH- (aq)
3OH- (aq)
2. Calcule a solubilidade de CaF2 a 25 oC. Onde a constante
do produto de solubilidade vale 3,9 x 10-11
EXERCÍCIOS
1. Calcule a solubilidade molar Mg(OH)2 sabendo que a
constante do produto de solubilidade é 1,8 x 10-11
2. Calcule a concentração de Ba2+ em um sistema onde o
BaSO4 se encontra em equilíbrio com seus íons. Sabendo
que Kps = 1,1 x 10-10
EQUILÍBRIOS AQUOSOS – SOLUBILIDADE
Efeito do íon comum
• A solubilidade diminui quando um íon comum é
adicionado.
• Isto é uma aplicação do princípio de Le Châtelier:
C aF 2 (s)
C a 2 + (aq) + 2F - (aq)
• À medida que se adiciona F- (do NaF, por exemplo), o
equilíbrio desloca-se no sentido contrário ao aumento.
• Conseqüentemente, forma-se CaF2(s) e ocorre uma
precipitação.
• À medida que se adiciona NaF ao sistema, a solubilidade
do CaF2 diminui.
EXERCÍCIOS
1. Calcule a solubilidade molar de CaF2 a 25 oC em que:
a) Apresenta 0,001 mol de Ca(NO3)2em 1000 mL;
b) Apresenta 0,005 mol NaF em 500 mL