A relação entre as reações químicas e a corrente
elétrica é estudada por um ramo da química
chamado
ELETROQUÍMICA
Quando
Quandouma
umareação
corrente
química
elétrica
de
provocaespontânea,
uma
óxido redução,
reação
química
teremos
umauma
produz
energia
elétrica
teremos
PILHAELETRÓLISE
ELETROQUÍMICA
Esta pilha baseia-se na seguinte reação:
Zn + CuSO4
Cu + ZnSO4
ou, na forma iônica
**
Zn
+
Cu2+
Cu +
Zn2+
ELÉTRONS
DANIELL percebeu que estes elétrons poderiam ser
transferidos do Zn para os íons Cu2+
por um fio condutor externo e, este movimento produzir uma
E isto seria possível montando
um esquema do tipo representado a seguir
ELÉTRONS
PONTE SALINA
ÂNIONS
Zn2+
Zn2+
Zn2+
Zn2+
CÁTIONS
Cu2+
Cu2+
Cu2+
Cu2+
Nas soluções
teremos
aa
passagem
dos
em
excesso, de
À eletrodo
medida
que
reação
vai íons,
ocorrendo
O
de
zinco
vai se desgastando
com
eletrodo
de CuSO
cobre
terá
sua
massa
aumentada
A solução
AO
solução
de ZnSO
de
4 vai
4 vai
ficando
ficando
mais
mais
concentrada
diluída
o
passar
do
tempo
um
lado
para
o
outro
através
da
ponte
salina
poderemos fazer as seguintes observações
ELÉTRONS
PONTE SALINA
ÂNIONS
CÁTIONS
Zn2+
Zn2+
Zn2+
Zn2+
Zn2+
Zn2+
Zn2+
Zn2+
Cu2+
Cu2+
Cu2+
Cu2+
Neste processo teremos,
simultaneamente,
a ocorrência das seguintes reações:
Zn
Zn2+ +
Cu2+ +
Zn
2e
+ Cu2+
–
2e
–
(semi-reação de oxidação)
Cu (semi-reação de redução)
Zn2+
+ Cu
(reação global)
O pólo onde
chegam
de onde
saem os
os elétrons
elétrons ocorrendo
ocorrendo aa
redução chama-se
oxidação
chama-se
CATODO
correspondeao
aoPÓLO
PÓLONEGATIVO
POSITIVO
ANODO eecorresponde
ELÉTRONS
ÂNODO
CÁTODO
PONTE SALINA
CÁTIONS
Zn2+
Zn2+
Zn2+
Zn2+
+
Cu2+
Cu2+
Cu2+
Cu2+
REPRESENTAÇÃO DE UMA PILHA
Uma pilha, segundo a IUPAC,
deve ser representada da seguinte forma:
0
M1
x+
M1
y+
M2
0
M2
Para a pilha de DANIELL
Zn0
Zn2+
Cu2+
Cu0
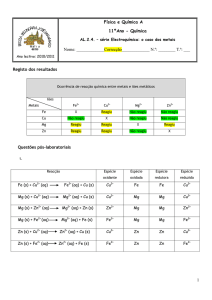
01) Observando a pilha abaixo, responda:
Co
Co2+
Au3+
Au
a) Quais as semi-reações?
Co – 2 e Au3+ + 3 e -
Co2+
semi-reação de oxidação
Au
semi-reação de redução
b) Qual a reação global?
3 Co
2e – 6
2 Au3+ + 3
6 e3 Co + 2 Au3+
3 Co2+
2 Au
3 Co2+ + 2 Au (reação global)
Co
Co2+
Au3+
c) Quem sofre oxidação?
Co
d) Quem sofre redução?
Au3+
Au
e) Qual o eletrodo positivo ou cátodo?
Au
f) Qual o eletrodo negativo ou ânodo?
Co
g) Que eletrodo será gasto?
Co
h) Qual dos eletrodos terá a sua massa aumentada?
Au
Os metais que fazem parte de uma reação
de óxido-redução
têm uma tendência a
CEDER ou RECEBER ELÉTRONS
Essa tendência é determinada pelo
potencial de eletrodo (E),
medido em volts (V)
Quanto maior for a medida
do potencial de oxidação,
maior é a tendência
do metal ceder elétrons
Quanto maior for a medida
do potencial de redução,
maior é a tendência
do metal ganhar elétrons
Este potencial, em geral, é medido a
1 atm, 25°C e solução 1 mol/L
Sendo assim, nestas condições,
Chamado de
POTENCIAL NORMAL DE ELETRODO (E°)
Esse potencial é medido tomando-se como
referencial um eletrodo de hidrogênio,
que tem a ele atribuído o potencial “0,00 V”
TABELA DE
POTENCIAIS-PADRÃO DE REDUÇÃO
(1 atm e 25°C)
Para a pilha de Daniell os potenciais são:
Zn2+
+ 2e
Cu2+
+ 2e
–
–
Zn
E°red = – 0,76 V
Cu
E°red = + 0,34 V
Como o cobre tem um maior potencial normal de redução
ele vai ganhar elétrons, sofrendo redução,
e o zinco vai perder elétrons, sofrendo oxidação
Cu2+
+ 2e
Zn
Zn + Cu2+
Cu
–
Zn2+
+ 2 e–
Zn2+ + Cu
E°red = + 0,34 V
E°oxi = + 0,76 V
ΔE = + 1,10 V
01) Conhecendo as seguintes semi-reações e os seus potenciais
padrão de redução abaixo, determine a “ d.d.p “ da pilha formada
pelos eletrodos indicados:
Sn2+
+
2e
Ag1+
+
1e
a) + 0,54 V.
–
Sn
E° = – 0,14 V
Ag
E° = + 0,80 V
O potencial de redução da prata
b) + 0,66 V.
é maior que o do estanho
c) + 1,46 V.
d) + 0,94 V.
–
A prata sofre redução e o estanho sofre oxidação
e) + 1,74 V.
2 Ag1+
Sn
+ 1
2e
2 Ag
–
Sn2+
+
2e
–
E° = + 0,80 V
E° = + 0,14 V
+ 0,94 V
02)(Covest-2006) O ácido ascórbico, mais conhecido por vitamina C,
é uma substância que apresenta atividade redox. Sendo o
potencial de redução do ácido ascórbico, em pH = 7, igual a 0,06 V,
podemos compará-lo com outras substâncias conhecidas, cujos
potenciais de redução a pH = 7 são também apresentados:
O2
(g)
+ 4e- +
(aq)
(aq)
+
(aq)
e-
+
Fe3+
H+
H+
2e-
H2O (l)
E° = 0,816 V
Fe2+
E° = 0,77 V
H2 (g)
E° = – 0,42 V
(aq)
Com base nessas informações, podemos afirmar que o ácido
ascórbico deve ser capaz de:
Ácido ascórbico: E = 0,06 V (redução)
a) reduzir o íon Fe3+
b) oxidar o íon Fe2+
c) oxidar o O2.
d) reduzir a água.
e) oxidar o íon H+
03) Considere as seguintes semi-reações e os potenciais
normais de redução:
Ni
2+
+ 2 e–
Ni
E
0
= – 0,25 V
Au
3+
+ 3 e–
Au
E
0
= + 1,50 V
O potencial da pilha formada pela junção dessas duas
semi-reações é:
a) + 1,25 V.
b) – 1,25 V.
c) + 1,75 V.
d) – 1,75 V.
e) + 3,75 V.
2 Au
3 Ni
2 Au
3+
3+
6e –
+3
2 Au
3 Ni
2+
+ 3 Ni 2 Au
6 e–
+ 2
3+
+ 3 Ni
E
0
= + 1,50 V
E
0
= + 0,25 V
E
0
= + 1,75 V