LCB 208 - BIOQUIMICA
Carboidratos
Introdução
•
Mais da metade do carbono orgânico do planeta está
armazenado em apenas duas moléculas de carboidratos:
amido e celulose.
•
Ambos são polímeros do monômero glicose,
diferenciando-se apenas pela forma na qual estão ligados.
• A glicose, oxidada em CO2 e H2O, é nossa fonte primária
de energia.
• A celulose, o componente principal das paredes celulares
(células vegetais) e de algodão e madeira, é um polímero
cujos monômeros encontram-se no mesmo plano.
Monossacarídeos - Introdução
• Existem aldoses com 4C (aldotetroses), 5C
(aldopentoses), 6C e 7C. O mesmo vale para as cetoses
(cetotetroses, cetopentoses…)
• Açúcares de 6C são os mais abundantes na natureza,
mas açúcares de 5C, ribose e desoxirribose, ocorrem no
RNA e DNA, respectivamente.
Monossacarídeos - Estereoisomeria
• Estereoisômeros com imagens especulares são também
chamados de enantiômeros (ex: L-gliceraldeído e Dgliceraldeído).
• Açúcares de 6C são os mais abundantes na natureza,
mas açúcares de 5C, ribose e desoxirribose, ocorrem no
RNA e DNA, respectivamente.
• Pode ser um polihidróxi-aldeído (aldose) ou uma
polihidroxi-cetona (cetose).
• Esquemas de representação: Projeção de Fischer e
Projeção de Haworth.
Monossacarídeos – Projeção de Fischer
• Cunhas pontilhadas e triângulos sólidos.
» Ligações horizontais são aquelas projetadas para a
frente do plano do papel, e as verticais representam
projetadas para trás do plano.
» O carbono mais oxidado é designado C-1. Os
demais átomos de C estão numerados a partir desse
carbono.
Monossacarídeos – Projeção de Fischer
• Na configuração D, o grupo hidroxila está à direita do
carbono quiral de maior número, ao passo que, na
configuração L, está à esquerda.
• Número de estereoisômeros possíveis: 2nº
de carbonos
quirais
• Quando os isômeros não se sobrepõem e nem são
imagens especulares uns dos outros são chamados de
diasteroisômeros.
Projeção de Fischer para uma
aldose e para uma cetose
Monossacarídeos – Projeção de Fischer
• Os diasteroisômeros que se diferem uns dos outros na
configuração em somente um C quiral são chamados de
epímeros.
• Alguns dos estereoisômeros possíveis são muito mais
comuns na natureza que outros (ex: açúcares D são
mais abundantes que açúcares L).
Epímeros
Monossacarídeos – Estruturas cíclicas
• A ciclização acontece como resultado de interação
entre carbonos distantes, tais como C-1 e C-5, para
formar um hemiacetal. Uma outra possibilidade é a
interação entre C-2 e C-5 para formar um hemicetal.
• O carbono carbonílico torna-se um novo centro quiral
chamado carbono anomérico.
• O açúcar cíclico pode assumir duas formas diferentes:
α e ß, denominados anômeros.
Monossacarídeos – Estruturas cíclicas
• Segundo a projeção de Fischer, o anômero α de um
açúcar D tem o grupo OH anomérico representado à
direita do C anomérico, e no ß, à esquerda.
• Pode haver interconversão entre as formas α e ß. A
formação de um ou de outro depende da reação
bioquímica.
Monossacarídeos – Projeção de Haworth
• Representa mais fielmente a configuração total das
moléculas. Mostra desenhos em perspectiva como anéis
planares de 5 ou 6 elementos.
» 5 elementos: furanose
» 6 elementos: piranose (cadeira)
• Para um açúcar D, qualquer grupo à direita de um C
na projeção de Fischer fica dirigido para baixo, e aqueles
à direita ficam para cima.
• Grupo terminal –CH2OH apontando para cima
Monossacarídeos – Reações – Óxido Redução
• A oxidação do açúcar fornece energia para a realização
dos processos vitais dos organismos.
• A oxidação (completa) fornece CO2 e H2O. O oposto
desta oxidação é o que ocorre na fotossíntese.
• As aldoses são chamadas açúcares redutores, pois,
quando um aldeído é oxidado, os agentes oxidantes
devem ser reduzidos.
• Cetoses também atuam como açúcares redutores, pois
se isomerizam a aldoses.
Monossacarídeos – Reações – Óxido Redução
• Além de açúcares oxidados, há açúcares reduzidos
importantes, como os desoxiaçúcares, onde um grupo
OH é substituído por um átomo de H (ex: D-2
desoxirribose).
B-D-Desoxirribose
Monossacarídeos – Reações – Esterificação
• Os grupos hidroxila, reagindo com ácidos, podem
formar ésteres.
• Os ésteres de fosfato são freqüentemente formados
pela transferência de um grupo Pi do ATP para formar
um açúcar fosforilado e ADP (metabolismo).
Monossacarídeos – Reações – Formação de
glicosídeos
• Um açúcar com um grupo OH ligado a um C
anomérico pode reagir com outra hidroxila para formar
uma ligação glicosídica (R-C-R’).
• Uma ligação glicosídica não é um éster, pois os
glicosídeos podem ser hidrolizados nos álcoóis originais.
Monossacarídeos – Reações – Formação de
glicosídeos
•
As
ligações
glicosídicas
entre as unidades
monossacarídicas são a base para a formação de oligo e
polissacarídeos.
• As ligações glicosídicas podem ter várias formas, pois
o C anomérico de um açúcar pode estar ligado a
qualquer um dos grupo OH de um segundo açúcar para
formar uma ligação α ou ß glicosídica.
• Os grupos OH são numerados e o esquema de
numeração segue o dos átomos de C nos quais estão
ligados.
Monossacarídeos – Reações – Formação de
glicosídeos
• A notação para a ligação glicosídica especifica qual
forma anomérica do açúcar (α ou ß) é a que está
envolvida na ligação e também quais átomos de C estão
ligados.
Formação da ligação glicosídica (ex: maltose)
As figuras mostram as
ligações glicosídicas e
sua
relação
com
a
formação de estruturas
ramificadas.
Monossacarídeos – Reações – Formação de
glicosídeos
• A natureza química de oligo e polissacarídeos depende
de quais monossacarídeos estão reunidos e da ligação
glicosídica em si.
• Os C anoméricos internos não estão livres para
participar das reações de açúcares redutores.
Monossacarídeos – Reações – Aminoaçúcares
• Nesse tipo de açúcares, um grupo OH do açúcar
parental é substituído pelo grupo amino (-NH2) ou um
de seus derivados.
• Dois exemplos importantes: N-acetil-ß-glicosamina e
seu ácido derivado N-acetil-ß-murâmico.
• Os dois exemplos acima são componentes da parede
celular de bactérias.
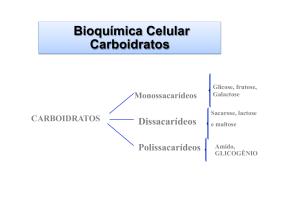
Oligossacarídeos
• Dissacarídeos importantes: sacarose, lactose e maltose.
• sacarose: α-D-glicose + ß-D-frutose
(aldohexose)
(cetohexose)
Ligação glicosídica: α , ß(1 → 2)
Não é um açúcar redutor (2 grupos anoméricos
envolvidos na ligação), apesar de a glicose e a frutose
serem redutores.
Estrutura da Sacarose
Oligossacarídeos
• lactose: ß-D-galactose + D-glicose (epímeros-C4)
Ligação glicosídica: ß(1 → 4)
Como o carbono anomérico não está envolvido na
ligação, a glicose assume tanto a forma α quanto a ß e
está livre para reagir com agentes oxidantes.
• maltose: D-glicose + D-glicose (hidrólise do amido)
Ligação glicosídica : α (1 → 4)
• celobiose: D-glicose + D glicose (hidrólise da celulose)
Ligação glicosídica: ß (1 → 4)
DISSACARIDEOS
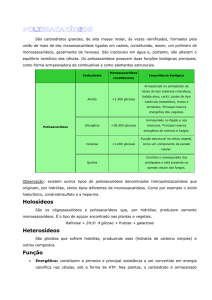
Polissacarídeos
• Homo ou Heteropolissacarídeos
• Uma caracterização completa de polissacarídeos inclui
a especificação de quais monômeros estão presentes, a
seqüência dos mesmos e também o tipo de ligação
glicosídica envolvida.
• Principais polissacarídeos:
- Celulose
- Amido
- Glicogênio
- Quitina
Polissacarídeos - Celulose
• É o principal componente estrutural das plantas,
especialmente de madeira e plantas fibrosas.
• É um homopolissacarídeo linear de ß-D-glicose, e
todos os resíduos estão ligados por ligações glicosídicas
ß (1 → 4).
• Cadeias individuais reunidas por pontes de H, que dão
às plantas fibrosas sua força mecânica.
• Os animais não possuem as enzimas celulases que
atacam as ligações ß, que são encontradas em bactérias
incluindo as que habitam o trato digestivo dos cupins,
animais de pasto, como gado e cavalo.
LIGAÇÕES BETA I,4GLICOSIDICAS
Estrutura polimérica da celulose. Longas cadeias que
podem se unir por pontes de Hidrogenio.
Polissacarídeos - Amido
• São polímeros de α-D-glicose, que ocorrem nas
células de plantas.
• Podem ser distinguidos uns dos outros pelo grau de
ramificação da cadeia. Ex: a ligação da amilose é α (1 → 4)
e a da amilopectina α (1 → 6).
• Enzimas que hidrolisam o amido: α e ß amilase, que
atacam as ligações α (1 → 4), e enzimas
desramificadoras, que degradam α (1 → 6).
SINTESE DO AMIDO NO
CLOROPLASTO
AMILOSE
AMILOPECTINA
Polissacarídeos - Glicogênio
• São polímeros de α-D-glicose, que ocorrem em animais,
sendo uma forma de armazenamento de energia.
• Possui cadeia ramificada, com ligações (1 → 4) e α (1 → 6)
nos pontos de ramificação.
• A glicogênio-fosforilase remove unidades de glicose do
glicogênio (uma por vez) a partir do final não-redutor.
Polissacarídeos – Quitina
• É semelhante à celulose, em estrutura e função, com
resíduos ligados por ligações glicosídicas ß (1 → 4).
• Difere-se da celulose na natureza de monossacarídeos; na
celulose o monômero é a ß-D-glicose, e na quitina o
monômero é a N-acetil- ß-D-glicosamina.
• Possui papel estrutural e apresenta boa resistência
mecânica (filamentos individuais unidos por pontos de
H).
Glicoproteínas
• As glicoproteínas contêm resíduos de carboidratos
além da cadeia polipeptídica (ex: anticorpos).
• Os carboidratos também atuam como determinantes
antigênicos, que os anticorpos reconhecem e aos quais
se ligam.
• As distinções entre os grupos sangüíneos dependem
das porções oligossacarídicas das glicoproteínas na
superfície dos eritrócitos.
• Em todos os tipos sangüíneos, a porção
oligossacarídica contém L-fucose (desoxiaçúcar).
Os diversos tipos sangüíneos se diferenciam pela porção
oligossacarídica das glicoproteínas na superfície dos eritrócitos,
que atuam como determinantes antigênicos. Em todos os tipos
sangüíneos o açúcar L-fucose está presente.
celulose
quitina
FIM