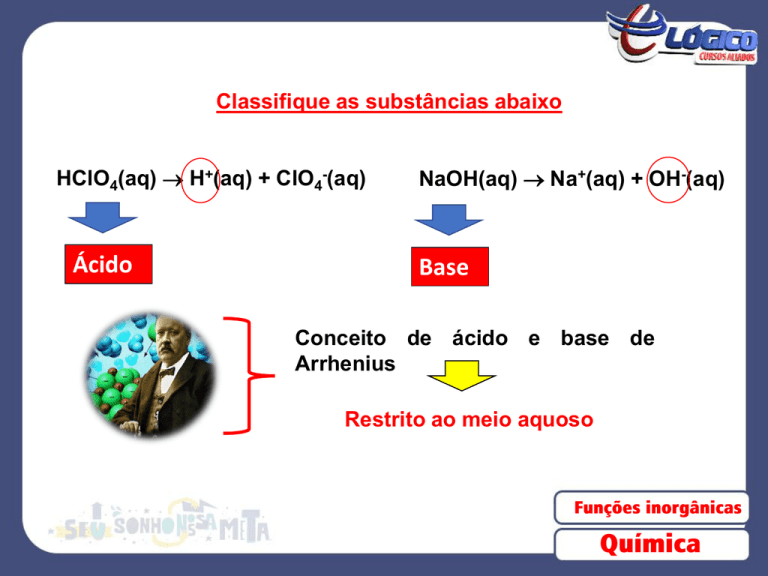
Classifique as substâncias abaixo
HClO4(aq) H+(aq) + ClO4-(aq)
Ácido
NaOH(aq) Na+(aq) + OH-(aq)
Base
Conceito de ácido e base de
Arrhenius
Restrito ao meio aquoso
Classifique as substâncias abaixo como ácido ou base
HClO4 + H2SO4 H3SO4+ + ClO4ácido
base
AlCl3 + Cl- AlCl4ácido
Teorias modernas de ácido-base
Brosted-Lowry
Lewis
base
Teoria de Brönsted-Lowry
Ácido é toda substância capaz de doar próton, H+.
Base é toda substância capaz de receber próton, H+.
H+
H+
HCl + CH3OH CH4OH+ + Clácido
base
ácido
Pares conjugados
Diferem por um H+
base
HClO 4 H2SO 4 ClO -4 H3SO 4
ácido
base
base
ácido
HCN(aq) H2O(l) H3O (aq) CN -(aq)
ácido
base
ácido
base
NH3(aq) H2O(l) NH4(aq) OH-(aq)
base
ácido
ácido
H2O Anfiprótica
base
Teoria de Lewis
As bases de Lewis – substâncias doadoras de pares eletrônicos
Os ácidos de Lewis–substâncias receptoras de pares eletrônicos
base
ácido
Nucleófilo
Eletrófilo
Ag+
+
ácido
NH3
[Ag(NH3)2]+
base
1) Uma vez que ácidos de Lewis são espécies que podem
receber pares de elétrons, então, todos os íons positivos são,
segundo esse conceito, ácidos, já que atraem elétrons
AlCl 3 Cl - AlCl -4
ácido
base
2) Por outro lado, todos os íons negativos são bases de
Lewis, porque uma vez com excesso de elétrons, podem
fornecê-los aos ácidos para formar ligações.
HCN(aq) H2O(l) H3O (aq) CN-(aq)
ácido
Arrhenius
Bronsted-Lowry
Lewis
Mas o que um sal ?
Do ponto de vista prático. Os sais apresentam como principal
característica o sabor salgado:
Sal de cozinha
Bicarbonato de sódio
Permanganato de potássio
Mas será que, além do sabor, existe
outra forma de definir um sal?
HCl(aq) NaOH(aq) NaCl(aq) H2O(l)
HMnO4(aq) KOH(aq) KMnO4(aq) H2O(l)
NaCl(aq) Na (aq) Cl -(aq)
KMnO4(aq)
Pode ser definido
como o produto de
uma neutralização
Em meio aquoso sofrem
dissociação
-
K (aq) MnO4 (aq)
Cátions ≠ H+
Ânions ≠ OH-
Classificação dos sais
• Sal normal
Neutralização total (H+ = OH-)
HNO3(aq) NaOH(aq) NaNO3(aq) H2O(l)
H2SO 4(aq) 2KOH(aq) K 2SO 4(aq) 2H2O(l)
• Hidrogenossal
Neutralização parcial ácida (H+ > OH-)
H2SO 4(aq) KOH(aq) KHSO 4(aq) H2O(l)
• Hidroxissal
HCl
Neutralização parcial básica (H+ < OH-)
(aq)
Al(OH)3(aq) Al (OH ) 2 Cl(aq) H 2O(l)
Nomenclatura dos sais
HCl(aq) NaOH (aq) NaCl(aq) H 2O(l)
Ácido clorídrico
Hidróxido de sódio
ácido
base
Nome do ânion
de
Nome do cátion
oso - ito
Cloreto de sódio
NO3
Nitrato
SO4
2
Sulfato
PO4
3
Fosfato
Ídrico - eto
ico - ato
CO3
2
Carbonato
Cl
Cloreto
Sal
hidratado
NaNO3
Nitrato de sódio
K 3 PO4
fosfato de potássio
NaHCO3
Monohidrogeno carbonato de sódio
Fe2 (SO4 )3
Sulfato de ferro III
CaSO4 2 H 2O
Al (OH ) 2 F
Carbonato de sódio
Sulfato de cálcio dihidratado
Dihidroxifluoreto de alumínio
Na CO3
2
Na2CO3
Algumas
substâncias
são
capazes de absorver facilmente
a água do ambiente e, por isso,
são
classificados
como
substâncias higroscópicas.
O cloreto de cálcio, CaC2, por exemplo, é vendido como
“antimofo”, pois absorve água, transformando-se no cloreto de
cálcio dihidratado.
Caráter ácido e básico dos sais
• Sal neutro
Ácido forte e base forte
HNO3(aq) NaOH (aq) NaNO3(aq) H 2O(l)
• Sal ácido
Ácido forte e base fraca
3H 2SO4 ( aq ) 2 Al (OH ) 3( aq ) Al2 ( SO4 )3( aq ) 6 H 2O(l )
• Sal básico
Ácido fraco e base forte
H 2CO3( aq ) NaOH ( aq ) NaHCO3( aq ) 6 H 2O(l )
Solubilidade dos sais
Sais solúveis
NaNO3
K 3 PO4
Sais insolúveis
CaCO3
AgCl
A solubilidade dos
sais
depende
do
cátion e do ânion.
Todos os sais dos metais alcalinos são solúveis
HCN
KOH
KCl
NH3
H2 O
Soluções
eletrolíticas
ácido HCN(aq) + H2O(l) H3O+(aq) + CN-
Ionização
base KOH(aq) K+(aq) + OH-
≠ H+ ≠ OHsal KCl(aq) K+(aq) + Clbase NH3(aq) + H2O(l) NH4+(aq) + OH-
Conceito de ácido e base de Arrhenius
Dissociação
Ionização
Mas o que um óxido ?
Composto binário onde o oxigênio é elemento
mais eletronegativo.
CO2
SO3
CaO
Na2O
Classificação
Tipo de ligação
comportamento
Classificação dos Óxidos quanto a ligação
SO3
CO2
CaO
Óxidos moleculares
Na2O
Óxidos iônicos
YO
XO
Eletronegatividade
Ametal
E
Metal
E
Nomenclatura dos Óxidos
Óxidos moleculares
Mono
Di
Tri
...
+
óxido
de
Mono
Di
Tri
...
Nome do
elemento
SO3
Trióxido de enxofre
NO2
dióxido de nitrogênio
N 2O5
Pentóxido de dinitrogênio
Nomenclatura dos Óxidos
Óxidos iônicos
óxido
Al2O3
de
óxido de alumínio
CaO
Nome do elemento
Fe2O3
óxido de cálcio
Óxido de ferro III
Classificação dos Óxidos quanto ao comportamento
Óxidos básicos
Se comportam como base
Óxido básico + água base
Óxido básico + ácido sal + água
CaO(g) H 2O(l) Ca(OH ) 2(aq)
CaO(s) H 2 SO4 ( aq) CaSO4(s) H 2O(l )
Como identificar
XO
metal com nox
baixo
Na2O
MgO
CrO
Classificação dos Óxidos quanto ao comportamento
Óxidos ácidos
Se comportam como ácido
Óxido ácido + água ácido
Óxido ácido + base sal + água
CO2(g) H 2O(l) H 2CO3(aq) CO2(g) Ca(OH ) 2 ( aq) CaCO3(s) H 2O(l )
Como identificar
XO
Ametal ou metal
com nox alto
SO2
NO2
H 2 SO4 H 2O SO3
CrO3
Anidrido
Sulfúrico
Classificação dos Óxidos quanto ao comportamento
Óxidos neutros
Não reagem com ácidos, bases e água
CO
NO
N 2O
CO
NO
N N O
Ligações difíceis de serem quebradas
Os óxidos neutros
podem reagir com o
oxigênio
2CO( g ) O2 ( g ) 2CO2 ( g )
Classificação dos Óxidos quanto ao comportamento
Óxidos anfóteros
reagem com ácidos e bases formando sal e água
Al2O3(s) 3H 2 SO4 ( aq) Al2 ( SO4 ) 3(s) 3H 2O(l )
Al2O3(s) 2 NaOH ( aq) 2 NaAlO2(s) H 2O(l )
Como identificar
ZnO
PbO
SnO2
Fe2O3
Classificação dos Óxidos quanto ao comportamento
O22
Peróxidos
Como identificar
XO2
Metal (1A ou 2A)
Na2O2
K 2O2
CaO2
BaO2
Peróxido
de sódio
Peróxido
de potássio
Peróxido
de cálcio
Peróxido
de bário
Na2O2 H 2O 2 NaOH H 2O2
Na2O2 2 HCl 2 NaCl H 2O2
A Classificação dos óxidos e a tabela periódica
Óxidos ácidos
Óxidos básicos
Li
Óxidos anfóteros
N
Si
P
Na
Mg
K
Ca
Rb
Sr
Sn
Cs
Ba
Pb
Fr
Ra
Cr
Mn
Al
C
S
Cl
Br
Zn
I