UNIVERSIDADE FEDERAL DE CIÊNCIAS DA SAÚDE DE PORTO ALEGRE
PROGRAMA DE PÓS-GRADUAÇÃO EM MEDICINA: HEPATOLOGIA
FATORES PROGNÓSTICOS DA HEPATECTOMIA POR METÁSTASE DE CÂNCER
COLORRETAL.
SERGIO LÓPEZ TÓRREZ
PORTO ALEGRE, BRASIL
2010
UNIVERSIDADE FEDERAL DE CIÊNCIAS DA SAÚDE DE PORTO ALEGRE
PROGRAMA DE PÓS-GRADUAÇÃO EM MEDICINA: HEPATOLOGIA
FATORES PROGNÓSTICOS DA HEPATECTOMIA POR METÁSTASE DE CÂNCER
COLORRETAL.
SERGIO LÓPEZ TÓRREZ
Dissertação apresentada ao Curso de PósGraduação em Medicina: Hepatologia da
Universidade Federal de Ciências da Saúde
de Porto Alegre
Orientador: Profº. Dr. Antônio Nocchi Kalil
Co-orientador: Profª. Dra Gabriela Coral
PORTO ALEGRE / BRASIL
2010
Dedicatória
A minha família:
Scarlett maravilhosa esposa, amor
incondicional. Este sucesso é teu.
Grace Stephanie, alegria imensa, dedicação e
amor.
Andre Lucia, filha de amor, vontade e força do
céu.
A minha Mãe e Irmãos, força, carinho e
compreensão.
A meus sogros por seu incansável apoio.
A memória do meu pai e de Elizabet.
Agradecimentos
A minhas famílias pelo seu amor e apoio.
A meu professor, orientador e amigo Dr.
Antonio Nocchi Kalil pela grande
oportunidade brindada na minha realização
pessoal e profissional.
Ao professor e amigo Dr. Angelo de Mattos
pela ajuda na aprendizagem da Hepatologia.
A Dra. Gabriela Coral, pela colaboração e
participação neste trabalho e seu ensinos na
patologia.
Aos Professores e colegas do Hospital Santa
Rita.
A Dra. Maria Eugenia Pinto e Eduardo Leite
pela revisão e análise dos dados.
IV
SUMÁRIO
LISTA DE ABREVIATURAS E SIGLAS ...................................................................05
LISTA DE TABELAS .................................................................................................06
LISTA DE FIGURAS .................................................................................................07
RESUMO ...................................................................................................................08
ABSTRACT ...............................................................................................................10
1 INTRODUÇÃO .......................................................................................................11
2 RESSECÇÃO CIRÚRGICA ...................................................................................12
3 QUIMIOTERAPIA...................................................................................................17
4 JUSTIFICATIVA .....................................................................................................19
5 OBJETIVOS ...........................................................................................................21
5.1 OBJETIVO PRINCIPAL .......................................................................................21
5.2 OBJETIVOS SECUNDÁRIOS .............................................................................21
6 METODOLOGIA ....................................................................................................22
6.1 DELINEAMENTO DO ESTUDO ..........................................................................22
6.2 CASUÍSTICA .......................................................................................................22
6.3 CRITÉRIOS DE INCLUSÃO ...............................................................................23
6.4 CRITÉRIO DE EXCLUSÃO .................................................................................23
6.5 TAMANHO E TIPO DA AMOSTRA ......................................................................23
6.6 LISTA DAS VARIÁVEIS .......................................................................................24
6.7 MÉTODO DE COLETA DE DADOS ....................................................................24
6.8 CONSIDERAÇÕES ÉTICAS ...............................................................................24
6.8.1 Processamento e Análise dos dados ...........................................................25
7 RESULTADOS .......................................................................................................29
7.1 RESULTADOS GERAIS ......................................................................................29
7.2 RESULTADOS NA SOBREVIDA E FATORES PROGNÓSTICOS ......................31
8 DISCUSSÃO ..........................................................................................................44
9 CONCLUSÕES ......................................................................................................49
REFERÊNCIAS .........................................................................................................50
ARTIGO.....................................................................................................................60
ANEXOS ...................................................................................................................80
V
LISTA DE ABREVIATURAS E SIGLAS
CEA: Antígeno Carcinoembrionário
CCR: Carcinoma colorretal
MCCR: Metástases do carcinoma colorretal
MH: Metástases hepáticas
RH: Ressecção hepática
TC: Tomografia computadorizada
RM: Ressonância magnética
PET scans: positron emission tomography
FU: 5- fluoracil
AIH: Quimioterapia arterial intra-hepática
RF: Radiofreqüência
TNM: estadiamento tumoral (tamanho, linfonodos e metástases).
UTI: Unidade de Terapia Intensiva
VI
LISTA DE TABELAS
TABELA 1. Características Clínico-biológicas, dos Pacientes submetidos à
Hepatectomia por MCCR (n=137)...........................................................................26
TABELA 2. Uso de Quimioterapia e Radioterapia Pré-operatória nos Pacientes
submetidos à Hepatectomia por MCCR (n=137). .................................................26
TABELA 3. Resultados Peri-operatórios dos Pacientes submetidos à
Hepatectomia por MCCR (n=137)...........................................................................27
TABELA 4. Tipo de Procedimentos associados e Complicações nos Pacientes
submetidos à Hepatectomia por MCCR (n=137). .................................................28
TABELA 5. Características anatomopatológicas dos Pacientes submetidos à
Hepatectomia por MCCR (n=137)...........................................................................29
TABELA 6. Análise Univariada dos possíveis Fatores Prognósticos nos
Pacientes submetidos à Hepatectomia por MCCR (n= 137)................................31
TABELA 7. Fatores Prognósticos nos Pacientes submetidos à Hepatectomia
por MCCR (n=137) ...................................................................................................38
VII
LISTA DE FIGURAS
FIGURA 1. Sobrevida Global após Hepatectomia por MCCR (n=137). ...............30
FIGURA 2. Sobrevida estratificada por gênero nos Pacientes submetidos à
Hepatectomia por MCCR (n=137)...........................................................................32
FIGURA 3. Sobrevida estratificada por idade nos Pacientes submetidos à
Hepatectomia por MCCR (n=137)...........................................................................32
FIGURA 4. Sobrevida segundo nível sérico do CEA nos Pacientes submetidos
à Hepatectomia por MCCR (n=137)........................................................................33
FIGURA 5. Sobrevida estratificada pelo intervalo de aparição das metástases
após o diagnóstico do CCR. (n=137). ....................................................................34
FIGURA 6. Sobrevida segundo uso da Quimioterapia neo-adjuvante nos
Pacientes submetidos à Hepatectomia por MCCR (n=137).................................34
FIGURA 7. Sobrevida de acordo ao comprometimento hepático nos pacientes
submetidos à Hepatectomia por MCCR (n=137). .................................................35
FIGURA 8. Sobrevida segundo as lesões únicas vs múltiplas nos Pacientes
submetidos à Hepatectomia por MCCR (n=137). .................................................35
FIGURA 9. Sobrevida estratificada pelo grau de diferenciação da metástase
nos Pacientes submetidos à Hepatectomia por MCCR (n=137). .......................36
FIGURA 10. Sobrevida segundo a presença de complicações peri-operatórias
nos Pacientes submetidos à Hepatectomia por MCCR (n=137). ........................37
FIGURA 11. Sobrevida segundo o período de realização da RH nos Pacientes
com MCCR (n=137)..................................................................................................37
8
RESUMO
O fígado é o órgão mais frequentemente acometido pelas metástases do
câncer colorretal (CCR), as quais ocorrem em até 65% dos pacientes, embora a
ressecção hepática seja factível em apenas 25% dos casos. Entre os tratamentos
curativos, a cirurgia oferece o melhor prognóstico, com sobrevida entre 30-60% em
cinco anos. O objetivo do estudo foi avaliar a sobrevida e os fatores prognósticos
dos pacientes submetidos à ressecção hepática por metástases de CCR. Trata-se
de uma coorte histórica de 173 pacientes operados entre novembro 1993 e março
2008, no Centro de Câncer do Hospital Santa Casa da Região Sul do Brasil. Foram
excluídos 36 pacientes por: prontuários incompletos, metástases irresecáveis e
ablação por radiofreqüência exclusiva. Foram consideradas as características
clínicas, peri-operatórias e histopatológicas de 137 pacientes. A análise da sobrevida
foi realizada usando o modelo de Kaplan-Meier. O valor de p considerado
estatisticamente significativo foi de 0,05%. A sobrevida global em 1, 3 e 5 anos foi de
82%, 43% e 32,3%, respectivamente, com uma média de 31,7 meses. A mortalidade
peri-operatória foi de 3,6% e o índice de complicações de 23,4%. Na análise
univariada, a sobrevida foi associada ao gênero, idade, nível sérico do CEA, período
de ressecção das metástases, quimioterapia neo-adjuvante, número de lesões,
distribuição das lesões no fígado, grau histológico, complicações peri-operatórias e
década da ressecção hepática. Na análise multivariada, a melhor sobrevida foi
associada ao: gênero feminino (p = 0,007); nível sérico do CEA menor de 100 ng/mL
(p = 0,031); lesão metacrônica (p = 0,011); quimioterapia neo-adjuvante (p = 0,028);
distribuição unilobar, e ausência de complicações pós-operatórias (p = 0.0109).
Conclue-se que a ressecção hepática continua sendo a terapia de escolha nos
9
pacientes com metástases por CCR. Oferece uma boa sobrevida a longo prazo,
sobretudo no gênero feminino, em lesões de distribuição unilobar e na ausência de
complicações no pós-operatório.
Palavras-Chave: Metástases hepáticas, câncer colorretal, fatores prognósticos,
ressecção hepática.
10
ABSTRACT
The liver is the organ most affected by the metastasis of colorectal cancer
(CRC), those occurring in up to 65% of patients, while liver resection is feasible in
only 25% of cases. Among the curative treatments, surgery offers the best prognosis,
with survival between 30-60% at five years. The objective this study was to evaluate
the survival and the prognostic factors of patients undergoing hepatic resection for
metastases from CRC. This is a historical cohort of 173 patients submitted to surgery
by November 1993 to March 2008, at the Cancer Center of the Hospital Santa Casa
from South of Brazil. We excluded 36 patients for the following reasons: incomplete
medical records, patients with unresectable metastases and those who underwent
radiofrequency ablation only. Therefore, we considered the clinical, histopathological
and peri-operative of 137 patients. Analysis of survival was performed using the
Kaplan-Meier model. P of 0.05% was considered statistically significant. The overall
survival at 1, 3 and 5 years was 82%, 43% and 32.3% respectively, with an average
of 31.7 months. Perioperative mortality was 3.6% and 23.4% had complications. In
univariate analysis gender, age, levels of CEA, length of resection of metastases,
neo-adjuvant chemotherapy, number of lesions, distribution of lesions in the liver,
histological grade, peri-operative complications and decade of liver resection were
statistically associated to mortality. In multivariate analysis, survival was associated
with: female gender (p = 0.007), serum levels of CEA less than 100 ng / mL (p =
0.031); parachronism lesion (p = 0,011), neo-adjuvant chemotherapy (p = 0.028) ;
one lobe distribution, and ausence of postoperative complications (p = 0.0109). In
conclusion, hepatic resection remains the therapy of choice in patients with
metastases in CRC, offers a good long-term survival, especially in females, in one
lobe lesions in the absence of postoperative complications.
Key-Words: liver metastases, colorectal cancer, prognostic factors, liver resection.
11
INTRODUÇÃO
1- CENÁRIO GERAL
Os tumores malignos que acometem o cólon e reto, câncer colorretal (CCR),
são responsáveis a cada ano por cerca de 950 mil casos novos, sendo a quarta
causa mais comum de câncer no mundo e a segunda em países desenvolvidos.
Aproximadamente 153,760 norte-americanos são diagnosticados com câncer
colorretal anualmente, dos quais 52,180 morrerão desta doença, a maioria por
doença metastática (JEMAL, 2007).
No Brasil, em 2008, o número de casos novos de câncer colorretal estimado
foi de 12,490 casos em homens e de 14,500 em mulheres, valores que
correspondem a um risco estimado de 13 casos novos a cada 100 mil homens e de
15 para cada 100 mil mulheres. Na região sul do Brasil, o câncer colorretal em
homens é o quarto mais freqüente (21/100,000), e o terceiro nas mulheres
(22/100,000). No Rio Grande do Sul, a estimativa para 2008 foi de 3,060 novos
casos, dos quais se esperavam 670 novos casos em Porto Alegre (INCA).
O fígado é o lugar mais atingido pelas metástases do CCR, ocorrendo em
aproximadamente 65% dos pacientes. Deste, em apenas 25% as metástases são
ressecavéisl no momento do diagnóstico. No mundo ocidental, as metástases
hepáticas representam a principal causa de morbidade e mortalidade nestes
pacientes (PAWLIK, 2008).
Pacientes com metástases hepáticas únicas, pequenas, não tratadas podem
apresentar uma sobrevida em torno de 50% no primeiro ano e praticamente zero aos
dois anos (STEELE, 1991; HESLIN, 2001; SCHINDL, 2005). Portanto, a doença
hepática metastática do câncer colorretal representa uma situação de importância
clínica no seu diagnóstico e tratamento.
Os tratamentos locais disponíveis para as metástases hepáticas estão a
ressecção cirúrgica, a ablação local do tumor (aplicação direta de álcool ou ácido
acético na lesão metastática, crioterapia, radiofreqüência), a quimioembolização ou
quimioterapia arterial intra-hepática e a radioterapia. Dentre estes tratamentos,
12
somente a cirurgia está associada com melhora da sobrevida dos pacientes
(NORDLINGER, 2002).
A ressecção hepática considera-se a terapêutica de eleição, com uma
estimativa de sobrevida entre 30% a 45% em cinco anos, dos quais 20% a 30%
estarão livres da doença depois deste período (AZOULAY, 2000; ADAM, 2004).
2- RESSECÇÃO CIRÚRGICA
A ressecção hepática (RH) atualmente é aceita como o único tratamento
potencialmente curativo das metástases hepáticas por CCR. A mortalidade e
morbidade peri-operatória atual está abaixo de 5%, e entre 20% e 30%,
respectivamente (MELENDEZ, 1998; FONG, 1999), fazendo da técnica cirúrgica um
procedimento seguro. A isto, agrega-se o advento de novas drogas na quimioterapia
pré-operatória, permitindo a execução da RH a um maior número de pacientes
(ALOIA, 2006).
A RH oferece uma sobrevida livre de recidiva em cinco anos de 24% a 58%,
(SHEELE, 1995; NORDLINGER, 1996; FONG, 1999; ABDALLA, 2004; WEI, 2006,
TAYLOR, 1997; POSTON, 2005). No entanto, é importante relembrar que
inicialmente somente 20% dos pacientes com metástases hepáticas poderão ser
submetidos à ressecção com potencial curativo. A maioria não é candidato à cirurgia
por diferentes motivos: tamanho do nódulo, posição do tumor, multi-focalidade, ou
inadequada reserva hepática. Não obstante, pelo impacto na sobrevida, a RH tem
sido considerada o tratamento de escolha, quando praticável (HESLIN, 2001).
Ekberg et al. estabeleceram há mais de duas décadas as contra-indicações à
RH, as quais seriam: pacientes com mais de quatro lesões, distribuição bilobar,
presença de metástase extra-hepática, tumores de grande tamanho e nos quais não
seja possível conseguir margens de 1 cm (EKBERG, 1986).
Entretanto, estes critérios, segundo Pawlik, têm sido expandidos devido aos
seguintes avanços: cirurgia mais segura e melhor quimioterapia. A cirurgia pode ser
efetiva na ressecção de múltiplos tumores, proporcionando uma sobrevida
semelhante àqueles com menor número de lesões (PAWLIK, 2008).
13
A ressecção simples das metástases, geralmente designada como
metastasectomia, tem sido associada à maior recidiva que as ressecções
anatômicas, nas quais é removida uma margem de tecido hepático normal (ADAM,
1997). A metastasectomia pode comprometer a vascularidade do tecido hepático
residual, o que às vezes resulta numa técnica mais difícil. Portanto, a hepatectomia
segmentada ou setoretomia (The Brisbane IHPB, 2000) é preferível para as lesões
pequenas e localizadas, já que resulta em maior sobrevida para estes pacientes.
Para metástases grandes ou múltiplas, as ressecções anatômicas garantem
adequadas margens cirúrgicas e, quando necessário, deve-se realizar
procedimentos mais radicais, como a trissetoretomia esquerda ou direita, para obter
melhores margens. Por outro lado, nestes casos, o tamanho e consequente
agressividade do tumor, resultam em pior prognóstico (BISMUTH, 1987; POSTON,
2004).
Atualmente a ressecção tem sido aplicada a pacientes mais idosos, sem
afetar a sobrevida, embora estes apresentem um maior número de co-morbidades,
as quais podem interferir nos resultados operatórios imediatos (ZACHARIAS, 2004).
Quanto ao gênero, alguns autores sugerem melhor sobrevida nas mulheres
em relação aos homens. Ressalve-se que este, no entanto, não deve ser fator
decisivo na indicação do tratamento cirúrgico (HESLIN, 2001; ADAM, 2008).
A localização do tumor primário parece não influenciar o prognóstico dos
pacientes, embora as MH originadas no cólon direito já tenham sido associadas à
pior sobrevida (ROUGIER, 1995).
Por outro lado, o estágio do tumor primário tem uma relação direta com o
prognóstico após a RH. Em estudo de Heslin et al, foi demonstrado que o tumor
pouco diferenciado tem um efeito desfavorável na sobrevida após a ressecção
cirúrgica (HESLIN, 2001), o que também foi sugerido por Poston (POSTON, 2004),
embora em outro estudo a diferenciação histológica não tenha sido fator
independente de sobrevida (GAYOWSKI, 1994).
A invasão linfonodal e o nível sérico do antígeno carcinoembrionário (CEA)
são fatores independentes de mau prognóstico nestes pacientes. (FONG,1997,1999;
BOLTON, 2000; ADAM, 2004; MINAGAWA, 2000;CHEDID, 2003; HERMAN, 2006).
Com relação ao número de metástases, para a maioria dos autores, a lesão
única oferece melhor sobrevida quando comparada a lesões múltiplas (TAYLOR,
14
1997; FONG, 1999; ALOIA, 2006; BUTTE, 2007; JONAS, 2007). Por outro lado, há
quem defenda que a presença de uma, duas ou três lesões não modifica o
prognóstico (ADAM, 2004).
Da mesma forma, a localização unilobar é conveniente para os pacientes
(GAYOWSKY, 1994; BOLTON, 2000; HERMANN, 2006), embora seja razoável
considerar que a presença de múltiplos nódulos, assim como em ambos os lobos
hepáticos não deva contra-indicar a ressecção cirúrgica. Nestes casos, deve-se
avaliar o remanescente hepático com vistas a se evitar a falência hepática no pós operatório (POSTON, 2004; ADAM, 2004).
Em geral, o tamanho da metástase representa maior tempo de crescimento
tumoral. Em decorrência disto, lesões maiores usualmente são expressão de
tumores mais agressivos, com conseqüente pior prognóstico. Para alguns autores,
lesões maiores de 5 cm são associadas com pior prognóstico após a RH
(NORDLINGER, 1996; FONG, 1999); por outro lado há quem discorde desta
assertiva (IRIE, 1999).
As metástases com aparecimento depois dos 12 meses do diagnóstico do
tumor primário são categorizadas como metacrônicas, que diferem das sincrônicas
(menos de 12 meses), as quais apresentam pior prognóstico (FONG, 1999).
Com relação ao aparecimento simultâneo do tumor primário e da metástase
hepática há controversa na literatura quanto ao prognóstico após a RH. A ressecção
simultânea da doença primaria e da metástase seria preferível para melhorar a
expectativa de vida do paciente (DE SANTIBAÑES, 2002). Há autores que sugerem
um pior prognóstico nestes casos em decorrência da dificuldade na detecção das
micro-metástases clinicamente ocultas (SCHEELE, 1995, LAMBERT, 2000).
Portanto, há quem defenda que a cirurgia hepática deva ser realizada de três a seis
meses após a colectomia. Esta estratégia permitiria que o comportamento biológico
da doença metastática pudesse se tornar evidente, melhorando assim a seleção dos
pacientes para ressecção hepática com objetivo curativo (LAMBERT, 2000).
A presença de metástase extra-hepática reduz as probabilidades de melhor
sobrevida, condição clínica que, na maioria das vezes, contra-indica a cirurgia
curativa (SHEELE, 1995; POSTON, 2004), com algumas exceções, tais como:
invasão do diafragma, recorrência de lesões hepáticas ressecáveis, metástases
15
pulmonares ressecáveis, ou invasão local de uma estrutura regional como a
glândula adrenal (NORDLINGER, 1996).
Com relação à margem cirúrgica livre de neoplasia, estudo da década de 80
demonstrou que quando a margem era maior de 10 mm a sobrevida era de até 45%
ao contrário de apenas 23% naqueles com margem menor (HUGHES, 1988).
Recentemente, demonstrou-se que a margem maior de 10 mm não tem diferença
estatística na sobrevida aos 5 e 10 anos quando comparada com margem entre 1 a
9 mm (PAWLIK, 2005). Por outro lado, Kokudo et al. propõe margem mínima de 2
mm (KOKUDO, 2002). Aqueles cirurgiões que tem uma opinião a favor da margem
ampla justificam que a margem estreita está relacionada com incidência maior de
recorrência do tumor (WRAY, 2005).
Quanto ao sangramento peri-operatório as evidências são contraditórias.
Ressecções maiores, devido a grandes lesões, estão associadas a maiores perdas
sangüíneas, sem implicância na sobrevida para alguns autores (GAYOWSKI, 1994),
ao contrário de outros (TAYLOR, 1997).
A infiltração tumoral dos linfonodos do hilo hepático parece contrapor-se à
ressecção curativa, considerando estes casos como uma doença já sistêmica.
Segundo Jaeck et al., a RH com ressecção dos linfonodos melhora a sobrevida em
três anos, embora não melhore em cinco anos. Isto é mais favorável quando se trata
de invasão limitada à tríade portal. (JAECK, 2002; NORDLINGER, 1996).
Quanto à avaliação das lesões hepáticas, a ecografia converteu-se na
ferramenta diagnóstica mais utilizada para o rastreamento destas, além de ser de
grande ajuda no acompanhamento dos pacientes operados por câncer colorretal. A
sensibilidade global da ecografia para a identificação das lesões focais é de 53%, e
de 20% para aquelas que medem menos de 1 cm de diâmetro (KHATRI, 2005).
Na tomografia computadorizada com contraste (TC), as lesões metastáticas
geralmente são nodulares (únicas ou múltiplas), hipovasculares, tendo o aspecto de
imagens hipodensas. Nos casos de esteatose importante, elas podem aparecer com
a mesma densidade do restante do parênquima, ou até mesmo, apresentarem
densidade maior que este. Frequentemente, com o uso do meio de contraste,
obtém-se um realce periférico com a porção central hipodensa (KALIL, 2001).
A ressonância nuclear magnética (RNM) tem uma acurácia maior de 90%
para a distinção entre hemangiomas e metástases após injeção de contraste
16
endovenoso, observando-se uma intensificação anular transitória das imagens em
T1 e esvaziamento periférico com bordo periférico hipodenso (KALIL, 2001).
O PET scan (positron emission tomography) tem sido utilizado, de forma mais
eficaz no acompanhamento pós-operatório ante a suspeita de recidiva
(FERNANDEZ, 2004).
A superioridade do PET scans sobre a TC foi comparada de forma
retrospectiva nos pacientes submetidos a RH. A sensibilidade e a especificidade do
PET scans para identificar as lesões hepáticas foi de 79,9 e 92,3% e para a TC foi
de 82,7 e 84,1%, respectivamente. Da mesma forma, para o diagnóstico da doença
extra-hepática, a sensibilidade e especificidade do PET scan foi de 91,2% e 98,4% e
para a TC foi de 60,9% e 91,1%, respectivamente (WEARING, 2005).
Em casos selecionados, a laparoscopia tem sido usada como um método de
avaliação das metástases, com o intuito de identificar aquelas irresecáveis, o que
acontece num pequeno número de pacientes que não são adequadamente
avaliados nos estudos de imagens (JARNAGIN, 2001).
A ecografia intra-operatória constitui um método efetivo de estudo da
anatomia normal e patológica do fígado e via biliares, assim como a relação das
lesões com principais estruturas vasculares hepáticas. Com relação aos outros
métodos de imagem, o uso da ecografia intra-operatória apresenta maior
sensibilidade e especificidade na identificação de tumores hepáticos primários ou
metastáticos, especialmente para lesões menores do que 1,5 cm. A ecografia intraoperatória pode mudar a conduta cirúrgica até em 33%, devido às informações
adicionais fornecidas durante sua execução (BISMUTH, 1987; GUIMARÃES, 2004).
Em relação à ablação local, a criocirurgia é aplicada na maioria das vezes
como um complemento da RH quando esta não é executável para todas as lesões,
assim como nas contra-indicações da mesma. Esta técnica de ablação permite
alcançar uma sobrevida até de 22 meses nos pacientes com MHCCR (SHEEN,
2002).
Atualmente, a radiofreqüência (RF) tem sido uma técnica de ablação utilizada
com maior freqüência. Pode ser utilizada no transoperatório para o tratamento das
lesões metastáticas não ressecáveis, mas sua aplicação mais eficaz é por via
percutânea no período pré-operatório, conjuntamente com quimioterapia neoadjuvante (LIVRAGHI, 2003; ABDALLA, 2004).
17
Após a ressecção hepática, o acompanhamento deve ser feito com anamnese
e exame físico completo, dosagem do antígeno carcinoembrionário, ecografia
hepática e CT a cada três meses.
Alguns parâmetros clínicos e radiológicos estão relacionados ao risco elevado
de presença de doença extra-hepática oculta, são estes: linfonodo positivo no tumor
primário, intervalo livre de recidiva inferior a 12 meses, múltiplos tumores hepáticos,
tumor único maior >5 cm e nível sérico do antígeno carcinoembrionário >200 ng/mL
no intervalo de um mês após da cirurgia
(SCHEELE,1995; JARNAGIN, 2001).
Quando três a cinco destas variáveis estão presentes há melhor sobrevida com a
terapia combinada (cirurgia e quimioterapia) (FONG, 1999).
Apesar destes tratamentos, aproximadamente 75% dos pacientes apresentam
doença recorrente, sendo que em 20% a 40% recorrem exclusivamente hepática
(ADAM, 2004). Uma nova RH pode ser considerada nos pacientes selecionados que
não têm evidência da doença extra-hepática, nos pacientes com bom estado geral e
naqueles com reserva hepática adequada. A re-ressecção apresenta mortalidade
peri-operatória é semelhante à primeira RH (menor de 5%), e a sobrevida livre de
doença apresenta taxas entre 20 a 43% em dois e cinco anos respectivamente
(ADAM, 1997; NORDLINGER, 1994; SHAW, 2006).
3-QUIMIOTERAPIA
A quimioterapia neo-adjuvante, cada vez mais eficaz, tem sido utilizada no
período pré-operatório, com o intuito de diminuir o tamanho tumoral antes da cirurgia
(downstaging).
As taxas de ressecção em pacientes inicialmente considerados irressecáveis
variam de 12 a 26%. No subgrupo submetido à ressecção, as taxas de sobrevida em
cinco anos são de 30 a 35% (MASI, 2006; ADAM, 2004; ALBERTS, 2005;
DELAUNOIT, 2005; POZZO, 2004; NORDLINGER, 2005).
Alguns pacientes que inicialmente apresentam metástases hepáticas
irresecáveis podem ser submetidos à ressecção depois de receber quimioterapia
neo-adjuvante com 5-Fluoracil (FU) /Leucovorin e Oxaliplatino ou Irinotecan. Nestes
18
casos, em estudo recente, a sobrevida em cinco anos foi de 49%, enquanto que
naqueles com doença multinodular ou com metástases extra-hepáticas foi de 18%
(ADAM, 2004).
Embora este tratamento possa ser associado com uma sobrevida mais longa
em pacientes com doença limitada ao fígado, alguns aspectos devem permitir
melhor inter-relação da quimioterapia com a cirurgia tais como: a otimização dos
critérios de seleção, um regime específico e a menor duração da quimioterapia neoadjuvante (BENOIST, 2006).
A ressecção não precedida de quimioterapia seria apropriada se as margens
adequadas pudessem ser definidas radiograficamente no pré-operatório, na
ausência de comprometimento de linfonodos, e na presença de quatro ou menos
lesões. Para pacientes com mais de quatro metástases ou a participação bilobar, a
RH é considerada apropriada somente após a regressão do tumor usando a
quimioterapia neo-adjuvante. Com relação aos efeitos adversos, têm sido
recentemente relatada incidência aumentada de esteatose, esteato-hepatite e de
lesão hepática vascular nos pacientes tratados com quimioterapia pré-operatória
contendo Irinotecan, Leucovirin ou Oxaliplatina (ALOIA, 2006; VAUTHEY, 2006). Em
pacientes submetidos à RH, a esteatose acentuada está associada às complicações
peri-operatórias (KOOBY, 2003).
Aloia et al. descreveram anormalidades hepáticas nos sinusóides similar
àquelas que caracterizam a doença veno-oclusiva, principalmente nos pacientes que
recebem quimioterapia com Oxaliplatina (ALOIA, 2006). Por outro lado, Vauthey et
al. associaram o uso do Irinotecan com a esteato-hepatite. Neste último estudo,
houve associação entre o desenvolvimento desta complicação e uma maior taxa de
mortalidade em 90 dias (VAUTHEY, 2006).
A quimioterapia pós-operatória pode ser considerada apropriada para os
pacientes que a receberam no pré-operatório, embora para os pacientes com
ressecção adequada o benefício seja incerto (MITRY, 2006).
Em estudo recente, o uso no pós-operatório de 5-FU e de Leucovorin
comparado com a observação apresentou uma melhor sobrevida livre de doença em
cinco anos (34% versus 27 %) (PORTIER, 2006).
Outra técnica que pode ser utilizada nestes doentes é a quimioterapia intrahepática, a qual tem sido executada após a ressecção em casos selecionados. A
19
indicação mais freqüente é utilizá-la nos pacientes em que a quimioterapia préoperatória fracassou, mas que têm a doença extra-hepática estável ou ausente
(ASAHARA, 1998; LORENZ,1998). O benefício da quimioterapia sistêmica
combinada com a arterial intra-hepática foi comparado ao manejo conservador após
a ressecção. Foi demonstrado que a combinação prolongou o tempo livre de
doença, entretanto, não houve nenhum benefício nos termos da sobrevida total
(KEMENY, 1999; KEMENY, 2002).
4. JUSTIFICATIVA
O câncer colorretal tem apresentado recente aumento na incidência,
principalmente nos países de ocidente. A expectativa é de que aproximadamente a
metade destes pacientes apresente metástase hepática em algum momento de sua
doença (ADAM, 1997).
Nos últimos anos, a ressecção cirúrgica, que constitui o único tratamento
curativo destas lesões, tem evoluído, assim como, também tem melhorado o
tratamento adjuvante e neo-adjuvante nestes pacientes.
Na era moderna, particularmente com os avanços na técnica cirúrgica e na
quimioterapia sistêmica mais eficaz, os critérios de ressecção são aplicados cada
vez mais a um maior grupo de pacientes.
Conhecer as características dos pacientes submetidos à hepatectomia por
metástases de câncer colorretal, assim como a taxa de sobrevida e fatores
associados permitirá selecionar de forma mais eficaz os pacientes para ressecção
hepática, e/ou para tratamento quimioterápico neo-adjuvante, e estabelecer um
protocolo para a abordagem destes pacientes. Desta forma,
poder-se-á oferecer
dados mais concretos aos pacientes, familiares e pessoal médico.
Por isso, este estudo se propõe a avaliar os fatores associados à sobrevida
nos pacientes submetidos à hepatectomia por metástases de Câncer Colorretal no
Centro de Câncer do Hospital Santa Casa, do Sul de Brasil, no período de
1993-2008.
20
PERGUNTA DA PESQUISA
Quais são os fatores associados à sobrevida nos pacientes submetidos à
Hepatectomia por Metástases de Câncer Colorretal no Centro de Câncer do Hospital
Santa Casa, do Sul de Brasil, no período de 1993-2008?
21
5 OBJETIVOS
5.1 OBJETIVO PRINCIPAL
•
Analisar a sobrevida e os fatores prognósticos da hepatectomia por
metástase de câncer colorretal nos pacientes submetidos a ressecção
com tentativa curativa.
5.2 OBJETIVOS SECUNDÁRIOS
•
Avaliar a morbi-mortalidade operatória nestes pacientes.
•
Estratificar os fatores prognósticos associados à sobrevida em fatores préoperatórios, trans-operatórios e pós-operatórios.
•
Conhecer as alterações anatomo-patológicas no fígado remanescente.
22
6 METODOLOGIA
6.1 DELINEAMENTO DO ESTUDO
Trata-se de um estudo de tipo descritivo classificado como coorte histórica.
6.2 CASUÍSTICA
Pacientes com lesão metastática no fígado secundário ao câncer colorretal,
diagnosticado por estudos de imagens: ecografia, tomografia computadorizada e/o
ressonância nuclear magnética. Todos os pacientes foram atendidos e submetidos à
hepatectomia no Centro de Câncer do Hospital Santa Rita localizado no Complexo
Hospitalar Santa Casa de Misericórdia, da Região Sul do Brasil, no período de
novembro 1993 a março 2008.
Os pacientes referidos ao Centro de Câncer da Santa Casa para ressecção
das metástases hepáticas procederam do mesmo centro, de outros hospitais da
capital e das cidades vizinhas. A avaliação clínica pré-operatória foi feita
conjuntamente com a oncologia clínica, e foram realizados exames laboratoriais e de
imagem. Para planejamento da cirurgia, foram revisadas as imagens diagnósticas
(ecografia, tomografia computadorizada e/ou ressonância magnética) e
corroboradas através de ecografia peri-operatória.
A decisão cirúrgica foi realizada levando em consideração o estado geral do
paciente, comprometimento hepático e a disponibilidade de uma efetiva
quimioterapia adjuvante ou neo-adjuvante. O procedimento cirúrgico foi
efetuado
por uma equipe de cirurgiões liderada por um cirurgião hepatobiliar, cirurgiões
oncológicos e residentes de cirurgia oncológica. A hepatectomia foi executada,
geralmente com técnica de Kellyclasia, usando eletrocauterio uni e bipolar. Nesta
técnica, se disseca o fígado com a pinça tipo Kelly, realizando o trajeto da ressecção
e fazendo a correspondente dissecção dos vasos e ductos hepáticos, com posterior
23
ligadura ou hemostasia destes com eletrocauterio. Quando disponível, foi
usado
ligasure ou ultrasicion. Geralmente, nas primeiras horas após a cirurgia, os
pacientes permaneceram na Unidade de Cuidados Intensivos até
a estabilidade
clínica. Após a alta hospitalar o paciente foi encaminhado ao ambulatório onde foi
seguido a cada 3 meses com exames de controle laboratoriais e de imagens.
6.3 CRITÉRIOS DE INCLUSÃO
•
Pacientes com metástases hepáticas secundária ao câncer colorretal,
diagnosticada através de estudo de imagens (ecografia, tomografia
computadorizada, ressonância magnética e/ou PET scan)
•
Pacientes submetidos à ressecção hepática com tentativa curativa.
6.4 CRITÉRIOS DE EXCLUSÃO
•
Presença de doença metastática extra-hepática não ressecável (exceção:
metástase pulmonar loco regional).
•
Pacientes submetidos à ablação por radiofreqüência exclusivamente.
•
Prontuários incompletos.
6.5 TAMANHO E TIPO DA AMOSTRA
Não probabilística (não aleatório) por conveniência, pacientes que
preencheram os critérios de inclusão.
24
6.6 LISTA DAS VARIÁVEIS
•
Variável independente: Ressecção cirúrgica.
•
Variáveis dependentes: Sobrevida global, morbidade e mortalidade perioperatórias.
•
Co-variáveis: Variáveis Pré-operatórias: Idade e gênero do paciente,
localização do câncer no intestino grosso, estadiamento TNM do Câncer
Colorretal, período da ressecção hepática após o diagnóstico do tumor
primário, tratamento neo-adjuvante recebido: quimioterapia e tipo de
quimioterapia, radioterapia, nível sérico do CEA.
•
Variáveis Peri-operatórias: número das lesões, comprometimento dos
lobos hepáticos, tipo de ressecção cirúrgica, procedimento associado,
estimativa de perda sangüínea e transfusão sanguínea, tempo cirúrgico,
complicações cirúrgicas e número de dias na CTI e no Hospital.
•
Variáveis pós-operatórias e anatomo-patológicas: tamanho das lesões,
margem cirurgica da peça de ressecção, grau histológico da metastáse,
avaliação do figado remanescente e do linfonodo peri-hilar.
6.7 MÉTODO DE COLETA DE DADOS
Foram revisados os prontuários de todos os indivíduos atendidos e
submetidos à RH por metástase de câncer colorretal durante o período de novembro
1993 a março 2008. A informação óbito do paciente também foi obtida através dos
registros da Secretária da Saúde.
6.8 CONSIDERAÇÕES ÉTICAS
O Estudo e Termo de Confidencialidade foram aprovados pelo Comitê de
ética e pesquisa da Irmandade Santa Casa de Misericórdia de Porto Alegre. Os
25
pacientes não foram individualizados, as informações foram mantidas de modo
confidencial, sem apresentar risco para os pacientes.
6.8.1 Processamento e Análise dos dados
As informações obtidas foram transportadas a uma base de dados nas
planilhas Excel com posterior processamento no SPSS (Stastitical Package for the
Social Sciences) versão 13.0.
A análise dos dados foi desenvolvida em três etapas distintas. Em um
primeiro momento, foi utilizado o modelo de sobrevida de Kaplan-Meier, sendo
observados os comportamentos da sobrevida. Foi utilizado o log-rank para
comparação da sobrevida, de acordo com o número de fatores prognósticos
presentes.
Em um segundo momento, foi realizada a análise gráfica bivariada da
sobrevida por meio da comparação dos grupos de acordo com a ressecção
efetuada. Em seguida, foi realizada a análise estratificada com verificação dos
possíveis fatores de confusão: gênero, idade, número de lesões, intervalo de
ocorrência.
Numa terceira etapa, foi realizada análise multivariada com modelo de
regressão de risco proporcional de Cox com as co-variáveis selecionadas a partir de
um valor p <0.2.
As variáveis numéricas são apresentadas como média e desvio-padrão ou
mediana e intervalos inter-quartis. Foi utilizado o test t para a análise da diferença
estatística, com um intervalo de confiança de 95% (IC 95%).
As variáveis categóricas são apresentadas como freqüência absolutas ou
relativas e percentagem. A diferença entre grupo foi analisada usando o test QuiQuadrado, e quando apropriado o test de Fisher. (Tabela de contingência).
Para selecionar o nível do CEA e a sobrevida foi utilizado a curva ROC.
Em cada análise, considerou-se o valor p menor do que 0.05 como
estatisticamente significativa.
26
7 RESULTADOS
7.1 RESULTADOS GERAIS
População e Pacientes
Cento e setenta e três pacientes foram submetidos à ressecção hepática por
metástase hepática secundária ao câncer colorretal no período de novembro 1993 a
março de 2008.
Foram excluídos 36 pacientes pelas seguintes razões: prontuários
incompletos (n=18), pacientes com metástases irressecáveis submetidos a
laparotomia exploratória unicamente (n=10) e pacientes submetidos à ablação por
radiofreqüência via aberta exclusivamente (n=8).
O estudo incluiu 137 pacientes, sendo gênero do masculino 50.4% com uma
média de idade de 57 anos (30 a 82 anos).
Características do Tumor Primário e das Metástases Hepáticas:
Em 86 pacientes (62.8%) a metástase era metacrônica. O tumor primário
esteve localizado no cólon em 70 pacientes (51.1%) seguido pelo reto em 32.8%.
Aproximadamente metade dos pacientes (43.8%) não apresentava doença
em linfonodo.
De acordo com a classificação de Dukes mais de 50% da amostra pertencia
aos estágios C e D.
Quanto ao nível do CEA, a média do valor foi de 136.5 ng/mL, com intervalos
entre 1 e 4268 ng/mL.
As características clínico-biológicas estão apresentadas na tabela 1.
27
TABELA 1. Características Clínico-biológicas, dos Pacientes submetidos à
Hepatectomia por MCCR (n=137).
Mediana
Variável
n
%
(IQ25-75)
Masculino
69
50.4
Idade dos pacientes
58 (50-65)*
Lesão Metacrônica
86
62.8
Meses (Tumor Primário à Hepatectomia)
11 (1-20)
Localização no Intestino Grosso
Cólon
70
51.1
Sigmóide
22
16.1
Reto
45
32.8
Linfonodos do Tumor Primário
N0
60
43.8
N1
28
20.4
N2
2
1.5
Desconhecido
47
34.3
Estado Patalógico de Dukes
Dukes A
3
2.2
Dukes B
14
10.2
Dukes C
34
24.8
Dukes D
42
30.7
Desconhecido
44
32.1
Nível Pré-operatório do CEA
89
64.5
136.5 (493.2)*
Desconhecido
48
35.5
*
Media (DS)
No que se refere às lesões metastáticas, o número de lesões variou de 1 a 9
lesões, com média de 2.1 e desvio-padrão de 1.6 lesões.
A maioria dos pacientes recebeu quimioterapia neo-adjuvante, sendo a combinação
de 5-Fluoracil e Leucovorin a quimioterapia mais frequentemente usada. Os
diferentes tipos de quimioterapia utilizados estão especificados na tabela 2.
28
TABELA 2. Uso de Quimioterapia e Radioterapia Pré-operatória nos
Pacientes submetidos à Hepatectomia por MCCR (n=137).
Variável
n
%
Quimioterapia Pré-operatória
85
62.0
Tipo de Quimioterapia
5FU+Leucovorin
35
25.6
5FU+Oxaliplatina
9
6.6
5FU+Irinotecan
1
0.7
Outros/Combinação
27
19.7
Quimioterapia Arterial e Sistêmica
1
0.7
Nenhuma
52
38.0
Radioterapia Pré-operatória
25
18.2
Resultados Peri-operatórios:
Realizou-se hepatectomia maior para ressecção de 3 ou mais segmentos
hepáticos em 56 pacientes (59.1%). A bissetoretomia e hepatectomia direita foram
os procedimentos mais praticados com 28.5% e 23.6%, respectivamente. Todas as
caracteristicas estão detalhadas na tabela 3.
A estimativa de perda sangüínea teve uma mediana de 400 ml (IQ25-75 de
250-800).
A permanência na UTI e hospitalar teve uma mediana de 3 e 8 dias,
respectivamente.
A mortalidade peri-operatória foi 3.6% (cinco casos). As complicações perioperatórias ocorreram em 23.4% da casuística, sendo as pulmonares e renais as
mais freqüentes. Os tipos de complicações estão detalhados na tabela 4.
Em 31% dos pacientes houve necessidade de outro procedimento cirúrgico
ou de ablação, inclusive radiofreqüência, quimio-embolização e ressecção pulmonar
no trans-operatório (ver tabela 4).
29
TABELA 3. Resultados Peri-operatórios dos Pacientes submetidos à Hepatectomia
por MCCR (n=137).
Mediana
Variável
n
%
media
(IQ25-75)
Número de lesões metastática
2 (1-3)
Comprometimento Bilobar
Hepatectomia Maior
Tipo de Cirurgia hepática
Metastasectomia/Ressecção Atípica
Bissetoretomia
Hepatectomia Esquerda
Hepatectomia Direita
Hepatectomia Central
Trissetoretomia Esquerda
52
56
38.0
59.1
28
39
19
36
6
5
20.4
28.5
13.9
26.3
4.4
3.6
Trissetoretomia Direita
4
2.9
Procedimento cirúrgico associado
Transfusão sangüínea
Estimativa de Perda Sangüínea (ml)
43
39
32
29
Tempo Cirúrgico (minutos)
Complicações no Pós-operatório
Não
Dias de permanência na UTI
Dias de Estadia Hospitalar
400 (250-800)
225
105
(162-270)
76.6
3 (2-3)
8(7-10)
TABELA 4. Tipo de Procedimentos associados e Complicações nos Pacientes
submetidos à Hepatectomia por MCCR (n=137).
Tipo de Procedimento associado
N
%
Colecistectomia
12
8.8
Radiofreqüência
10
7.3
Ressecção Intestinal
14
10.2
Ressecção Vascular
2
1.5
Ressecção Pulmonar
2
1.5
Ressecção Pancreática
1
0.7
Quimioterapia arterial intrahepática
2
1.5
Nenhuma
94
68.6
Tipo de Complicações
GI: RENAL
GIa: PULMONAR
GII: PULMONAR
GIIa: RENAL
GIIa: GASTROINTESTINAL
GIIIb: RENAL
GIIIb: OUTRA
GIIIa: GASTROINTESTINAL
GIIIa: PULMONAR
GIVa: NEUROLOGICA
1
1
5
4
1
1
1
7
1
4
2.6
2.6
13.1
10.5
2.6
2.6
2.6
18.4
2.6
10.5
GIVa: PULMONAR
GIVa: RENAL
Óbito
TOTAL
5
1
5
38
13.1
2.6
13.1
27/100
30
Avaliação Histopatológica:
Quanto ao grau de diferenciação histológica da metástase, o mais freqüente
foi o moderadamente diferenciado em 80 pacientes (58.4%).
Por outro lado, o fígado remanescente foi normal em 64.2% (88 pacientes),
apresentando alterações em 35.8%, sendo a esteatose a mais freqüente,
acometendo 17.5% (24 pacientes). Figado reacional foi encontrado em 12.4%,
fibrose em 3%, colestase em 2.2% e cirrose hepática em um caso. Estes resultados
estão mostrados na tabela 5.
TABELA 5. Características Patológicas dos Pacientes submetidos à
Hepatectomia por MCCR (n=137).
Variável
n
%
Mediana
(IQ25-75)
Maior diâmetro da lesão metastática cm
Margens cirúrgicas das peças
Livre
Comprometida
Grau histológico das metástases
Pouco diferenciado
Moderadamente diferenciado
Bem diferenciado
Desconhecido
Histopatologia do fígado não tumoral
Normal
Esteatose
Colestase
Fibrose
Reacional
Cirrose
Linfonodos no trans-operatório
Não
4.5 (3-6.1)
107
30
78.1
21.9
14
80
20
23
10.2
58.4
14.6
16.8
88
24
3
4
17
1
64.2
17.5
2.2
2.9
12.4
0.7
129
94.2
31
7.2 RESULTADOS NA SOBREVIDA E FATORES PROGNÓSTICOS
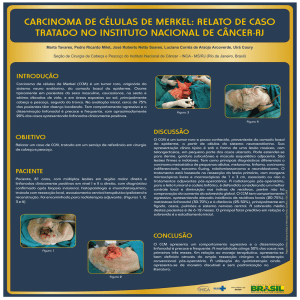
Sobrevida após a ressecção hepática
A sobrevida dos pacientes submetidos à RH variou de 3 dias a 134 meses,
com uma média de 31.7 meses, incluído nesta análise os óbitos peri-operatórios (ver
figura 1). Excluídos estes 5 pacientes, obteve-se uma sobrevida de 34.7%. A
sobrevida global em um, três e cinco anos foi de 82%, 43% e 32.3%,
respectivamente.
Por outro lado, não foi possível avaliar o período livre de doença neste
estudo.
FIGURA 1. Sobrevida Global após Hepatectomia por MCCR (n=137).
Fatores Prognósticos da Sobrevida: Análise Univariada.
Na análise univariada, não houve diferença estatística nas curvas de
sobrevida para as seguintes variáveis: sítio do tumor primário, classificação de
Dukes, radioterapia, tamanho da lesão metastática, tipo de ressecção hepática,
margem cirúrgica, transfusão sangüínea e alteração histológica no fígado
remanescente.
Por outro lado, foi identificada diferença estatisticamente significativa para as
seguintes variáveis: gênero, idade, nível sérico do CEA, período de ressecção das
metástases desde o diagnóstico do tumor primário, quimioterapia neo-adjuvante,
número de lesões, distribuição no fígado (unilobar ou bilobar), grau histológico das
metástases, complicações peri-operatórias e década da ressecção hepática. Estes
dados são descrito detalhadamente na tabela 6.
32
TABELA 6. Análise Univariada dos possíveis Fatores Prognósticos nos Pacientes
submetidos à Hepatectomia por MCCR (n= 137).
Sobrevida 5
Mediana
Fatores Prognóstico
N
P
anos (%)
meses
Gênero: Feminino
68(49,6)
44.0
35.4
0.009
Masculino
69 (50,4)
19.7
24.4
Idade: <65 anos
107(68,5)
35.1
31.6
0.023
> 65 anos
30 (21,9)
12.1
22.2
Nível do CEA: < 50 ng/mL
56 (40,9)
49.4
57.0
<0.001
> 50 ng/mL
81 (59,1)
33.1
22.5
Lesã: Sincrônica
79 (57,7)
24.3
23.5
0.019
Metacrônica
58 (42,3)
40.4
38.3
Quimioterapia Pré-Op: Sim
85 (62,0)
35.5
35.4
0.031
Não
52 (38,0)
23.1
24.4
Tamanho da Lesão: > 5 cm
88 (64,2)
28.7
26.2
0.225
< 5 cm
49 (35,8)
33.0
31.1
Lesões: únicas
64 (43,7)
40.0
45.0
0.005
múltiplas
73 (57,3)
20.3
24.1
Distribuição: Unilobar
85 (62,0)
40.1
38.3
0.002
Bilobar
52 (38,0)
17.4
21.1
Hepatectomia: Menor
56 (40,9)
37.4
35.4
0.328
Maior
81 (59,1)
28.3
28.4
Margens de Ressecção: Livre
107 (78,1)
33.7
31.2
0.225
Comprometida 30 (21,9)
<25.9
24.4
Diferenciação do Tumor: Bem
20 (14,6)
52.4
63.0
0.016
Modero/Pouco Diferenciado.
100 (69,0)
22.9/19.0
20.5
Fígado remanescente: Normal
88 (64,2)
31.6
29.4
0.74
Alterado
49 (35,8)
24.5
31.4
Complicações Não
105 (76,6)
34.8
31.2
0.014
Sim
32(23,4)
12.6
23.5
Período da R H: antes de 2000
39 (28,5)
17.9
25.3
0.058
Depois de 2001
98 (71,5)
40.6
35.0
33
A sobrevida foi superior para o gênero feminino, observando-se uma
sobrevida aos 5 anos de 40.0% versus 19.7% nos homens (p = 0.009) (figura 2).
FIGURA 2. Sobrevida estratificada por gênero nos Pacientes submetidos à hepatectomia por
MCCR (n=137).
34
Foi evidenciada diferença significativa para os pacientes com idade menor de
65 anos, resultando numa sobrevida de 35.1% em 5 anos versus 12.1% para
aqueles com 65 anos ou mais (p = 0.023). Ver figura 3.
FIGURA 3. Sobrevida estratificada por idade nos Pacientes submetidos à Hepatectomia por
MCCR (n=137).
35
No que se refere ao nível sérico do CEA, foi observada sobrevida favorável
aos 5 anos para os pacientes com nível sérico do CEA menor de 50 ng/mL em
relação com aqueles com nível acima deste valor, 34.4% versus 18.8%,
respectivamente (p = <0.001). Ver figura 4.
FIGURA 4. Sobrevida segundo nível sérico do CEA nos Pacientes submetidos à
Hepatectomia por MCCR (n=137).
36
As lesões metacrônicas foram associadas a maior sobrevida em comparação
às sincrônicas, 40.4% versus 24.3% aos 5 anos, respectivamente (p = 0.019). Ver
figura 5.
FIGURA 5. Sobrevida estratificada pelo intervalo de aparição das metástases após o
diagnóstico do CCR. (n=137).
37
A quimioterapia neo-adjuvante oportunizou também melhor sobrevida, 35.5%
aos 5 anos, comparado com 23.1% em aqueles que não a receberam (p = 0.031).
Ver figura 6.
FIGURA 6. Sobrevida segundo uso da Quimioterapia neo-adjuvante nos Pacientes
submetidos à Hepatectomia por MCCR (n=137).
38
Os pacientes com metástases únicas, assim como de localização unilobar,
apresentaram melhor sobrevida, quando comparados com os pacientes cujas
metástases eram múltiplas ou bilobares. Sendo a sobrevida aos 5 anos de 40.0% vs
20.3%, e 40.1% vs 17.4%, respectivamente (p = 0.005) (p = 0.002) (figuras 7 e 8).
FIGURA 7. Sobrevida de acordo ao comprometimento hepático nos pacientes submetidos à
Hepatectomia por MCCR (n=137).
39
FIGURA 8. Sobrevida segundo as lesões únicas vs múltiplas nos Pacientes submetidos à
Hepatectomia por MCCR (n=137).
FIGURA 7. Sobrevida de acordo ao comprometimento hepático nos pacientes
submetidos à Hepatectomia por MCCR (n=137).
40
Quanto ao grau histológico do tumor, os pacientes com lesões bem
diferenciadas tiveram melhor sobrevida, 52.4% aos 5 anos, quando comparados
com os pacientes com neoplasia moderadamente ou pouco diferenciada, com
sobrevidas de 20.9% e 19.0%, respectivamente (p = 0.016) ver figura 9.
FIGURA 9. Sobrevida estratificada pelo grau de diferenciação da metástase nos Pacientes
submetidos à Hepatectomia por MCCR (n=137).
41
Segundo a presença de complicações peri-operatórias, identificou-se
diferença significativa para os pacientes que não tiveram complicações, resultando
numa sobrevida de 34.8% em 5 anos versus 12.6% para aqueles que apresentaram
(p = 0.014). Ver figura 10.
FIGURA 10. Sobrevida segundo a presença de complicações peri-operatórias nos Pacientes
submetidos à Hepatectomia por MCCR (n=137).
42
A sobrevida foi melhor para os pacientes submetidos à ressecção hepática a
partir do ano 2001, atingindo uma sobrevida de 40.6% versus 17.9% nos submetidos
antes desta data (p = 0.058) (figura 11).
FIGURA 11. Sobrevida segundo o período de realização da RH nos Pacientes com MCCR
(n=137).
43
Fatores Prognósticos da Sobrevida: Análise Multivariada.
Na análise multivariada, melhor sobrevida foi associada aos seguintes fatores:
gênero feminino (p = 0.007); nível sérico do CEA menor de 100 ng/mL (p = 0.031);
lesão metacrônica (p = 0.011); quimioterapia neo-adjuvante (p = 0.028); distribuição
unilobar das metástases e a ausência de complicações pós-operatórias (p = 0.010).
Ver tabela 7.
TABELA 7. Fatores Prognósticos nos Pacientes submetidos à Hepatectomia
por MCCR (n=137)
Fatores Prognóstico
Hazard Ratio
95% IC
Gênero: Feminino
Masculino
Nível do CEA: < 50 ng/mL
> 50 ng/mL
Lesão Metacrônica: Sim
Não
Quimioterapia Neo-adjuvante: Sim
Não
Distribuição: Unilobar
Bilobar
Complicação Pós-operatória: Sim
Não
1
2.09
1
1.97
1
1.77
1
1.56
1
1.841
1
2.096
_
1.31-3.34
_
1.17-3.31
_
1.34 -2.77
_
0.99 - 2.44
_
1.18-2.85
_
1.26-3.46
P
0.002
0.010
0.012
0.051
0.006
0.004
44
8 DISCUSSÃO
No presente estudo, a média de sobrevida encontrada foi de 31.7 meses;
sendo em um, três e cinco anos de 82%, 43% e 32.3%, respectivamente. Estes
resultados são próximos aos relatados nas grandes séries das últimas duas décadas
(GAYOWSKI, 1994; NORDLINGER, 1994; TAYLOR, 1997; FONG, 1999; BOLTON,
2000; WEBER, 2000; CHEDID, 2003; ELIAS, 2004; SCHINDL, 2005; ETO, 2006;
JONAS, 2007; ZAKARIA, 2007; REES, 2008).
A sobrevida relatada após a ressecção cirúrgica das MHCCR é bastante
ampla, variando entre 25% e 60% em 5 anos, sendo de qualquer forma muito
superior à oferecida pelo manejo conservador obtido exclusivamente por
quimioterapia ou ablação, seja crioablação ou radiofreqüência: 3%, 22% e 27%,
respectivamente (STEELE, 1991; HESLIN, 2001; SCHINDL, 2005; SHEEN, 2002;
ABDALLA, 2004; ALOIA, 2006).
Por outro lado, as últimas grandes séries relatam sobrevida entre 40% e 60%
(CHOTI, 2002; FERNANDEZ, 2004; ABDALLA, 2004; HERMAN, 2006; WEI, 2006,
NAGASHIMA, 2006; ALOIA, 2006; TAKAHASHI, 2006; BUTTE, 2007; MALIK, 2007;
TANIANI, 2007; TANAKA, 2008; ARRU, 2008).
A sobrevida dos pacientes neste estudo, como já referido, é similar aos
resultados dos autores anteriores, reforçando a idéia de que a RH é a terapêutica de
escolha para as metástases hepáticas por câncer colorretal. Por outro lado,
provavelmente a quimioterapia usada no tratamento dos pacientes do presente
estudo não necessariamente reflete a usada nos países desenvolvidos. Pode-se
observar que a maioria dos pacientes recebeu como base da quimioterapia o 5-FU e
Leucovorin unicamente, que atualmente deve ser combinado ao uso de Oxaliplatin
ou Irinotecan e recentemente com Bevacizumab, como primeira linha de tratamento
quimioterápico (KEMENY, 2002; ELLIS, 2005). Apesar disso, observa-se que a
quimioterapia neo-adjuvante teve uma influência positiva nos pacientes com uma
sobrevida duas vezes superior nos pacientes que a receberam. Tal achado também
foi registrado por Pawlik et al. e por Adam et al (PAWLIK, 2005; ADAM, 2004).
No presente estudo, foram considerados distintos parâmetros com relação a
sobrevida após ressecção das metástases hepáticas. Desde os primeiro relatos de
45
casos de RH por Nordlinger et al (1987) até os estudos recentes, vários fatores têm
sido elencados como de importância prognóstica (GAYOWSKI, 1994; TAYLOR,
1997, WEBER, 2000; OLIVEIRA, 2004; WEI, 2006; HERMAN, 2006; NAGASHIMA,
2006; ARRU, 2008) (NORDLINGER, 1987), (EKBERG, 1986). Características
próprias do paciente, do câncer primário e das metástases, derivadas da ressecção
hepática propriamente dita e as que decorrem no pós-operatório têm sido avaliadas
(CAPUSSOTTI, 2007). Identificar estes fatores nas distintas etapas é muito
importante tanto para a equipe cirúrgica e oncológica como para a família a fim de
planejar de forma conjunta a melhor conduta terapêutica.
Têm sido propostos inúmeros escores prognósticos na avaliação do paciente
com MHCCR (NORDLINGER, 1996; FONG, 1999; NAGASHIMA, 2006; SCHINDL,
2005; WRAY, 2005; ZAKARIA, 2007; MALIK, 2007; TAN, 2008; KATTAN 2008),
inclusive retoma-se a importância da laparoscopia nesta nova era da cirurgia para
avaliar os pacientes que irão se beneficiar da ressecção cirúrgica (JARNAGIN,
2001).
Com relação aos resultados aqui apresentados, o fato de que o gênero
feminino e a idade menor de 65 anos resultarem em fatores de bom prognóstico,
deve-se provavelmente ao fato de que este é um subgrupo de pacientes com melhor
expectativa de vida, com melhor resposta orgânica após a ressecção. Achados
similares são encontrados na literatura (HESLIN, 2001)(KATTAN, 2008)(ADAM,
2008). Do mesmo modo, em diversos estudos, a idade avançada foi identificada
como fator de mau prognóstico (WEI, 2006; HESLIN, 2001; GAYOWSKI, 1994;
NORDLINGER, 1996; LEPORRIER, 2006; MANFREDI, 2006; THELEN, 2007;
ZACHARIAS, 2004; KATTAN, 2008).
O presente estudo tem algumas limitações traduzidas pela ausência de
informações clínicas relacionadas à classificação de Dukes e nível de CEA no pré
operatório em aproximadamente 30% da amostra analisada.
No entanto, os pacientes com níveis sérico de CEA acima de 50 ng/mL, assim
como as metástases de localização bilateral, associaram-se ao pior prognóstico.
Considera-se que estas condições traduzem tanto uma doença avançada quanto
agressiva. A localização hepática bilateral das metástases foi referida como um fator
de mau prognóstico por vários autores (GAYOWSKI, 1994; BOLTON, 2000;
HERMAN, 2006; MALIK, 2007; TANAKA, 2008; KATTAN, 2008).
46
Do mesmo modo, as metástases sincrônicas determinaram pior sobrevida
nesta série, o qual manifesta a agressividade do tumor, já comprovado em várias
importantes casuísticas (FONG, 1999; CHEDID, 2003; MINAGAWA, 2000; HESLIN,
2001; GAYOWSKI, 1994; NORDLINGER, 1996; ARRU, 2008; ZAKARIA, 2007;
ADAM, 1997; FONG 1997; SCHINDL, 2005).
Houve uma tendência a melhor sobrevida para lesões únicas, embora na
análise multivariada este achado não tenha sido confirmado. Na literatura, a maioria
dos estudos demonstra que a presença de metástase única favorece o paciente,
pois representa uma etapa mais precoce da doença metastática, portanto sua
ressecção acarreta melhor prognóstico a longo prazo (FONG, 1999; TAYLOR, 1997;
BOLTON, 2000; WEBER, 2000; CHEDID, 2003; HERMAN, 2006; BUTTE, 2007;
MINAGAWA, 2000; HESLIN, 2001; CHOTI, 2002; ABDALLA, 2004; NAGASHIMA,
2006; ALOIA, 2006; TANIANI, 2007; JONAS, 2007; ZAKARIA, 2007). Dentro desta
linha de raciocínio, alguns autores demonstraram diferença na sobrevida quando
havia a presença de três lesões ou mais (REES, 2008; ZACHARIAS, 2004;
SCHINDL, 2005). Em outros dois estudos a diferença foi encontrada com relação a
quatro ou mais lesões (NORDLINGER, 1996; GAYOWSKI, 1994). E, ainda, outros
evidenciaram diferença ao avaliar cinco (ELIAS.2004) ou mais lesões (TANAKA,
2008).
Entre os resultados peri-operatórios, como seria de se esperar, a presença de
complicações resultou em fator independente de mau prognóstico na sobrevida. Por
outro lado, o tipo de ressecção hepática, a estimativa de sangramento e o tempo
cirúrgico não foram associados ao prognóstico. No estudo de Khuri et al. (2005) a
ocorrência de complicações dentro dos primeiros 30 dias após diferentes cirurgias
de alta complexidade determinou a diminuição da sobrevida a longo prazo. Postulase que a resposta inflamatória e imunológica inadequadas seriam as responsáveis
por esta pior sobrevida (KHURI, 2005).
Um dado importante a ser considerado é o grau de diferenciação tumoral.
Observa-se nesta análise uma tendência à pior sobrevida naqueles pacientes com
tumor pouco diferenciado. Resultados adversos com este grau histológico já foram
evidenciados na literatura (HESLIN, 2001; ARRU, 2008; FERNANDEZ, 2004; REES,
2008; TAN 2008).
47
Com relação ao fígado remanescente, não houve correlação com a sobrevida
neste estudo. Na maioria dos pacientes o fígado era normal ou reacional. Ressalvese que no presente estudo apenas uma minoria recebeu Irinotecan e Oxaliplatin,
drogas relacionadas como esteato- hepatite e alteração sinusoidal, respectivamente
(KOOBY, 2003; ALOIA, 2006; VAUTHEY, 2006; MCCORMACK, 2007; NAKANO,
2008).
Da mesma forma, não se evidencia diferença entre o tamanho da lesão e a
sobrevida com relação ao diâmetro acima de 5 cm (FONG, 1999; BOLTON, 2000;
NAGASHIMA, 2006; NORDLINGER, 1996; REES, 2008), acima de 8 cm (ZAKARIA,
2007) ou maior de 10 cm (FONG, 1997). O tamanho do tumor pode traduzir maior
agressividade tumoral ou até mesmo um diagnóstico mais tardio (PAWLIK, 2008).
Com o advento da cirurgia em dois tempos (ADAM, 2004), o tamanho deixou de ser
uma contra-indicação absoluta da RH.
Neste estudo, a margem de ressecção cirúrgica não teve impacto nos
resultados. Apesar de ser este um princípio da cirurgia oncológica, nem sempre é
possível conseguir margens livres, mesmo que este seja um parâmetro fundamental
dentro dos fatores prognóstico da RH MCCR; uma vez que a maioria dos relatos
associa a margem a melhor prognóstico (FONG, 1997A; 1999B; WEI, 2006;
WEBER, 2000; CHEDID, 2003; HESLIN, 2001; CHOTI, 2002; NORDLINGER,1996;
GAYOWSKI, 1994; TANIANI, 2007; ARE, 2007, REES, 2008).
Porém, para outros autores a margem não influencia a sobrevida (BOLTON,
2000; HERMAN, 2006; BUTTE, 2007; NAGASHIMA, 2006; MINAGAWA, 2000;
ARRU, 2008; JONAS, 2007; ZAKARIA, 2007; TAYLOR, 1997; MALIK, 2007). Não
obstante, os autores sugerem que se deve tentar na medida do possível a ressecção
curativa como princípio oncológico.
Fernandez et al. afirmaram não haver mudança na sobrevida ao longo do
tempo (2004); porém, vários autores evidenciaram uma melhor sobrevida no período
recente (CHOTI, 2002; MANFREDI, 2006; JONAS, 2007). Neste estudo, percebe-se
igual propensão nos pacientes operados a partir do ano 2001, que tiveram uma
sobrevida superior a 50% comparada com 12% dos operados antes desta data.
Provavelmente tal fato se deve aos seguintes avanços: melhor treinamento da
equipe cirúrgica, melhor técnica anestésica, utilização de novos instrumentos de
ressecção e ablação, ressecção hepática em dois tempos, novas drogas de
48
quimioterapia assim como o advento de melhores técnicas diagnósticas (TAN, 2008;
LUBEZKY, 2007; FERNANDEZ, 2004).
A literatura sugere que a seleção do paciente é mais importante que as
características das metástases, embora as duas condições sejam determinantes
para o sucesso da ressecção curativa (PAWLIK, 2008).
Por outro lado, cada vez mais os critérios de ressecabilidade têm se
expandido a um maior grupo da pacientes graças à experiência dos grupos de
cirurgia hepática, assim como ao advento de novas drogas (ALBERTS, 2005;MASI,
2006). Apesar da acurácia de vários sistemas de avaliação destes fatores
(GAYOWSKI, 1994, FONG, 1999, NAGASHIMA 2006, TAN, 2008; REES, 2008),
alguns deles não podem ser avaliados previamente à ressecção nem no pós
operatório, por exemplo, o tipo de ressecção, estimativa de sangramento, margem
cirúrgica, complicações e a alteração da histologia hepática, especificamente a
presença de esteato-hepatite (MCCORMACK, 2007).
Descreve-se neste relata uma das maiores séries de caso consecutivo realizado por
uma mesma equipe no Brasil, com resultados são bastante semelhantes aos
publicados em grandes centros internacionais em termos de sobrevida, mortalidade
e morbidade, reafirmando a ressecção hepática como o melhor tratamento para
estes pacientes.
Contudo, este estudo trata-se da experiência de um Centro de Câncer do Sul do
Brasil que pelo, número de procedimentos hepáticos, considera-se um centro de alto
volume, que influencia positivamente na sobrevida dos pacientes, como foi analisado
por Fong et al. (2005).
Considera-se que este estudo tem o poder estatístico para reforçar a literatura
nacional e internacional sobre a importância dos fatores prognósticos antes citados.
Embora não tenha sido possível avaliar o período livre de doença, reconhece-se a
importância de acompanhar de perto estes pacientes e oferecer maior informação ao
paciente, familiares e médicos tratantes com o intuito de oferecer um adequado e
oportuno tratamento ante a presença de recorrência.
49
9 CONCLUSÕES
•
A Sobrevida global dos pacientes em um, três e cinco anos foi de 82%,
43% e 32.3%, respectivamente, com uma média de 31.7 meses.
•
A ressecção hepática esteve associada a 3.6% de mortalidade e 23.4% de
complicações pós-operatorias, respectivamente.
•
Os fatores independentes que se associaram ao bom prognóstico foram:
gênero feminino; nível sérico do CEA menor de 50 ng/mL; lesão
metacrônica; uso da quimioterapia neo-adjuvante; distribuição unilobar das
metástases e a ausência de complicações pós-operatórias.
•
Um terço dos pacientes apresentaram alterações anátomo-patológicas
discretas no fígado remanescente.
REFERÊNCIAS
ABDALLA, E.K.; VAUTHEY, J.N.; ELLIS, L.M. et al. Recurrence and Outcomes
Following Hepatic Resection, Radiofrequency Ablation, and Combined Resection/
Ablation for Colorectal Liver Metastases. Ann Surg, v.23, n.6, p.818–827, Jun. 2004.
ADAM, R. Últimos resultados del registro internacional de las metástasis colorrectal:
LiverMetSurvey. In: 79º CONGRESO ARGENTINO DE CIRUGÍA, 14 de Nov, 2008.
Buenos Aires, Argentina. Disponivel em: <http://ww.livermetsurvey.org>.
ADAM, R.; BISMUTH, H.; CASTAING, D.I. et al. Repeat Hepatectomy for Colorectal
Liver Metastases. Ann Surg. v. 225, n. 1, p. 51-62, Jan. 1997.
ADAM, R.; DELVART, V.; PASCAL, G. et al. Rescue surgery for unresectable
colorectal liver metastases downstaged by chemotherapy: a model to predict longterm survival. Ann Surg, v.240, n.4. 644-658. Oct. 2004.
ALBERTS, S.R.; HORVATH, W.L.; STERNFELD, W.C. et al. Oxaliplatin, Fluorouracil,
and Leucovorin for Patients With Unresectable Liver-Only Metastases From
Colorectal Cancer: A North Central Cancer Treatment Group Phase II Study. J Clin
Oncol, v. 23, p. 9243. 2005.
ALOIA, T. ; SEBAGH, M. ; PLASSE, M. et al. Liver histology and surgical outcomes
after preoperative chemotherapy with fluorouracil plus oxaliplatin in colorectal cancer
liver metastases. J Clin Oncol, v. 24, p. 4983. 2006
ALOIA, T.A.; VAUTHEY, J.N.; LOYER, E.M. et al. Solitary Colorectal Liver Metastasis
Resection Determines Outcome. Arch Surg, v.141, p.460-467. May. 2006.
ARE, C.; GONEN, M.; ZAZZALI, K. et al. The impact of margins on outcome after
hepatic resection for colorectal metastasis. Ann Surg, v.246, n. 2, p. 295-300. Aug.
2007.
ARRU, M.; ALDRIGHETTI, L.; CASTOLDI, R. et al. Analysis of prognostic factors
influencing long-term survival after hepatic resection for metastatic colorectal cancer.
World J Surg, v.32, n.1, p. 93-103. Jan. 2008.
ASAHARA, T.; KIKKAWA, M.; OKAJIMA, M. et al. Studies of postoperative
transarterial infusion chemotherapy for liver metastasis of colorectal carcinoma after
hepatectomy. Hepatogastroenterology, v.45, p.805. 1998.
AZOULAY, D.; CASTAING, D.; SMAIL A. et al. Resection of Nonresectable Liver
Metastases From Colorectal Cancer After Percutaneous Portal Vein Embolization.
Ann Surg, v.231, n. 4, p. 480-486. Abr. 2000.
BENOIST, S.; BROUQUET, A.; PENNA, C. et al. Complete response of colorectal
liver metastases after chemotherapy: does it mean cure?. J Clin Oncol, v. 24, n.24, p.
3939-3945. Aug. 2006.
BISMUTH, H.; CASTAING, D.; GARDEN, O.J. The Use of Operative Ultrasound in
Surgery of Primary Liver Tumors. World J. Surg, 11,610-614, 1987.
BOLTON, J.; FURMAN, G. Survival After Resection of Multiple Bilobar Hepatic
Metastases From Colorectal Carcinoma. Ann Surg, Lousiana. v. 231, n. 5, p.
743-751, May. 2000.
BUTTE, J.M.; JARUFE, N.; BELLOLIO, F. et al. Factores pronósticos de pacientes
con metástasis hepáticas de cáncer de colon y recto. Rev Chil Cir, Chile. v. 59, n.4,
p.293-298. Ago. 2007.
CAPUSSOTTI, L. Manejo de las metástasis hepáticas del cáncer colorrectal. In: 78º
CONGRESO ARGENTINO DE CIRUGÍA, 26 de Oct. 2007. Buenos Aires, Argentina.
CHEDID, A.; VILLWOCK, M.; CHEDID, M.; RODHE, L. Fatores Prognósticos na
Ressecção de Metástases Hepáticas de Câncer Colorretal. Arq Gastroenterol, Brasil.
v. 3. p.159-165. 2003.
CHOTI, M.; SITZMANN, J.; TIBURI, M. et al. Trends in Long-Term Survival Following
Liver Resection for Hepatic Colorectal Metastases. Ann Surg, v. 235, n.6. p.759–766.
Jun. 2002.
DE SANTIBAÑES, E.; LASALLE, F.B.; McCORMACK, L. et al. Simultaneous
colorectal and hepatic resections for colorectal cancer: postoperative and longterm
outcomes. J Am Coll Surg, v. 195, p.196. 2002.
DELAUNOIT, T. ; ALBERTS, S.R. ; SARGENT, D.J. et al. Chemotherapy permits
resection of metastatic colorectal cancer: experience from Intergroup N9741. Ann
Oncol, v.16, p.425. 2005.
EKBERG, H.; TRANBERG, K.G.; ANDERSON, R. et al. Determinants of survival in
liver resection for colorectal secundaries. Br J Surg, v. 73, p.727-731. 1986.
ELIAS, D.; SIDERIS, L.; POCARD, M. et al. Results of R0 Resection for Colorectal
Liver Metastases Associated With Extrahepatic Disease. Ann Surg Oncol, v. 11, n.3,
p.274–280.2004.
ELLIS, L.M.; CURLEY, S.A.; GROTHEY, A. Surgical resection after downsizing of
colorectal liver metastasis in the era of bevacizumab. J Clin Oncol, v. 23, n.22, p.
4853-4855. Aug. 2005.
ETO, TA. ; CHIJIIWA, K.; HIDAKA, H. et al. Sum of the longest diameters of
metastatic liver tumors is a possible new prognostic factor after hepatectomy in
patients with colorectal liver metastases. Hepatogastroenterology, v. 53, n.72, p.
909-912. Nov-Dec.2006. (Abstract)
FERNANDEZ, F.; DREBIN, J.; DAVID C.; et al. Five-Year Survival After Resection of
Hepatic Metastasis From Colorectal Cancer in Patients Screened by Positron
Emission Tomography With F-18 Fluorodeoxyglucose (FDG-PET). Ann Surg, v. 240,
n. 3, p. 438–450. Sep. 2004.
FONG, Y.; COHEN, A.M.; FORTNER, J.G. et al. Liver Resection for Colorectal
Metastases. J Clin Oncol, v.15, n.3, p.938-946. Mar.1997.
FONG, Y.; FORTNER, J.; SUN, R.; BRENNAN, M.; BLUMGART, L. Clinical Score for
Predicting Recurrence after Hepatic Resection for Metastatic Colorectal Cancer
Analysis of 1001 Consecutive Cases. Ann Surg, v.230, n.3, p.309–321, Set. 1999.
GAYOWSKI, T.J., IWATSUKI, S., MADARIAGA, J.R., et al. Experience in hepatic
resection for metastatic colorectal cancer: Analysis of clinical and pathologic risk
factors. Surgery. v.119, n. 4, p.703-711 Out. 1994.
GUIMARÃES, C.M.; CORREIA, M.M.; BALDISSEROTTO M.; AIRES E. P. COELHO,
J.F. Intraoperative Ultrasonography of the Liver in Patients With Abdominal Tumors A
New Approach. J Ultrasound Med, v.23. p. 1549–1555. Aug. 2004.
HERMAN, P.; MACHADO, M.C,; DINIZ, A.; COIMBRA, F,; SALLUM, R.;
MONTAGNINI, A. Surgical Treatment of Colorectal Cancer Hepatic Metastases.
Experience of A.C. Camargo Cancer Hospital - São Paulo. Appl Can Res, Brasil. v.
26, n.3, p. 88-93. 2006.
HESLIN, M.; MEDINA-FRANCO, H.; PARKER, M.; VICKERS, S.; ALDRETE, J.;
URIST, M. Colorectal Hepatic Metastasis Resection, local Ablation, and Hepatic
Artery Infusion Pump Are Associated With Prolonged Survival. Arch Surg, v. 136, p.
318-323. Mar. 2001.
HUGHES, K.S. Resection of the liver for colorectal carcinoma metastases- a multiinstitutional study of indications for resections. Surgery, v.103, p.278-88. 1988.
INSTITUTO NACIONAL DO CANCER (INCA). Disponivel em:
<http.www.inca.gov.br>. Acesso em: 27 abr 2008.
IRIE, T.; ITAI, Y.; HATSUSE, K.; MOCHIZUKI, H. Does resection of small liver
metastases from colorectal cancer improve survival of patients? B J Radio, v. 72, p.
246-249. Mar.1999.
JAECK, D.; NAKANO, H.; BACHELLIER, P. et al. Significance of Hepatic Pedicle
Lymph Node Involvement in Patients With Colorectal Liver Metastases: A Prospective
Study. Ann Surg Oncol, v.9, n.5. p.:430–438. 2002.
JARNAGIN, W.R.; CONLON, K.; BODNIEWICZ, J. et al. A clinical scoring system
predicts the yield of diagnostic laparoscopy in patients with potentially resectable
hepatic colorectal metastases. Cancer, v.91, n.6, p.1121-1128. Mar. 2001.
JEMAL, A., SIEGEL, R., WARD, E. et al. Cancer statistics, 2007. CA Cancer J Clin;
57:43 . 2007. Acesso em: 27 abr. 2008.
JONAS, S.; THELEN, A.; BENCKERT, C. et al. Extended resections of liver
metastases from colorectal cancer. World J Surg, v.31, n. 3, p. 511-521. Mar 2007.
KALIL, A.N.; COELHO, J.C; STRAUSS, E. Fígado e Vias Biliares: Clínica e Cirurgia.
Rio de Janeiro: Revinter. 2001. 678 p.
KATTAN, M.W.; GÖNEN, M.; JARNAGIN, W.R. et al. A Nomogram for Predicting
Disease-specific Survival After Hepatic Resection for Metastatic Colorectal Cancer.
Ann Surg, v.247, n.2, p.282–287. Feb. 2008.
KEMENY, M.M.; ADAK, S.; GRAY, B. et al. AL. Combined-modality treatment for
resectable metastatic colorectal carcinoma to the liver: surgical resection of hepatic
metastases in combination with continuous infusion of chemotherapy-an intergroup
study. J Clin Oncol, v.20, n.6. p.1499-1505. Mar. 2002.
KEMENY, N.; HUANG, Y.; COHEN, A.M. et al. Hepatic Arterial Infusion Of
Chemotherapy After Resection Of Hepatic Metastases From Colorectal Cancer. N
Engl J Med, v. 341, n.27, p. 2039-2048. Dec. 1999.
KHATRI, V.P.; PETRELLI, N.J.; BELGHITI, J. Extending the Frontiers of Surgical
Therapy for Hepatic Colorectal Metastases: Is There a Limit? J Clin Oncol, v.23, n.33,
p.8490-8499, Nov. 2005.
KHURI, S.F.; HENDERSON, W.G.; DePALMA, R.G. et al. Determinants of Long-Term
Survival after Major Surgery and the Adverse Effect of Postoperative Complications.
Ann Surg, v. 242, n.3, p.326-343. Set. 2005.
KOKUDO, N.; MIKI, Y.; SUGAI, S.; YANAGISAWA, A. et al. Genetic and histological
assessment of surgical margins in resected liver metastases from colorectal
carcinoma minimum surgical margins for successful resection. Arch Surg, v.137, p.
833-840. Jul. 2002.
KOOBY, D.A.; FONG, Y.; SURIAWINATA, A. et al. Impact of steatosis on
perioperative outcome following hepatic resection. J Gastrointest Surg, v. 7, p. 1034.
2003.
LAMBERT, L.A.; COLACCHIO, T.A.; BARTH, R.J. Interval hepatic resection of
colorectal metastases improves patient selection. Arch Surg, v. 135. p.473. 2000.
LEPORRIER, J.; MAUREL, J.; CHICHE, L.; BARA, S.; SEGOL, P.; LAUNOY, G. A.
Population-based study of the incidence, management and prognosis of hepatic
metastases from colorectal cancer. Br J Surg, v. 93, n.4, p.465-474. Apr. 2006.
LIVRAGHI, T. ; SOLBIATI, L. ; MELONI, F. et al. Percutaneous radiofrequency
ablation of liver metastases in potential candidates for resection: the "test-of-time
approach". Cancer, v.97, p.3027. 2003.
LORENZ, M.; MULLER, H.H.; SCHRAMM, H.; GASSEL, H.J. Randomized trial of
surgery versus surgery followed by adjuvant hepatic arterial infusion with 5fluorouracil and folinic acid for liver metastases of colorectal cancer. German
Cooperative on Liver Metastases (Arbeitsgruppe Lebermetastasen). Ann Surg, v.228,
p.756. 1998.
LUBEZKY, N.; METSER, U.; GEVA, R. et al. The Role and Limitations of 18-Fluoro-2deoxy-D-glucose Positron Emission Tomography (FDG-PET) Scan and
Computerized Tomography (CT) in Restaging Patients with Hepatic Colorectal
Metastases Following Neoadjuvant Chemotherapy: Comparison with Operative and
Pathological Findings. J Gastrointest Surg, n.11, p.472–478. Feb.2007.
MALIK, H.Z.; PRASAD, K.R.; HALAZUN, K.J. et al. Preoperative Prognostic Score
for Predicting Survival After Hepatic Resection for Colorectal Liver Metastases. Ann
Surg, v.246, n.5, p. 806–814. Nov. 2007.
MANFREDI, S.; LEPAGE, C.; HATEM, C.; COATMEUR, O.; FAIVRE, J.; BOUVIER,
A.M. Epidemiology and Management of Liver Metastases From Colorectal Cancer.
Ann Surg, v. 244, n. 2, p.254–259. Aug. 2006.
MASI, G.; CUPINI, S.; MARCUCCI, L. et al. Treatment with 5-fluorouracil/folinic acid,
oxaliplatin, and irinotecan enables surgical resection of metastases in patients with
initially unresectable metastatic colorectal cancer. Ann Surg Oncol, v.13, n. 1, p.
58-65. Jan. 2006.
McCORMACK, L.; PETROWSKY, H.; JOCHUM, W.; FURRER, K.; CLAVIEN, P.A.
Hepatic Steatosis Is a Risk Factor for Postoperative Complications After Major
Hepatectomy A Matched Case-Control Study. Ann Surg, v.245, n.6, p.923–930. Jun.
2007.
MELENDEZ, J.A.; ARSHLAN, V.; FISCHER, M. et al. Perioperative Outcomes of
Major Hepatic Resection under Low Central Venous Pressure Anesthesia: Blood
Loss, Blood Transfusion, and the Risk of Posoperative Renal Dysfunction. J Am Coll
Surg, v.187, n.6, p.620-625. Dec.1998.
MINAGAWA, M.; MAKUUCHI, M.; GUIDO, Ti. et al. Extension of the Frontiers of
Surgical Indications in the Treatment of Liver Metastases from Colorectal Cancer:
Long-Term Results. Ann Surg, v. 231, n. 4, p 487–499. Apr. 2000.
MITRY, E.; FIELDS, A.; BLEIBERG, H. et al. Adjuvant chemotherapy after potentially
curative resection on metastases from colorectal cancer: a meta-analysis of two
randomized trials. J Clin Oncol, v.24, p.152. 2006.
NAGASHIMA, I.; TAKADA, T,; NAGAWA, H.; MUTO, T.; OKINAGA, K. Proposal of a
new and simple staging system of colorectal liver metastasis. World J Gastroenterol,
v.12, n. 43, p. 6961-6965. Nov. 2006 .
NAGASHIMA, I.; TAKADA, T.; ADACHI, M,; NAGAWA, H.; MUTO, T.; OKINAGA, K.
Proposal of criteria to select candidates with colorectal liver metastases for hepatic
resection: comparison of our scoring system to the positive number of risk factors.
World J Gastroenterol, v. 12, n. 39, p.6305-6309. Oct. 2006.
NAKANO H.; OUSSOULTZOGLOU, E.; ROSSO, E. Sinusoidal Injury Increases
Morbidity after Major Hepatectomy in Patients With Colorectal Liver Metastases
Receiving Preoperative Chemotherapy. Ann Surg, v. 247, n.5, p. 118–124. Jan. 2008.
NORDLINGER, B, SORBYE, H, DEBOIS, M, et al. Feasibility and risks of preoperative chemotherapy (CT) with Folfox 4 and surgery for resectable colorectal
cancer metastases. Interim analysis of the EORTC Intergroup randomized phase III
study (abstract). J Clin Oncol, v. 23, p.253. 2005.
NORDLINGER, B.; GUIGUET, M.; VAILLANT, J.C. et al. Surgical Resection of
Colorectal Carcinoma Metastases to the Liver A Prognostic Scoring System to
Improve Case Selection, Based on 1568 Patients. Cancer, v.77, n.7, p.1254-1262.
Abr. 1996.
NORDLINGER, B.; PARC, R.; DELVA, E.; QUILICHINI, M.A.; HANNOUN, L.;
HUGUET, C. Hepatic Resection for Colorectal Liver Metastases Influence on Survival
of Preoperative Factors and Surgery for Recurrences in 80 Patients Ann Surg, v.205,
n.3, p.256-263, Mar.1987.
NORDLINGER, B.; PHILIPPE, R. Liver Metastases From Colorectal
Turning Point. J Clin Oncol, v.20, n.6 , p.1442-1445. Mar. 2002.
Cancer: The
NORDLINGER, B.; VAILLANT, J.C.; GUIGUET, M. et al. Survival benefit of repeat
liver resections for recurrent colorectal metastases: 143 cases. Association Francaise
de Chirurgie. J Clin Oncol, v.12, p.1491. 1994.
OLIVEIRA, R.B.; PINHAL, M.A.; MARTINS, L.C. et al. Análise dos Parâmetros de
Sobrevivência em Pacientes Submetidos à Extirpação das Metástases Hepáticas do
Carcinoma Colo-Retal. Rev bras Coloproct , v.24, n.4, p.300-307. Out/Dez 2004.
PAWLIK, T.M.; SCHULICk, R.; CHOTI, M. Expanding Criteria for Resectability of
Colorectal Liver Metastases. The Oncologist, v.13. p. 51-64. 2008.
PAWLIK, T.M.; SCOGGINS, C.R.; ZORZI, D. et al. Effect of surgical margin status on
survival and site of recurrence after hepatic resection for colorectal metastases. Ann
Surg, v. 241, n.5, p.715-724. May. 2005.
PORTIER, G.; ELIAS, D.; BOUCHE, O. et al. Multicenter randomized trial of adjuvant
fluorouracil and folinic acid compared with surgery alone after resection of colorectal
liver metastases: FFCD ACHBTH AURC 9002 trial. J Clin Oncol, v.24, p.4976. 2006.
POSTON, G. Surgical Strategies for colorectal liver metastases. Surg Oncol, v.13. p.
125-136. 2004.
POSTON, G.J.; ADAM, R.; ALBERTS, S. et al. OncoSurge: A Strategy for Improving
Resectability With Curative Intent in Metastatic Colorectal Cancer. J Clin Oncol, v.23,
n.28, p. 7125-7134, Oct. 2005.
POZZO, C.; BASSO, M.; CASSANO, A. et al. Neoadjuvant treatment of unresectable
liver disease with irinotecan and 5-fluorouracil plus folinic acid in colorectal cancer
patients. Ann Oncol, v.15, p.933. 2004.
REES, M.; TEKKIS, P.P.; WELSH, F.K.S.; O’ROURKE, T.; JOHN, T.G. Evaluation of
Long-term Survival After Hepatic Resection for Metastatic Colorectal Cancer A
Multifactorial Model of 929 Patients. Ann Surg, v.247, n.1, p. 125–135. Jan. 2008.
ROUGIER, P.; MILAN, C.; LAZORTHES, F. et al. Prospective study of prognostic
factors in patients with unresected hepatic metastases from colorectal cancer. Br J
Surg, v.82, p.1397. 1995.
SCHEELE, J.; STANG, R.; ALTERNDORF-HOFMAN, A.; PAUL, M. Resection of
colorectal liver metastases. World J Surg, v. 19, p.59. 1995.
SCHINDL, M.; WIGMORE, S.J.; CURRIE, E.J.; LAENGLE, F.; GARDEN, O.J.
Prognostic Scoring in Colorectal Cancer Liver Metastases Development and
Validation. Arch Surg, v.140, p.183-189, Feb. 2005.
SHAW, I.M.; REES, M.; WELSH, F.K.; BYGRAVE, S.; JOHN, T.G. Repeat hepatic
resection for recurrent colorectal liver metastases is associated with favorable longterm survival. Br J Surg, v. 93, p. 457–464. 2006.
SHEEN, A.J.; POSTON, G.J.; SHERLOCK, D.J. Cryotherapeutic ablation of liver
tumours. Br J Surg, v.89, p.1396-1401. 2002.
STEELE, G.; BLEDAY, R.; MAYER, R. et al. A Prospective Evaluation of Hepatic
Resection for Colorectal Carcinoma Metastases to the Liver: Gastrointestinal Tumor
Study Group Protocol 6584. J Clin Oncol, v.9, n.7, p.105-1112. Jul. 1991.
TAKAHASHI, S.; KONISHI, M.; NAKAGOHRI, T. et al. Importance of intra-individual
variation in tumour volume of hepatic colorectal metastases. Eur J Surg Onco, v.32,
n.10, p.1195-200. Dec. 2006. (Abstract).
TAN, M.C.; CASTALDO, E.T.; GAO, F. et al. A Prognostic System Applicable To
Patients With Resectable Liver Metastasis From Colorectal Carcinoma Staged By
Positron Emission Tomography With [18F] Fluoro-2-Deoxy-D-Glucose: Role Of
Primary Tumor Variables. J Am Coll Surg, v. 206, n. 5, p.857-868; May. 2008.
(Abstract)
TANAKA, K.; SHIMADA, H.; UEDA, M.; MATSUO, K.; ENDO, I.; TOGO, S. Role of
hepatectomy in treating multiple bilobar colorectal cancer metastases. Surgery, v. 43,
n.2, p. 259-270. Feb. 2008.
TANIANI, N.; AKIMARU, K.; YOSHIDA, H.; TAJIRI, T. Surgical treatment for better
prognosis of patients with liver metastases from colorectal cancer.
Hepatogastroenterology, v.54, n.78, p.1805-1859. Sep. 2007. (Abstract).
TAYLOR, M.; FORSTER, J.; LANGER, B.; TAYLOR, B.; GREIG, P.; MAHUT, C. A
Study of Prognostic Factors for Hepatic Resection for Colorectal Metastases. Am J
Surg, Toronto, Canada, v. 173, 467-471, Jun. 1997.
The Brisbane 2000 terminology of Liver Anatomy and Resections. HPB Surg 2000;
2:333–339.
THELEN, A.; JONAS, S.; BENCKERT, C. et al. Simultaneous versus staged liver
resection of synchronous liver metastases from colorectal cancer. Int J Colorectal
Dis, v.22, p.1269–1276. Feb. 2007.
VAUTHEY, J.N.; PAWLIK, T.M.; RIBERO, D. et al. Chemotherapy regimen predicts
steatohepatitis and an increase in 90-day mortality after surgery for hepatic colorectal
metastases. J Clin Oncol, v. 24, n.13, p.2065-2072. May. 2006.
WEARING, B.; KRABBE, P.F.; JAGER, G.J. et al. The Impact of fluor-18deoxyglucose-positron emission tomography in the management of colorectal liver
metastases. Cancer, v.104, p.2658. 2005.
WEBER, S.; JARNAGIN, W. DEMATTEO, R.; BLUMGART, L.; FONG, Y. Survival
After Resection of Multiples Hepatic Colorectal Metastases. Ann Surg Oncol, v.7, n.9,
p. 643-650, Mar. 2000.
WEI, A.C.; GREIG, P.D.; GRANT, D, et al. Survival after Hepatic Resection for
Colorectal Metastases: A 10-years Experience. Ann Surg Oncol, Ontario, Canadá. v.
13, n. 5, p.668-676. Mar. 2006.
WRAY, C.J., LOWY, A.M., MATHEWS, J.B. et al. The Significance and Clinical
Factors Associated With a Subcentimeter Resection of Colorectal Liver Metastases.
Ann Surg Oncol, v.12, n.5, p.1-5. 2005.
YAN, TD.; LIAN, K.Q.; CHANG, D.; MORRIS, D.L. Management of intrahepatic
recurrence after curative treatment of colorectal liver metastases. Br J Surg, v.93, n.
7, p.854-859. Jul. 2006. (Abstract)
ZACHARIAS, T.; JAECK, D.; OUSSOULTZOGLOU, E.; BACHELLIER, P.; WEBER,
J.C. First and Repeat Resection of Colorectal Liver Metastases in Elderly Patients
Ann Surg, v. 240, n.5, p. 858–865. Nov. 2004.
ZAKARIA, SHAHEEN,; DONOHUE, J.H.; QUE, F.G. et al. Hepatic Resection for
Colorectal Metastases Value for Risk Scoring Systems? Ann Surg, v. 246, n. 2, p.
183–191. Aug. 2007.
ORIGINAL ARTICLE
Prognostic Factors in Patients submitted to Hepatectomy for Colorectal Liver
Metastases, Experience from one Brazilian Cancer Center.
Sergio Lopez T 1,3, Eduardo Leite 1, Amanda Nicoladeli 1, Maria E. Pinto 2, Gabriela
Coral 2, Antonio Nocchi Kalil 1,3.
from The Departments of Surgical Oncology 1, Public Health 2 and Hepathology
Postgraduade Course 3, The Universidade Federal de Ciencia da Saude de Porto
Alegre, Centro de Cancer Hospital Santa Casa, Porto Alegre, Brazil.
Correspondence and reprints to:
Antonio Nocchi Kalil
Department of Surgical Oncology
The UFCSPA, Hospital Santa Casa, Porto Alegre, Brazil.
Runnig head: surgery of colorectal liver metastases
61
ABSTRACT
Purpose: To evaluate the survival of patients undergoing hepatic resection for
metastases from Colorectal Liver Metastases (CRLM).
Patients and Methods: On the Cancer Center of the Hospital Santa Casa southern
Brazil, from November 1993 to March 2008, data of 173 patients with CRLM
(historical cohort) were collected prospectively. We analyzed outcome of patient who
underwent resection of CRLM, we considered the clinical, histopathological and perioperative of 137 patients. Analysis of survival was performed using the Kaplan-Meier
model, and calculation of significance by * log-rank *.
Results: The overall survival at 1, 3 and 5 years was 82%, 43% and 32.3%
respectively, with an average of 31.7 months. There were 3.6% of peri-operative
death and 23.4% of complications. In univariate analysis the statistically significant
difference in gender, age, levels of CEA, length of resection of metastases, neoadjuvant chemotherapy, number of lesions, distribution of lesions in the liver,
histological grade, peri-operative complications and decade of liver resection . In
multivariate analysis was associated with better survival: female gender (p = 0.007),
serum levels of CEA less than 100 ng / mL (p = 0,031); parachronism lesion (p =
0,011), neoadjuvant chemotherapy (p = 0,028); one lobe distribution, and no
postoperative complications (p = 0.0109).
Conclusion: Hepatic resection remains the therapy of choice in patients with
metastases in CRC, offers a good long-term survival, especially in females, one lobe
distribution of lesions, and in the absence of postoperative complications.
Key-Words: liver metastases, colorectal cancer, prognostic factors, liver resection.
62
INTRODUCTION
Colorectal cancer each year total almost 950 000 cases new, being the fourth
most common cause of cancer worldwide and second in developed countries. The
liver is the most affected by CRLM, occurs in approximately 65% of patients, and
only 25% present a viable tumor resection at diagnosis, liver metastases are the
leading cause of morbidity and patient mortality (2). Although only 20 of the patients
benefited from surgery, this treatment offers is associated with improved survival of
patients with a survival rate between 30% and 45% at five years, (3,4,5). The old
criteria for LR (6), have been expanded due to better and more efective
chemotherapy (2). Has been considered numerous factors associated with survival,
including patient characteristics, (4,7), the primary tumor and metastases, (4,5,7-15).
Some data suggest that patients can be identified with high risk for extrahepatic
disease using a hidden count clinical risk for outcomes after liver resection of these
have been used some criteria to select the preoperative whow patient benefit from
LR (4,15). We sought to know the survival of patients with MCL undergoing LR a
center of Cancer, Hospital Santa Casa, southern Brazil, period 1993-2008.
PATIENTS AND METHODS
Patient populations and definitions
Between November 1993 and March 2008, the date on 137 who underwent
surgical resection Were Were Collected prospectively for CLM (history cohort) in the
Cancer Center, Hospital Santa Rita (CCHSR) of a Hospital in Southern Brazil. We
excluded patients who had extrahepatic metastatic disease unresectable not
submitted to biopsy or only radiofrequency ablation.
The Study and Confidentiality Agreement were approved by the Ethics Committee
and research Santa Casa de Misericordia de Porto Alegre.
Preoperative assesment
The policy of the CCHSR make the preoperative clinical evaluation was done
in conjunction with the oncology clinic, assessing the patient, laboratory tests and
radiologic studies in the images. For planning the surgery, diagnostic images were
reviewed (ultrasonography and computed tomography, magnetic resonance. If the
patient had CRLM of resection was feasible routed to LR, the contrary, the patient
63
first received chemotherapy, imaging studies were done after the 3 or 5
chemotherapy cycles, the surgery was indicated.
Surgical Procedure:
Liver resections with curative intent were performed, However other
techniques were used, ie, radiofrequency ablation and intraabdominal resections.
The stars with the surgery laparotomy exploration, bimanual palpation liver
intraoperative ultrasonography were carried out to define the location of the CRLM
and their relations with vascular structures. Parenchymal transection was performed
using Kellyclasy technique, with eletrocautery, or LigaSure ultrasicion. Major
hepatectomy was defined including the liver resection 3 or more contiguous liver
segments. Usually the recovery patients was in the Intensive Care Unite for the first
24 or 48 hours, until to get clinic stabilization. After discharge, the patient was sent to
the clinic every three months in the first year. Survillance included imagen CT of the
thorax, abdominal and pelvis, and control laboratory tests.
Perioperative results:
Postoperative morbidity, mortality, 30 days rates were evaluated.
Postoperative complications were graded using the Dindo classification, inside that
major postoperative complications graded 3 or more in the Dindo classification was
evaluated. Cumulative overall postoperative morbidity and mortality rates were
defined as the ratio of patients with postoperative complications and the ratio of
postoperative death, respectively, after the primary tumor and/or resection of CLM.
Postoperative period and long-term outcomes:
Overall survival rates was calculated from the time of liver resection and the
last follow up or the date of death of the patient.
Statistical analysis:
Quantitative and qualitative variables were expressed as mean (range), and
frequency. Overall survival was calculated using the Kaplan Meier method and
compared using the log rank test. To detect factors associated with survival in
patients, univariate analysis was used to examine the relationship between the
64
survival and the following variables: age, gender, location of the primary tumor, nodes
status of the primary tumor, sateg of the primary tumor, time of diagnostic CRLM in
the relations with the primary tumor, number of CRLM, the size of CRLM, localization
CRLM in the liver, CEA plasma level > 5 ng/dL, preoperative or postoperative
chemotherapy, the type of chemotherapy, the type of liver resection (major
hepatectomy for three or more segments liver), associated procedures, blood lost
during the surgery, transfusions, ocurrence of postoperative complications,
anatomopathology report, and the period the surgery was perfomed before 2001 or
after. All variables associated with survival with p <_ 0.2 in a univariate proportional
hazard model were subsequently entered into a Cox multivariate regression model.
Values of p < 0.05 were considered statistically significant. Comparisons between
groups were analyzed with the chisquare or Fisher exact test for proportions
(contingence table). Stastistical analysis was performed using the statistical
sowfware package SPSS version 13.0 (SPSS).
RESULTS
Patients and Tumor Characteristcs
This study of 137 patients underwent liver resection of CRLM were 69 (50.4%)
male gender, the median patient age was 57 years (IQ 50-65) and the half of the m
had a primary colon tumor (70/137). Most CRLM presentation was metachronous
(86/62.8%). The mean of CRLM was 2.1 (DS 1.6), the majority the patients received
preoperative chemotherapy (62%). All characteristics are detailed in table 1.
Perioperatives outcomes and postoperative morbidity and mortality
Perioperative and postoperative characteristics of the 137 patients who
underwent resection of CRLM as listed in table 2. Most patients underwent with
major hepatectomy (56/59.1%). The bisectomy and right hepatectomy were the most
common procedures performed with 28.5% (39/137) and 23.6% (36/137),
respectively, and one third of the patients underwent additional procedures (31%).
The median estimated blood loss was 400 mL (IQ25-75, 250-800). The median
Intensive United Care and hospital stay was 3 and 8 days, respectively.
As to mediate postoperative outcomes, there were 5 (3.6%) deaths postoperative,
with 23.4% (32/137) of complications. Regarding the histopathological analysis, the
65
median diameter of lesions was 4.5 cm (intervals 3-6.1). Resection margin free (R0)
was 78.1% (107/137).
Survival:
With a median follow-up of 28 months, overall median survival 31.7 months
(range 1 to 134 months), with 1-year, 3-year, and 5-year actuarial overall survival rate
were 82%, 43% and 32.3% respectively (Figure 1). This analysis included
perioperative deaths 5 patients, excluding these, we obtained 34.7% 5-year overall
survival rate.
In this study we analyzed the time when liver resection was performed in
relation with 2001 year, we found 40.6% 5-year overall survival rate in the patients
underwent after 2001, in comparison with 17.9% 5-year before this time (p = 0.058)
(figure 2).
Univariate and multivariate predictors of survival following resection of CRLM
Results of univariate and multivariate analysis for factors associated with
survival following LR of CRLM are detailed in table 3 and 4 respectively.
Univariate analysis showed difference was statistically significant for the
following variables and their categories: sex, age, preoperative CEA level >50 ng/mL,
period of resection of metastases from diagnosis of primary tumor, preoperative
chemotherapy, number of lesions, distribution in the liver, histology grade of
metastases, perioperative complications and decade of liver resection.
In multivariate analysis, male gender (p = 0.002, hazard ratio = 2.09, confidence
interval 95% = 1.31-3.34); preoperative CEA level >50 ng/mL (p = 0.010, hazard ratio
= 1.97, confidence interval 95% = 1.17-3.31); synchronous lesion (P = 0.012, hazard
ratio = 1.77, confidence interval 95% = 1.34-2.77), not preoperative chemotherapy (p
= 0.051 hazard ratio = 1.56, confidence interval 95% = 0.99 - 2.44), bilateral
metastases and postoperative complications (p = 0.006, hazard ratio = 1.841,
confidence interval 95% = 1.18-2.85) were independent factors associated to overall
survival.
66
DISCUSSION
The reported survival after surgical resection is the MHCCR quite wide,
ranging between 25% and 60% in 5 years, being anyway superior to that offered by
not surgical management obtained exclusively by chemotherapy, cryoablation or
radiofrequency albation: 3%, 22% and 27% respectively (15, 7, 16). In this study, the
median survival was found 31.7 months, being in one, three and five years of 82%,
43% and 32.3%, respectively. These results are close to reported in large series the
past two decades (4, 8, 10, 14, 16-20, 29,30). On the other hand, there are large
series reporting good survival in selective patients very, 40% and 60% (3, 21, 11, 23,
24, 13, 25, 26, 27, 28). Survival in this study, as mentioned above, is similar to the
results of previous authors, reinforcing the idea that the LR is the therapy of choice
for colorectal cancer liver metastases.
On the other hand, was observed that the majority of patients received as a basis
chemotherapy flouruoracil (5-FU) and leucovorin alone that now be combined with
the use of oxaliplatin or irinotecan and recently with bevacizumab as first line
chemotherapy treatment (22,31). Nevertheless, it is observed that the neo-adjuvant
chemotherapy had a positive effect in patients with a survival two times higher in
patients who received. This finding was also recorded by Pawlik et al. and Adam et al
(32; 33). Regarding the results presented here, the fact that the female and younger
than 65 years resulting in good prognostic factors, this is probably due is a subgroup
of patients with better expected life, with better biologic response after resection.
Findings similar are found in the literature (7, 8, 23, 33, 35, 36). This study has some
limitations translated by absence of clinical information related to the classification
Dukes and level of preoperative CEA in approximately 30% of the sample. However,
patients with preoperative CEA levels >50 ng/mL, and the bilateral location of
metastases, were associated with worse prognosis. It is considered that these
conditions reflect both an advanced and aggressive disease. The location of the liver
metastases was reported bilateral as a factor of poor prognosis by several authors (8
17, 11 26; 28; 36). Similarly, synchronous metastases of worse survival in this series,
which shows the aggressiveness of tumor, already proven in several major case
series (4, 8-10, 16, 29, 34). Among the perioperative outcomes, as would be
expected, the presence of complications resulted in a factor independent poor
prognostic outcome like Vauthey et al, in their series found (37). Moreover, the type
67
of liver resection, the estimated bleeding and duration of surgery were not associated
with the prognosis. In the study of Khuri et al. the occurrence of complications within
the first 30 days after different surgical procedures of high complexity led to the
decreased survival in the long term. It is postulated that the inflammatory and
immune response inadequate would be responsible for this poor survival (38).
Fernandez et al. reported no change in survival over time (21), but several authors
showed a better survival in the recent period (14,39-40). In this study, we found the
same propensity in patients operated on from 2001, which had a survival above 50%
compared with 18% of those operated before this date. Probably this is due to the
following advances: better training of the surgical team, the better anesthetic
technique, new instruments resection and ablation, two stages LR, new
chemotherapy drugs as well as the advent in diagnostic techniques (21, 41, 42).
The patient selection is more important that the characteristics of metastases,
although the two conditions are crucial for the success of resection curative (2). On
the other hand, increasing the criteria for resectability have expanded to a larger
group of patients due to groups' experience of liver surgery, as well as the advent of
new drugs (43,44, 45).
In conclusion, although 5-year survival was 32.3% in variated group of patient with
CRLM, this is s good outcome in report one of the largest case series consecutive
conducted by the same team in Brazil, results are quite similar to those published in
large international centers in terms of survival, mortality and morbidity, reaffirming the
liver resection as the best treatment for these patients. We confirmed that better
survival of patient with CRLM dependent overall of the biologic characteristic of the
tumor, in that we need to know more about the molecular biology of this kind of
tumor. However, this study focuses on the experience of a center Cancer in southern
Brazil that the, number of procedures liver, it is considered a center of high-volume,
positive influence on patient survival, as analyzed by Fong et al. (46).
68
Authors Contributions
Study conception and designs: Kalil, Lopez T.
Aquisition of data: Lopez T, Leite. Vittoreti.
Analysis and interpretation: Lopez T. Kalil, Pinto, Coral.
Drafting of manuscript: Lopez T, Kalil, Coral
Critical revision: Lopez T, Leite, Pinto, Coral, Kalil
Acnkowledgements
The authors thank Secretaria da Saude de Rio Grande do Sul for provide the data
set use in this study and Orieta de Lima to provide the liver resection data base.
REFERENCES
1.
Jemal A, Siegel R, Ward E, Hao Y, Xu J, Thun MJ: Cancer statistics, 2008. CA
Cancer J Clin 58:71-90, 2008.
2.
Abdalla E, Vauthey JN, Ellis LM, et al: Recurrence and outcomes following
hepatic resection, radiofrequency ablation, and combined resection/ablation for
colorectal liver metastases. Ann Surg 239: 818–27, 2004.
3.
Pawlik T, Schulick R, Choti M. et al: Expanding criteria for resectability of
colorectal liver metastases. The Oncologist 13:51-64, 2008.
4.
Fong Y, Fortner J, Sun R, Brennan M, Blumgart L: Clinical score for predicting
recurrence after hepatic resection for metastatic colorectal cancer analysis of
1001 consecutive cases. Ann Surg 230:309–21, 1999.
5.
Poston G, Adam R, Alberts S, et al: OncoSurge: A strategy for improving
resectability with curative intent in metastatic colorectal cancer. J Clin Oncol 23:
7125-7134, 2005.
6.
Ekberg H, Tranberg K.G, Anderson R, et al: Determinants of survival in liver
resection for colorectal secundaries. Br J Surg 73:727-731, 1986.
7.
Heslin M, Medina-Franco H, Parker M, Vickers S, Aldrete J, Urist M: Colorectal
hepatic metastases resection, local ablation, and hepatic artery infusion pump
are associated with prolonged survival. Arch Surg 136:318-23, 2001.
8.
Gayowski TJ, Iwatsuki S, Madariaga JR. et al: Experience in hepatic resection
for metastatic colorectal cancer: Analysis of clinical and pathologic risk factors.
Surg 119:703-11, 1994.
9.
Minagawa M, Makuuchi M, Guido Ti, et al: Extension of the frontiers of surgical
indications in the treatment of liver metastases from Colorectal Cancer: LongTerm Results. Ann Surg 231: 487–99, 2000.
10.
Chedid A, Villwock M, Chedid M, Rohde L. Fatores prognósticos na ressecção
de metástases hepáticas de câncer colorretal. Arq Gastroenterol 3:159-65.
2003.
11.
Herman P, Machado M.C, Diniz A, Coimbra F, Sallum R, Montagnini A: Surgical
treatment of colorectal cancer hepatic metastases. Experience of A.C. Camargo
Cancer Hospital-São Paulo. Applied Cancer Research 26:88-93, 2006.
12.
Aloia TA, Vauthey JN, Loyer EM, et al: Solitary colorectal liver metastasis
resection determines outcome. Arch Surg 141:460-467, 2006.
13.
Butte J M, Jarufe N, Bellolio F, et al: Factores pronósticos de pacientes con
metástasis hepáticas de cáncer de cólon y recto. Rev. Chilena de Cirugía.
59:293-98, 2007.
14.
Jonas S, Thelen A, Benckert C, et al. Extended resections of liver metastases
from colorectal cancer. World Journal of Surgery 31:511-21, 2007;.
15.
Scheele J, Stang R, Alterndorf-Holman A, Paul M: Resection of colorectal liver
metastases. World J Surg 19:59, 1995.
16.
Schindler M, Wigmore SJ, Currie EJ, Laengle F, Garden OJ: Prognostic scoring
in colorectal cancer liver metastases development and validation. Arch Surg
140:183-189, 2005.
17.
Bolton J, Fuhrman G et al: Survival After Resection of Multiple Bilobar Hepatic
Metastases From Colorectal Carcinoma. Ann Surg 2000; 231:743-51.
18.
Weber S, Jarnagin W, DeMatteo R, Blumgart L, Fong Y: Survival after resection
of multiples hepatic colorectal metastases. Ann Surg Oncol 7:643-50, 2000.
19.
Elias D, Sideris L, Pocard M, et al: Results of R0 resection for colorectal liver
metastases associated with extrahepatic disease. Ann Surg Oncol 11:274–280,
2004.
20.
Rees M, Tekkis PP, Welsh FK, O’Rourke T, John TG: Evaluation of long-term
survival after hepatic resection for metastatic colorectal cancer a multifactorial
model of 929 patients. Ann Surg 247:125–135, 2008.
21.
Fernandez F, Drebin J, David C, et al: Survival after resection of hepatic
metastases from colorectal cancer in patients screened by positron emission
tomography with f-18 fluorodeoxyglucose (FDG-PET). Ann Surg 240:438–
50,2004.
22.
Kopetz S, Chang G, Overman M, Eng C, Sargent D, Larson D, Grothey A,
Vauthey J, Nargoney D. Improved survival in metastatic colorectal cancer is
associated with adoption of hepatic resection and improved chemotherapy. J
Clin Oncol 27:3677-3683, 2009.
23.
Wei A, Greig P, Grant D, Taylor B, Langer B, Gallinger S: Survival after hepatic
resection for colorectal metastases: A 10-years experience. Ann Surg Oncol
13:668-76, 2006.
24.
Nagashima I, Takada T, Adachi M, Nagawa H, Muto T, Okinaga K. Proposal of
criteria to select candidates with colorectal liver metastases for hepatic
resection: Comparison of our scoring system to the positive number of risk
factors. World J Gastroenterol 12: 6305-09, 2006.
25.
Aloia T, Sebagh M, Plasse M. et al: Liver histology and surgical outcomes after
preoperative chemotherapy with fluorouracil plus oxaliplatin in colorectal cancer
liver metastases. J Clin Oncol 24: 4983, 2006.
26.
Malik HZ, K. Rajendra Prasad, Karim J. Halazun, et al: Preoperative prognostic
score for predicting survival after hepatic resection for colorectal liver
metastases. Ann Surg 246:806–814, 2007.
27.
Taniai N, Akimaru K, Yoshida H, Tajiri T. et al: Surgical treatment for better
prognosis of patients with liver metastases from colorectal cancer.
Hepatogastroenterology 54:1805-9, 2007..
28.
Tanaka K, Shimada H, Ueda M, Matsuo K, Endo I, Togo S. Role of hepatectomy
in treating multiple bilobar colorectal cancer metastases. Surgery 143:259-270.
2008.
29.
Arru M, Aldrighetti L, Castoldi R, et al: Analysis of prognostic factors influencing
long-term survival after hepatic resection for metastatic colorectal cancer. World
J Surg 32:93-103, 2008.
30.
Gomez D. Sangha V, Morris-Stiff G, Malik H.Z, Guthrie A, Toogoog G, Lodge J,
Prasad K. Outcomes of intensive surveillance after resection of hepatic
colorectal metastases. Br J Surg 97:1552-1560, 2010.
31.
Kishi Y, Zorsi D, Contreras C, Maru D, Kopetz S, Ribero D, et al: Extended
preoperatice chemotherapy does not improve pathologic response and increase
postoperative liver insufficiency after hepatic resection for colorectal liver
metastases. Ann Surg Oncol published on line June 2010.
32.
Pawlik T.M,
Scoggins CR, Zorzi D, et al: Effect of surgical margin status on
survival and site of recurrence after hepatic resection for colorectal metastases.
Ann Surg 241:715-724, 2005.
33.
Adam R, Delvart V, Pascal G, et al: Rescue surgery for unresectable colorectal
liver metastases downstaged by chemotherapy: a model to predict long-term
survival. Ann Surg 240:644-658, 2004.
34.
Nordlinger B, Guiguet M, Vaillant JC, et al: Surgical resection of colorectal
carcinoma metastases to the liver a prognostic scoring system to improve case
selection, based on 1568 patients. Cancer 77:1254-1262, 1996.
35.
Leporrier J, Maurel J, Chiche L, Bara S, Segol P, Launoy G. A population-based
study of the incidence, management and prognosis of hepatic metastases from
colorectal cancer. Br J Surg 93:465-74, 2006.
36.
KATTAN, M.W.; GÖNEN, M.; JARNAGIN, W.R. et al. A Nomogram for
Predicting Disease-specific Survival After Hepatic Resection for Metastatic
Colorectal Cancer. Ann Surg, v.247, n.2, p.282–287. Feb. 2008.
37.
Vauthey JN, Pawlik TM, Ribero D, et al: Chemotherapy regimen predicts
steatohepatitis and an increase in 90-day mortality after surgery for hepatic
colorectal metastases. J Clin Oncol 24:2065-2072, 2006.
38.
Khuri SF, Henderson WG, DePalma RG, et al: Determinants of long-term
survival after major surgery and the adverse effect of postoperative
complications. Ann Surg 242:326-343, 2005.
39.
Choti M, Sitzmann J, Tiburi M, et al: Trends in long-term survival following liver
resection for hepatic colorectal metastases. Ann Surg; 235:759–66, 2002.
40.
Manfredi S, Lepage C, Hatem C, Coatmeur O, Faivre J, Bouvier AM.
Epidemiology and management of liver metastases from colorectal cancer. Ann
Surg 244:254–259, 2006.
41.
Lubezky N, Metser U, Geva R, et al: The role and limitations of 18-fluoro-2deoxy-D-glucose positron emission tomography (FDG-PET) scan and
computerized tomography (CT) in restaging patients with hepatic colorectal
metastases following neoadjuvant chemotherapy: comparison with operative
and pathological findings. J Gastrointest Surg 11:472–478,2007.
42.
Tan, MC: Castaldo ET, Gao F, et al: A prognostic system applicable to patients
with resectable liver metastasis from colorectal carcinoma staged by positron
emission tomography with [18F] fluoro-2-deoxy-D-glucose: role of primary tumor
variables. J Am Coll Surg 206:857-868, 2008.
43.
Masi G, Cupini S, Marucci L. et al: Treatment with 5-fluorouracil/folinic acid,
oxaliplatin, and irinotecan enables surgical resection of metastases in patients
with initially unresectable metastatic colorectal cancer. Ann Surg Oncol 13:
58-65, 2006.
44.
Alberts SR, Horvath WL, Sternfeld WC. et al: Oxaliplatin, fluorouracil, and
leucovorin for patients with unresectable liver-only metastases from colorectal
cancer: a north central cancer treatment group phase II study. J Clin Oncol
23:9243, 2005.
45.
Khatri VP, Petrelli NJ, Belghiti J. Extending the Frontiers of Surgical Therapy for
Hepatic Colorectal Metastases: Is There a Limit? J Clin Oncol 23:8490-9, 2005.
46.
Fong Y, Gonen M, Rubin D, Radzyner M, Brennan MF. Long-term survival is
superior after resection for cancer in high-volume centers. Ann Surg
242:54-547, 2005.
TABEL 1. Patient Clinicopathologic Characteristics underwent to Liver
Resection of CRLM (n=137).
Variable
Number (%)
Patient characteristics
Gender (male)
69 (50.4)
Age (median)
58 (50-65)*
Preoperative factors
CEA level (n=89)
Disease-free interval > 12 months
Preoperative chemotherapy
136.5
86 (62.8)
85 (62)
Primary tumor characteristics
Primary tumor site (colon)
70 (55.1)
N-positive disease
60 (43.8)
Dukes stage (n=93) > B
76 (82)
Hepatic metastasis characteristics
Tumor number (median)
Size of largest hepatic lesion (cm)
Bilateral disease
Poor/moderate grade tumor
*Median (Interquantiel Intervals 25-75)
2.1 (1-3)
4.5 (3-6.1)
52 (38)
117 (85.4)
TABEL 2. Perioperative and Postoperative outcomes (n=137).
Variable
Minor hepatic resection (two segments or less)
Number (%)
67 (48.9)
Non-anatomical resection/metastasectomy
28
Bisegmectomy
39
Major hepatic resection (three or more segments)
70 (59.1)
Left hemihepatectomy
19 (13.9)
Right hemihepatectomy
36 (26.3)
Central hepatectomy
6 (4.4)
Left trisegmentectomy
5 (3.6)
Right trisegmentectomy
4(2.9)
Additional procedure
Blood lost estimative (ml)
43 (32)
400 (250-800)
Transfusion (median)
39 (29)
Surgical time (median)
225 min
Complications
32 (23.3)
Margen R0 (> 1mm)
107 (78.1)
Mean UTI days
3 (2-3)
Mean hospital days
8(7-10)
FIGURA 1. Sobrevida Global após Hepatectomia por MCCR (n=137).
TABEL 3. Univariate and analysis of prognostics factor of survival in 137 patients
following resection of colorectal liver metastases.
Number (%)
Gender: Female
Male
Age: < 65 year
> 65 year
CEA level: < 50 ng/mL
> 50 ng/mL
Lesion Synchromous <12 m
Metachronous >12 m
Preoperative chemotherapy: Yes
No
Size Lesion: > 5 cm
< 5 cm
Lesion unique
multiples
Liver distribution one lobe
both lobe
Minor hepatectomy
Major hepatectomy
R0 (> 1 mm)
R1 (involved)
Histopathology tumor grade: Well
Moderate/poorly
Liver remnant: Normal
Steatotosis/hepatitis
Complication: No
Yes
Liver resection: before 2001
after 2001
68 (49,6)
69 (50,4)
107(68,5)
30 (21,9)
56 (40,9)
81 (59,1)
79 (57,7)
58 (42,3)
85 (62,0)
52 (38,0)
88 (64,2)
49 (35,8)
64 (43,7)
73 (57,3)
85 (62,0)
52 (38,0)
56 (40,9)
81 (59,1)
107 (78,1)
30 (21,9)
20 (14,6)
107 (85.4)
88 (64,2)
49 (35,8)
105 (76,6)
32(23,4)
39 (28,5)
98 (71,5)
5 year survival
44.0
19.7
35.1
12.1
49.4
33.1
24.3
40.4
35.5
23.1
28.7
33.0
40.0
20.3
40.1
17.4
37.4
28.3
33.7
25.9
52.4
23.9
31.6
24.5
34.8
12.6
17.9
40.6
p
0.009
0.023
<0.001
0.019
0.031
0.225
0.005
0.002
0.328
0.225
0.016
0.74
0.014
0.058
FIGURE 2. Comparison of survival after liver resection practiced before and after 2001
in 137 patients.
TABEL 4. Multivariate analysis of prognostic factors in survival in 137 patients
following resection of colorectal liver metastases
Hazard Ratio
95% IC
p
1
2.09
_
1.31-3.34
0.002
< 50 ng/mL
1
_
> 50 ng/mL
1.97
1.17-3.31
Yes
1
_
No
1.77
1.34 -2.77
Yes
1
_
No
1.56
0.99 - 2.44
One lobe
1
_
Both lobe
1.841
1.18-2.85
1
_
2.096
1.26-3.46
Gender
Female
Male
CEA level
0.010
Metachronous lesion
0.012
Preoperative chemotherapy
0.051
Liver distribution
0.006
Complication
Yes
0.004
Anexo
80
ANEXOS
Anexo
81
Anexo I
Categorização Operacional
Variável
Definição
Idade
Tempo transcorrido em anos desde o nascimento até Em anos
a data da cirurgia hepática.
Divisão biológica segundo o fenótipo do individuo.
Não mensurável
Gênero
Medição
Escore TNM e
Estádio Clínico Dukes
Estado clínico e patológico do tumor primário com
Não mensurável
relação ao tamanho do tumor, infiltração linfonodos e
metástases a distância.
Antígeno carcinoembrionário
Medição pré-operatório à hepatectomia do antígeno ng/mL
tumoral sérico.
Intervalo de ocorrência das
metástases
Número de metástases
Período de aparecimento das lesões a partir do
diagnóstico do tumor primário.
Quantidade de lesões identificadas por médio de
imagens radiológicas.
Divisões anatômicas do fígado segundo a
classificação de Couinaud.
Tratamento a base de drogas oncológicas recebido
pelo paciente com objetivo curativo ou paliativo.
Meses
Cirurgia realizada
Tipo de procedimento efetuado para ressecar as
lesões metastática segundo a International
HepatoPancreatoBiliar Association.
Não mensurável
Tipo de Hepatectomia
Ressecção hepática tomando em consideração o
Não mensurável
mumero de segmentos ressecados. (Bismuth 1983).
Tratamento Adicional
Procedimento de ablação das lesões adicionado ao
procedimento cirúrgico.
Não mensurável
Tempo cirúrgico
Duração do procedimento cirúrgico.
Minutos
Perda sangüínea
Quantidade de sangue que resultado procedimento
cirúrgico hepático.
mililitros
Transfusões sangüíneas:
Administração endovenosa de sangue e substituto
durante o ato cirúrgico
mililitros
Tamanho da Lesão
O maior diâmetro da lesão maior
cm
Alterações hepáticas patológicas
Estado histológico apresentado pelo parênquima
hepático.
Não mensurável
Segmentos
Tipo de Quimioterapia
Grau de diferenciação histológica. Característica morfológica de malignidade do tumor
metastático.
Margem de ressecção em
milímetros.
Linfonodos hepático
Estadia na UTI
Tipo de complicações
Morte operatória
Recorrência hepática
Recorrência extra-hepática
Recidiva e Tempo:
Re-ressecção hepática
Tratamento da recidiva
Mortalidade
Mensurável
Mensurável
Não mensurável
Não mensurável
Distancia da neoplasia na borda da peça ressecada milímetro
Infiltração de neoplasia nos linfonodos ressecado
quando identificado
Tempo de 24 horas de permanência pós-operatória
na Unidade de Cuidados Intensivo.
Resultado adverso na evolução pós-operatório do
pacientes, segundo a Classificação STROC
(Dindo, 2002).
Não mensurável
dias
Grau
I-IV
Óbito do paciente dentro dos 30 dias após a cirurgia Não mensurável
ou depois deste período se o paciente continua
hospitalizado
Aparecimento de lesões metastática após a
Não mensurável
ressecção hepática
Aparecimento de lesões metastática após a
Não mensurável
ressecção hepática
Aparição de novas lesões hepáticas ou extrahepáticas após a primeira ressecção hepática.
Tipo de procedimento efetuado para ressecar as
lesões metastática recidivantes.
Tratamento proporcionado à recorrência das
metástases
Mensurável
Óbito relacionado à doença.
Não mensurável
Não mensurável
Não mensurável
Escala
15 a 100
Homem
Mulher
pT
pN
pM
Dukes A B C D
<100 ng/dL,
100-200 ng/dL
>200 ng/dL
Sincrônica <12 meses
Metacrônica >12 meses
1 __ 2___ 3____
4____ 5___
mais ____
I, II, III, IV, V, VI, VII e VIII
Unilobar / Bilobar
Adjuvante
Neoadjuvante
5-Flouracilo, Ácido Fólinico Leucovorin,
Oxaliplastino, Irinotecan, outras.
Metastasectomia não anatômica
Bissetoretomia
Hepatectomia Direita
Hepatectomia Esquerda
Hepatectomia Central Trissetorectomia Esquerda
Trissetorectomia Direita
Hepatectomia menor = ressecção de 2 ou menos
segmentos
Hepatectomia maior = ressecção de 3 ou mais
segmentos.
Radiofreqüência
Quimioembolização
Crioablação
Quimioterapia arterial
intra-hepática
<120 minutos
120-180 minutos
>180 minutos
<500 mililitros
500-1000 mililitros
> 1000 mililitros
300 mililitros
600 ml
>600 ml
Cm
Normal
Esteatose
Fibrose
Cirrose
Pobremente
Moderadamente
Altamente
Livre= >1mm
Comprometido= <1mm
Comprometidos
Não comprometidos
2dias
> 2 dias
Insuficiência renal
Sepse/abscesso intra-abdominal
Pneumonia
Alteração gastrointestinal
Complicação neurológica
Outras
Sim
Não
Sim
Não
Cérebro
Pulmão
Intra-abdominal
Meses
Sim
Não
Cirúrgico
Radiofreqüência
Quimioterápico
Sim
Não
Meses
AnexoMensurável
II
FATORES DE SOBREVIDA EM PACIENTES SUBMETIDOS À HEPATECTOMIA POR
METÁSTASES DE CÂNCER COLORETAL, CENTRO DE CANCER HOSPITAL SANTA
RITA 1993-2008. POA, BRASIL.
Ficha de Colheita da informação
Sobrevida Global
Intervalo entre a ressecção hepática e morte ou
último acompanhamento do paciente.
1. Dados Pessoais Nome:
_______________________________________________________ID:_____________
•Idade:
Origem:
Sexo:
2. Estadiamento do Câncer Primário
Localização: Cólon
Sigmóides
Reto
Anexo
• pT____
N____
M____
Estádio Clínico Dukes: A B C D
•Período desde o diagnóstico do CCR até à Hepatectomia (meses):<6__ 6-12___ >12___
3. Antígeno Carcinoembrionário: <100 mg/dL 100-200mg/dL, > 200mg/dL
4. Imagens:
•Ecografia: Sim
Não
Tomografia Computadorizada: Sim Não
•Ressonância Magnética: Sim
Não
PET scan: Sim
Não
•Número de Nódulos 1__ 2___ 3____
4____ 5___ mais ____
•Segmentos I
II
III
IV
V
VI
VII
VIII
•1 Lobo
Bilobar
•Tamanho _______________ cm
5. Tratamento Qumioterápico
• Neo-adjuvante Sim
Não
Adjuvante: Sim
Não
• Esquemas: 5-FU/Oxiplatino_____ 5FU/Leucovorin______ 5FU/Irinotecan____ 5-FU/
Acido Folínico_____ Outro______
6. Tratamento regional auxiliar:
• Radiofreqüência ___
Quimioembolização_____
• Crioablação___
Quimioterapia intra-hepática arterial_____
• Quimioterapia IHA + Quimioterapia Sistêmica______
7. Tipo de Ressecção efetuado
a) Metastasectomia
b) Bissetoretomia
c) Hepatectomia Esquerda
d) Hepatectomia Direita
d) Trisstoretomia Esquerda
f) Trissetoretomia Direita
g) Hepatectomia Central
8. Estimativa de Perda Sangüínea:______ml; Transfusões sangüíneas: Sim__ Não__
Quantidade___________ ml
9. Anatomopatólogico No.___________
• Margem da ressecção: ____________ mm
• Alterações hepáticas: Esteatohepatite___________ Alteração vascular: _____________
• Grau : Leve______, Moderado____
Severo:_______
10. Tipo de complicações: Sim____
Não ______Grau de Complicação____
• Infecção FO: __ Pneumonia: ____Sangramento: _____ Disfunção Hepática: _____
• Insuficiência Renal: ________ Insuficiência Cardíaca: _____ Abscesso
•
Intra-abdominal:______ Alteração Neurológica: ______
Outra: ________
11. Recidiva: Sim____
Não ____
12. Localização: Hepática: Sim___
Não____
Extrahepática: Sim____
Não___
13. Número de lesões: _______
14. Tempo da recidiva em meses após a cirurgia: ____________meses
15. Reintervenção: Sim__ Não ___
1___
2___ >3
16. Ressecção efetuada na reintervenção (pergunta 8): _____
17. Tipo de tratamento adjuvante:
18. Causa e Data de óbito: _____________
82
Anexo
83
Anexo III
Termo de Consentimento Informado, Livre e Esclarecido.
(Confidencialidade dos Prontuários)
Estamos realizando um estudo retrospectivo para avalizar os fatores prognóstico da
sobrevida nos pacientes submetidos à Hepatectomia por Metástases de Câncer
Coloretal no Hospital Santa Casa, pelo qual devemos incluir a todos os pacientes
que foram operados nesse centro hospitalar durante os últimos 14 anos.
Para tal fim, precisamos registrar o nome dos pacientes conforme as estatísticas e
revisar as anotações armazenadas nos prontuários em quanto a: dados gerais do
paciente, diagnósticos e resultados de exames laboratoriais, tratamento médico e
cirúrgico, anatomopatológico da peça cirúrgica, evolução pós-operatória e
acompanhamento no ambulatório.
É compromisso dos pesquisadores garantir e manter o sigilo e privacidade tanto das
informações dos pacientes, resultados de exames, descrição operatória e registro
das evoluções pela equipe médica assim como das informações armazenadas no
banco de dados.
_______________________________________
Pesquisador
Anexo
84
Anexo IV
Terminologia da anatomia segmentária e das ressecções do fígado
Terminologia anatómica segmentaria do Fígado
Anexo
85
Anexo
86
Anexo
87
Anexo
88