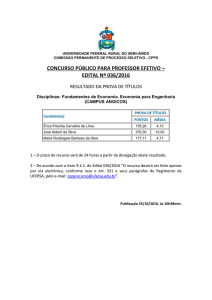
Universidade Federal Rural do Semi-Árido - UFERSA
1. Reações de Ácidos Carboxílicos e Seus Derivados
O grupo carboxila (―CO2H ou ―COOH), é um dos grupos funcionais mais
amplamente encontrados na química e na bioquímica. Não apenas os próprios ácidos
carboxílicos são importantes, mas o grupo carboxila é o grupo gerador de uma família
enorme de compostos relacionados chamados compostos acílicos ou derivados de
ácido carboxílico.
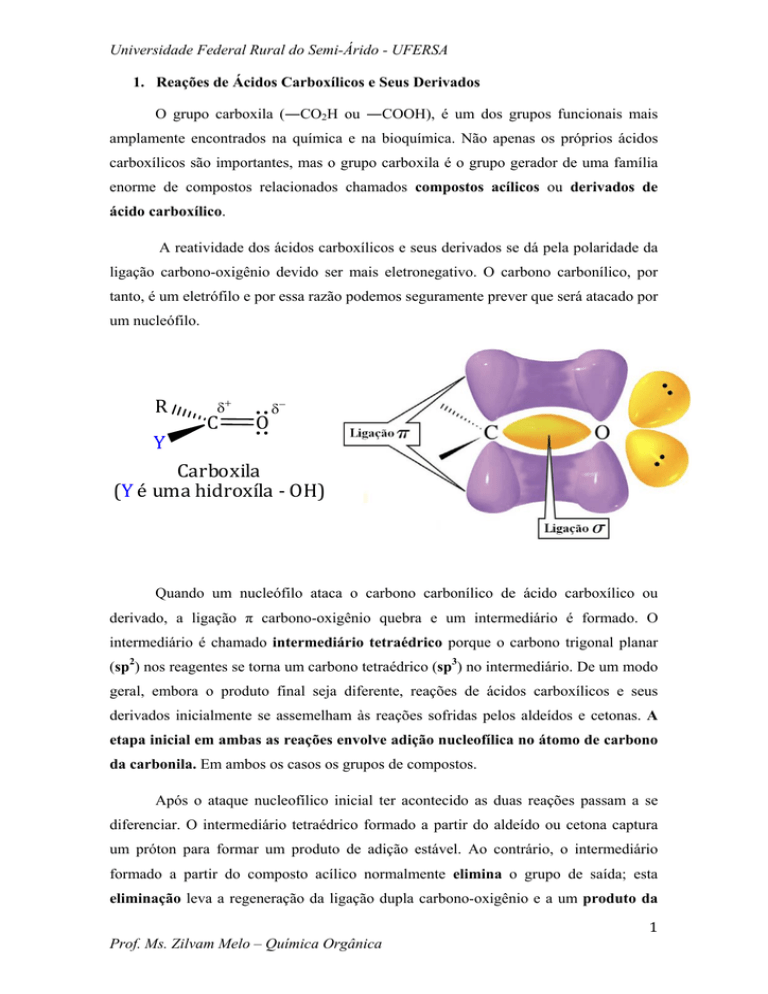
A reatividade dos ácidos carboxílicos e seus derivados se dá pela polaridade da
ligação carbono-oxigênio devido ser mais eletronegativo. O carbono carbonílico, por
tanto, é um eletrófilo e por essa razão podemos seguramente prever que será atacado por
um nucleófilo.
R
Y
δ+
C
O
δ−
Carboxila
(Y é uma hidroxíla ‐ OH)
Quando um nucleófilo ataca o carbono carbonílico de ácido carboxílico ou
derivado, a ligação π carbono-oxigênio quebra e um intermediário é formado. O
intermediário é chamado intermediário tetraédrico porque o carbono trigonal planar
(sp2) nos reagentes se torna um carbono tetraédrico (sp3) no intermediário. De um modo
geral, embora o produto final seja diferente, reações de ácidos carboxílicos e seus
derivados inicialmente se assemelham às reações sofridas pelos aldeídos e cetonas. A
etapa inicial em ambas as reações envolve adição nucleofílica no átomo de carbono
da carbonila. Em ambos os casos os grupos de compostos.
Após o ataque nucleofílico inicial ter acontecido as duas reações passam a se
diferenciar. O intermediário tetraédrico formado a partir do aldeído ou cetona captura
um próton para formar um produto de adição estável. Ao contrário, o intermediário
formado a partir do composto acílico normalmente elimina o grupo de saída; esta
eliminação leva a regeneração da ligação dupla carbono-oxigênio e a um produto da
1 Prof. Ms. Zilvam Melo – Química Orgânica
Universidade Federal Rural do Semi-Árido - UFERSA
substituição. O processo global no caso da substituição acílica ocorre, portanto, pelo
mecanismo adição-eliminação nucleofílica.
Os compostos acílicos reagem desta forma porque todos eles possuem bons
grupos de saída (ou eles podem ser protonados para vir a se tornar bons grupos de
saída), ou razoavelmente bons, ligados ao átomo de carbono carbonílico.
a) Mecanismo geral para reação onde o nucleófilo está carregado negativamente
1o Etapa: Reação de adição
δ−
O
O
δ+
C
Nu
+
R
R
C
Y
C
Nu
Y
2 o Etapa: Reação de eliminação
O
R
-
O
Nu
C
R
Y
+
Y‐
Nu
b) Mecanismo geral para reação onde o nucleófilo está eletricamente neutro
1 o Etapa: Reação de adição
δ−
O
δ+
R
C
O
+
Nu
H
R
Y
C
Y
-
O
+
Nu
H
R
-
C
YH
+
2 Prof. Ms. Zilvam Melo – Química Orgânica
Nu
Universidade Federal Rural do Semi-Árido - UFERSA
2o Etapa: Reação de eliminação
O
R
C
O
Nu
YH
+
C
R
+
HY
Nu
2. Reatividades Relativas dos Ácidos Carboxílicos e Seus Derivados
Ambas as etapas são reações de equilíbrio, portanto, a eliminação de Y- ou Nudepende de suas basicidades relativas. A base mais fraca é preferencialmente eliminada.
Como discutido em aulas anteriores, quanto mais forte for o ácido (menor valor de pKa)
mais fraca será a base conjugada. Deste modo, quanto mais fraca for a base ligada à
carboxila melhor será como grupo de saída.
Em outras palavras, numa reação de adição-eliminação nucleofílica, devemos
avaliar qual grupo de saída ligado será a base mais fraca (menor valor de pKa), pois este
grupo que será preferencialmente eliminado ao restaurar a dupla ligação carbonooxigênio. Abaixo temos a ordem de reatividade relativa do ácido carboxílico e seus
derivados. Observe que os haletos de acila apresentam a maior reatividade de todos.
Isso se deve ao fato destes compostos liberarem Cl- ou Br- que são as bases mais fracas.
Como o HCl e o HBr são ácidos muito fortes (apresentam baixos pKa), suas bases
conjugadas são muito fracas e, por tanto, são bastante estáveis. Já as amidas o grupo
NH2 é um mau grupo de saída, pois é uma base relativamente forte. Mais abaixo temos
uma tabela com valores de pKa para grupos de saída de ácido carboxílico e seus
derivados:
3 Prof. Ms. Zilvam Melo – Química Orgânica
Universidade Federal Rural do Semi-Árido - UFERSA
Perceba nos mecanismos abaixo que o grupo de saída (sofre a eliminação)
sempre apresenta menor valor de pKa. Veja a seguir algums exemplos específicos:
a) Mecanismo para a conversão de haleto de acila em éster:
b) Mecanismo para a conversão de haleto de acila em anidrido:
4 Prof. Ms. Zilvam Melo – Química Orgânica
Universidade Federal Rural do Semi-Árido - UFERSA
c) Mecanismo para a conversão de amida em ácido carboxílico (hidrólise catalisada
por ácido):
Uma amida não pode ser hidrolisada sem catalisador. Um catalisador ácido torna um grupo um melhor grupo de saída. d) Mecanismo para a conversão de anidrido em éster (e em um ácido carboxílixo:
5 Prof. Ms. Zilvam Melo – Química Orgânica
Universidade Federal Rural do Semi-Árido - UFERSA
e) Mecanismo para a conversão de éster em ácido carboxílico (hidrólise ácida):
O excesso de água forçará o equilíbrio para a direita. Os alcoóis que têm baixos
pontos de ebulição podem ser removidos por destilação assim que são formados.
f) Mecanismo para a conversão de éster em ácido carboxílico (hidrólise básica):
6 Prof. Ms. Zilvam Melo – Química Orgânica
Universidade Federal Rural do Semi-Árido - UFERSA
g) Reação para a conversão de ácido carboxílico em éster (esterificação):
h) Reação para a conversão de óleo ou gordura em sais de ácido graxo
(saponificação):
3. Referências 1. SOLOMONS, T. W.; GRAHAM; CRAIG FRYHLE. Química Orgânica. 8. ed. Rio de Janeiro: LTC, 2005. 1 e 2 v. 2. BRUICE, P. Y. Química Orgânica. 4. ed. São Paulo: Pearson, 2006 3. ALLINGER, N. L. Química Orgânica. 2. ed. Rio de Janeiro: Guanabara, 1978. 7 Prof. Ms. Zilvam Melo – Química Orgânica