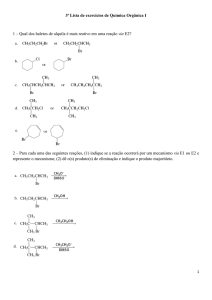
Problemas de revisão IX
Quando dissolvemos 7.4g de ácido propanoico
(CH3CH2COOH) em 1L de água, o pH da solução
obtida é 2.94. Qual é o pKa do ácido propanoico ?
1. Se fosse ácido forte qual seria o pH?
M(ácido prop)= 3 × 12 + 2 × 16 + 6 = 74 g/mol
1 mol
—
74 g
n
—
7.4 g
n = 0.1 mol
Se fosse ácido forte estaria todo dissociado, logo
[H3O+] = 0.1 mol / 1 L = 0.1 M ⇒ pH= - log 0.1 = 1
Não é ácido forte! (o pH é 2.94)
2. Dissociação de ácido fraco
←
CH3CH2COOH + H2O → CH3CH2COO- + H3O+
In.:
0.1
0
0
Eq.:
0.1-x (≈ 0.1)
x
x
pH=2.94 ⇒ [H3O+] = 10-2.94 = 1.15 × 10-3 = x
(
[H3O + ][CH3CH2COO - ] x 2
1.15 × 10 − 3
Ka =
=
=
[CH3CH2COOH]
0.1
0.1
pKa= -log Ka = 4.9
)
2
= 1.32 × 10 − 5
Problemas de revisão X
Qual é o pH duma solução 0.100 M de NaOH ?
É base forte. Está toda dissociada, logo
[OH-] = 0.100 M ⇒ pOH= - log 0.1 = 1
⇒ pH = 14 - pOH = 13
Esta é a situação ‘base forte em água’ !
Problemas de revisão XI
Qual é o pH duma solução 0.100 M de ácido
acético? (pKa = 4.74)
Esta é a situação ‘ácido fraco em água’ !
←
CH3COOH + H2O → CH3COO- + H3O+
In.:
Eq.:
0.1
0.1-x
(≈ 0.1)
0
x
[H3O+ ][CH3COO- ]
Ka =
[CH3COOH]
Ka= 10-4.74 = 1.82 × 10-5 = x2 / 0.1
⇒ x2 = 1.82 × 10-6
⇒ x = 1.35 × 10-3 M = [H3O+]
⇒ pH = - log 1.35 × 10-3 = 2.9
0
x
Problemas de revisão XII
Titulação de 50 mL de ácido acético 0.100 M com
NaOH 0.100 M. Calcular o pH a) no início da
titulação; b) depois de adicionar 25 mL de base; c)
no ponto de equivalência.
a) Só ácido acético em água. Situação ‘ácido fraco em
água’ ! É o problema anterior: obtivemos pH=2.9
b) Base adicionada reage com o ácido presente:
CH3COOH + NaOH → CH3COO- + H2O + Na+
Quantidade de base: 25×10–3 L × 0.100 M = 2.5 × 10–3mol
= Quantidade de AcH gasto = 2.5 × 10–3mol
= Quantidade de Ac- formado = 2.5 × 10–3mol
Havia 50×10–3 L × 0.100 M = 5.0×10–3mol de AcH
Há 5.0×10–3 - 2.5×10–3 mol = 2.5×10–3mol de AcH
[AcH]= 2.5×10–3mol / 75×10–3 L = 3.33 ×10–2 M
[Ac-]= 2.5×10–3mol / 75×10–3 L = 3.33 ×10–2 M
Solução
tampão
CH3COOH + H2O ←
→ CH3COO- + H3O+
[H3O+ ][Ac - ]
[H3O+ ] × 3.33 × 10-2
−5
Ka =
⇔ 1.8 × 10 =
[AcH]
3.33 × 10-2
pH = -log 1.8×10–5 = 4.7
Problemas de revisão XII
Titulação de 50 mL de ácido acético 0.100 M com
NaOH 0.100 M. Calcular o pH a) no início da
titulação; b) depois de adicionar 25 mL de base; c)
no ponto de equivalência.
c) Volume de NaOH adicionado para alcançar o p.e.:
50 × 0.100 = V × 0.100 ⇒ VNaOH = 50 mL
nbase = nácido = 5.0×10–3mol de AcH
Base adicionada reage com TODO o ácido presente:
CH3COOH + NaOH → CH3COO- + H2O + Na+
que é transformado em acetato (Ac-).
Quantidade de base: 50×10–3 L × 0.100 M = 5.0×10–3mol
= Quantidade de Ac- formado = 5.0 × 10–3mol
[Ac-]= 5.0×10–3mol / 100×10–3 L = 5.0 ×10–2 M
Situação ‘base fraca em água’ !
CH3COO- + H2O ←
→ CH3COOH + OH5.0 ×10–2
0
5.0 ×10–2 – x
x
≈ 5.0 ×10–2
Kb= 10-14 / 1.8×10–5 = 5.6×10–10 = x2 / 5.0 ×10–2
In:
Eq:
0
x
x = 5.3 ×10–6 M = [OH-] ⇒ pOH = 5.3 ⇒ pH = 8.7