GABARITO – Prof. Mauricio
1º) Em 30/09, exercício sobre a 2ª aula: Titulação potenciométrica de ácido fraco.
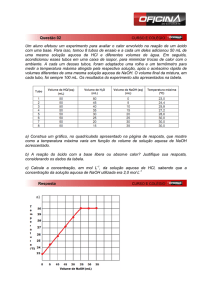
- Considere a titulação de 50,00 mL de uma solução de ácido acético (HAc) 0,1000 mol.L-1 com
uma solução de hidróxido de sódio (NaOH) 0,1000 mol.L-1. Qual o volume gasto de solução de
NaOH no ponto de equivalência (PE)? No PE o pH da solução resultante será ácido, neutro ou
básico? Justifique as duas respostas.
A titulação ácido/base é uma reação de neutralização que termina quando há o consumo total
de um dos reagentes (esse momento é apontado pelo indicador). Para a construção da curva
de titulação (volume de titulante vs pH) é necessária a adição de um excesso do reagente que
não é o limitante e sem isso não se encontra o perfil da curva. O ponto da curva que indica a
quantidade exata do volume do reagente no final da reação é chamado de ponto de
equivalência. A equação da reação em questão é
HAc(aq) + NaOH(aq) Na+(aq) + Ac-(aq) + H2O(aq)
No final da reação (PE) tem-se que nHAc = nNaOH. Pela concentração e volume de HAc encontrase nHAc. Assim, C = n/V(L) e nHAc = C x V(L) = 0,1000 mol.L-1 x 50,00.10-3 L = 5,000.10-3 mol.
Se nHAc = nNaOH e nNaOH = 5,000.10-3 mol, vem que V(L) = n/C = 5,000.10-3 mol / 0,1000 mol.L-1 =
5,000.10-2 L = 50,00 mL = Volume de equivalência (Veq).
No final da reação somente os produtos encontram-se em solução, ou seja, Na+ e Ac- e H2O.
Sendo que o íon Na+ encontra-se somente na forma dissociada (íon de base forte) enquanto
que o íon Ac- encontra-se parcialmente associado (base conjugada de ácido fraco) deslocando
o equilíbrio de ionização da água e ocasionando um aumento da concentração de íon OH- em
solução, conforme a equação abaixo.
Na+(aq) + Ac-(aq) + H2O(aq) Na+(aq) + HAc-(aq) + OH-(aq)
É possível concluir que o pH da solução deve aumentar devido ao aumento da concentração de
OH- deixando o pH da solução básico.