QUÍMICA GERAL
PROFESSOR JEFFERSON
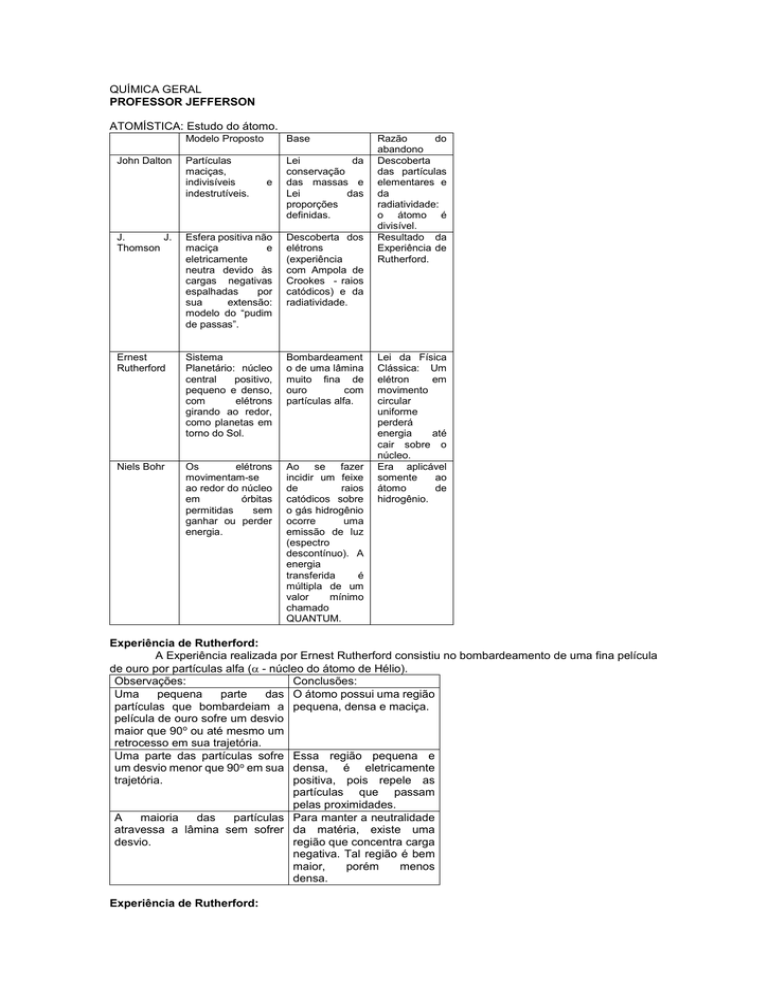
ATOMÍSTICA: Estudo do átomo.
John Dalton
Modelo Proposto
Base
Partículas
maciças,
indivisíveis
indestrutíveis.
Lei
da
conservação
das massas e
Lei
das
proporções
definidas.
e
J.
J.
Thomson
Esfera positiva não
maciça
e
eletricamente
neutra devido às
cargas negativas
espalhadas
por
sua
extensão:
modelo do “pudim
de passas”.
Descoberta dos
elétrons
(experiência
com Ampola de
Crookes - raios
catódicos) e da
radiatividade.
Ernest
Rutherford
Sistema
Planetário: núcleo
central
positivo,
pequeno e denso,
com
elétrons
girando ao redor,
como planetas em
torno do Sol.
Bombardeament
o de uma lâmina
muito fina de
ouro
com
partículas alfa.
Niels Bohr
Os
elétrons
movimentam-se
ao redor do núcleo
em
órbitas
permitidas
sem
ganhar ou perder
energia.
Ao se fazer
incidir um feixe
de
raios
catódicos sobre
o gás hidrogênio
ocorre
uma
emissão de luz
(espectro
descontínuo). A
energia
transferida
é
múltipla de um
valor
mínimo
chamado
QUANTUM.
Razão
do
abandono
Descoberta
das partículas
elementares e
da
radiatividade:
o átomo é
divisível.
Resultado da
Experiência de
Rutherford.
Lei da Física
Clássica: Um
elétron
em
movimento
circular
uniforme
perderá
energia
até
cair sobre o
núcleo.
Era aplicável
somente
ao
átomo
de
hidrogênio.
Experiência de Rutherford:
A Experiência realizada por Ernest Rutherford consistiu no bombardeamento de uma fina película
de ouro por partículas alfa ( - núcleo do átomo de Hélio).
Observações:
Conclusões:
Uma
pequena
parte
das O átomo possui uma região
partículas que bombardeiam a pequena, densa e maciça.
película de ouro sofre um desvio
maior que 90o ou até mesmo um
retrocesso em sua trajetória.
Uma parte das partículas sofre Essa região pequena e
um desvio menor que 90o em sua densa, é eletricamente
trajetória.
positiva, pois repele as
partículas que passam
pelas proximidades.
A
maioria
das
partículas Para manter a neutralidade
atravessa a lâmina sem sofrer da matéria, existe uma
desvio.
região que concentra carga
negativa. Tal região é bem
maior,
porém
menos
densa.
Experiência de Rutherford:
Modelo atômico de Rutherford:
Matéria descontínua (formada por “pedaços” - átomos).
Prova: Experiência de Rutherford com bombardeamento de uma película de ouro por partículas alfa ().
Átomo formado por núcleo e eletrosfera. O núcleo concentra a massa do átomo e tem partículas positivas
(prótons - p) e neutras (nêutrons - n) no seu interior. Já a eletrosfera fica na periferia do núcleo e contém
partículas negativas (elétrons – e-).
Postulados de Bohr:
1- Os elétrons se movem ao redor de um núcleo, central pequeno e positivo, em um número limitado de
órbitas (que varia para cada elemento) bem definidas chamadas órbitas estacionárias;
2- Cada órbita possui uma quantidade fixa de energia;
3- Movendo-se numa órbita estacionária o elétron não absorve nem emite energia espontaneamente;
4- Ao saltar de uma órbita para outra o elétron absorve ou emite uma quantidade bem definida de energia
chamada quantum de energia.
Evolução:
Dalton
Thomson
Rutherford / Bohr
prótons()
núcleo
ÁTOMO
nêutrons (0)
eletrosfer aelétrons ()
Átomos isolados: São átomos eletricamente neutros. Para isso temos número de prótons igual ao número
de elétrons (p = e-).
Íons: São átomos com carga elétrica, ou seja, p e-.
Se p > e- temos um cátion (átomo com carga positiva);
Se p < e- temos um ânion (átomo com carga negativa);
Número atômico (Z): número de prótons presentes no núcleo;
Número de massa (A): soma do número de prótons e nêutrons (A=Z+n ou A=p+n) ;
Representação:
A
Z
X ou
Z
XA
Obs.:
As propriedades químicas dos elementos dependem de Z;
Átomos com mesmo Z apresentam as mesmas propriedades químicas;
Elemento químico: conjunto de átomos com mesmo Z;
Em um átomo neutro: Z = p = e-;
Em um íon:
Se Z = p > e-, temos um cátion (íon com carga positiva);
Se Z = p < e-, temos um ânion (íon com carga negativa);
Isótopos: Átomos com mesmo Z e A diferentes;
14
12
Ex.: C e C .
Isóbaros: Átomos com mesmo A e Z diferentes;
Ex.:
40
19
K
e
40
20
Ca .
Isótonos: Átomos com mesmo número de nêutrons;
Ex.:
37
17
Cl
e
40
20
Ca .
Isoeletrônicos: Espécies que apresentam mesmo número de elétrons. Ex.:
CN
e
Si .












