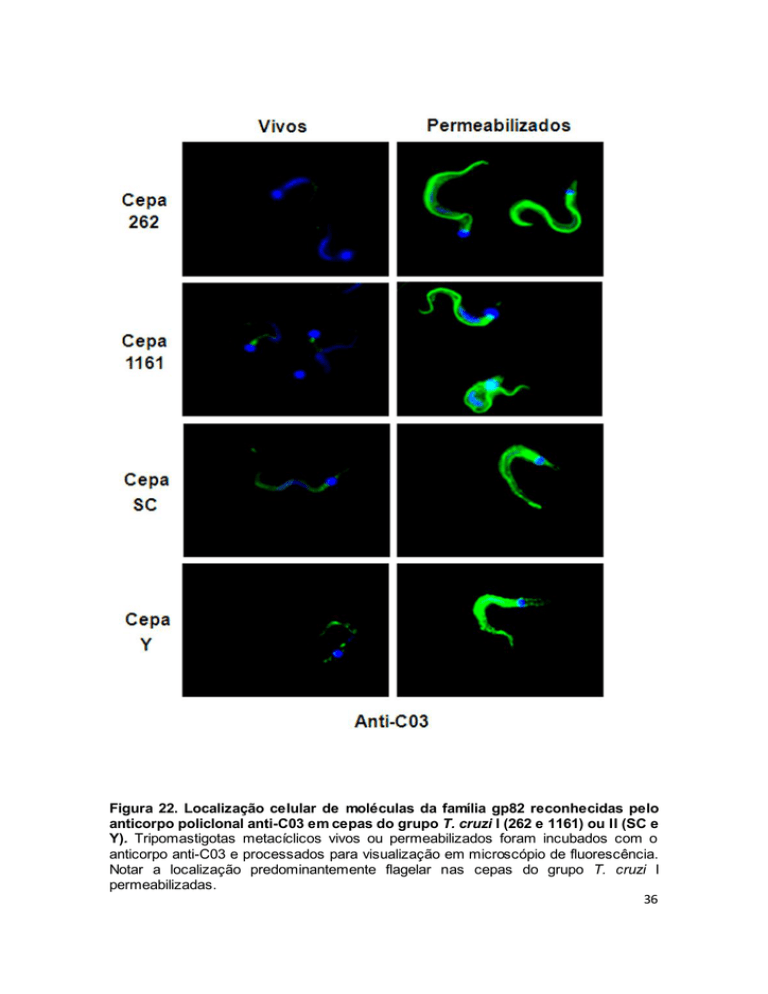
Figura 22. Localização celular de moléculas da família gp82 reconhecidas pelo
anticorpo policlonal anti-C03 em cepas do grupo T. cruzi I (262 e 1161) ou II (SC e
Y). Tripomastigotas metacíclicos vivos ou permeabilizados foram incubados com o
anticorpo anti-C03 e processados para visualização em microscópio de fluorescência.
Notar a localização predominantemente flagelar nas cepas do grupo T. cruzi I
permeabilizadas.
36
Expressão de moléculas da família gp82 em outras formas do T. cruzi
Os genes codificadores de proteínas dos tripanossomatídeos estão
organizados em unidades transcricionais policistrônicas, como ocorre nos
procariontes (Ullu et al., 1996). Sendo assim, mRNA de proteínas estágioespecíficas podem ser transcritos nas outras formas do parasita. Em análises
de transcrição do gene gp82, foram detectadas pequenas quantidades de
mRNA em epimastigotas, amastigotas e tripomastigotas (Carmo et al., 1999,
Manque et al., 2003, Songthamwat et al., 2007).
Restava saber se os transcritos gp82, presentes nas outras formas do
parasita além das formas metacíclicas, são traduzidos em proteínas. Para
responder a essa pergunta, analisamos a expressão de moléculas da família
gp82 nas formas epimastigotas, amastigotas e TCT, das cepas G e CL, por
“immunoblot” revelados com os anticorpos indicados (Fig.23).
Na cepa CL, o MAb 3F6 reagiu com moléculas gp82 somente das
formas metacíclicas, corroborando dados anteriores. O anticorpo policlonal
anti-J18, além das formas metacíclicas, reconheceu bandas de 60-100 kDa das
formas TCT, uma banda de ~110 kDa de amastigotas intracelulares e bandas
de ~70 e 82 kDa de amastigotas extracelulares. O anticorpo policlonal antiC03, além das formas metacíclicas, reconheceu bandas das formas TCT de
~82 e 95 kDa e não reconheceu nenhuma molécula de amastigotas (Fig.23A).
Na cepa G, o MAb 3F6 também reagiu com moléculas gp82 somente
das formas metacíclicas. O anticorpo policlonal anti-J18, além das formas
metacíclicas, reconheceu bandas de 67-100 kDa das formas TCT e bandas de
~70 e 82 kDa de amastigotas extracelulares. O anticorpo policlonal anti-C03,
além das formas metacíclicas, reconheceu uma banda de ~95 kDa das formas
TCT e uma banda de ~67 kDa de formas amastigotas extracelulares (Fig.23B).
Os dados mostram que moléculas da família gp82 sem o epítopo do
MAb 3F6 são expressas em todas as formas do T. cruzi, exceto em
epimastigotas. Porém, a expressão é diferencial entre as cepas G e CL. Além
disso, os anticorpos policlonais anti-J18 e anti-C03, apesar de apresentarem
37
reatividade cruzada (Fig.3 do artigo), reagem com diferentes membros da
família gp82 nas formas do parasita analisadas.
A
Cepa CL
B
Cepa G
Figura 23. Expressão de moléculas da família gp82 em diferentes formas do T.
cruzi. Extratos dos parasitas foram analisados por “immunoblot” com os anticorpos
indicados. (A) Cepa CL. (B) Cepa G. E, epimastigotas, M, formas metacíclicas, T,
tripomastigotas de cultura de tecido, AI, amastigotas intracelulares, AE, amastigotas
extracelulares. Os números à esquerda indicam as massas moleculares (kDa).
38
Capítulo 3
Indução de apoptose em células de melanoma pela
gp82 em sua forma recombinante
Artigo:
“A recombinant protein based on Trypanosoma cruzi surface molecule
gp82 induces apoptotic cell death in melanoma cells”
Atayde, V., Jasiulionis, M.G., Cortez, M., Yoshida, N.
Melanoma Research, 2008, 18: 172-183
39
O melanoma inicia-se a partir da transformação maligna do melanócito,
célula produtora de pigmento encontrada na lâmina basal da epiderme. Essa
transformação ocorre devido a di versos fatores genéticos, epigenéticos e
ambientais (Satyamoorthy & Herlyn, 2002, Correa et al., 2005). Normalmente,
os melanócitos sintetizam melanina e a transferem em grânulos aos
queratinócitos subjacentes, que a armazenam. Essa pigmentação protege
contra os danos causados pela radiação ultravioleta solar (Ueda & Richmond,
2006) (Fig.24).
Figura 24. Melanócitos na lâmina basal da epiderme. Em destaque está a
transferência de grânulos de melanina aos queratinócitos (training.seer.cancer.gov).
A linhagem de melanócitos melan-a, derivada de camundongo C57BL,
possui características de melanócitos normais, exceto senescência e resposta
proliferativa ao PMA (phorbol-12-myristate-13-acetate), ativador da PKC
(Bennett et al., 1987, Furstenberger et al., 1981). A partir de melan-a, foi
estabelecida a linhagem de melanoma Tm5, que apresenta crescimento
independente de PMA, menores tempos de duplicação e diferente adesividade
40
a componentes da matriz extracelular. Além disso, Tm5 é altamente
tumorigênica in vivo (Oba-Shinjo et al., 2006).
A incapacidade das células em entrar em apoptose (Fig.25) contribui
para a patogênese de diversos cânceres, incluindo o melanoma (Hanahan &
Weinberg, 2000, Herlyn et al., 2002).
Figura 25. Vias clássicas de indução da apoptose. Na via extrínseca, é ativada a
caspase-8. Na via intrínseca, é ativada a caspase-9. IAP, c-FLIP, Bcl-2, HSP70 e
HSP90 são inibidores endógenos da apoptose. Bax e p53 são indutores (adaptado de
Heussler et al., 2001).
41
A morte celular por apoptose é induzida por duas vias principais: uma
extrínseca, que envolve os membros da família de receptores do TNF (fator de
necrose tumoral) com recrutamento e ativação da caspase-8, e outra
intrínseca, através da liberação do citocromo C mitocondrial e sua interação
com Apaf-1 no citoplasma, com ativação da caspase-9 (Fig.25). As duas vias,
que possuem conexões entre si (Taylor et al., 2008), convergem para ativar as
caspases efetoras 3, 6 e 7, responsáveis pelas alterações específicas da
apoptose: condensação e clivagem do DNA, exposição da fosfatidilserina na
porção externa da membrana plasmática e fragmentação celular em corpos
apoptóticos (Fig.26), dentre outras (Heussler et al., 2001, Fulda & Debatin,
2006). A liberação do citocromo C é controlada pela família bcl-2 de proteínas,
que tem sua transcrição regulada pelo fator NF-κB, constitutivamente ativo em
células de melanoma (Richmond, 2002, Fecker et al., 2005, Amiri and
Richmond, 2005, Ueda and Richmond, 2006).
Figura 26. Corpos apoptóticos observados por microscopia eletrônica de
varredura. Os corpos apoptóticos não permitem o extravasamento do conteúdo
intracelular no tecido, protegendo-o de inflamação (mun.ca).
Durante a apoptose, o citoesqueleto de actina, responsável pelo formato,
motilidade celular e transdução de sinais exteriores (Ho et al., 2008), é alvo das
caspases efetoras. Mudanças na dinâmica da actina filamentosa (F-actina), por
sua vez, induzem a ativação das caspases (Leadsham & Gourlay, 2008).
42
O aumento do “turnover” da F-actina promove a longevidade celular,
enquanto que a diminuição pode induzir a apoptose (Gourlay & Ayscough,
2005, Thomas et al., 2006). Drogas que alteram a dinâmica da F-actina, como
a citocalasina D, ativam a apoptose em células humanas e murinas através de
uma via caspase-3-dependente (Posey & Bierer, 1999, Yamazaki et al., 2000,
Odaka et al., 2000, Boldogh & Pon, 2006). Ainda não se sabe ao certo por qual
mecanismo a caspase-3 é ativada nesses casos. A proteína recombinante J18,
baseada na molécula de superfície gp82 de formas metacíclicas do T. cruzi
(Araya et al., 1994), induz despolimerização do citoesqueleto de actina, efeito
análogo ao da citocalasina D (Cortez et al., 2006b) (Fig.27). Esse efeito é
dependente da liberação de Ca +2 induzida por J18 na célula hospedeira (Ruiz
et al., 1998, Cortez et al., 2006b).
Figura 27. Diminuição das fibras de actina em células HeLa tratadas com J18 ou
citocalasina D por 30 minutos. Verde: actina, azul: núcleos (Cortez et al., 2006b).
As interações entre a actina e as mitocôndrias, que agem como
sensores da diminuição do “turnover” da actina, são centrais na regulação da
apoptose pelo citoesqueleto. (Gourlay and Ayscough, 2005, Leadsham &
Gourlay, 2008). Quando a actina é estabilizada, um canal iônico voltagemdepentente (VDAC) da mitocôndria é aberto, permitindo a liberação de
moléculas apoptogênicas como citocromo C, AIF e smac (Gourlay & Ayscough,
43
2005). Além disso, alguns membros da família bcl-2 podem interagir
diretamente com VDAC, determinando a permeabilidade da membrana
mitocondrial (Tsujimoto, 2002). Transições na permeabilidade alteram o
potencial transmembrânico, um dos primeiros sinais apoptóticos de células de
mamíferos (Simeonova et al., 2004) (Fig.28).
Figura 28. Regulação de VDAC pela actina. A redução na dinâmica da actina pode
levar à redução no potencial mitocondrial e indução da apoptose após a liberação de
fatores apoptogênicos (adaptado de Gourlay & Ayscough, 2005).
Muitas evidências experimentais mostram que infecções com diversos
patógenos, como Salmonella typhimurium (Pawelek et al., 1997), Toxoplasma
gondii (Hunter et al., 2001) ou Trypanosoma cruzi (Oliveira et al., 2001), podem
retardar ou inibir o crescimento de tumores malignos, inclusive dos melanomas,
em animais e humanos. Para explicar o efeito antitumoral das infecções pelo T.
cruzi, alguns pesquisadores propuseram a existência de uma toxina secretada
pelos parasitas, outros a ocorrência de resposta imune contra antígenos das
células tumorais (Cabral, 2000).
44
Pouco se sabe sobre a produção de fatores solúveis ou secretados por
patógenos que podem agir nas células tumorais, causando sua morte. A
proteína azurina, de Pseudomonas aeruginosa, entra em células de melanoma
humano e induz apoptose devido ao aumento dos níveis intracelulares de p53
(Yamada et al., 2002). Uma fração rica em lipídeos, isolada de promastigotas
de Leishmania donovani, induz apoptose em melanomas de camundongo e
humano (Ratha et al., 2006).
Evidências sobre as propriedades antitumorais do T. cruzi mostram o
efeito citotóxico direto de lisados dos parasitas sobre células tumorai s in vitro
(Kallinikova et al., 2001, Sheklakova et al., 2003), efeito que deve existir devido
ao potencial pró-apoptótico que é visto em algumas moléculas do T. cruzi
contra células do sistema imune. Uma dessas moléculas é a transialidase
(Freire-de-Lima et al., 1998, Borges et al., 2005, Mucci et al., 2006).
Nosso principal objetivo foi investigar o efeito pró-apoptótico da proteína
gp82 recombinante (J18) sobre células do melanoma Tm5, comparado ao
efeito sobre a linhagem de melanócitos melan-a. Os resultados mostraram que
o tratamento com J18 induz a despolimerização da F-actina somente nas
células do melanoma Tm5, levando à indução da apoptose através da ativação
da caspase-3. Sinais apoptóticos específicos como encolhimento nuclear e
citoplasmático, exposição da fosfatidilserina e fragmentação do DNA nuclear,
foram observados. Também notamos a perda do potencial transmembrânico e
a localização citoplasmática de NF-kB decorrentes do efeito de J18 no
citoesqueleto de actina.
45
Experimentos complementares:
Análise da proteína recombinante J18:
Uma questão em relação à proteína recombinante J18 que não havia sido
ainda determinada é como ela se apresenta na forma purificada, se como
monômero, dímero ou aglomerado protéico. Para responder a essa pergunta,
purificamos uma preparação de J18 por gel filtração em sistema FPLC e
obtivemos três principais picos correspondentes a: proteínas maiores de 160
KDa representando aglomerados de J18, proteínas de aproximadamente 160
kDa representando dímeros de J18, proteínas de aproximadamente 80 kDa
representando monômeros de J18 (Fig.29A). Submetemos as frações 11 a 43 à
SDS-PAGE em condições desnaturantes, seguido de “immunoblot” revelado
com o MAb 3F6. Como mostrado na Figura 29B, bandas de aproximadamente
80 kDa foram detectadas nas frações 14 a 30 e uma maior quantidade de
proteína foi detectada nas frações 20 a 24, representando aglomerados e
dímeros de J18 (>160 kDa e ~160 kDa). Selecionamos algumas frações
representantes dos diferentes picos da gel filtração e submetemos à eletroforese
não-desnaturante seguida de “immunoblot” e revelação com o MAb 3F6. Foram
detectadas bandas maiores de 80 kDa, atingindo até ~230 kDa, principalmente
nas frações 21 e 24, representantes dos picos de proteínas maiores de 160 kD a
e de ~160 kDa (Fig.30).
O efeito inibitório de J18 sobre a invasão celular de formas metacíclicas é
conhecido. Para comparar com o efeito de J18 na sua forma monomérica,
dimérica
ou
oligomérica,
realizamos
experimentos
com
as
seguintes
preparações: frações 11, 21, 24 e 27, a preparação completa de J18, o
sobrenadante e o “pellet” de uma preparação de J18 centrifugada a 13.000 rpm
por 15 minutos. A inibição da invasão foi semelhante (~40%) para todas as
amostras, exceto para a fração 11, que foi utilizada como controle (Fig.31).
46
Figura 29. Purificação da proteína recombinante J18 por gel filtração em sistema
FPLC. (A) Uma preparação de J18 foi purificada em coluna cromatográfica de gel
filtração Superdex HR200 em sistema FPLC, como descrito (Amino et al., 2002). (B)
As frações de 0.5 ml coletadas foram submetidas à SDS-PAGE e “immunoblot”
revelado com o MAb 3F6. Notar o reconhecimento das frações 14 a 30 pelo MAb 3F6,
de acordo com os picos do gráfico.
47
Figura 30. “Immunoblot” de preparações da proteína recombinante J18
submetidas à SDS-PAGE não-desnaturante. As frações coletadas da gel filtração
(11, 21, 24 e 27), a proteína total (J18), a proteína centrifugada (C), ou o “pellet” (P)
foram submetidos à SDS-PAGE não-desnaturante, transferidos à membrana de
nitrocelulose e revelados com o MAb 3F6. Notar o reconhecimento de bandas maiores
de 80 kDa principalmente nas frações 21 (> 160 kDa) e 24 (~160 kDa). Os números à
esquerda representam as massas moleculares (kDa).
Figura 31. Invasão celular de formas metacíclicas da cepa CL na presença de
preparações da proteína recombinante J18. Formas metacíclicas da cepa CL foram
incubadas por 1 hora com células HeLa (10: 1) na presença das frações coletadas da
gel filtração (11, 21, 24 e 27), da proteína total (J18), da proteína centrifugada (C), ou
do “pellet” da centrifugação (P), na concentração final de 40 µg/ml. O total de parasitas
em 100 células foi estimado contando-se lamínulas coradas com Giemsa em
duplicatas (500 células por lamínula). Experimento representativo de três
experimentos independentes.
48
Com esses resultados, mostramos que uma preparação de J18 contém
proteínas com diferentes níveis de agregação e que essas diferentes formas têm
a mesma capacidade de interagir com a célula hospedeira, competi ndo com os
parasitas no momento da invasão. Dessa maneira, obtivemos mais informações
em relação ao preparado (J18) utilizado no tratamento das células melan-a e
Tm5.
Imagens de tumores em camundongos infectados com T. cruzi
Camundongos C57BL/6 foram infectados com formas metacíclicas de
duas cepas de T. cruzi expressando ou não a gp82 na superfície, cepas G e Y*,
respectivamente. Três semanas após a infecção, os camundongos receberam
células do melanoma Tm5 (2 x 10 5) por via subcutânea na região dorsal e o
desenvolvimento dos tumores foi acompanhado. Os volumes tumorais foram
significativamente menores nos animais infectados com a cepa G, comparados
aos volumes tumorais dos camundongos infectados com a cepa Y* ou dos
camundongos não-infectados, como mostrado na figura 9 do artigo (Fig.32).
Y*
Figura 32. Desenvolvimento tumoral (20 dias pós-inoculação de células Tm5) em
camundongos infectados com T. cruzi.
49
Discussão
Nosso principal objetivo foi caracterizar a família gp82 de proteínas do T.
cruzi. Até o início desse projeto, somente a gp82 de superfície, identificada pelo
MAb 3F6 e envolvida na invasão celular das formas metacíclicas, havia sido
descrita.
Mostramos
que
membros
da
família
gp82
são
expressos
intracelularmente e que alguns têm localização diferenciada em parasitas dos
grupos T. cruzi I e II. Ao contrário das glicoproteínas gp82 reativas com o MAb
3F6, específicas das formas metacíclicas (Teixeira & Yoshida, 1986), outras
moléculas da família foram detectadas nas formas TCT e amastigotas.
Descrevemos ainda o efeito antitumoral da gp82 de superfície em sua forma
recombinante, propriedade nunca antes descrita para outro componente do T.
cruzi molecularmente definido.
Na primeira parte do estudo, investigamos as bases da avirulência das
formas metacíclicas do clone CL-14, derivado da cepa CL. Descobrimos que a
baixa infectividade desses parasitas está associada com a reduzida expressão
da gp82 na superfície, reforçando o papel central da molécula na infecção pelo
T. cruzi. Além de invadir cerca de quatro vezes menos do que a cepa CL in
vitro, as formas amastigotas do clone CL-14 não foram capazes de se replicar
em células HeLa mantidas a 37 oC. Esse resultado está de acordo com achados
anteriores onde
foi mostrado que a
temperatura permissiva para a
diferenciação do clone CL-14 em células não-fagocíticas é de 33oC (Almeidade-Faria et al., 1999). A temperatura como um fator do hospedeiro na inibição
do desenvolvimento intracelular é compatível com nossa observação de que as
formas metacíclicas do clone CL-14 não produzem parasitemia patente em
camundongos infectados por via oral.
Uma vez que a infecção oral por formas metacíclicas da cepa CL é
extremamente eficiente e é dependente da gp82 de superfície (Neira et al.,
2003), a deficiência na expressão dessa molécula no clone CL-14 seria o único
fator responsável pela baixa infectividade, não fosse seu desenvolvimento
limitado pela temperatura. Na infecção oral, além de promover a invasão das
50
células da mucosa gástrica, foi descrito que a interação entre a gp82 e a
mucina é fundamental (Neira et al., 2003). No estudo de formas metacíclicas de
cepas do T. cruzi gp82-deficientes, observou-se que essas são pouco
infectivas em camundongos por via oral, embora a invasão celular in vitro seja
eficiente devido à expressão da glicoproteína gp30, que tem características
similares à gp82 (Cortez et al., 2003). Gp30 liga-se à célula hospedeira de
maneira receptor-dependente e induz sinal de Ca +2, propriedade associada à
invasão celular. Entretanto, ao contrário da gp82, a capacidade de ligação da
gp30 à mucina gástrica é reduzida (Cortez et al., 2003). No caso do clone CL14, as formas metacíclicas não expressam na superfície nem a gp82 nem a
gp30, e são pouco invasivas tanto in vivo como in vitro.
As formas metacíclicas do clone CL-14 e da cepa G assemelham-se
quanto à baixa infectividade e aparentemente prescindem da gp82 para invadir
a célula hospedeira. É possível que o clone CL-14, como a cepa G, faça uso da
gp35/50 para interagir com a célula hospedeira. Entretanto, a gp35/50 expressa
no clone CL-14 é uma variante da gp35/50 da cepa G, que reage com o MAb
2B10 mas não é reconhecida pelo MAb 10D8 (Mortara et al., 1992). Embora as
formas metacíclicas da cepa G expressem gp82 na superfície em níveis
comparáveis aos da cepa CL, a interação da gp82 com a célula hospedeira é
prejudicada pela gp90, molécula que modula negativamente a penetração do
parasita (Málaga e Yoshida, 2001). O clone CL-14 expressa baixos níveis de
uma molécula variante da gp90 da cepa G, reconhecida pelo MAb 5E7, mas
não pelo MAb 1G7 (Yoshida, 2006). Nesse caso, a gp90 provavelmente não
atua como modulador negativo da invasão.
Na segunda parte do estudo, analisamos a expressão e a localização de
moléculas da família gp82 em formas metacíc licas das cepas G e CL. Para
isso, isolamos um novo membro, que não contém o epítopo do MAb 3F6.
Quando alinhamos as seqüências de aminoácidos dos clones C03 (gp82) e Tc85 (gp85 das formas TCT), observamos 57,2% de identidade, indicando que o
novo clone é parte da família gp85/trans-sialidase. As duas seqüências
possuem semelhanças na região N-terminal, que é inexistente no clone J18
(gp82). J18 e Tc-85 apresentam 53,3% de identidade (Fig.33).
51
Figura 33. Alinhamento das seqüências de aminoácidos dos clones J18, C03 e
Tc85. J18 (AAA21303), C03 (EF445668) Tc85-11 (AAD13347.1). Preto: representa
100% de identidade, amarelo: motivos Asp, rosa: motivo VTV, verde: sinal de âncora
GPI, vermelho: regiões do epítopo do MAb 3F6 e do sítio de adesão celular do clone
J18, azul: sítio de ligação à laminina do clone Tc-85.
Um
achado
interessante
desse
trabalho
foi
a
marcação
predominantemente flagelar do anticorpo policlonal anti-C03 em formas
metacíclicas de cepas do grupo T. cruzi I. O flagelo dos tripanossomatídeos é
único e multifuncional, atuando na motilidade, quimiotaxia, sinalização e
invasão celular. Muitas moléculas do T. cruzi associadas ao flagelo têm sido
descritas. Uma delas, cuja função ainda não se conhece, tem 160 kDa (FL-160)
52
e é codificada por uma família gênica que é parte da grande família gp85/transsialidase. Essa proteína é expressa em formas TCT, na membrana do bolso
flagelar, região de onde emerge o flagelo (Van Voorhis et al., 1993). Um
membro dessa família gênica, FL-160-CRP, é expresso na superfície dos
parasitas, mas não é expresso no flagelo. Na análise dos transcritos da FL160-CRP, variações nas seqüências foram associadas com a divisão das
cepas em grupos T. cruzi I e II (Mathieu-Daudé et al., 2008). Se o anticorpo
anti-C03 pode ser usado como um marcador de cepas do grupo T. cruzi I,
ainda precisa ser estabelecido. A função dos membros da família gp82
expressos no flagelo é desconhecida.
Em comparação com o clone J18, os clones C03 e Tc-85 apresentam
diversas substituições de aminoácidos nas regiões do epítopo do MAb 3F6 e
do sítio de adesão celular da gp82 (Fig.33). Talvez por isso a gp85 não tenha
sido reconhecida pelo anticorpo monoclonal em extratos de formas TCT das
cepas G ou CL, nos ensaios de “immunoblot”. Porém, como possuem diversos
epítopos comuns, os anticorpos policlonais anti-J18 e anti-C03 reagiram com
um conjunto de moléculas dessas formas, que possivelmente inclui a gp85
(Fig.23).
Em relação à adesão celular, foi descrito que a molécula de superfície
gp85 contém sítios de ligação à laminina e à citoqueratina 18 (CK18) (Giordano
et al., 1999, Magdesian et al., 2001), interações que podem promover ou
facilitar a invasão das formas TCT. Utilizando peptídeos sintéticos, Giordano et
al. (1999) mapearam o sítio de adesão do clone Tc-85 à laminina (peptídeo
TGETPLEPFGFCFGA). Dos 15 aminoácidos que compõem a região referente
ao peptídeo de ligação à laminina, o clone J18 possui apenas 5 em comum,
sugerindo que se essa molécula também interage com a laminina é através de
outro sítio (Fig.33). A Tc-85 interage com a CK18 através do motivo VTV, que
aumenta a invasão das formas TCT (Magdesian et al., 2007). O clone J18
possui esse motivo na região subterminal (Fig.33), e a sua relevância na
adesão do parasita à célula é discutível.
53
Outras moléculas das formas TCT, além da gp85, interagem direta ou
indiretamente com moléculas da matriz extracelular (ECM). A gp83, molécula
de superfície de 83 kDa, aumenta a expressão da laminina-γ1 em células
musculares humanas após a exposição à sua forma recombinante. A
superexpressão da laminina torna as células mais susceptíveis à infecção (Nde
et al., 2006). A gp83 tem 32,8% de identidade na seqüencia de aminoácidos
com o clone J18 e 32,3% com o clone C03. É possível que os anticorpos
policlonais anti-C03 e anti-J8 reconheçam epítopos da gp83 das formas TCT
das cepas G ou CL, como visto na figura 23. Foram também detectadas, nas
formas
TCT, proteínas
ligantes
de
heparina
e
heparan
sulfato
de
aproximadamente 59 e 65,8 kDa, e essa ligação está envolvida na invasão de
cardiomiócitos. Uma delas pode ser a penetrina, previamente descrita, que
possui as mesmas características (Ortega-Barria & Pereira, 1991, Oliveira Jr. et
al., 2008). A serino-protease POP Tc80, hidrolisa colágeno dos tipos I e IV e
fibronectina, provavelmente como modo de facilitar a migração através da ECM
(Grellier et al., 2001, Bastos et al., 2005). Também foi mostrado que formas
TCT possuem um receptor de superfície para a fibronectina (Ouaissi et al.,
1984).
A ligação de moléculas do T. cruzi à laminina, heparan sulfato,
fibronectina e outros componentes, pode ser essencial na migração dos
parasitas através da ECM em direção às células-alvo. É importante lembrar
que, de maneira similar, a gp82 interage com a mucina gástrica, facilitando o
acesso das formas metacíclicas às células do epitélio gástrico durante a
infecção oral (Neira et al., 2003). Até o momento, o receptor celular da gp82 de
superfície não foi identificado. Além disso, a qual componente da ECM se liga a
gp82 também não é conhecido. Foi mostrado que formas TCT entram em
células epiteliais preferencialmente pela porção baso-lateral (Schenkman et al.,
1991c). Se isso ocorrer também com as formas metacíclicas, uma hipótese
seria que a gp82 contém sítios de interação com componentes da lâmina basal,
já que essas formas, quando iniciam a infecção no hospedeiro vertebrado,
invadem células epiteliais. A gp82 parece não interagir com colágeno tipo IV,
54
presente na lâmina basal (Ramirez et al., 1993). Resta saber se interage com a
laminina.
Na terceira parte do estudo, ocorreu-nos a idéia de examinar a ação de
J18 sobre as células de melanoma, em função das propriedades dessa
molécula reveladas em trabalhos anteriores. Cortez et al. (2006b) observaram
que J18 induz a despolimerização da F-actina de células HeLa. Levantamos a
possibilidade de que o tratamento das células com J18 por tempo prolongado
levaria, em última instância, à morte celular. Nos diversos experimentos, J18
mostrou efeito seletivo sobre as células do melanoma Tm5, mas não sobre as
células parentais não tumorigênicas, melan-a. Esse efeito não se deve à falta
do receptor para essa molécula nas células melan-a, pois J18 liga-se a estas
células do mesmo modo que às células Tm5. Uma possibilidade é que, após a
ligação de J18 ao seu receptor, vias de sinalização distintas sejam induzidas
nas duas linhagens, levando à desestruturação dos filamentos de actina
somente nas células de melanoma (Fig.34). Em células HeLa, foi mostrado que
a despolimerização da F-actina é dependente de sinal de Ca+2, deflagrado
após a ativação de uma via de sinalização ainda desconhecida (Cortez et al.,
2006b).
Segundo dados da literatura, a citocalasina D induz morte celular por
apoptose em células transformadas através da ativação da caspase-3
(Yamazaki et al., 2000) sendo estas mais susceptíveis do que células normais
(Odaka et al., 2000). O fato das células tumorais conterem menor quantidade
de F-actina do que células e tecidos normais (Verderame et al., 1980, Varani et
al, 1983, Rao et al., 1990), poderia explicar a diferença entre as
susceptibilidades de melan-a e Tm5 à J18. Como J18 tem ação similar à da
citocalasina D (Cortez et al., 2006b), analisamos o tipo de morte induzida por
esta molécula nas células Tm5 e encontramos diversas evidências de
apoptose. O primeiro evento apoptótico detectado foi a ativação da caspase-3,
provavelmente responsável pela ocorrência dos eventos subseqüentes
(Fig.34). Não observamos ativação das caspases 8 e 9. Algumas moléculas do
T. cruzi apresentam efeito contrário ao de J18. A transialidase inibe a apoptose
em células de Schwan humanas, através de uma via ativada pela PI-3 quinase
55
(Chuenkova et al., 2001). A cruzipaína, cisteína protease envolvida na invasão,
crescimento e diferenciação do T. cruzi (Murta et al., 1990, Paiva et al., 1998,
Meirelles et al., 1992, Scharfstein et al., 2000), quando inativada, promove a
sobrevivência de cardiomiócitos de culturas primárias de camundongos através
da indução da expressão de Bcl-2, molécula anti-apoptótica (Aoki et al., 2006).
Figura 34. Representação esquemática da via apoptótica ativada em células do
melanoma Tm5 pelo tratamento com J18. A ligação de J18 com seu receptor (J18R)
na célula Tm5 leva à desorganização do citoesqueleto de actina com ativação da
caspase-3, responsável pela exposição da fosfatidilserina (PS), perda do potencial da
membrana mitocondrial (ψm), inibição da translocação de NF-κB ao núcleo e
fragmentação do DNA nuclear, fenômenos apoptóticos. Entre parênteses estão os
tempos de tratamento.
56
Uma possibilidade que não foi confirmada em nossos estudos é a
ativação da caspase-3 nas células Tm5, via ativação da caspase-12. A caspase12, que está envolvida na indução da apoptose após estresse de retículo
endoplasmático (Liu et al., 1998, Rao et al., 2002, Xie et al., 2002, Hitomi et al.,
2003) poderia, em seguida, ativar a caspase-3 nas células Tm5. Outra molécula
que poderia estar envolvida na ativação da apoptose em células Tm5 é a
calpaína, cisteína protease citossólica também intimamente relacionada com a
via de estresse de retículo endoplasmático. Essa enzima é ativada por Ca +2 e
tem como alvo a caspase-12, ativando-a (Vandenabeele et al., 2005).
Investigamos
ainda
o
efeito
tumoricida
de
J18
in
vivo.
O
desenvolvimento do melanoma Tm5 foi significativamente mais lento em
camundongos tratados com J18 na região tumoral. Eventualmente, esses
resultados poderiam ser melhorados com outras dosagens de J18 e/ou tempo
de tratamento. O bloqueio da translocação de NF-kB ao núcleo in vitro pode ser
também a causa da inibição do crescimento de células Tm5 in vivo. Esse
resultado contrasta com resultados recentes com a transialidase em sua forma
recombinante que, ao invés de inibir, ativa a translocação de NF-kB ao núcleo
de células endoteliais humanas. Esse resultado é também observado quando
as células são tratadas com lipopolissacarídeo (LPS) bacteriano (Dias et al.,
2008). Contudo, não podemos descartar a hipótese de que o J18 tenha outra
ação in vivo, diferente da observada in vitro. Talvez o crescimento dos tumores
seja reduzido pela indução de alterações importantes no microambiente
tumoral que, por sua vez, eliminariam as células tumorais dos tecidos.
Quanto à proteção ao desenvolvimento tumoral pela infecção com o T.
cruzi, descrita em diversos trabalhos, confirmamos esses achados infectando
camundongos com a cepa G, que é pouco infectiva, porém expressa altos
níveis de gp82 na superfície, e com a cepa Y*, uma amostra da cepa Y, isolada
inicialmente por Silva & Nussenzweig (1953) de um paciente na fase aguda da
doença de Chagas. Formas metacíclicas de Y* expressam somente a gp30 na
superfície. Apesar das formas metacíclicas existirem por pouco tempo no
hospedeiro
vertebrado,
observamos
significativa
redução
tumoral
em
camundongos pré-infectados com a cepa G. Em contraste, camundongos pré57
infectados com a cepa Y*, que não expressa a gp82 reativa com o MAb 3F6,
mas expressa outros membros da família gp82 reconhecidos pelo anticorpo
policlonal anti-J18, foram incapazes de conter o crescimento tumoral.
A associação entre esses dados e os dados referentes à gp82
recombinante (J18) não é clara. O que pode ser hipotetizado é que moléculas
da família gp85/trans-sialidase, que têm seqüências em comum com a gp82, e
que são expressas em tripomastigotas sanguíneos, exerçam o papel de reduzir
o desenvolvimento dos tumores. Para citar um exemplo, a trans-sialidase
presente
na corrente sanguínea, secretada pelos parasitas, possui a
característica de induzir a apoptose de células do sistema imune do hospedeiro
(Mucci et al., 2006). Outra molécula que poderia ser responsável pela redução
tumoral é a gp85 expressa pelas formas sanguíneas da cepa G, uma vez que
vimos que as duas moléculas, gp82 e gp85 possuem epítopos comuns. Seria
interessante investigar se a gp85 de fato possui efeito antitumoral como
observamos com a gp82 recombinante. Outra explicação para a redução
tumoral em camundongos infectados com a cepa G seria a de que membros da
família gp82 expressos por formas sanguíneas ou amastigotas, quando
liberados no meio extracelular ou na corrente sanguínea, pudessem agir nas
células tumorais. Os membros da família gp82 expressos por formas
metacíclicas da cepa Y* não teriam função antitumoral.
Segundo Cabral (2000), a redução dos tumores de camundongos
infectados com T. cruzi ocorreria pelo desenvolvimento de uma resposta autoimune contra as células tumorais, devido à lise daquelas infectadas com o
parasita. Essa resposta ocorreria devido ao extravasamento e exposição do
conteúdo celular no meio extracelular. Alguns estudos mostram a autoimunidade à miosina cardíaca desenvolvida em camundongos ou humanos
infectados com T. cruzi. Porém, não se sabe ao certo se é resultado da lise e
destruição celular, ou da reatividade cruzada entre antígenos do parasita e do
hospedeiro (Engman & Leon, 2002). Dessa maneira, existe a possibilidade de
ocorrer reatividade cruzada entre moléculas dos parasitas da cepa G e das
células tumorais.
58
Nossos estudos abrem perspectivas para o estudo das proteínas da
família gp82, principalmente dos membros que possam ter funções diferentes
da função da gp82 de superfície, como por exemplo, os flagelares. Em
trabalhos
subseqüentes,
esses
membros
devem
ser
caracterizados
funcionalmente.
59
Referências Bibliográficas
Acosta-Serrano, A., Schenkman, S., Yoshida, N., Mehlert, A.,
Richardson, J.M. & Ferguson, M.A., 1995. The lipid structure of the
glycosylphosphatidylinositol-anchored mucin-like sialic acid acceptors of
Trypanosoma cruzi changes during parasite differentiation from epimastigotas
to infective metacyclic trypomastigote forms. J. Biol. Chem., 270: 27244-27253.
Acosta-Serrano, A., Almeida, I.C., Freitas-Junior, L.H., Yoshida, N. &
Schenkman, S., 2001. The mucin-like glycoprotein super-family of
Trypanosoma cruzi: structure and biological roles. Mol. Biochem. Parasitol.,
114: 143-150.
Almeida-de-Faria, M., Freymüller, E., Colli, W. & Alves, M.J., 1999.
Trypanosoma cruzi: characterization of na intracellular epimastigote-like form.
Exp. Parasitol., 92: 263-274.
Amiri, K.I. & Richmond, A., 2005. Role of nuclear factor-kappa B in
melanoma. Cancer Metastasis Rev., 24: 301-313.
Andrade, S.G., Rassi, A., Magalhães, J.B., Ferriolli Filho, F. &
Luquetti, A.O., 1992. Specific chemotherapy of Chagas disease: a comparison
between the response in patients and experimental animals inoculated with the
same strains. Trans. Royal Soc. Trop. Med. Hyg., 86: 624-626.
Aoki, M. del P., Cano, R.C., Pellegrini, A.V., Tanos, T., Guiñazú, N.L.,
Coso, O.A. & Gea, S., 2006. Different signaling pathways are involved in
cardiomyocyte survival induced by a Trypanosoma cruzi glycoprotein. Microbes
Infect., 8: 1723-1731.
Aragão, M.B., 1983. Domiciliação de triatomíneos ou pré-adaptação à
antropofilia e à ornitofilia? Rev. Saúde Públ., 17: 51-55.
Araya, J. E., Cano, M.I., Yoshida, N. & Franco da Silveira, J., 1994.
Cloning and characterization of a gene for stage specific 82-kDa surface
antigen of metacyclic trypomastigotes of Trypanosoma cruzi. Mol. Biochem.
Parasitol., 65: 161-169.
Aufderheide, A.C., Salo, W., Madden, M., Streitz, J., Bulkestra, J.,
Guhl, F., Arriaza, B., Renier, C., Wittmers Jr., L.E., Fornaciari, G. & Alisson,
A., 2004. A 9000-years record of Chagas’ disease. Proc. Nat. Acad. Sci. USA,
101: 2034-2039.
60
Bahia, M.T., Tafuri, W.L., Caliari, M.V., Veloso, V.M., Carneiro, C.M.,
Coelho, G.L. & Lana, M., 2002. Comparison of Trypanosoma cruzi infection in
dogs inoculated with blood or metacyclic trypomastigotes of Berenice-62 and
Berenice-78 strains via intraperitoneal and conjuctival routes. Rev. Soc. Bras.
Med. Trop., 35: 339-345.
Baptista, C.S., Vêncio, R.Z.N., Abdala, S., Carranza, J.C.,
Westenberger, S.J., Silva, M.N., Pereira, C.A.B., Galvão, L.M.C., Gontijo,
E.D., Chiari, E., Sturn, N. & Zingales, B., 2006. Differential transcription
profiles in Trypanosoma cruzi associated with clinical forms of Chagas’ disease:
Maxicircle NADH dehydrogenase subunit 7 gene truncation in asymptomatic
patient isolates. Mol. Biochem. Parasitol., 150: 236-248.
Barbosa, H.S. & Meirelles, M.N., 1995. Evidence of participation of
cytoskeleton of heart muscle cells during the invasion of Trypanosoma cruzi.
Cell. Struct. Funct., 20: 275-284.
Bastos, I.M., Grellier, P., Martins, N.F., Cadavid-Restrepo, G., de
Souza-Ault M.R., Augustyns, K., Teixeira, A.R., Schrével, J., Maigret, B., da
Silveira, J.F. & Santana JM., 2005. Molecular, functional and structural
properties of the prolyl oligopeptidase of Trypanosoma cruzi (POP Tc80) that is
required for parasite entry into mammalian cells. Biochem. J., 388: 29–38.
Bennett, D.C., Cooper, P.J. & Hart, I.R., 1987. A line of non-tumorigenic
mouse melanocytes, syngeneic with the B16 melanoma and requiring a tumor
promoter for growth. Int. J. Cancer, 39: 414-418.
Beyrer, C., Villar,J.C., Suwanvanichkij, V., Singh, S., Baral, S. &
Mills, E., 2007. Neglected diseases, civil conflicts, and the right to health.
Lancet, 370: 619-627.
Boldogh, I.R. & Pon, L.A., 2006. Interactions of mitochondria with the
actin cytoskeleton. Biochim. Biophys. Acta., 1763: 450-462.
Borges, M., Cordeiro-da-Silva, A., Vergnes, B., Sereno, D. & Ouaissi,
A., 2005. Conversion of Trypanosoma cruzi Tc52 released factor to a protein
inducing apoptosis. Tissue Cell., 37: 469-478.
Bourdet-Sicard, R., Egile, C., Sansonetti, P.J. & Tran Van Nhieu, G.,
2000. Diversion of cytoskeletal processes by Shigella during invasion of
epithelial cells. Microbes Infect., 2: 813-819.
Boutayeb, A., 2007. Developing countries and neglected diseases:
challenges and perspectives. Int. J. Equity Health, 6: 1-4.
61
Brener, Z. & Chiari, E., 1963. Variações morfológicas observadas em
diferentes amostras de Trypanosoma cruzi. Rev. Inst. Med. Trop. São Paulo, 5:
220-224.
Brener Z., Costa, C.A.G. & Chiari, C., 1976. Differences in the
susceptibility of Trypanosoma cruzi strains to active chemotherapeutic agents.
Rev. Inst. Med. Trop. São Paulo, 18: 450-455.
Briones, M.R.S., Souto, R.P., Stolf, B.S.& Zingales, B., 1999. The
evolution of two Trypanosoma cruzi subgroups inferred from rRNA genes can
be correlated with the interchange of American mammalian faunas in the
Cenozoic and has implications to pathogenicity and host specificity. Mol.
Biochem. Parasitol., 104: 219-232.
Brisse, S., Dujardin, J.C. & Tibayrenc, M., 2000. Identification of six
Trypanosoma cruzi lineages by sequence-characterized amplified region
markers. Mol. Biochem. Parasitol., 111: 95-105.
Buck, A.A., Anderson, R.I. & McRae, A.A., 1978. Epidemiology of polyparasitism. II. Types of combinations, relative frequency and associations of
multiple infections. Tropenmed. Parasitol., 29: 137-144.
Buekens, P., Almendares, O., Carlier, Y., Dumonteil, E., Eberhard,
M., Gamboa-Leon, R., James, M., Padilla, N., Wesson, D. & Xiong, X., 2008.
Mother-to-child transmission of Chagas’ disease in North America: why don’t we
do more? Matern. Child Health J., 12: 283 -286.
Burleigh, B.A. & Andrews, N.W., 1998. Signaling and host cell invasion
by Trypanosoma cruzi. Curr. Opin. Microbiol., 1: 461-465.
Buscaglia, C.A., Campo, V.A., Frasch, A.C. & Di Noia, J.M., 2006.
Trypanosoma cruzi surface mucins: host-dependent coat diversity. Nat. Ver.
Microbiol., 4: 229-236.
Cabral, H.R., 2000. The tumoricidal effect of Trypanosoma cruzi: its
intracellular cycle and the immune response of the host. Med. Hypothesis, 54:
1-6.
Cardoso de Almeida, M.L. & Heise, N., 1993. Proteins anchored via
glycosylphosphatidylinositol and solubilizing phospholipases in Trypanosoma
cruzi. Biol. Res., 26: 285-312.
Carmo, M.S., Araya, J.E., Ramirez, M.I., Boscardin, S., Cano, M.I.,
Baida, R.P., Ruiz, R.C., Santos, M.R., Chiurillo, M.A., Ramirez, J.L.,
Yoshida, N. & Silveira, J.F., 1999. Organization and expression of a multigene
family encoding the surface glycoproteins of Trypanosoma cruzi metacyclic
62
trypomastigotes involved in the cell invasion. Mem. Inst. Oswaldo Cruz, 1: 169171.
Cerqueira, G.C, Bartholomeu, D.C., DaRocha, W.D., Hou, L., FreitasSilva, D.M., Machado, C.R., El-Sayed N.M. & Teixeira, S.M., 2008. Sequence
diversity and evolution of multigene families in Trypanosoma cruzi. Mol.
Biochem. Parasitol., 157: 65-72.
Chiari, E., 1981. Diferenciação do Trypanosoma cruzi em cultura. Ph.D.
Thesis. Universidade Federal de Minas Gerais, M.G., Brasil.
Chuenkova, M.V., Furnari, F.B., Cavenee, W.K. & Pereira, M.A., 2001.
Trypanosoma cruzi trans-sialidase: a potent and specific survival factor for
human Schwann cells by means of phosphatidylinositol 3-kinase/Akt signaling.
Proc. Natl. Acad. Sci. USA, 98: 9936-9941.
Cortez, M, Neira, I., Ferreira, D., Luquetti, A.O., Rassi, A., Atayde,
V.D. & Yoshida,N., 2003. Infection by Trypanosoma cruzi metacyclic forms
deficient in gp82 but expressin a related surface molecule, gp30. Infect.
Immun., 71: 6184-6191.
Cortez, M., Silva, M.R., Neira, I., Ferreira, D., Sasso, G.R., Luquetti,
A.O., Rassi, A. & Yoshida, N., 2006a. Trypanosoma cruzi surface molecule
gp90 downregulates invasion of gastric mucosal epithelium in orally infected
mice. Microbes Infect., 8: 36-44.
Cortez, M., Atayde, V.D. & Yoshida, N., 2006b. Host cell invasion
mediated by Trypanosoma cruzi surface molecule gp82 is associated with Factin disassembly and is inhibited by enteroinvasive Escherichia coli. Microbes
Inf., 8: 1502-1512.
Cossart, P. & Sansonetti, P.J., 2004. Bacterial invasion: the paradigms
of enteroinvasiva pathogens. Science, 304: 242-248.
Coura, J.R., Junqueira, A.C.V., Fernandes, O., Valente S.A.S. &
Miles, M.A., 2002. Emerging Chagas disease in Amazonian Brazil. Trends
Parasitol., 18: 171-176.
Coura, J.R., 2006. Transmissão da infecção chagásica por via oral na
história natural da doença de Chagas. Rev. Soc. Bras. Med. Trop., 39: 113-117.
Coura, J.R., 2007. Chagas disease: what is known and what is needed –
A background article. Mem. Inst. Oswaldo Cruz, 102: 113-122.
Coutinho, M., Freire Jr., O. & Dias, J.C.P., 1999. The Noble enigma:
Chagas’ nominations for the Nobel prize. Mem. Inst. Oswaldo Cruz, 94: 123129.
63
Covarrubias, C., Cortez, M. Ferreira, D. & Yoshida, N., 2007.
Interaction with host factors exacerbates Trypanosoma cruzi cell invasion
capacity upon oral infection. Int. J. Parasitol., 37: 1609-1616.
Correa, M., Machado, J. Jr., Carneiro C.R., Pesquero, J.B., Bader, M.,
Travassos, L.R., Chammas, R. & Jasiulionis, M.G., 2005. Transient
inflammatory response induced by apoptotic cells is an important mediator of
melanoma cell engraftment and growth. Int. J. Cancer, 114: 356-363.
Crennell, S.J., Garman, E.F., Laver, W.G., Vimr, E.R. & Taylor, G.L.,
1993. Crystal structure of a bacterial sialidase (from Salmonella typhimurium
LT2) shows the same fold as an influenza virus neuraminidase. Proc. Natl.
Acad. Sci. USA, 90: 9852-9856.
Crisante, G., Rojas., A., Teixeira, M.G. & Añez, N., 2006. Infected dogs
as a risk factor in the transmission of human Trypanosoma cruzi infection in
western Venezuela. Acta Tropica, 98: 247 -254.
Cross, G.A., & Takle, G.B., 1993. The surface trans-sialidase family of
Trypanosoma cruzi. Annu. Rev. Microbiol., 47: 385-411.
Deane, M.P., Lenzi, H.L. & Jansen, A.M., 1984. Trypanosoma cruzi:
vertebrate and invertebrate cycles in the same mammal host. Mem Inst.
Oswaldo Cruz, 79: 513-515.
Devera, R., Fernandes, O. & Coura, J.R., 2003. Should Trypanosoma
cruzi de called “cruzi” complex? A review of the parasite diversity and the
potential of selecting population after in vitro culturing and mice infection. Mem.
Inst. Oswaldo Cruz, 98: 1-12.
Di Noia, J.M., D’Orso, I., Aslund, L., Sánchez, D.O. & Frasch, A.C.,
1998. The Trypanosoma cruzi mucin family is transcribed from hundreds of
genes having hypervariable regions. J. Biol. Chem., 273: 10843-10850.
Di Noia, J.M., Buscaglia, C.A., De Marchi, C.R., Almeida, I.C. &
Frasch, A.C.C., 2002. A Trypanosoma cruzi small surface molecule provides
the first immunological evidence that Chagas’ disease is due to a single
parasite lineage. J. Exp.Med., 195: 401-413.
Dias, W.B., Fajardo, F.B., Graça-Souza, A.V., Freire-de-Lima, L.,
Vieira, F., Girard, M.F., Bouteille, B., Previato, J.O., Mendonça-Previato, L.
& Todeschini, A.R., 2008. Endothelial cell signaling induced by trans-sialidase
from Trypanosoma cruzi. Cell Microbiol., 10: 88-99.
64
Docampo, R., Scott, D.A., Vercesi, A.E. & Moreno, S.N.J., 1995.
Intracellular Ca2+ storage in acidocalcisomes of Trypanosoma cruzi. Biochem.
J,. 310: 1005-1012.
Dorta, M.L., Ferreira, A.T., Oshiro, M.E.M. and Yoshida, N., 1995.
Ca2+ signal induced by Trypanosoma cruzi metacyclic trypomastigote surface
molecules implicated in mammalian cell invasion. Mol. Biochem. Parasitol., 73:
285-289.
Dvorak, J.A., Hall, T.E., Crane, M.S, Engel, J.C., Mc Daniel, J.P. &
Uriegas, R., 1982. Trypanosoma cruzi: flow cytometric analysis. I. Analysis of
total DNA/organism by means of mithramycin-induced fluorescence. J.
Protozool., 29: 430-437.
Elias, M.C.Q.B., Vargas, N., Tomazi, L., Pedroso, A., Zingales, B.,
Schenkman, S. & Briones, M.R.S., 2005. Comparative analysis of genomic
sequences suggests that Trypanosoma cruzi CL Brener contains two sets of
non-intercalated repeats of satellite DNA that correspond to T. cruzi I and T.
cruzi II types. Mol. Biochem. Parasitol., 140: 221-227.
El-Sayed, N.M., Myler, P.J., Bartholomeu, D.C., Nilsson, D.,
Aggarwal, G., Tran, A.N., Ghedin, E., Worthey, E.A., Delcher, A.L., Blandin,
G., Westenberger, S.J., Caler, E., Cerqueira, G.C., Branche, C., Haas, B.,
Anupama, A., Arner, E., Aslund, L., Attipoe, P., Bontempi, E., Bringaud, F.,
Burton, P., Cadag, E., Campbell, D.A., Carrington, M., Crabtree, J., Darban,
H., da Silveira, J.F., de Jong, P., Edwards, K., Englund, P.T., Fazelina, G.,
Feldblyum, T., Ferella, M., Frasch, A.C., Gull, K., Horn, D., Hou, L., Huang,
Y., Kindlund, E., Klingbeil, M., Kluge, S., Koo, H., Lacerda, D., Levin, M.J.,
Lorenzi, H., Louie, T., Machado, C.R., McCulloch, R., McKenna, A., Mizuno,
Y., Mottram, J.C., Nelson, S., Ochaya, S., Osoegawa, K., Pai, G., Parsons,
M., Pentony, M., Pettersson, U., Pop, M., Ramirez, J.L., Rinta, J.,
Robertson, L., Salzberg, S.L., Sanchez, D.O., Seyler, A., Sharma, R.,
Shetty, J., Simpson, A.J., Sisk, E., Tammi, M.T., Tarleton, R., Teixeira, S.,
Van Aken, S., Vogt, C., Ward, P.N., Wickstead, B., Wortman, J., White, O.,
Fraser, C.M., Stuart, K.D. & Andersson, B., 2005. The genome sequence of
Trypanosoma cruzi, etiologic agent of Chagas disease. Science, 309: 409-415.
Engmam, D.M., & Leon, J.S., 2002. Pathogenesis of Chagas heart
disease: role for autoimmunity. Acta. Trop., 81: 123-132.
Favoreto Jr, S., Dorta, M.L. & Yoshida, N., 1998. Trypanosoma cruzi
175-kDa protein tyrosine phosphorylation is associated with host cell invasion.
Exp. Parasitol., 89: 188-194.
65












