UFJF – ICE – DEPARTAMENTO DE QUÍMICA
Química dos Elementos – 2a Série de Exercícios – Metais Alcalinos
Prof. Emanoel de Castro Antunes Felício
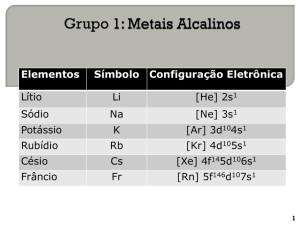
1-Por que os elementos do Grupo 1 são:
a)monovalentes
b)essencialmente iônicos
c)agentes redutores fortes
2-Por que os elementos do grupo 1 têm os menores valores para a primeira energia de
ionização nos respectivos períodos?
3-Por que o lítio tem uma maior tendência de formar compostos covalentes que os
demais elementos do grupo?
4-Por que os metais alcalinos são moles e voláteis?
5-Por que o KCl é branco enquanto o KMnO4 é violeta intenso?
6-Por que as energias de ionização diminuem quando passamos do Li ao Cs?
7-Cite as etapas que consomem e as etapas que liberam energia no ciclo de Born-Haber
dos compostos MgO e NaF.
8-Qual dos métodos a seguir você usaria para extinguir um incêndio provocado pelo
lítio:
a)água
b)nitrogênio
c)dióxido de carbono
d)manta de amianto
9-Como você apagaria um incêndio provocado pelo sódio metálico no laboratório?
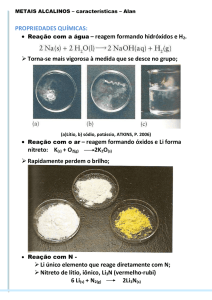
10-Escreva as equações químicas para as reações:
a)lítio e oxigênio
b)lítio e nitrogênio
c)sódio e água
11- Quais são os produtos quando cada um dos metais do grupo 1 é queimado em
atmosfera de oxigênio?
12-O lítio é o menor íon do Grupo 1. Seria de esperar que ele tivesse a maior
mobilidade iônica e, portanto, as soluções de seus sais deveriam ter uma maior
condutividade que soluções de sais de césio. Explique por que isso não ocorre.
13-Complete e equilibre as seguintes reações:
a)Ca + H2
→
b)K + H2O →
c)Li + H2O →
d)K + H2
→
e)H2 + Cl2 →








![caso_clinico_Litio[1]](http://s1.studylibpt.com/store/data/000229299_1-a58e0c512acfc7e4a7b0f6a6626c6623-300x300.png)