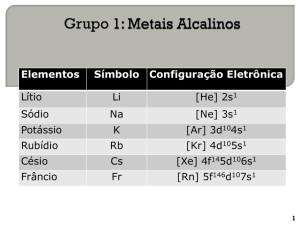
METAIS ALCALINOS – características – Alan
PROPRIEDADES QUÍMICAS:
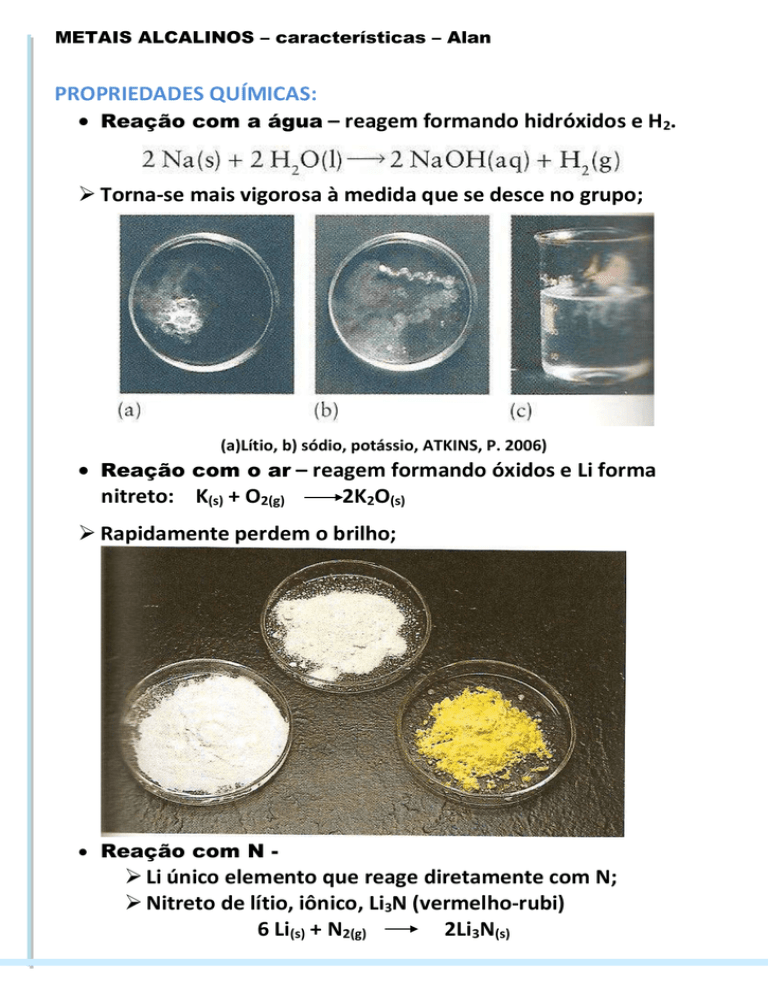
Reação com a água – reagem formando hidróxidos e H2.
Torna-se mais vigorosa à medida que se desce no grupo;
(a)Lítio, b) sódio, potássio, ATKINS, P. 2006)
Reação com o ar – reagem formando óxidos e Li forma
nitreto: K(s) + O2(g)
2K2O(s)
Rapidamente perdem o brilho;
Reação com N -
Li único elemento que reage diretamente com N;
Nitreto de lítio, iônico, Li3N (vermelho-rubi)
6 Li(s) + N2(g)
2Li3N(s)
METAIS ALCALINOS – Características – Alan
O Na2O2 reage com o CO2 do ar desprendendo O2, sendo usado
para purificar o ar em submarinos e recintos fechados;
2Na2O2 + CO2
2Na2CO3 + O2
b) Superóxidos
características: possui o íon [O2]-, que possui um elétron
desemparelhado e são coloridos;
são agentes oxidantes ainda mais forte que os peróxidos e
reagem com água ou ácidos desprendendo H2O2 eO2:
2KO2 + 2H2O
2KOH + H2O2 + ½O2
O K2O é usado em cápsulas espaciais, submarinos
e máscaras de respiro:
4KO2 + 2CO2
2K2CO3 + 3O2
O superóxido de sódio é produzido
industrialmente com bons rendimentos (450°C e 300 atm);
Na2O2 +O2
2NaO2
Geralmente átomos ou íons grandes formam ligações
mais fracas que átomos ou íons pequenos;
Cátions grandes podem ser estabilizados por ânions
grandes;
Nº de cordenação, energia reticular;
PONTOS DE FUSÃO E EBULIÇÃO
METAIS ALCALINOS – Características – Alan
COR DOS COMPOSTOS
Surge porque a energia absorvida ou emitida nas transições
eletrônicas corresponde aos comprimentos de onda da luz na região
do visível.
Todos os íons dos metais do G1 apresentam configuração de
gás nobre, todos os elétrons emparelhados;
Alta quantidade de energia requerida;
Todos os compostos tipicamente brancos;
Formam compostos em que todos os elétrons estão
emparelhados, exceção superóxidos;
Lítio
potássio
Sódio
rubídio e césio
METAIS ALCALINOS – Características – Alan
DIFERENÇAS ENTRE O LÍTIO E OS DEMAIS ELEMENTOS DO GRUPO 1
O lítio se diferencia dos demais elementos do grupo 1, têm
relação diagonal com o magnésio, é encontrado em minerais de
magnésio, nos quais substitui o íon magnésio.
Li Be B
Na Mg Al
C
Si
Causas:
Pequeno tamanho do cátion Li+;
Forte poder polarizante;
Forma ligações de alto caráter covalente;
Forte interação íon-dipolo
Conseqüências:
Pontos de fusão e ebulição bem mais alto; mais duro
Reage menos facilmente com o oxigênio;
O hidróxido de lítio é menos básico (sais menos estáveis);
Forma nitreto, comum para o Grupo 2;
Reage diretamente com o carbono;
Maior tendência de formar complexos;
Li2CO3, LiF (insolúveis); LiOH (pouco solúvel em H2O);
Haletos e alqui-lítios mais covalentes que os comp. De
Sódio;
Li+ e seus compostos mais fortemente hidratados.
METAIS ALCALINOS – Características – Alan
IMPORTÂNCIA BIOLÓGICA
Os organismos vivos requerem 27 elementos, 15 dos quais são
metais. Em maior quantidade: K, Mg, Na e Ca.
Função dos metais no corpo:
Equilibrar as cargas elétricas associadas com macromoléculas
orgânicas negativamente carregadas;
Manter a pressão osmótica dentro da célula;
Bomba de Sódio-Potássio
Na e K semelhantes, porém funções biológicas diferentes;
Na+ é expulso da célula, mas K+ não;
Nas células animais K+ (0,15 M) e Na+ (0,01 M)
A hidrólise de ATP expulsa 3 íons de Na+ para fora da célula e
força a entrada de dois íons K+ e um íon H+ para dentro;
A diferença de concentração na célula produz uma diferença de
potencial elétrico através da membrana;
Relacionando-se com o funcionamento de células nervosas e
musculares;
Facilitam a entrada de outras moléculas (glicose);
Os íons K são essenciais para a glicose, síntese de proteínas e
ativação de enzimas.
METAIS ALCALINOS – Características – Alan
ÓXIDOS, HIDRÓXIDOS, PERÓXIDOS E SUPERÓXIDOS
Óxidos normais – monóxidos
São iônicos; sólidos brancos;
Os óxidos típicos são fortemente alcalinos;
Reagem com água formando bases fortes.
Li2O + H2O
2LiOH
Hidróxidos
Bases fortes em soluções aquosas;
Muito solúveis em água, exceto LiOH;
Reagem com ácidos e formam sais e água,
neutralização;
NaOH + HCl
Na2CO3 + H2O
Reagem com CO2 e formam carbonatos;
2NaOH + CO2
Na2CO3 + H2O
Reagem com óxidos anfóteros Al2O3 formando
Aluminatos;
Reagem com sais amônio e complexos liberando
gás amônia;
NaOH + NH4Cl
NH3 + NaCl + H2O
Reagem com H2S p/ formar sulfetos S-e
hidrogenossulfetos HS-;
NaOH + H2S
NaSH
Na2S
Reagem com álcoois formando alcóxidos;
NaOH + EtOH
NaOEt + H2O
(Etóxido de sódio)
Peróxidos e superóxidos
a) Peróxidos
Características dos peróxidos: contém o íon (-O-O-)2-;
Todos os e- estão emparelhados e são agentes oxidantes;
São sais de ácidos dibásicos, pois reagem com água e ácido
formando peróxido de hidrogênio;
Na2O2 + 2H2O
NaOH + H2O2