A natureza dual dos elétrons:
Partícula ou Onda
Partícula:
Bohr e Rutherford
Modelo planetário / núcleo central rodeado por elétrons.
Requer informação precisa da posição e velocidade do elétron.
Fóton da luz colidindo com elétron de uma superfície metálica , se a
energia do foton for suficiente, o elétron pode ser removido da superfície
do metal.
Onda:
Evidência da natureza ondulatória do elétron foi obtida quando anéis de
difração foram observados fotograficamente, após a passagem de um
feixe de elétrons através de uma fina lâmina metálica.
G1 – Metais Alcalinos
Efeito do tamanho dos átomos e íons e sua estrutura eletrônica sobre as
propriedades físicas e químicas.
O lítio, o primeiro elemento, difere consideravelmente dos demais elementos
do grupo (isso ocorre em todos os elementos representativos).
Metais: Li, Na, K, Cs e Fr
Não são encontrados livres na natureza;
Agentes redutores mais fortes;
Reagem com água;
Moles: a magnitude das energias de coesão determina a dureza;
Baixos pontos de fusão e ebuilição;
Estrutura cúbica de corpo centrado NC = 8;
O lítio metálico não se mistura com os outros alcalinos. Já os demais
metais alcalinos, Na, K, Rb, Cs, são miscíveis uns com os outros em
todas as proporções.
Métodos de obtenção
Eletrólise ígnea.
Menu Principal
Menu Principal
Compostos
Hidretos
Óxidos, Peróxidos e superóxidos
Hidróxidos
Raio do átomo
angstrons
Raio do íon
angstrons
Densidade dos
metais (g/mL)
Li
1,52
0,76
0,54
Na
1,86
1,02
0,97
K
2,27
1,38
0,86
Rb
2,48
1,52
1,53
Cs
2,65
1,67
1,9
Não é comum metais
terem densidades tão
baixas.
Tabela 1.1 – Tamanho e densidade
Energia de ionização
é a energia necessária
para remover o elétron
mais fracamente ligado
de um átomo gasoso
isolado.
A 2ª energia de
ionização é sempre
maior. Por que?
Primeira energia
Segunda energia
de ionização (kJ mol-1)
de ionização (kJ mol-1)
Li
520,1
7.296
Na
495,7
4.563
K
418,6
3.069
Rb
402,9
2.650
Cs
375,6
2.420
Tabela 1.2 – Energias de ionização
Menu Principal
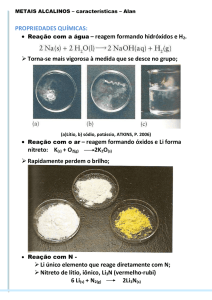
Reagem com água
Todos os metais do Grupo 1 reagem com água, liberando hidrogênio e
formando os correspondentes hidróxidos.
2Li(s)
+
2H2O(l)
2LiOH(aq) + H2(g)
2Na(s) + 2H2O(l)
2NaOH(aq) + H2(g)
2K(s) + 2H2O(l)
2KOH(aq) + H2(g)
O lítio reage a uma velocidade moderada; o sódio funde na superfície
da água e o metal fundido desliza vigorosamente, podendo inflamar-se
(especialmente se ficar parado); e o potássio funde e sempre se
inflama. Com rubídio e césio a reação é explosiva.
Menu Principal
Moles : a magnitude das energias
de coesão determina a dureza
Energia de coesão
(entalpia de atomização)
(kJ mol-1)
Li
161
Na
108
K
90
Rb
82
Cs
78
Tabela 1.3 – Entalpias de coesão
Menu Principal
Pontos de Fusão e Ebulição
Ponto de Fusão
Ponto de
Ebulição
(0C)
(0C)
Li
181
1.347
Na
98
881
K
63
766
Rb
39
688
Cs
28,5
705
Tabela 1.4 – Pontos de fusão e de ebulição
As baixas energias de coesão se refletem nos valores muito baixos
das temperaturas de fusão e ebulição dos elementos do grupo.
Menu Principal
Estrutura cúbica de corpo centrado
Menu Principal
Hidretos
• Fortes agentes redutores.
• M+ H• O hidreto de lítio é o mais fácil de formar.
(Para os demais a facilidade decresce do lítio para o césio).
2M(s) + H2(g)
2 MH(s)
Compostos
Óxidos, Peróxidos e Superóxidos
4Li(s) + O2(g)
2Li2O(s)
2Na(s) + O2(g)
Na2O2(s)
M(s) + O2(g)
MO2(g)
Os peróxidos contém o íon [-O-O-]2- . Eles são diamagnéticos (todos os
elétrons estão emparelhados) e agentes oxidantes.
Os superóxidos contêm o íon [O2]- que possui um elétron desemparelhado;
sendo portanto paramagnético e coloridos :LiO2 e NaO2 são amarelos, KO2
alaranjado, RbO2 castanho e CsO2 alaranjado .
Compostos
Hidróxidos
2M(s) + 2H2O(l)
2 MOH(aq) + H2(g)
Solubilidade
(g/100 g de H2O)
Li
13,0 (25 oC)
Na
108,3 (25 oC)
K
112,8 (25 oC)
Rb
197,6 (30 oC)
Cs
385,6 (15 oC)
Tabela 1.4 – Solubilidades dos hidróxidos do Grupo 1
Compostos