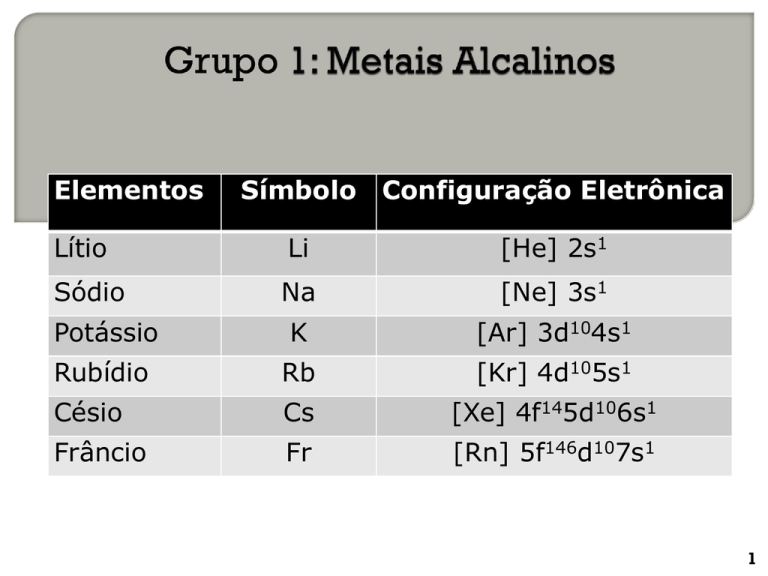
Elementos
Símbolo Configuração Eletrônica
Lítio
Li
Sódio
Na
[He] 2s1
Configuração Eletrônica
[Ne] 3s1
Potássio
K
[Ar] 3d104s1
Rubídio
Rb
[Kr] 4d105s1
Césio
Cs
[Xe] 4f145d106s1
Frâncio
Fr
[Rn] 5f146d107s1
1
Metais
Excelentes condutores de eletricidade
Moles
Altamente reativos
Fortes agentes redutores
São eletropositivos
Compostos monovalentes, iônicos e incolores
Hidróxidos e óxidos são bases muito fortes
Sódio metálico
Explosão do sódio
Lâmpada de sódio
2
Li
Menor metal alcalino
35º em abundância
Descoberto por J.A. Afrvedson (1817)
Encontrado nos minérios Spodumena
LiAl(SiO3)2 e Petalita Li2Al2(SiO3)3(FOH)2
Obtido por redução eletrolítica
Usado em baterias recarregáveis e
plataformas espaciais para remoção de CO2
e ar
Usado no tratamento de depressão maníaca
3
Na
Metal branco prateado
7º em abundância
Descoberto por Sir Humphrey Davy em
1807
Encontrado na sal gema NaCl e água do
mar
Obtido por eletrólise do NaCl
Usado na síntese de organo-metálicos, em
sistemas de refrigeração de usinas nucleares
e na iluminação pública
4
K
Metal branco prateado
8º em abundância
Descoberto por Sir Humphrey Davy em
1807
Encontrado na silvita KCl e água do mar
Obtido por eletrólise do KOH
Usado na forma de sais como fertilizante
K2SO4 (aditivo do gesso), K2CO3 (vidros e
cerâmicas),
KNO3
(explosivo),
KBr
(sedativo), KMnO4 (bactericida)
5
Metal sólido que funde a 40ºC
23º em abundância (16º metal)
Descoberto
por Robert Bunsen e Gustav
Kirchhoff em 1861
Encontrado em diversos minerais. A lepidolita
(principal fonte) contém 1,5% de rubídio metal
Obtido como sub-produto do processamento
do Lítio
Usado
em motores iônicos para naves
espaciais
É utilizado na fabricação de cristais especiais
para sistemas de telecomunicação de fibra
óptica e equipamentos de visão noturna
Aula 4: Química de Elementos
6
Polucita
Metal sólido que funde a 28,5ºC
46º em abundância
Descoberto por Robert Bunsen e Gustav
Kirchhoff em 1860
Coloração amarelo prateada
Usado nas indústrias de energia nuclear,
Obtido por eletrólise do cianeto ou cloreto
de césio
7
Metal radioativo
Obtido como resultado da desintegração do
actínio.
Encontrado em minerais de urânio
Pode ser feito artificialmente bombardeando
tório com prótons.
É o mais instável dos primeiros 101 elementos.
O seu isótopo 223Fr têm uma meia-vida de 22
minutos. Este é o único isótopo que ocorre na
natureza
Existe no máximo 20-30g na crosta terrestre.
8
Propriedades Físicas e Químicas
As propriedades dos metais alcalinos estão
intimamente relacionadas com a estrutura eletrônica
e tamanho do átomo
Todos dos metais
alcalinos
apresentam
estrutura cúbica de
corpo centrado
N.C.=8
9
Propriedades Gerais
Elemento
Raio metálico
(Å)
Raio Iônico
(Å)
d
(g/cm3)
Li
1,52
0,76
0,53
Na
1,86
1,02
0,97
K
2,27
1,38
0,86
Rb
2,48
1,52
1,53
Cs
2,65
1,67
1,90
Os metais alcalinos são grandes, mas apresentam
baixa densidade em comparação a outros metais:
Fe (7,9g/cm3); Hg (13,6g/cm3)
Os elementos do grupo 1 são os maiores do seu
período
10
Propriedades Gerais
Metal
Alcalino
Energia de
Ionização
(KJ/mol)
Ponto de Ponto de
Entalpia
Fusão
Ebulição de Coesão
(°C)
(ºC)
(KJ/mol)
Li
520,1
181,0
1347,0
161,0
Na
495,7
98,0
881,0
108,0
K
418,6
63,0
766,0
90,0
Rb
402,9
39,0
688,0
82,0
Cs
375,6
28,5
705,0
78,0
Baixa E.I. considerável em relação aos demais
elementos. 2ª. EI muito alta (não ocorre em condições
normais)
Pontos de Fusão e Ebulição baixos
Energia de coesão baixa (força que mantém unidos os
átomos ou íons no sólido)
11
Eletronegatividade e tipo de ligação
Eletronegatividade baixa
(menor do que qualquer outro elemento)
Formam ligações iônicas
Eletronegatividade
Na
0,9
Cl
3,0
Diferença = 2,1
Diferença entre as eletronegatividades entre 1,7 a 1,8
ligação 50% iônica
12
Aplicação dos Metais Alcalinos e Compostos
Estereato de Lítio: usado na fabricação de
graxas e lubrificantes
Carbonato de Lítio: usado no tratamento de
doenças mentais, na produção eletrolítica do Al
adicionado à bauxita e no endurecimento do
vidro
Lítio
metálico:
usado
em
células
eletroquímicas, pilhas e ligas. Li:Pb (metal
branco), Li:Al (peças de avião), Li:Mg (chapas de
blindagem)
Hidróxido de Sódio: usado na fabricação de
papel, obtenção de alumina, sabões
13
Carbonato de Sódio: usado na fabricação de
sabão e detergentes, vidros e produtos de limpeza
Hipoclorito de Sódio: usado como alvejante e
desinfetante
Bicarbonato de Sódio: usado como fermento
químico
Cloreto, Sulfato e Nitrato de Potássio: usados
como fertilizante
Permanganato
sacarina
de
Potássio:
fabricação
de
Carbonato e Óxido de Potássio: usado em
cerâmicas
14
Importância Biológica
Na e K são essenciais manter pressão
osmótica e equilibrar cargas elétricas
associadas com macromoléculas orgânicas
15
Propriedades Químicas
Reatividade em água
Na(s) + H2O → Na+ (aq) + OH- (aq) + ½H2 (g)
Velocidade da reação:
Li<Na<K
16
Reatividade com oxigênio
2Li(s) + ½O2 → Li2O (s) (Formação de óxidos)
Na(s) + O2 → Na2O2 (s) (Formação de peróxidos)
K(s) + O2 → KO2 (s) (Formação de superóxidos)
17
Reatividade com nitrogênio
6Li(s) + N2 → 2Li3N (s)
(único metal alcalino que reage com
nitrogênio)
Composto iônico vermelho-rubi,
importante na síntese da
amônia
2Li3N → 6Li + N2
Li3N + 3H2O → 3LiOH + NH3
18
Óxidos
Monóxidos são sólidos iônicos
Alcalinos
K2O + H2O→ 2KOH
Hidróxidos
NaOH – soda cáustica
KOH – potassa cáustica
corrosivo (pele e
vidro)
Todos os hidróxidos dos metais alcalinos são solúveis
em água (exceção LiOH pouco solúvel)
19
Reações dos hidróxidos de metais alcalinos
Ácidos
NaOH + HCl NaCl + H2O
Dióxido de Carbono
2NaOH + CO2 Na2CO3 + H2O
Sais de amônio
NaOH + NH4Cl NH3 + NaCl + H2O
Álcoois
NaOH + EtOH NaOEt (alcóxidos) + H2O
20
Diferença entre o lítio e os demais
elementos do Grupo 1
Assemelha-se mais aos
(particularmente o Mg)
elementos
do
Grupo
2
1 – p.f. e p.e. maior que os demais elementos do Grupo1
2 – Li possui maior dureza
3 – Menos reativo com o oxigênio
4 – LiOH é menos básico
5 – Li forma nitreto (LiN3) – nenhum outro elemento do
Grupo 1 forma nitreto, mas os elementos do Grupo 2 sim
6 – Li2CO3, Li3PO4 e LiF são insolúveis em água
(semelhante ao Mg)
7 – O Li+ e seus compostos são mais fortemente
hidratados que os compostos dos demais elementos do
grupo 1
21
Razões e Generalizações
Generalização
Primeiros elementos de cada um dos grupos
representativos (Li, Be, C, N, O e F) diferem do
restante dos elementos de seus respectivos grupos
Razões
1 – Menor tamanho dos primeiros elementos em
relação aos demais elementos do grupo
2 – Primeiro elemento forma no máximo 4 ligações
(apenas 1 orbital s e 3p). Os demais podem usar
orbitais d em suas ligações
3 – As similaridades entre o Li(1º. Elemento grupo 1)
e o Mg (2º. Elemento grupo 2) seguem a correlação
diagonal na TP.
22












