ENSINO MÉDIO
3
RESPOSTAS DAS TAREFAS
1ª SÉRIE
Química - Setor A
Aulas 13 e 14:
2.O carbono e o oxigênio estão no mesmo período, portanto têm o mesmo número de camadas. Como o
oxigênio tem mais prótons que o carbono (6C e 8O),
há maior atração do seu núcleo pela eletrosfera, o que
torna seu raio atômico menor do que o do carbono.
Portanto a representação I é a mais apropriada.
Tarefa mínima
1.Não metal, metal, gás nobre, não metal e metal,
respectivamente.
2.Essas propriedades são características dos elementos
metálicos, logo: Mg e K.
Tarefa complementar
1.Sim. O ânion é sempre maior que seu átomo, pois os
dois elétrons a mais que ele tem tornam sua eletrosfera mais “inchada” (maior raio). Isso ocorre devido
ao aumento da repulsão entre os elétrons. Dessa forma, o desenho correto deveria ser:
Átomo de oxigênio (O):
3.Não, pois não existe metal gasoso nas condições
ambientes.
4.Sim. A carga é Ba21, pois o bário (Ba) é um metal. Essa
categoria de elementos químicos tende a dar elétrons
e se transformar em cátion.
5.O bário pertence à família dos metais alcalinos terrosos (grupo 2A). Os elementos dessa família têm 2
elétrons na camada de valência.
Ânion do oxigênio (O22):
Tarefa complementar
1.O não metal carbono – na forma da substância simples grafite – é um bom condutor de corrente
elétrica.
Aula 16:
2.Os metais sódio (Na) e potássio (K) são metais de
baixa dureza, visto que podem ser riscados até por um
palito de dente.
3. a)Ca e Mg.
c) (Grupo 5A): N, P e As.
Tarefa mínima
1.a)Ca: metal; C e O: não metais.
b) CaCO3 e CaO: iônicos; CO2: molecular.
b) Cl e F.
2.a)Todos são metálicos.
b) Ligação metálica.
Aula 15:
Tarefa complementar
Tarefa mínima
1.a)NaCl: iônico; C12H22O11: molecular
b) Açúcar, já que compostos moleculares têm menor
ponto de ebulição.
c) O sal de cozinha.
d) Não. Objetos metálicos conduzem corrente elétrica no estado sólido. Exemplos: garfo, faca, panela, etc.
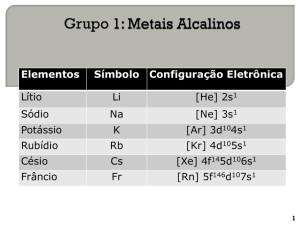
1.Esses elementos estão na mesma família (2A). Dessa forma, quanto mais baixa for a posição do elemento na família, maior será o número de camadas
e, consequentemente, maior será o raio atômico.
Portanto a ordem crescente de raio atômico é:
Mg Ca Sr Ba.
SISTEMA ANGLO DE ENSINO
1
Ensino Médio zeta - 1a série
Aulas 17 e 18:
cátions e ânions se atraem.
⎧
⎨
⎩
2.K: família 1 (metal)
KI
I: família 17 (não metal)
Tarefa mínima
1.(V) Ligações iônicas ocorrem entre metais e não
metais.
(V) Ligações covalentes ocorrem entre não metais.
(V) L igações metálicas ocorrem apenas entre
metais.
(F) Cátions são íons negativos, e ânions, positivos.
(V) Metais geralmente formam cátions, e ametais formam ânions.
(F) Cátions e ânions se repelem.
Cátions são íons positivos, e ânions são negativos;
3.a)Ra3N2
b) RaO
c) RaCl2
4.a)Porque esses elementos já são estáveis, assim não
tendem a dar nem a receber elétrons.
b) BaI2.
c) NaF
d) FeO e Fe2O3.
Tarefa complementar
1.
Fórmula
Nome
Uso medicinal
Al(OH)3
Hidróxido de alumínio
Antiácido estomacal
CaSO4
Sulfato de cálcio
Imobilização de membros em caso de fratura
FeSO4
Sulfato de ferro II
Tratamento de anemia
NaHCO3
Bicarbonato de sódio
Antiácido
BaSO4
Sulfato de bário
Contraste para radiografias gastrointestinais
2.Cax(PO4)3OH → x(12) 1 3(23) 1 1(21) 5 0
x55
Química - Setor B
Aulas 13 e 14:
Tarefa complementar
Tarefa mínima
1.a)Adicionar os sais na água. O sal que se dissolve é o
KCl, o outro é o AgCl.
b)Como o AgCl não se dissolve na água, basta fazer
uma filtração do sistema.
c)Não é possível separar o KCl por filtração porque
ele se dissolve na água. Nesse caso pode-se fazer
uma evaporação ou destilação simples.
1.c
2.a)As mudanças de estado físico são observadas na
evaporação e na destilação. A única separação que
não tem mudanças de estado físico é a da mistura
I, que é heterogênea (decantação).
b)Evaporação para extrair o sal e destilação simples
para obter os dois componentes.
2.a)De acordo com a tabela, se em cada litro de água
do mar há (27 g 1 6,8 g 1 5,6 g 1 1,8 g) 41,2 g,
então em 500 mL (metade desse volume teríamos
20,6 g.
b)Não, ele estaria misturado aos outros sais.
c)A tabela não indica que os sais contêm o elemento
iodo, portanto só pode ter sido adicionado
posteriormente.
3.a)Todas as substâncias são líquidas a 25˚C.
b)100 mL de etanol 1 100 mL de ácido acético 1 100
mL de acetona correspondem à massa de (respectivamente): 78,9 g 1 105 g 1 79,1 g 5 263 g.
c)Não, pois é uma mistura homogênea.
d)A mais volátil (menor temperatura de ebulição), ou
seja, a acetona.
3.a)Destilação fracionada.
b)O mais volátil é o GLP, e o menos volátil é o
piche.
c)O s compostos que possuem temperaturas de
fusão maiores que 25˚C são sólidos nas condições ambientes. Dentre os presentes na tabela, são sólidos nessas condições a parafina
e o piche.
4.a)Melhorar a oxigenação do paciente, ou seja, fazer
com que ele respire mais eficientemente.
b)O gás oxigênio se encontra misturado no ar
atmosférico.
c)Para se obter esse gás, é feita uma liquefação total
do ar atmosférico, seguida de destilação fracionada
do ar líquido.
SISTEMA ANGLO DE ENSINO
2
Ensino Médio zeta - 1a série
Aula 15:
b)Seria necessário colocar, num prato, dois pacotes
inteiros de biscoito (2 x 200 g 5 400 g) mais meio
pacote (100g), e completar o outro prato com farinha até equilibrar os pratos.
Tarefa mínima
1.a)É uma transformação de uma substância em
outra.
b)Há reação em III e IV; em I e II, apenas mistura.
2.Y 5 5u’ e Z 5 30 u’.
3.a)Como é uma média, seu valor obrigatoriamente
será entre 10 u e 11 u. Como existem mais isótopos
11 do que isótopos 10, essa média estará mais próxima de 11 u.
Tarefa complementar
1.a)Duas transformações, uma de CaO em Ca(OH)2 e
outra de Ca(OH)2 em CaCO3.
b)O Ca(OH)2 é solúvel em água, e o CaCO3, não, já
que se precipita.
2.II e IV não são reações químicas. Em II, ocorre apenas
a condensação do vapor, e em IV, a solidificação da
água.
Tarefa mínima
1.a)2 H2(g) 1 1 O2(g) ⎯⎯→ 2 H2O(l)
2.a)MACo 5 4,9111 12,0000 u 5 58,9332 u
b)No 59
27 Co encontramos 27 prótons, 32 nêutrons e
27 elétrons.
c)O número de massa é a soma de prótons e nêutrons, ou seja, 59.
2.d.
Tarefa complementar
3.a)Sim, esses números não são exatamente iguais, porém próximos, para um dado isótopo.
b)O número de massa corresponde à soma de prótons e nêutrons de um átomo. É um número adimensional, ou seja, sem unidade. Já massa atômica
é um número medido em u (unidade de massa
atômica), obtido pela comparação da massa do
isótopo com a massa do carbono 12.
c)É uma massa média obtida pela média ponderada
das massas dos isótopos desse elemento.
d)Como cada isótopo aparece com porcentagem de
50%, a média será 80 u.
e)N essas moléculas de Br 2, temos as seguintes
possibilidades:
79
Br-79Br: massa molecular 5 158 u
79
Br-81Br: massa molecular 5 160 u
81
Br-81Br: massa molecular 5 162 u
1.a)Para que ocorra a liberação do gás NH3, o fermento
em questão deve conter em sua fórmula o elemento
nitrogênio, portanto é o NH4HCO3.
b)NH4HCO3(s) → NH3(g) 1 H2O(v) 1 CO2(g)
c)2 NaHCO3(s) → Na2CO3(s) 1 H2O(v) 1 CO2(g)
8 CO 2(g) 1
Etanol: C2H6O(l) 1 3 O2(g) → 2 CO2(g) 1 3 H2O(g)
Aulas 17 e 18:
Tarefa mínima
1.a)Deve-se pôr dois pacotes num prato e, no outro,
uma quantidade de farinha que os equilibre.
SISTEMA ANGLO DE ENSINO
200 u 1 880 u
5 10,8 u
100
1.a)O átomo-padrão é o isótopo 12 do carbono.
b)A massa desse padrão é 12,0000 u.
c)Essa massa foi convencionada nesse valor.
800ºC
b)CaCO3(s) ⎯⎯→ CaO(s) 1 CO2(g)
5
c)2 NH3 1 O2 → 2 NO 1 3 H2O
2
d)H 3 PO 4(aq) 1 3 NaOH (aq) → Na 3 PO 4(aq) 1
1 3 H2O(l)
→
MAB 5
Tarefa complementar
25
2.Gasolina: C 8H 18(l) 1
O 2(g)
2
1 9 H2O(g)
20% 10 u 1 80% 11 u
100%
4.a)58,5 u
b)44 u
c)100,1 u
d)310,3 u
Aula 16:
b)MAB 5
3
Ensino Médio zeta - 1a série