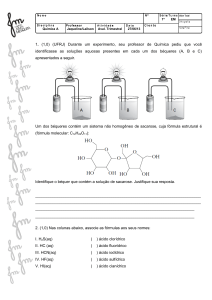
Definições:
Cátions e ânions:
Cátions são íons com carga positiva isto é que perderam um elétron. Já ânions
são íons com carga negativa que ganharam um elétron.
Ácidos:
Em geral ácidos, são substâncias que se ionizam em solução aquosa,
libertando iões H+ (íons hidrogênio).
Bases:
Base é toda substância que, em solução aquosa, libera, exclusivamente como
ânion, o íon OH– (hidróxido).
Sal:
Em geral, é um sal é um composto iônico que em água se dissocia
num cátion diferente de H+ e um ânion diferente de OH. Eles são tipicamente o
produto de uma reação
Óxido:
Em geral óxidos são compostos binários em que o oxigênio é o elemento
mais eletronegativo.
Classificação:
Básicos: reagem com água, formando uma base, e reagem com ácidos,
formando sal e água.
Ácidos: reagem com água, formando ácido, e reagem com base, formando sal
e água.
1) Monte ácidos a partir dos ânions monovalentes a seguir:
Cl , Br, I, eF
Resposta:
HCl, HBr e HF
Monte bases a partir dos cátions monovalente a seguir:
Na, Ca, Ag, e K
Resposta:
NAOH, CaOH, AgOH e KOH
2) Monte sais a partir dos cátions e ânions a seguir:
Cátions: Na, Ca, Ag e K
Ânions: Cl, Br, CO3 e F
Resposta possível (pois pode haver outras possibilidades):
NaF, CaCl2, AgBr, KCO3
3) Monte óxidos a partir dos elementos a seguir:
Ca, F e Na,
Resposta:
CaO, Na2O. Não é possível formar óxido com flúor porque ele é mais
eletronegativo que o oxigênio, portanto forma-se um fluoreto quando esse
elemento se associa ao O e não um óxido.
4) Monte uma reação uma reação de um ácido com uma base:
Uma reação de um ácido com uma base forma sal e água conforme o exemplo
a seguir:
H2SO4 + KOH
K2SO4 + H2O
5) Monte uma reação de um óxido ácido e água:
Uma reação de um óxido ácido com água forma um ácido, conforme o exemplo
a seguir:
SO3 + H2O
H2SO4
6) Monte uma reação de um óxido básico e água:
NaO + H2O
NaOH