Aula: 24
Temática: Metabolismo dos aminoácidos – parte II
Além de serem constituintes das proteínas, os aminoácidos podem ser
usados como precursores de moléculas biológicas nitrogenadas. O processo
envolve a eliminação do grupo amina (desaminação), incorporação do amônio
assim produzido em uréia para posterior excreção e conversão do esqueleto
carbonado em intermediários metabólicos. Nesta aula iremos estudar como
isto ocorre. Acompanhe!
A desaminação é a remoção de um grupo amino (–NH2) de um composto. A
desaminação enzimática ocorre no fígado e é importante no metabolismo dos
aminoácidos, especialmente na sua degradação e subseqüente oxidação. O
grupo amino é removido como amônia e excretado como uréia ou ácido úrico.
A desaminação da maior parte dos aminoácidos envolve uma transaminação
prévia, que consiste na transferência do seu grupo amino para um α-cetoácido,
produzindo o aminoácido correspondente ao α-cetoácido e o α-cetoácido
correspondente ao aminoácido original. Geralmente o aceptor do grupo amina
é o α-cetoglutarato, que é convertido em glutamato.
As aminotransferases usam piridoxal-5'-fosfato, um derivado da vitamina B6. O
piridoxal está também envolvido em reações de descarboxilação de
aminoácidos e de eliminação das suas cadeia laterais. As aminotransferases
são específicas para cada tipo de aminoácido, produzindo os α-cetoácidos
correspondentes. No entanto, a maioria só aceita α-cetoglutarato ou
oxaloacetato, como aceptor de grupo amina, produzindo glutamato ou
aspartato. Por conseguinte, os grupos amina da maior parte dos aminoácidos
são utilizados para produzir glutamato ou aspartato, que por sua vez podem ser
reconvertidos pela glutamato-aspartato aminotransferase.
BIOQUÍMICA
Reações Gerais dos Aminoácidos.
Transaminação. A reação de transaminação envolve a transferência do
aminogrupo de um aminoácido a um cetoácido para formar o aminoácido
análogo a este e produzir o cetoácido (esqueleto carbônico) correspondente ao
doador de amino original (fig. 1).
Fig. 1 – Transaminação: reação geral da transferência do aminogrupo (NH2).
Transaminases como as enzimas glutamato-transaminase e a alaninatransaminase, capazes de reagir com quase todos os aminoácidos são
extremamente importantes. A glutamato-transaminase é específica para ácido
glutâmico e α-cetoglutárico, mas reagirá, em diferentes velocidades, com
aproximadamente todos os outros aminoácidos protéicos (fig.2).
Fig. 2 – Transaminação, ou seja, transferência do grupo amina (NH2) de um aminoácido
doador para o ácido α-cetoglutárico, com intervenção da enzima glutamato-transaminase,
originando como produtos um cetoácido e ácido glutâmico.
Da mesma forma, alanina-transaminase é específica para alanina e ácido
pirúvico, como um dos seus dois pares complementares de substrato, mas
reage com quase todos os outros aminoácidos. Finalmente, uma glutamato-
BIOQUÍMICA
alanina-transaminase altamente específica, encontrada em muitos organismos,
catalisa a transaminação entre esses dois aminoácidos (fig. 3).
O significado do processo de transaminação é melhor avaliado quando se
compreende que a reação da figura 2, juntamente com a reação da figura 3,
servem para coletar aminogrupos de muitos outros aminoácidos, sob forma de
ácido glutâmico. Essas reações ocorrem, sobretudo, no citoplasma celular.
Sendo a membrana mitocondrial permeável ao ácido glutâmico, esse então
pode penetrar na matriz mitocondrial, onde pode transaminar novamente por
meio de uma aspartato-transaminase mitocondrial ou, alternativamente, ser
desaminado oxidativamente pela glutamato-desidrogenase. As transaminases
são, portanto, encontradas tanto no citoplasma celular, como dentro da
mitocôndria de células eucarióticas, tendo, em cada uma dessas regiões da
célula, propriedades características. As reações catalisadas pelas enzimas
transaminases são reversíveis.
Fig. 3 – Transaminação do grupo amina (ou aminogrupo) da alanina para o ácido αcetoglutárico, transformando-o em ácido glutâmico.
As transaminases requerem piridoxal-fosfato como cofator e, na presença da
enzima, a coenzima forma uma base de Schiff com o aminoácido. Por
rearranjos eletrônicos subseqüentes o aminogrupo é transferido para a
coenzima para formar piridoxamina-fosfato. O último composto pode então
reagir com o cetoácido aceptor para regenerar o piridoxal-fosfato e produzir o
aminoácido.
BIOQUÍMICA
A base de Schiff é o primeiro produto formado pelo ataque da glicose à
proteína. A reação se inicia quando um grupo aldeídico (CHO) de glicose se
liga a um grupo amino (NH2) da proteína. As moléculas se combinam formando
o que é chamado uma base de Schiff. Esta combinação é instável e
rapidamente se rearranja, mas é ainda reversível e produz uma substância
conhecida como produto de Amadori.
Embora algumas enzimas sejam formadas apenas por proteína, muitas outras
são proteínas complexas (heteroproteínas); elas têm um componente de
proteína e um cofator.
Um cofator pode ser um metal, como ferro, cobre, ou magnésio; uma molécula
orgânica firmemente ligada ao corpo da enzima, ou um tipo especial de
molécula de substrato conhecido como coenzima. O cofator ajuda a ação
catalítica de uma enzima, como fazem os cofatores metálicos e os grupos
prostéticos ou tomam parte na reação enzimática, como fazem as coenzimas
solúveis.
Uma coenzima serve como um tipo de substrato em certas reações
enzimáticas e assim reagem nas proporções exatas (estequiometricamente)
exigidas pela reação. Podem ser também, consideradas como co-substratos,
pois tem tamanho e comportamento semelhantes e são solúveis como os
substratos. Por exemplo, uma coenzima pode assumir o papel de um aceptor
de hidrogênio, como fazem o NAD (que aceita hidrogênio) ou uma substância
doadora de grupamentos químicos, como faz o ATP (que doa ácido fosfórico radical fosforil, grupo fosfato).
DESAMINAÇÃO: É a remoção de um grupo amino (–NH2) de um composto. A
desaminação enzimática ocorre no fígado e é importante no metabolismo dos
aminoácidos, especialmente na sua degradação e subseqüente oxidação. O
grupo amino é removido como amônia (NH3) e excretado, como uréia ou ácido
úrico.
A transaminação do ácido glutâmico (fig. 4) estabelece um mecanismo de
desaminação de todos os outros aminoácidos.
BIOQUÍMICA
Fig. 4 – Esquema da desaminação.
A transaminação conserva os grupos amina. A desaminação é levada a cabo
principalmente pela glutamato desidrogenase, uma enzima mitocondrial que
usa quer NAD+ quer NADP+.
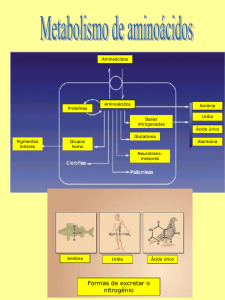
O NH3 produzido dessa maneira (amônia) é tóxico e deve ser eliminado. Nos
animais, desenvolveram-se mecanismos elaborados para a detoxificação. Nas
plantas, que são desprovidas dos órgãos excretores, o NH3 é convertido a
amidas não-tóxicas, glutamina e asparagina. Muitos animais aquáticos
excretam-no simplesmente sob a forma de amônio. Outros animais, que não
têm tanta água à sua disposição, convertem-no em produtos menos tóxicos
como a uréia, e que por isso não precisam de tanta água para serem
excretados.
A uréia é sintetizada no fígado, e levada (secretada) para a corrente
sangüínea, de onde será excretada pelo rim. O ciclo da uréia (fig. 5), é uma
via metabólica cíclica, que transforma duas moléculas de amônia e uma
molécula de gás carbônico em uma molécula de uréia. Possui várias e
complexas etapas enzimáticas e gasta três ATPs para cada uréia sintetizada:
Compostos como o fumarato, o aspartato, o glutamato e o α-cetoglutarato
participam do processo, que envolve também 2 enzimas mitocondriais e 3
citoplasmáticas.
BIOQUÍMICA
Fig. 5 – Esquema do ciclo da uréia. A hidrólise da arginina produz uréia e ornitina, que depois
de reentrar na mitocôndria pode recomeçar o ciclo.
O ciclo da uréia tem um elevado custo energético, equivalente à hidrólise de
quatro ATP a quatro ADP. No entanto, este custo pode ser recuperado na
cadeia transportadora de elétrons, uma vez que um NADH é produzido na
desaminação do glutamato e outro NADH na posterior oxidação do fumarato a
oxaloacetato, o que é equivalente a cerca de seis ATP.
Além da enzima glutâmico desidrogenase, existem outras que também
exercem a função de desidrogenação, como a aminoácido-oxidase, que
provoca
a
desaminação
oxidativa.
Também
ocorrem
processos
de
desaminação não-oxidativa, catalisada pelas amônia-liases.
A desaminação catalisada por desaminases específicas, com a enzima
hepática chamada serina-desidratase (nome sistemático para a L-serinahidrolase) é específica para a L-serina, envolvendo a perda de NH3 e rearranjo
dos átomos restantes para liberar piruvato.
As desamidases também agem nas desaminações, mas de forma diferente
daquelas nas quais os α-aminogrupos dos aminoácidos são libertados como
NH3. nNessas reações, o nitrogênio amídico da glutamina e asparagina são
liberados como amônia. Enzimas hidrolíticas especificas catalisam a hidrólise
dessas duas amidas e produzem NH3.
BIOQUÍMICA
A glutamina desempenha um papel central no metabolismo do nitrogênio como
um percursor de aminogrupos. Ela é também usada para transportar e
armazenar NH3 em uma forma não-tóxica antes de ser excretado. Assim, os
organismos têm os meios de sintetizar, bem como de degradar esse composto.
DESCARBOXILAÇÃO: É um terceiro tipo de reação enzimática sofrida por
muitos aminoácidos.
Em contraste com as reações de desaminação e transaminação no
catabolismo de aminoácidos, devem ser assinalados os aspectos anabólicos
das reações de descarboxilação catalisadas por enzimas aminoácidodescarboxilase.
Muitas
das
aminas
formadas
como
resultado
da
descarboxilação tem importantes efeitos fisiológicos. Assim, uma histidinadescarboxilase, encontrada em tecidos animais, pode produzir histamina, uma
substância que, entre outros efeitos, estimula a secreção gástrica.
DESTINO METABÓLICO DOS AMINOÁCIDOS: As proteínas e, portanto, os
aminoácidos, não são usualmente desdobrados para a produção de energia, se
os carboidratos ou os lipídeos estiverem disponíveis ao organismo. Assim, os
aminoácidos são normalmente usados:
(1) Na síntese de peptídeos e de proteínas;
(2) Como uma fonte de átomos de nitrogênio (por transaminação) para a
síntese de outros aminoácidos;
(3) Na síntese de outros compostos nitrogenados e não-nitrogenados.
Qualquer aminoácido em excesso em relação às quantidades
requeridas para essas três atividades será desdobrado por desaminação, e o
esqueleto carbonado resultante será metabolizado. O NH3 produzido, se em
excesso, será eliminado como uma excreta nitrogenada. Todavia o estado
dinâmico dos compostos de nitrogênio requer que boa parte do NH3 seja
assimilada pela célula na síntese de novos compostos nitrogenados.
BIOQUÍMICA