Ministério da Educação
UNIVERSIDADE TECNOLÓGICA FEDERAL DO PARANÁ
Campus Dois Vizinhos
QUÍMICA ANALÍTICA
Prof.a. Renata P. Herrera Brandelero
FORMULÁRIO DE QUÍMICA ANALÍTICA
Aluno:_____________________________________________data___/____/_____
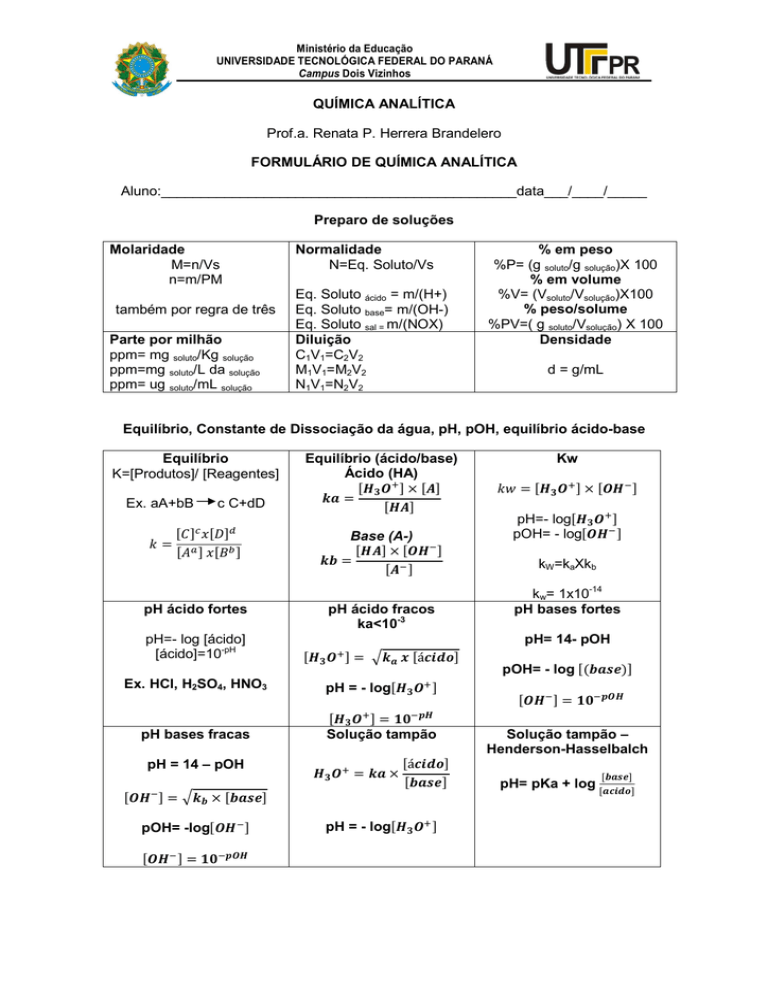
Preparo de soluções
Molaridade
M=n/Vs
n=m/PM
também por regra de três
Parte por milhão
ppm= mg soluto/Kg solução
ppm=mg soluto/L da solução
ppm= ug soluto/mL solução
Normalidade
N=Eq. Soluto/Vs
Eq. Soluto ácido = m/(H+)
Eq. Soluto base= m/(OH-)
Eq. Soluto sal = m/(NOX)
Diluição
C1V1=C2V2
M1V1=M2V2
N1V1=N2V2
% em peso
%P= (g soluto/g solução)X 100
% em volume
%V= (Vsoluto/Vsolução)X100
% peso/solume
%PV=( g soluto/Vsolução) X 100
Densidade
d = g/mL
Equilíbrio, Constante de Dissociação da água, pH, pOH, equilíbrio ácido-base
Equilíbrio
K=[Produtos]/ [Reagentes]
Ex. aA+bB
=
c C+dD
pH ácido fortes
pH=- log [ácido]
[ácido]=10-pH
Ex. HCl, H2SO4, HNO3
pH bases fracas
pH = 14 – pOH
= × %&
pOH= -log = !"#
Equilíbrio (ácido/base)
Ácido (HA)
× =
Base (A-)
× =
pH ácido fracos
ka<10-3
Kw
= × pH=- log pOH= - log kW=kaXkb
kw= 1x10-14
pH bases fortes
pH= 14- pOH
= á pH = - log = !"#
Solução tampão
= ×
á %&
pH = - log pOH= - log (%&)
= !"#
Solução tampão –
Henderson-Hasselbalch
%&
pH= pKa + log Ministério da Educação
UNIVERSIDADE TECNOLÓGICA FEDERAL DO PARANÁ
Campus Dois Vizinhos
Volumetria de Neutralização, Oxido Redução, Complexação
Neutralização
Complexação
Òxido-Redução
Ponto de Equivalência
Ponto de Equivalência
E= E câtodo – E anâdo
x(n )titulado=x(m/PM)complexante
E ânodo = E◦ ânodo + (0,06/n)
log -./0123/43/52-4
x(n ácido)=x(n base)
x= índice estequiométrico
x= índice estequiométrico
E câtodo = E◦ câtodo + (0,06/n)
log -./0123/43/52-4
Ácido forte/base forte
pH=7,0
PM EDTA= 292 g/mol
Ácido fraco/base forte
pM=-log M
pH = 14 – pOH
α= Y/CT
OH-=encontra-se
aplicando a equação de
equilíbrio da base
CT= H4Y+H3Y+H2Y+HY+Y
Ponto de Equivalência
Para um único pH
()
k´MY= α k MY= (* +,
x(n redutor)=x(n oxidante)
x= índice estequiométrico
E= (E◦1+E◦2)/2 (relação 1:1)
E=( n1E1+n2E2)/ (n1+n2)
(observar o balanceamento)
se meio ácido, neutro ou
alcalino
Solubilidade, atividade, força iônica, coeficiente de atividade
Solubilidade
Força iônica (µ)
Kps= ()n()M
µ= ½ (Za2+ Zb2+ ...)
S= mg/L ou g/L
Kps observar a
estequiometria
Atividade
ax= . ϒA
Coeficiente de atividade
- 6-78 =
9,;<=> ? ?√A
?
<B,BC √ DA












