Universidade Federal de Ouro Preto
Núcleo de Pesquisas em Ciências Biológicas
Programa de Pós-Graduação em Ciências Biológicas
Bruna Trindade de Carvalho
Fermentação Consorciada Leveduras/Bactérias Láticas Aplicada à
Produção de Cachaça como Possibilidade de Melhoria do Padrão
de Qualidade
Ouro Preto
2011
Bruna Trindade de Carvalho
Fermentação Consorciada Leveduras/Bactérias Láticas Aplicada à
Produção de Cachaça como Possibilidade de Melhoria do Padrão
de Qualidade
Dissertação de Mestrado
ORIENTADOR: PROF. DR. ROGELIO LOPES BRANDÃO
CO-ORIENTADORA: PROF.ª DR.ª LEONEIDE ÉRICA MADURO BOUILLET
Dissertação apresentada ao programa de pósgraduação do Núcleo de Pesquisas em Ciências
Biológicas da Universidade Federal de Ouro Preto,
como parte integrante dos requisitos para a
obtenção do título de Mestre em Biotecnologia,
área de concentração Biotecnologia aplicada a
processos e ao tratamento de doenças.
Ouro Preto, Junho de 2011.
ii
1.
2. C331f
Carvalho, Bruna Trindade de
Fermentação consorciada leveduras/bactérias láticas aplicada à produção
de cachaça como possibilidade de melhoria do padrão de qualidade
[manuscrito] / Bruna Trindade de Carvalho. - 2011.
xiii, 78f.: il., color; graf.; tabs.
Orientador: Prof. Dr. Rogélio Lopes Brandão
Co-orientadora: Profª Drª Leoneide Érica Maduro Bouillet
Dissertação (Mestrado) - Universidade Federal de Ouro Preto.
Instituto de Ciências Exatas e Biológicas. Núcleo de Pesquisas em
Ciências Biológicas. Programa de Pós-Graduação em Biotecnologia.
Área de concentração: Biotecnologia Aplicada a Processos e
Catalogação: [email protected]
ao Tratamento de Doenças.
1. Bebidas fermentadas - Teses. 2. Compostos orgânicos voláteis - Teses.
3. Cromatografia de gás - Espectrometria de massa - GC-MS - Teses.
4.
Fermentação - Teses. I. Universidade Federal de Ouro Preto. II. Título.
Dedicatória
Dedico ao meu falecido pai, que me ensinou que o
conhecimento é o nosso maior patrimônio. À minha
querida mãe e queridos irmãos, que sempre me
apoiaram, incentivaram e se esforçaram para que
hoje eu estivesse aqui. Amo muito todos vocês.
iii
Agradecimentos
Ao meu orientador, Prof. Dr. Rogelio Brandão, pela oportunidade do mestrado, por todo o
aprendizado e principalmente pela confiança depositada em meu trabalho.
À minha co-orientadora, Prof.ª Dr.ª Leoneide Bouillet, mais que uma co-orientadora, uma
amiga, sempre com uma palavra carinhosa nos momentos difíceis, e conselhos preciosos.
Ao Prof. Dr. Ieso Castro, por toda a sua disponibilidade e auxílio.
À Zezé Trópia, por toda a sua paciência, alegria, ensinamentos e preocupação com todos
no laboratório.
Aos professores do Laboratório Caracterização Molecular/Espectrometria de Massas da
UFOP, Dr. Maurício Coutrim e Dr. Robson Afonso, colaboradores deste projeto, pelo
imenso auxílio, valorosas ideias, disponibilização do laboratório, confiança e pela
maravilhosa convivência. Aos demais membros do laboratório, especialmente os mestres
Júlio e Gustavo, as mestrandas Keila, Fernanda e Ananda, e a aluna de iniciação científica
Regiane, por todo o auxílio.
Às alunas de iniciação científica envolvidas neste trabalho, Mariana e Gabriella, por toda a
dedicação e comprometimento com o trabalho, e principalmente, pela amizade.
Aos amigos do LBCM, Anderson, Aninha, Érica, Érica Milena, Fernando, Filippe, Max,
Laura, Soraya, Simone, Priscila e Taís, pela maravilhosa convivência no laboratório e fora
dele!
Aos amigos de mestrado e laboratório, Cris, Pep, Rê e Carol, pelas animadas discussões
sobre papers, projetos e seminários, mas principalmente pelo companheirismo e momentos
maravilhosos de uma amizade verdadeira.
Aos colegas do mestrado, pela boa convivência, especialmente Fran, Val, David, Dani,
Rodrigo, Bruno, Iara. Com vocês o mestrado ficou bem mais divertido!
Aos amigos de Salinas, Magal, Andreia, Dani, Rose, Oscar e principalmente Thiago e
Edilene, pela amizade e experiências compartilhadas.
Aos professores do NUPEB, pelo ensino, base para o desenvolvimento acadêmico.
Cida e Josino, por toda a prestatividade.
À UFOP pelo excelente ensino na graduação e pós-graduação.
iv
RESUMO
Fermentação Consorciada Leveduras/Bactérias Láticas Aplicada à Produção de
Cachaça como Possibilidade de Melhoria do Padrão de Qualidade
Cachaça é a bebida destilada mais consumida no Brasil, e a terceira mais consumida no
mundo. O Brasil exporta este produto para 45 países, porém estas vendas não atingem 1%
da produção nacional. Para incrementar a exportação é necessário que se atinja um novo
patamar de qualidade. Tal qualidade pode ser alcançada pela utilização de leveduras
selecionadas, que permitem a obtenção de estabilidade físico-química e sensorial, além de
incremento do “flavour” devido à maior produção de compostos voláteis, especialmente
álcoois superiores e ésteres. Um importante éster, o lactato de etila, é descrito como tendo
caráter frutado e habilidade de mascarar o sabor vegetal residual da cachaça. Ele é formado
pela esterificação do etanol com ácido lático, produzido por bactérias láticas (LABs), que
por sua vez são consideradas contaminantes do processo. O objetivo deste trabalho é
investigar se é possível a utilização de bactérias láticas em fermentação mista, para a
produção de cachaça de alto padrão de qualidade, devido ao incremento nos teores do éster
lactato de etila. Este trabalho utiliza uma cepa de levedura Saccharomyces cerevisiae
selecionada, a LBCM606, em associação a cada uma das quatro cepas bacterianas descritas
entre os contaminantes mais comuns da fermentação da cachaça: Bacillus coagulans,
Bacillus stearothermophilus, Lactobacillus plantarum e Lactobacillus fermentum, além da
cepa isolada de Yakult® Lactobacillus casei Shirota, utilizada como controle industrial, e
duas cepas isoladas de dorna, bLBCM680-2 e bLBCM680-3. As fermentações mistas
foram comparadas à fermentação tradicional. Alíquotas da fermentação foram retiradas nos
tempos de 0, 2, 4, 6, 8, 24 e 48h e analisadas quanto ao pH e consumo de sacarose, e nos
tempos 0, 24 e 48h quanto à população de células. Tais análises não forneceram evidências
de que bactérias até a concentração de 10 6 UFC/ml possam prejudicar o processo produtivo
da cachaça devido ao consumo de açúcares e queda da viabilidade de leveduras provocada
por acidificação do meio. A dosagem de lactato de etila foi realizada por CG-MS nos
tempos de 8, 24 e 48h de fermentação, e revelam um desempenho superior das cepas
isoladas de dorna e, principalmente, do controle industrial, L. casei. Estas três cepas
testadas sob a condição de reciclo de células, mantém a viabilidade de células bacterianas
apenas ao longo dos três primeiros ciclos, sendo que no décimo ciclo, a contagem de
células viáveis é menor que 0,5% da contagem do primeiro ciclo. A cepa bLBCM680-2
v
por possuir uma produção de lactato de etila mais estável ao longo dos ciclos, é a mais
promissora para a utilização em dornas de produção de cachaça.
Palavras chave: Bebidas Fermentadas, Compostos Voláteis, Flavour, Lactato de Etila,
Fermentação Mista, GC-MS.
vi
ABSTRACT
Consortium Fermentation Yeast/Lactic Bacteria Applied to Cachaça Production as
Quality Improvement Possibility
Cachaça is the most consumed distilled beverage in Brazil and the third one in the world.
Brazil exports this product to 45 countries, but it is less than 1% of the national production.
To increase external selling, quality enhancement of the product is necessary. The quality
can be achieved using selected yeast, as starters, to obtain physical-chemistry and sensorial
stability, besides sensorial improvement by volatile compounds production, especially high
alcohols and esters. An important ester, ethyl lactate, seems to contribute with a fruity
flavor and ability to mask green flavor. It is formed from lactic acid, produced by lactic
acid bacteria (LAB), that are considered until now, contaminants of the fermentative
process involved in cachaça production. The goal of the present study is to investigate if it
is possible to use bacteria in a mixed fermentation process to produce high quality cachaça,
by increase of ethyl lactate levels. This study uses starter cultures of selected
Saccharomyces cerevisiae, LBCM606c, combined with common cachaça‟s contaminants:
Bacillus
coagulans,
Bacillus
stearothermophilus,
Lactobacillus
plantarum,
and
Lactobacillus fermentum, besides a strain isolated from Yakult®, the Lactobacillus casei
Shirota, used as industrial control, and two strains isolated from cachaça vats, bLBCM6802 and bLBCM680-3. The mixed fermentation was compared to the traditional
fermentation. Samples were analyzed at 0, 2, 4, 6, 8, 24, and 48 hours for pH and sucrose
consumption, and at 0, 24 and 48h for cell population. These analyses do not give
evidences that bacteria until 106 CFU/mL can damage the production process by nutritional
competition and medium acidification. The ethyl lactate analysis was performed by GCMS at 8, 24 and 48 hours of fermentation. This analysis demonstrates the superior
performance of the strains isolated from vats, and especially, the industrial control, L.
casei. These three strains tested with recycling cells, maintain the viability just over three
cycles. At the tenth cycle, the viable count is less than 0,5% of the first cycle count. The
strain bLBCM680-2 has the most stable production of ethyl lactate and seems to be the
most promising strain to be used in cachaça production.
Keywords: Fermented beverage, Brazilian spirit, volatile compounds, flavor, ethyl lactate,
mixed fermentation, GC-MS.
vii
LISTA DE FIGURAS
Figura 1 - Principais países de destino (volume) da cachaça e caninha brasileiras exportadas no
ano de 2010.. .................................................................................................................................3
Figura 2 - Participação dos estados brasileiros (em volume) nas exportações de cachaça e caninha
no ano de 2010. .............................................................................................................................4
Figura 3 - Esquema simplificado das vias do metabolismo homofermentativo e
heterofermentativo em bactérias láticas do gênero Lactobacillus. Fonte: Gomes, 2009. .............16
Figura 4 - Delineamento Experimental .........................................................................................20
Figura 5 - Esquema para a fermentação mista, em escala laboratorial. .........................................26
Figura 6 - Esquema para a fermentação mista com reciclo de células, em escala laboratorial. ......27
Figura 7 - Padronização do número de células de leveduras em suspensão (YPD2%) pela medida
da absorbância 600nm e pela contagem de células em Câmara de Neubauer. .............................32
Figura 8 - Avaliação dos parâmetros fermentativos na fermentação mista com 10 4 UFC/mL de
bactérias láticas. ..........................................................................................................................39
Figura 9 - Avaliação da interferência do tamanho do inóculo bacteriano com relação aos
parâmetros fermentativos. ..........................................................................................................42
Figura 10 - Avaliação dos parâmetros fermentativos com relação à presença das bactérias láticas
L. plantarum, L. casei, bLBCM680-2 e bLBCM680-3 inoculadas na concentração de 106 UFC/mL. .45
Figura 11 - Viabilidade das bactérias láticas inoculadas na concentração de 1e6 UFC/ml em cultivo
misto com S. cerevisiae por 48h. ..................................................................................................46
Figura 12 - Cromatogramas obtidos por GC-MS............................................................................48
Figura 13 - Avaliação da presença das bactérias selecionadas com relação aos parâmetros
fermentativos. .............................................................................................................................51
Figura 14 - Avaliação da viabilidade das bactérias selecionadas nos tempos 0, 24 e 48h da
fermentação mista. ......................................................................................................................52
Figura 15 - Dosagens de lactato de etila em amostras de mosto fermentado extraídas com acetato
de etila.........................................................................................................................................55
Figura 16 - Avaliação da interferência das bactérias láticas L. casei, bLBCM680-2 e bLBCM680-3
com relação aos parâmetros fermentativos ao longo de 10 ciclos fermentativos. ( ......................58
Figura 17 - Desempenho das bactérias láticas L. casei, bLBCM680-2 e bLBCM680-3 no reciclo
fermentativo com relação a (a) sobrevivência bacteriana e (b) teores de lactato de etila. As
medidas foram realizadas ao final de cada ciclo fermentativo (24h). ............................................60
Figura 18 - Curva de calibração de lactato de etila obtida.. ...........................................................71
Figura 19 - Linearidade e análise de regressão obtidos para o lactato de etila. .............................72
Figura 20 - Linearidade e análise de regressão obtidos para o ácido lático....................................77
Figura 21 - Pico do ácido lático obtido por HPLC (UV-Vis). ............................................................78
viii
LISTA DE TABELAS
Tabela 1 - Quantidade de cachaça e caninha exportadas pelo Brasil e pelo estado de Minas Gerais,
no período de 2000-2010 em volume (litros) e em valor (U$FOB). .................................................4
Tabela 2 - Micro-organismos utilizados no presente trabalho.......................................................21
Tabela 3 - Íons monitorados (m/z) para a análise de lactato de etila no modo SIM .......................29
Tabela 4 - Medida da concentração de células em suspensões bacterianas. .................................33
Tabela 5 - Porcentagem de recuperação de ácido lático e lactato de etila por extração com
solventes orgânicos......................................................................................................................35
Tabela 6 – Viabilidade de leveduras (%) ao longo da fermentação, frente a diferentes bactérias na
concentração de 104 UFC/mL, quando comparadas ao tempo 0h. ................................................38
Tabela 7 - Viabilidade de leveduras (%) ao longo da fermentação, frente a diferentes
concentrações de L. plantarum, quando comparadas ao tempo 0h. .............................................41
Tabela 8 - Viabilidade de L. plantarum (%) inoculado em diferentes concentrações, ao longo da
fermentação, quando comparado ao tempo 0h. ..........................................................................41
Tabela 9 - Viabilidade de leveduras (%) ao longo da fermentação, frente a diferentes bactérias na
concentração de 106 UFC/mL, quando comparadas ao tempo 0h. ................................................44
Tabela 10 - Viabilidade das diferentes bactérias (%) quando inoculadas na concentração de 106
UFC/mL ao longo da fermentação, quando comparadas ao tempo 0h. .........................................46
Tabela 11 - Viabilidade de leveduras (%) ao longo da fermentação, frente a diferentes bactérias na
concentração de105 e 106 UFC/mL, quando comparadas ao tempo 0h. ........................................50
Tabela 12 - Viabilidade das diferentes bactérias (%) quando inoculadas na concentração de10 5 e
106 UFC/mL ao longo da fermentação, quando comparadas ao tempo 0h. ...................................52
Tabela 13 - Viabilidade de leveduras (%) ao longo de 10 ciclos fermentativos, frente a diferentes
bactérias na concentração de 106 UFC/mL, quando comparadas à quantidade de células
adicionadas no ciclo 1. .................................................................................................................57
Tabela 14 - Viabilidade das diferentes bactérias (%) quando inoculadas na concentração de 10 6
UFC/mL ao longo de 10 ciclos fermentativos, quando comparadas à quantidade de células
adicionadas no ciclo1. ..................................................................................................................61
Tabela 15 – Porcentagem de produção de lactato de etila em relação às quantidades produzidas
no ciclo 1 pelas diferentes bactérias quando inoculadas na concentração de 10 6 UFC/mL . ..........62
Tabela 16 - Resultado da busca no banco de dados Saccharomyces Genome Database por lactate
dehydrogenase. ...........................................................................................................................70
Tabela 17 - Valores aceitáveis de desvio padrão relativo (DPR) em função da concentração do
analito. ........................................................................................................................................73
Tabela 18 - Dados de concentração de lactato de etila para a matriz isenta de padrão de lactato de
etila para avaliação da precisão do método de extração. .............................................................73
ix
Tabela 19 - Dados de concentração de lactato de etila para a matriz adicionada de 7,0 ppm de
padrão de lactato de etila para avaliação da precisão do método de extração. ............................74
Tabela 20 – Recuperação do analito em função da concentração .................................................75
Tabela 21 - Dados de concentração de lactato de etila de uma mesma amostra injetada 7 vezes. 75
x
LISTA DE ABREVIATURAS
ATP
Adenosina Trifosfato
D.O.600nm
Densidade Ótica medida a 600 nanômetros
FENACA
Federação Nacional das Associações de Produtores de Cachaça de
Alambique
GC
Gas Chromatography/Cromatografia Gasosa
GC-MS
Gas chromatography-mass spectrometry / cromatografia gasosa
hifenada à espectrometria de massas
HPLC
High Performance Liquid Chromatography / Cromatografia liquida
de alta eficiência
LAB
Lactic Acid Bacteria / Bactéria ácido-lática
MAPA
Ministério da Agricultura, Pecuária e Abastecimento.
MLF
Mallolactic Fermentation / Fermentação Malolática
PBDAC
Programa Brasileiro de Desenvolvimento da Aguardente, Caninha e
Cachaça.
SEBRAE
Serviço Brasileiro de Apoio às Micro e Pequenas Empresas
SIM
Selected íon monitoring
TFL
5,5´, 5´´-trifluoro-DL-leucina
v/v
Volume por volume
UFC
Unidade Formadora de Colônia
xi
Índice
RESUMO ........................................................................................................................................ v
ABSTRACT .................................................................................................................................... vii
LISTA DE FIGURAS ....................................................................................................................... viii
LISTA DE TABELAS ......................................................................................................................... ix
1.
INTRODUÇÃO .........................................................................................................................1
1.1 A cachaça .............................................................................................................................1
1.2 Legislação.............................................................................................................................1
1.3 O mercado da cachaça .........................................................................................................2
1.4 A cachaça de alambique .......................................................................................................5
1.5 Leveduras selecionadas ........................................................................................................6
1.6 Ésteres e sua importância para o “flavour” da bebida. ..........................................................8
1.7 Fermentação Malolática .......................................................................................................9
1.8 Bactérias como contaminantes da cachaça .........................................................................11
1.9 Metabolismo das bactérias láticas ......................................................................................14
1.10 Interações entre leveduras e bactérias .............................................................................16
2.
JUSTIFICATIVA ......................................................................................................................18
3.
OBJETIVOS ...........................................................................................................................19
3.1 Objetivo geral.....................................................................................................................19
3.2 Objetivos específicos ..........................................................................................................19
4.
MATERIAIS E MÉTODOS........................................................................................................20
4.2 Cepas de micro-organismos utilizadas ................................................................................21
4.3 Meios de cultura ...............................................................................................................22
4.3.1 Meio YPD2% ...............................................................................................................22
4.3.2 Meio mínimo (YNB Sac8%) ..........................................................................................22
4.3.3 Meio PCB (Plate Count Broth) ......................................................................................22
4.3.4 Meio MRS (de Man, Rogosa and Sharpe) .....................................................................22
4.4 Padronização das cepas de levedura e bactérias para uso na fermentação mista................22
4.4.1 S. cerevisiae LBCM606c................................................................................................22
4.4.2 Bactérias......................................................................................................................23
4.5 Adaptação das bactérias ao meio de cultivo misto..............................................................24
xii
4.6 Fermentação Mista de 48h .................................................................................................25
4.7 Fermentação Mista com reciclo de células..........................................................................26
4.8 Análises químicas e microbiológicas ...................................................................................27
4.8.1 Análise de Voláteis.......................................................................................................28
4.9 Análise estatística...............................................................................................................30
5.
RESULTADOS E DISCUSSÃO...................................................................................................32
5.1 Padronizações de micro-organismos ..................................................................................32
5.1.1 Padronização da suspensão de leveduras.....................................................................32
5.1.2 Padronização da suspensão de bactérias .....................................................................33
5.2 Avaliação do melhor solvente para extração de lactato de etila. .........................................34
5.3 Fermentações Mistas .........................................................................................................36
5.3.1 Fermentação mista utilizando-se 104 UFC/mL das bactérias Bacillus coagulans, Bacillus
stearothermophilus, Lactobacillus plantarum, Lactobacillus fermentum ...............................36
5.3.2 Fermentação mista utilizando-se Lactobacillus plantarum nas concentrações de 104, 105
e 106 UFC/mL .......................................................................................................................40
5.3.3 Fermentação mista utilizando-se 106 UFC/mL de bactérias. .........................................43
5.3.4 Padronização de uma metodologia cromatográfica (GC-MS) para análise de lactato de
etila e ácido lático. ...............................................................................................................47
5.3.5 Fermentações mistas de 48h com as cepas selecionadas nas concentrações de 10 5 e 106
UFC/mL para dosagem de lactato de etila e ácido lático. ......................................................49
5.3.6 Dosagem de lactato de etila e ácido lático. ..................................................................53
5.3.7 Fermentações mistas utilizando-se reciclos de células. ................................................56
6.
CONSIDERAÇÕES ADICIONAIS...............................................................................................63
7.
CONCLUSÕES .......................................................................................................................64
8.
PERSPECTIVAS ......................................................................................................................65
REFERÊNCIAS BIBLIOGRÁFICAS.....................................................................................................66
ANEXO 1 – Resultado da busca no banco de dados SGD por lactate dehydrogenase.....................70
ANEXO 2 – Validação do método de dosagem de lactato de etila .................................................71
ANEXO 3 – Dosagens de ácido lático ............................................................................................77
xiii
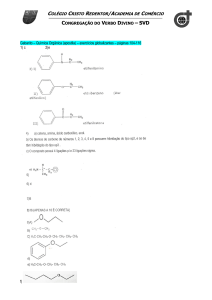
Introdução
1. INTRODUÇÃO
1.1 A cachaça
Cachaça é o destilado obtido da fermentação do caldo de cana pela Saccharomyces
cerevisiae. É caracterizada pela presença de componentes minoritários (congêneres), que
apesar de representarem menos de 1% do total, são responsáveis por suas características
organolépticas. Tais compostos são alcoóis superiores, etil ésteres, aldeídos, cetonas e
ácidos orgânicos, sendo os alcoóis superiores os de maior abundância (BOSCOLO et al.,
2000; NONATO et al., 2001; OLIVEIRA, 2001; NASCIMENTO, 2007).
Segundo a legislação brasileira, cachaça é a denominação típica e exclusiva da
Aguardente de Cana produzida no Brasil, com graduação alcoólica de 38 % vol. (trinta e
oito por cento em volume) a 48% vol. (quarenta e oito por cento em volume) a 20ºC (vinte
graus Celsius), obtida pela destilação do mosto fermentado do caldo de cana-de-açúcar,
com características sensoriais peculiares, podendo ser adicionada de açúcares até 6g/L (seis
gramas por litro), expressos em sacarose (BRASIL, 2005).
Já a aguardente de cana é a bebida com graduação alcoólica de 38% vol. (trinta e
oito por cento em volume) a 54% vol. (cinquenta e quatro por cento em volume) a 20ºC
(vinte graus Celsius), obtida do destilado alcoólico simples de cana-de-açúcar ou pela
destilação do mosto fermentado do caldo de cana-de-açúcar, podendo ser adicionada de
açúcares até 6g/L (seis gramas por litro), expressos em sacarose (BRASIL, 2005).
1.2 Legislação
Os decretos 4062/01 e 4072/02 estabelecem a denominação “cachaça” como oficial
e exclusiva para a aguardente de cana produzida no Brasil, protegendo a propriedade do
nome “cachaça” e contribuindo para a sua divulgação no mercado internacional.
(SEBRAE/NA, 2008).
Em junho de 2005 foi publicada pelo MAPA (Ministério da Agricultura, Pecuária e
Abastecimento) a Instrução Normativa n°13 que tem como objetivo fixar a identidade e as
características de qualidade que a Cachaça e a Aguardente de Cana devem obedecer. Esta
1
Introdução
Instrução Normativa define a composição química e requisitos de qualidade, fixando os
ingredientes básicos e opcionais da cachaça, além do coeficiente de congêneres (limites
permitidos para os componentes voláteis, “não álcool”) que são a soma de acidez volátil
(expressa em ácido acético); aldeídos (expressos em acetaldeído); ésteres totais (expressos
em acetato de etila); álcoois superiores (expressos pela soma do álcool n-propílico, álcool
isobutílico e álcoois isoamílicos); furfural + hidroximetilfurfural.
Em junho de 2009 passa a vigorar o Decreto no 6.871 regulamentando a Lei nº
8.918, de 14 de julho de 1994, que dispõe sobre a padronização, a classificação, o registro,
a inspeção, a produção e a fiscalização de bebidas.
1.3 O mercado da cachaça
A cachaça é a segunda bebida alcoólica mais consumida no Brasil, perdendo apenas
para a cerveja; e é a bebida destilada de maior consumo. Seu consumo anual é quase 5
vezes maior do que o do whisky (438 milhões de litros) e da vodca (270 milhões de litros).
No cenário mundial, a cachaça é a terceira bebida destilada mais consumida, ficando atrás
apenas da vodca e do soju (GOMES, 2004).
Estima-se que no Brasil existam mais de 5mil marcas de cachaça, gerando mais de
400 mil empregos diretos e um faturamento anual de mais de U$600 milhões. Porém,
apenas cerca de 1% da produção total nacional é exportada (GOMES, 2004; SEBRAE/NA,
2008). A Figura 1 mostra os principais países de destino da cachaça e caninha exportadas
no ano de 2010.
Entre 2004 e 2005 o volume exportado cresceu cerca de 20%, e entre 2005 e 2006 o
crescimento ficou na casa de 10%. Já o valor médio por litro obtido no mercado externo,
atingiu US$1,27, com um crescimento de mais de 53% entre 2001 e 2006 (VERDI, 2006;
SEBRAE/NA, 2008). Segundo VERDI, (2006), tal crescimento se deve à criação do
PBDAC (Programa Brasileiro de Desenvolvimento da Aguardente, Caninha e Cachaça) e
das ações da FENACA (Federação Nacional das Associações de Produtores de Cachaça de
Alambique), e SEBRAE (Serviço Brasileiro de Apoio às Micro e Pequenas Empresas).
Além da criação da Câmara Setorial da Cachaça pelo MAPA, em setembro de 2004,
reunindo a cadeia produtiva do setor.
2
Introdução
Figura 1 - Principais países de destino (volume) da cachaça e caninha brasileiras exportadas no ano de
2010. O Brasil exportou um total de 10.441.107 litros de cachaça/caninha no ano de 2010, sendo Alemanha
e Paraguai os principais países consumidores, representando 27% e 12% do destino, respectivamente.
Em Minas Gerais, os estabelecimentos produtores de cachaça registrados são
apenas 15% do total de estabelecimentos produtores. 43% das cachaças comercializadas
vêm de estabelecimentos registrados e 57% de clandestinos. São aproximadamente 8.500
estabelecimentos produtores no estado, gerando um total de 182 milhões de litros de
cachaça. No país, são cerca de 25.000 estabelecimentos, sendo que aproximadamente 90%
deles operam na informalidade. A produção total de cachaça no Brasil é de 500 milhões de
litros, e destes, cerca de 36% provém dos estabelecimentos clandestinos. Quando se
consideram os dois processos de produção, cachaça de alambique e cachaça de coluna
(descritos na próxima seção), a produção nacional ultrapassa 1,5 bilhão de litros
(SEBRAE/NA, 2005; 2008).
De acordo com o SEBRAE, em Minas Gerais, a produção de aguardentes (cachaça
e caninha, ver definição no item 1.4) é de cerca de 230 milhões de litros/safra, o que
representa 18% da produção nacional. Quanto ao mercado externo, pode-se observar um
crescente aumento na participação de Minas, sendo que em 2010, 5% do total de cachaça e
caninha exportadas eram provenientes deste estado (Tabela 1 e Figura 2). Como o preço
médio de exportação de cachaça de Minas Gerais é maior que o valor médio brasileiro, a
3
Introdução
participação percentual mineira na arrecadação é maior do que aquela obtida em volume
exportado (Tabela 1).
Tabela 1 - Quantidade de cachaça e caninha exportadas pelo Brasil e pelo estado de Minas Gerais, no
período de 2000-2010 em volume (litros) e em valor (U$FOB).
Valor
Volume (L)
Preço Médio /L
(U$FOB*)
Ano
MG
Brasil
% MG/
Brasil
MG
Brasil
% MG/
Brasil
MG
Brasil
2010
503.420
10.441.107
4,82
1.621.519
15.954.447
10,16
US$ 3
US$ 1
2009
376.386
10.831.805
3,47
1.197.108
15.585.578
7,68
US$ 3
US$ 1
2008
193.644
11.092.088
1,75
806.511
16.418.978
4,91
US$ 4
US$ 1
2007 332.074
9.052.453
3,67
1.065.897
13.838.276
7,70
US$ 3
US$ 1
2006
238.981
11.322.568
2,11
860.289
14.415.033
5,97
US$ 3
US$ 1
2005
202.891
10.343.146
1,96
625.288
12.528.158
4,99
US$ 3
US$ 1
2004
112.308
8.607.150
1,30
398.144
11.087.500
3,59
US$ 3
US$ 1
2003
77.649
8.663.912
0,90
320.251
9.016.444
3,55
US$ 4
US$ 1
2002
262.847
14.535.046
1,81
314.266
8.733.811
3,60
US$ 1
US$ 1
2001
34.658
10.150.312
0,34
83.305
8.452.635
0,99
US$ 2
US$ 1
2000
73.809
13.429.284
0,55
160.060
8.146.524
1,96
US$ 2
US$ 1
* FOB: Free On Board
Fonte: Ministério de Desenvolvimento, Indústria e Comércio – MDIC / Aliceweb NCM 2208.40.00.
Figura 2 - Participação dos estados brasileiros (em volume) nas exportações de cachaça e caninha no ano
de 2010.
Fonte: Ministério de Desenvolvimento, Indústria e Comércio – MDIC / Aliceweb NCM 2208.40.00.
4
Introdução
1.4 A cachaça de alambique
A cachaça de alambique é a cachaça destilada em alambique de cobre, sem a adição
de açúcar, corante ou outros ingredientes (GOMES, 2004). O destilado é separado em três
frações, “cabeça”, “coração” e “cauda”, sendo que os pontos de corte entre as frações
podem variar de acordo com a geometria do alambique e o grau alcoólico inicial do mosto
fermentado. Já na caninha industrial ou cachaça de coluna, o mosto fermentado é destilado
em coluna de destilação contínua, e hidratado para obtenção do teor alcoólico estabelecido
por lei (SEBRAE, 2001).
Em geral, os alambiques utilizam a fermentação espontânea, onde o “pé-de-cuba” é
formado pelos micro-organismos naturalmente presentes nos substratos, assim como
aqueles presentes no ambiente e nas superfícies dos utensílios utilizados no seu preparo.
Neste caso, o “pé-de-cuba” consiste em uma mistura de caldo de cana não diluído, farelos
de milho ou arroz, biscoitos, adicionados de caldo de laranja ou limão para diminuição do
pH (SCHWAN et al., 2001; SOUSA, 2005; VICENTE, 2007).
Este processo é conduzido predominantemente por leveduras, notadamente
Saccharomyces cerevisiae. O “pé-de-cuba” quando sedimentado corresponde a cerca de
20% do volume útil da dorna de fermentação, e é em média, composto por 3,6 x 109
UFC/mL(unidade formadora de colônias por mililitro) de leveduras e de 3,6 x 10 4 UFC/mL
de bactérias (SCHWAN et al., 2001).
Segundo VICENTE (2007), uma das maneiras de se preparar o “pé-de-cuba”
consiste em formar uma pasta com os ingredientes e deixá-la em repouso por 12 à 24h;
adicionar o caldo de cana diluído (1:1) em quantidade suficiente para se cobrir a pasta,
deixar em repouso por mais 24h, e por último, repetir este procedimento até que ocupe o
volume correspondente a 20% do volume de trabalho na dorna de fermentação. Atingindose tal volume, pode-se então dar início aos ciclos de fermentação do mosto que podem
durar até 24h. Após a fermentação do mosto e decantação do fermento, o sobrenadante, ou
vinho, é então encaminhado para a destilação e o fermento reaproveitado, caracterizando o
processo semicontínuo.
A fermentação espontânea, por ser conduzida pelos micro-organismos presentes
nos substratos e ambiente, tem sua composição sujeita a variação constante. Além disso,
por se tratar de um processo semicontínuo e aberto, novos micro-organismos são
5
Introdução
constantemente inseridos. Sabendo-se que os compostos minoritários produzidos pelas
leveduras durante a fermentação são responsáveis pelas características organolépticas das
bebidas, pode-se inferir que, a composição química e consequentemente suas
características sensoriais podem variar ao longo da produção, devido à variação dos
organismos presentes na dorna. Logo, não é possível uma padronização do produto ao
longo de diferentes safras e nem mesmo dentro de uma mesma safra, uma vez que cada
ciclo fermentativo possui a sua própria população de células (PATARO, 1998 apud
VICENTE, 2007).
1.5 Leveduras selecionadas
A matéria-prima, a fermentação, a destilação e o envelhecimento são fatores que
interferem na qualidade das bebidas alcoólicas destiladas, porém as leveduras e as
condições de fermentação são os fatores que mais influenciam o sabor das bebidas
(OLIVEIRA, 2001).
Uma alternativa para a padronização das características sensoriais da cachaça é o
uso de cepas de leveduras selecionadas. O Laboratório de Biologia Celular e Molecular –
LBCM – da Universidade Federal de Ouro Preto, coordenado pelo prof. Rogelio Lopes
Brandão, desenvolveu uma metodologia para seleção de leveduras bem adaptadas ao
processo de produção de cachaça e potencialmente produtoras de maiores níveis de
compostos voláteis, importantes para o “bouquet” da bebida.
Esta metodologia gerou uma patente de invenção que encontra-se depositada no
Instituto Nacional de Propriedade Industrial – INPI (PI0304436-0 A2) e combina a seleção
de cepas capazes de resistir ao estresse provocado por altas temperaturas, elevados teores
de etanol e resistência a variações osmóticas, pois são as condições de produção da
cachaça; com capacidade de floculante, que facilita a decantação do fermento após o ciclo
fermentativo, consequentemente, a sua separação do mosto fermentado; incapacidade de
produção de ácido sulfídrico, considerado um “off flavour”, ou seja, uma substância que
confere características sensoriais desagradáveis à bebida; e alta atividade invertásica, o que
propicia ciclos fermentativos mais curtos, reduzindo as chances de contaminação. Além
disto, são utilizados testes de resistência às drogas cerulenina e 5,5´,5´´-trifluoro-DLleucina (TFL), que selecionam cepas com alto potencial de produção de álcoois superiores
6
Introdução
e seus ésteres (VICENTE et al., 2003; VICENTE et al., 2006). Segundo os autores, a
metodologia pode ser validada, pois nas cachaças produzidas em escala piloto com tais
cepas, foram realmente encontrados teores mais elevados de alguns dos compostos
flavorizantes analisados.
Acredita-se que o uso de leveduras localmente selecionadas seja mais eficaz, pois
tais leveduras já estão melhores adaptadas às condições ambientais da região. As leveduras
devem apresentar características desejáveis como: serem viáveis para a produção
industrial, além de possuírem capacidade de baixa produção de acidez volátil e alta
tolerância a etanol, capacidade de fermentarem totalmente os açúcares do meio, boa
velocidade de fermentação para minimizar riscos de contaminação, baixa produção de
sulfeto de hidrogênio, produzir a melhor concentração e balanço de compostos secundários
desejáveis (REGODON et al., 1997; OLIVEIRA, 2001).
O uso de cepas localmente selecionadas também já foi utilizado para o vinho. Em
muitos países a maior parte da produção de vinho, utiliza leveduras selecionadas, e em
alguns casos bactérias láticas selecionadas, obtendo-se assim um produto de melhor
qualidade (FLEET et al., 1984).
VILANOVA & SIEIRO (2006) concluíram que o uso de cepas de leveduras
selecionadas para a produção do vinho contribui para a sua qualidade, já que o aroma é um
dos mais importantes determinantes da qualidade.
RUSSEL et al., 1987 (citados por OLIVEIRA, 2001), afirmam também que as
leveduras devem apresentar estabilidade genética e ao fim da fermentação devem ser
facilmente removidas do meio de fermentação por floculação ou centrifugação.
Em um modelo de processo fermentativo com S. cerevisiae, partindo-se de um
inóculo com 22 a 24% de açúcar, 95% deste açúcar é convertido a etanol e dióxido de
carbono, 1% é convertido em material celular e o restante é convertido em outros produtos
como glicerol, álcoois superiores e ésteres (LAMBRECHTS & PRETORIUS, 2000).
BOSCOLO et al., (2000) investigaram o conteúdo de álcoois superiores e ésteres de
diversas regiões produtoras de cachaça e demonstraram que os seus níveis em cachaça
foram menores do que em rum, uísque e vinho. Acetato de etila foi o principal éster
encontrado nas bebidas alcoólicas e sua concentração na cachaça foi aproximadamente
metade daquela encontrada no rum e no uísque. Os níveis encontrados de alcoóis
superiores estavam próximos aos limites estabelecidos por lei, enquanto os de ésteres
7
Introdução
foram 10 vezes menores que o limite permitido pela legislação brasileira. Este fato
corrobora com a ideia do projeto, permitindo uma ampla margem para incremento do nível
de ésteres e consequentemente, do flavour da bebida.
O fato da quantidade de ésteres na cachaça ser baixa em relação a outras bebidas
pode influenciar no aroma e na qualidade, uma vez que o teor destes compostos está ligado
a essas características (NONATO et al., 2001; NÓBREGA, 2003).
Segundo NÓBREGA (2003), o limiar de odor ou limiar de detecção de um
composto pode ser definido como a concentração mínima para a qual um composto pode
ser detectado pelo sentido do olfato. Ainda segundo este autor, o componente volátil
majoritário das bebidas alcoólicas é o álcool etílico, porém, devido ao seu alto limiar de
odor e característica de aroma pouco marcante, ele é provavelmente um dos compostos de
menor destaque no “bouquet” da bebida. Já os ésteres, alcoóis superiores, aldeídos e
outros, possuem limiar de odor relativamente baixo, e aromas mais marcantes.
1.6 Ésteres e sua importância para o “flavour” da bebida.
Os ésteres, juntamente com os alcoóis superiores, são os maiores grupos de
compostos voláteis das bebidas alcoólicas (NÓBREGA, 2003). Os ésteres são produzidos
durante a fermentação em decorrência do metabolismo secundário dos açúcares
(LAMBRECHTS & PRETORIUS, 2000; NÓBREGA, 2003).
Os ésteres mais abundantes tendem a ser aqueles derivados dos ácidos e dos alcoóis
mais abundantes (NÓBREGA, 2003). Segundo NASCIMENTO (2007), os ésteres etílicos
derivados dos ácidos graxos são os compostos presentes em maior concentração seguidos
pelos acetatos, e são descritos como os responsáveis pelo aroma frutado do vinho. No
entanto, acetato de etila não contribui para o sabor em níveis abaixo de 75mg/L e quando
presente em teores acima de 200mg/L promove um efeito desagradável.
Os ésteres etílicos de ácidos graxos e ésteres de acetato são considerados os mais
importantes em bebidas por possuírem aroma agradável, limiares de percepção
relativamente baixos e concentrações relativamente elevadas (NÓBREGA, 2003).
Entretanto, segundo VAN ROOYEN et al., 1978 (citados por
(LAMBRECHTS &
PRETORIUS, 2000) um aroma particular raramente pode ser associado a um éster
especifico.
8
Introdução
NASCIMENTO (2007), estudando amostras de cachaça de diferentes produtores de
São Paulo, amostras de rum e de uísque, verificou que o acetato de etila foi o principal
éster presente nas bebidas destiladas seguido do lactato de etila. Porém a presença deste
último está relacionada à contaminação do mosto por bactérias.
Características sensoriais diferenciadas são alcançadas em outras bebidas,
particularmente o vinho, em função da existência de uma fermentação secundária efetuada
por bactérias lácticas, denominada fermentação malolática. A principal reação envolvida é
a descarboxilação do ácido málico a ácido lático com liberação de gás carbônico através da
enzima malolática, contribuindo para o “flavour” da bebida. As bactérias responsáveis por
este processo são pertencentes aos gêneros Lactobacillus, Leuconostoc, Oenococcus e
Pediococcus (LONVAUD-FUNEL, 1995; LONVAUD-FUNEL, 1999; FLEET, 2003).
Destiladores de uísque também utilizam a fermentação lática buscando uma
melhoria das características sensoriais da bebida, devido à formação de ácido lático, ácido
acético e outros metabólitos que podem contribuir para o flavour (SOUSA, 2005).
1.7 Fermentação Malolática
A fermentação malolática (MLF) é uma fermentação secundária que ocorre na
fabricação do vinho, em geral ao final da fermentação alcoólica, podendo em alguns casos
ocorrer antes. A fermentação alcoólica em geral precede a MLF já que as leveduras são
melhores adaptadas ao mosto, que possui alta concentração de açucares (>210g/L) e baixo
pH (3,0 a 3,3). A MLF não é realmente um processo fermentativo, mas sim uma reação de
descarboxilação, pois neste processo o ácido málico, um ácido dicarboxílico, é convertido
a dióxido de carbono e ácido lático, um ácido monocarboxílico. É realizada por bactérias
ácido láticas (LABs), preferencialmente Oenococcus oeni (LONVAUD-FUNEL, 1999;
NIELSEN & RICHELIEU, 1999; LIU, 2002; RUIZ et al., 2010).
Oenococcus oeni é descrito como a bactéria mais tolerante às condições da
produção do vinho, isto é, baixo pH e alta concentração de etanol, por isso, a preferência
em sua utilização. Cepas de Lactobacillus plantarum também são capazes de sobreviver e
se proliferar por possuírem mecanismos de resistência a estas condições de produção do
vinho (POZO-BAYON et al., 2005).
9
Introdução
A metabolização do ácido málico a ácido lático é o evento mais importante da
MLF, e resulta em diminuição da acidez titulável, pequeno aumento do pH, e mudanças no
sabor da bebida devido à troca do forte sabor vegetal do ácido málico pelo paladar mais
suave do ácido lático. Além disso, outras mudanças ocorrem como aumento da
complexidade de aromas do vinho e aumento da estabilidade microbiana, devido à
remoção de nutrientes residuais e produção de bacteriocinas (LONVAUD-FUNEL, 1999;
NIELSEN&RICHELIEU, 1999; LIU, 2002; FLEET, 2003; POZO-BAYON et al., 2005;
RUIZ et al., 2010).
O aroma do vinho se deve a variedade da uva, a fermentação pela levedura, a MLF
e ao envelhecimento, que por reações químicas ou enzimáticas produz compostos
importantes para o aroma (MAICAS et al., 1999; LAMBRECHTS & PRETORIUS, 2000).
Segundo LIU (2002), a complexidade e diversidade da atividade metabólica das
bactérias láticas sugerem que a fermentação malolática pode afetar a qualidade do vinho
tanto positiva quanto negativamente. DAVIS et al., 1985 (citados por MAICAS et al.,
1999) estudaram o uso de diferentes cepas de bactérias láticas na produção de vinho e
encontraram diferenças no efeito sensorial causado por elas, sendo que algumas
produziram compostos voláteis que contribuíram para o aroma do vinho, enquanto outras
não contribuíram para o “flavour” da bebida.
Em trabalho realizado por NIELSEN & RICHELIEU (1999) constatou-se que as
cepas usadas de Oenococcus oeni degradaram quase todo o ácido málico presente no
mosto, enquanto quantidades residuais consideráveis foram encontradas quando em
presença de Lactobacillus.
A utilização de cepas comerciais de LABs permite um maior controle sobre a
fermentação malolática (MAICAS et al., 1999; NIELSEN & RICHELIEU, 1999).
HENICK-KLING, 1985 (citado por MAICAS et al., 1999) analisando por cromatografia
gasosa vinhos produzidos com e sem MLF, encontra que vinhos produzidos com cepas
selecionadas de bactérias láticas possuem “flavour” melhores do que aqueles produzidos
por fermentação espontânea.
Porém, poucas cepas comerciais de bactérias láticas obtiveram sucesso ao serem
utilizadas como culturas iniciadoras no processo de MLF (POZO-BAYON et al., 2005).
Segundo VAILIANT et al., (1995) a atividade malolática depende de fatores como pH,
10
Introdução
etanol, teor de SO, e temperatura, sendo que outros fatores como aminoácidos, açucares,
ácidos orgânicos também interferem nesta atividade.
Bactérias láticas são utilizadas com sucesso para a produção de vinhos de melhor
qualidade sensorial, porém, no que se refere à produção de cachaça, as bactérias são ainda
consideradas contaminantes do processo produtivo.
1.8 Bactérias como contaminantes da cachaça
A contaminação das matérias-primas aliadas à deficiência do tratamento de
descontaminação do caldo leva grande número de bactérias para a fermentação. A
contaminação do mosto por bactérias pode ocorrer devido ao local de produção da bebida
ou devido às matérias-primas, já que tanto o caldo de cana quanto o mosto são ótimos
substratos para o crescimento de micro-organismos devido aos teores de nutrientes
orgânicos e inorgânicos, alta atividade de água, pH além da temperatura (OLIVEIRAFREGUGLIA & HORII, 1998; CHERUBIN, 2003; NASCIMENTO, 2007).
Em experimento realizado por GALLO, 1992 (citado por NOBRE, 2005; SOUSA,
2005) verificou-se que na microbiota bacteriana isolada de mosto e dornas de fermentação
alcoólica, houve predomínio de bactérias Gram-positivas (98,52%), bastonete (87,76%) e
não esporuladas (73,95%). O gênero Lactobacillus foi o contaminante mais frequente
(59,75%), seguido de Bacillus (26,58%). As espécies isoladas com maior frequência
foram: Bacillus coagulans (15,09%), Lactobacillus fermentum (15,04%), Lactobacillus
helveticus (14,08%), Bacillus stearothermophilus (6,91%) e Lactobacillus plantarum
(5,69%).
Os micro-organismos do ambiente que se aderem à cana-de-açúcar constituem
carga microbiana contaminante do processo, podendo atingir níveis que são prejudiciais à
produção de álcool (NOBRE, 2005).
A redução da produção de etanol devido à contaminação bacteriana pode ocorrer
tanto por competição pelo consumo de açúcares, quanto por diminuição da viabilidade das
leveduras, devido à produção de toxinas e/ou acidificação do meio. O consumo de sacarose
pelas bactérias também ocasiona formação de ácidos orgânicos, especialmente acido lático
e acido acético, que causam a acidificação. (LUDWIG et al., 2001; NOBRE, 2005;
SOUSA, 2005; CARVALHO-NETTO et al., 2008).
11
Introdução
Além disso, a contaminação também pode causar a floculação do fermento, que
reduziria a produtividade da fermentação, devido ao menor contato entre células e mosto
(LUDWIG et al., 2001; NOBRE, 2005; SOUSA, 2005). GALLO, 1991 (citado por
GOMES, 2009) afirma que bactérias como Lactobacillus e Bacillus podem causar a
floculação de leveduras devido à composição gelatinosa de sua capa proteica, constituída
majoritariamente de floculinas, que possibilita a fixação mecânica das células de leveduras.
(GOMES, 2009) afirma ainda que a floculação provoca aumento no tempo de fermentação
tanto por causa da decantação das células quanto pela redução da superfície de contato
entre as células de leveduras e o mosto. Apesar da floculação ser desfavorável no processo
fermentativo, alguns estudos mostram que a floculação pode ser desejável por facilitar a
decantação do fermento após o ciclo fermentativo, consequentemente, a sua separação do
mosto fermentado. (VICENTE et al., 2003; VICENTE et al., 2006).
A literatura é ainda muito controversa no que diz respeito a teores de contaminação
bacteriana capazes de prejudicar o processo produtivo de cachaça/etanol. GOMES, (2009)
cita que segundo ALCARDE et al., (2003), para as indústrias de etanol contaminações
bacterianas de até 105 UFC/mL são aceitáveis, não sendo economicamente viável diminuir
este nível. O autor cita ainda que segundo AMORIM (1981) contaminações acima de
1.107 UFC/mL causam queda significativa no rendimento alcoólico na produção de etanol.
ALTERTHUM et al., 1984 (citados por OLIVA NETO, 1995) relataram quedas de
14 a 90% no rendimento alcoólico quando a concentração de bactérias atingiu 10 8 a 109
células/mL. Corroborando com este resultado, MAKANJOULA et al., 1992 (citados por
SOUSA, 2005) constataram redução de 17% no rendimento de etanol em cultivo de 30h
com bactérias em concentrações acima de 4,5.10 8 UFC/mL.
OLIVEIRA-FREGUGLIA & HORII, (1998) verificou a redução de 96% na
viabilidade de leveduras em 12 horas de cultivo misto com bactérias ativas. Já THOMAS
et al., (2001), encontram que bactérias e leveduras quando inoculadas ao mesmo tempo e
na concentração de 1.107 células/mL, acarretam a redução da população bacteriana em
94%, enquanto o crescimento de leveduras não sofre alterações. Quando as bactérias foram
inoculadas 24h antes das bactérias, houve rápida diminuição da viabilidade das leveduras
após a exaustão dos açucares fermentáveis, porém ainda assim, leveduras foram capazes de
reduzir a população de bactérias a uma concentração cujo efeito sobre a taxa de
fermentação é insignificante. Consequentemente, a produção de ácido lático e ácido
acético foi baixa (THOMAS et al., 2001).
12
Introdução
OLIVA-NETO & YOKOYA, (1994) descrevem uma influência negativa de L.
fermentum na fermentação alcoólica de leveduras do fermento Fleishmann pelo processo
de batelada alimentada com reciclo de células. A eficiência alcoólica foi notadamente
inibida a partir do 15º ciclo, onde as bactérias alcançaram níveis da ordem de 10 9
células/mL e a acidez maior que 6g/l expressos em ácido lático. OLIVA NETO, (1995) cita
que o crescimento da população bacteriana parece não ser dependente do tamanho da
população, mas sim das condições nutricionais do meio. Outra observação feita pelo autor
é que ciclos longos (20h) favorecem o crescimento de bactérias, o que não ocorre em ciclos
de 12 horas de fermentação, onde é menor a competição das bactérias.
CHIN & INGLEDEW, 1984 (citados por CHERUBIN, 2003), ao contrário de
(OLIVA-NETO & YOKOYA, 1994; OLIVA NETO, 1995), encontraram que L.
fermentum quando inoculado na concentração de 1.10 8 UFC/mL não afetou a produção de
etanol em fermentação de mosto de trigo, não encontrando correlação entre a
contaminação bacteriana e a viabilidade de leveduras/ rendimento fermentativo. Porém,
neste experimento o reciclo de células não foi utilizado.
SOUSA, (2005), conclui que a cepa de Lactobacillus fermentum utilizada em seu
trabalho quando inoculada na concentração de 10 7 UFC/mL, teve seu crescimento
reprimido após 12 horas de co-incubaçao com Saccharomyces cerevisiae inoculada na
concentração de 109 UFC/mL. Além disso, a bactéria não contribuiu para redução do pH e
nem influenciou o crescimento da S. cerevisiae.
SCHWAN et al., (2001) afirmam que contaminações bacterianas são um problema
em potencial especialmente em dornas antigas de madeira, onde a relação levedura:
bactéria pode ser de 10:1 ou ainda menor. Em um estudo realizado em 15 destilarias do Sul
de Minas, os autores encontraram que a população microbiológica se manteve estável por
até 4 meses, apesar do influxo de leveduras da natureza, sugerindo uma pressão fisiológica
e ecológica para esta manutenção. A população encontrada foi de: 4.10 8 UFC/mL de
leveduras, 4.105 UFC/mL de bactérias láticas, e 5.104 UFC/mL de bacilos. Os autores
ainda afirmam que apesar das bactérias láticas serem as bactérias mais comuns, elas não se
propagam durante a fermentação.
A correlação entre contaminação bacteriana e perda alcoólica ainda precisa ser
determinada, apesar de ser obvio que cada molécula de açúcar desviada para a produção de
ácido lático resulta em perda de duas moléculas de etanol que poderiam ser produzidas
pelas leveduras. Porém, tal análise é complicada pelo fato da bactéria heterofermentativa
13
Introdução
produzir ácido lático, CO2 , etanol, além de quantidades menores de glicerol e ácido acético
(NARENDRANATH et al., 1997).
Segundo NASCIMENTO, (2007), durante a fermentação lática, as bactérias láticas
utilizam substratos que não são fermentados pelas leveduras, como dextranas residuais e
pentoses, sendo que tal fermentação não afeta o rendimento do destilado.
1.9 Metabolismo das bactérias láticas
Muitos são os micro-organismos contaminantes presentes na cana-de-açúcar, porém
poucos são os gêneros capazes de contaminar a fermentação alcoólica, isto porque os
efeitos de pH, temperatura, condições atmosféricas e produtos inibidores presentes no
substrato, influem diretamente na seleção de micro-organismos que melhor se adaptarão.
Apenas os micro-organismos resistentes ao etanol e baixo pH são capazes de contaminar o
processo. (OLIVA NETO, 1995).
Bactérias láticas são os contaminantes mais comuns e podem ser definidas como:
micro-organismos gram-positivos, não esporulantes, aeróbios a anaeróbios facultativos,
formato de bacilos e cocos, são oxidase, catalase e benzidina negativas, não possuem
citocromos, não reduzem nitrato a nitrito, exigentes quanto a fatores nutricionais, tolerantes
ao ácido, estritamente fermentativos, incapazes de utilizar lactato e cujo produto
majoritário da fermentação de carboidratos é o lactato (KANDLER, 1983; GOMES, 2009;
SANADA, 2009). Os principais gêneros incluem Aerococcus, Carnobacterium,
Enterococcus, Lactococcus, Lactobacillus, Leuconostoc, Oenococcus, Pediococcus,
Streptococcus, Tetragenococcus, Weissella e Vagococcus (SANADA, 2009).
Segundo OLIVA NETO, (1995), o gênero Leuconostoc, apesar de ser contaminante
comum do caldo de cana, raramente causa grandes contaminações no mosto, isto porque
possui resistência ao etanol relativamente baixa. O autor cita ainda que em experimento
realizado por KAJI (1989) seu crescimento foi reduzido em 50% quando 3% de etanol foi
utilizado e interrompido em concentrações maiores que 6% de etanol.
As bactérias láticas não possuem o ciclo de Krebs e a cadeia respiratória clássica, o
que as limita à ambientes de ausência ou baixa concentração de oxigênio. São acidófilas,
limitando-se a ambientes de pH relativamente baixos, crescendo numa faixa ótima de pH
5,5 a 6,2, mas também a valores menores do que 5,0. Possuem requerimentos nutricionais
14
Introdução
complexos, dentre eles aminoácidos, peptídeos, derivados de ácidos nucleicos, vitaminas,
sais, ácidos graxos ou ésteres de ácidos graxos e carboidratos fermentáveis. Lactobacilos
requerem as vitaminas
pantotenato de
cálcio
e niacina
para
crescer
e
os
heterofermentativos, como cepas de L. plantarum, L. fermentum e L. brevis, necessitam de
tiamina (OLIVA NETO, 1995).
Quanto ao metabolismo fermentativo, as bactérias láticas se dividem em 3 grupos:
homofermentativos obrigatórios, heterofermentativos facultativos e heterofermentativos
obrigatórios. Os homofermentativos obrigatórios fermentam hexoses quase exclusivamente
a ácido lático pela via Embdem-Meyerhof, e as pentoses e gluconato não são fermentados.
Neste grupo, 1 mol de hexose leva à formação de 2 moles de ácido lático e 2 moles de
ATP.
Os
heterofermentativos
facultativos
fermentam
as
hexoses
como
os
homofermentativos obrigatórios, exceção a poucas espécies que produzem ácido lático,
ácido acético e/ou etanol em condições limitadas de glicose. Pentoses são fermentadas
produzindo ácido
acético
e ácido
lático
via
fosfocetolase
induzível.
Já
os
heterofermentativos obrigatórios fermentam hexoses pela via 6-fosfogluconato. Muitos
carboidratos podem ser fermentados variando entre as espécies. Em condições de
anaerobiose, as hexoses são convertidas em quantidade equimolares de ácido lático, etanol
e/ou ácido acético, gás carbônico e ATP (KANDLER, 1983; OLIVA NETO, 1995;
GOMES, 2009).
Os tipos de metabolismo podem ser determinados com base nos produtos finais,
sendo que, de um modo geral, fermentações que resultam na formação do ácido lático
como produto majoritário são conduzidos pelas bactérias homofermentativas. Já as que
apresentam como produtos principais ao lado do ácido lático, etanol e/ou ácido acético, são
realizadas por bactérias do tipo heterofermentativas (KANDLER, 1983). Um esquema
simplificado destes metabolismos pode ser verificado na Figura 3.
15
Introdução
Figura 3 - Esquema simplificado das vias do metabolismo homofermentativo e heterofermentativo em
bactérias láticas do gênero Lactobacillus. Fonte: Gomes, 2009.
1.10 Interações entre leveduras e bactérias
Como já descrito, os ácidos orgânicos produzidos pelas bactérias podem afetar a
viabilidade das leveduras, porém esta inibição é dependente de outros fatores, como tipo e
concentração do ácido, tipo de leveduras, sinergismo com outros produtos e pressão
osmótica do meio (OLIVA NETO, 1995). Segundo BASSO et al., 1997 (citados por
SOUSA, 2005), a fermentação pode causar uma ação antibacteriana, pela ação sinérgica do
ácido succínico e etanol, ambos produzidos pela S. cerevisiae.
Quanto ao tipo de ácido, o ácido acético, pode causar mais danos às leveduras do
que o ácido lático. Isto porque, o acetato é solúvel nos lipídeos da membrana celular, e o
seu ácido correspondente (ácido acético) ou seus sais, inibem o crescimento da levedura
devido à interferência com o transporte de fosfato. Isto resulta em aumento da quantidade
de ATP necessária para manutenção da função celular. Já o ácido lático, é bem menos
solúvel em lipídeos devido à presença da hidroxila, portanto, a inibição somente se dá em
concentrações bem mais elevadas. Além disso, ácido lático não inibe o transporte de
fosfato, logo, o mecanismo pelo qual ele inibe as leveduras é provavelmente diferente do
mecanismo do ácido acético. Concentrações de 0,5 a 9,0g/L de ácido acético inibiram o
16
Introdução
crescimento de S. cerevisiae, sendo que para o ácido lático a concentração necessária para
a inibição foi e de 10 a 40g/L. Uma redução de 80% na massa celular de leveduras foi
observada para as concentrações de 1,5g/L de ácido acético e 38g/L de ácido lático.
(MAIORELLA et al., 1983).
ALCARDE et al., 2002 (citados por SOUSA, 2005) afirmam que a queda no
rendimento fermentativo quando em presença de bactérias se deve à redução da viabilidade
celular de leveduras devido ao aumento da acidez no mosto após 8h de cultivo associado
com bactérias do gênero Bacilllus e Lactobacillus.
As bactérias láticas exercem um efeito inibidor sobre o crescimento da levedura
devido à função osmótica causada pela presença do ácido lático. Porém, as leveduras
produzem ácido succínico, que exerce uma pressão sobre o crescimento bacteriano e,
consequentemente reduz os níveis de ácido lático. Além disso, leveduras com caráter
“killer” secretam compostos que são capazes de inibir o crescimento de diversas bactérias,
tanto Gram-positivas quanto Gram-negativas. (CHERUBIN, 2003; GOMES, 2009).
Em algumas situações a fermentação é considerada um ótimo inibidor da
multiplicação bacteriana, seja pela presença de etanol, de ácidos orgânicos ou pela rápida
assimilação de substrato; em outras a presença da levedura favorece o desenvolvimento
bacteriano (GOMES, 2009). OLIVA-NETO & YOKOYA em 1996 (citados por SOUSA,
2005) afirmam que aminoácidos oriundos da levedura morta são importantes para a
nutrição e desenvolvimento de lactobacilos. Segundo (GOMES, 2009), diversas interrelações entre leveduras e Lactobacillus foram observadas, e em cada uma delas a levedura
parece ser o organismo ativo, ou seja, aquele que sintetiza a substância ausente essencial
para o crescimento da bactéria.
Portanto, este trabalho tem como objetivo investigar se é possível a utilização de
bactérias láticas em fermentação mista, para a produção de cachaça de alto padrão de
qualidade, devido ao incremento nos teores do éster lactato de etila. Os desafios deste
projeto são a obtenção de níveis adequados deste éster e manutenção da viabilidade dos
micro-organismos.
17
Justificativa
2. JUSTIFICATIVA
“O aumento do consumo interno e a busca por espaço no mercado internacional são
fatores que reforçam a necessidade de se melhorar e ou de se garantir a qualidade da
cachaça produzida. Entretanto, em função de reduzido número de trabalhos publicados
e/ou literatura especializada disponível é difícil estabelecer um padrão de qualidade para a
cachaça” (VICENTE, 2007) p. 27
Estudos desenvolvidos no Laboratório de Biologia Celular e Molecular (LBCM) do
Núcleo de Pesquisas em Ciências Biológicas (NUPEB) da UFOP permitiram o
desenvolvimento de uma estratégia de isolamento de cepas de Saccharomyces cerevisiae
com propriedades adequadas a produção de cachaça de alambique. Esta metodologia
combina a seleção de cepas com características como a alta resistência a diferentes tipos de
estresse (temperatura; alta osmolaridade; presença de etanol), a capacidade de flocular, a
incapacidade de produzir ácido sulfídrico (e a alta atividade invertásica). Além disto, são
utilizados testes de resistência a drogas específicas (TFL e cerulenina) para propiciar a
seleção de cepas com alta capacidade de produção de álcoois superiores e seus ésteres
(VICENTE et al., 2006).
Esta linha de trabalho tem resultado em aplicações no setor produtivo, através da
empresa Cerlev que tem como cliente uma empresa americana que adquire cachaça em
Minas Gerais para a formulação de um “blend” registrado como cachaça Leblon. Esta
empresa tem fornecido ao nosso grupo de trabalho um “feedback” sobre as carências do
mercado da cachaça. São escolhidas cachaças que apresentem estabilidade físico-química e
sensorial e que não evidenciem sabores vegetais residuais, e que apresentem um paladar
frutado. Temos observado que cachaças com teores mais elevados do éster lactato de etila
têm sido preferidas nos processos de compra dos produtos que compõem este “blend”.
Observamos ainda que os teores deste composto variam entre 30 e 250 mg/litro.
O lactato de etila pode então, contribuir para o aumento da qualidade sensorial da
bebida devido ao incremento do paladar frutado. Com isso, visa-se não só o ganho de
qualidade como também a agregação de valor ao produto, incrementando lucros e volume
de venda, no mercado interno e externo, contribuindo para a economia do estado/país.
18
Objetivos
3. OBJETIVOS
3.1 Objetivo geral
Estudar a possibilidade de utilização de bactérias láticas, em um processo de fermentação
mista, para melhoria das características sensoriais da cachaça devido à produção do éster
lactato de etila.
3.2 Objetivos específicos
3.2.1 Avaliar a influência das bactérias láticas na viabilidade de leveduras através de
análises de pH, consumo de sacarose e contagem de células viáveis de leveduras.
3.2.2 Comparar as cepas de bactérias laboratoriais e isoladas de dornas de fermentação de
cachaça quanto ao desempenho na produção de ácido lático/lactato de etila.
3.2.3 Verificar a correlação entre o a população de bactérias e a produção de substâncias
aromatizantes específicas (lactato de etila) em processos produtivos.
3.2.4 Verificar a possibilidade de utilização da fermentação mista com reciclo de células.
19
Materiais e Métodos
4. MATERIAIS E MÉTODOS
4.1 Delineamento Experimental
Figura 4 – Delineamento Experimental
20
Materiais e Métodos
4.2 Cepas de micro-organismos utilizadas
Tabela 2 - Micro-organismos utilizados no presente trabalho
Espécie
Origem
Saccharomyces cerevisiae LBCM 606c
Coleção do LBCM
Lactobacillus plantarum
UFMG
Lactobacillus fermentum
UFMG
Bacillus coagulans
UFV
Bacillus stearothermophilus
UFV
Lactobacillus casei Shirota
Isolado do Yakult®
bLBCM 680-2 (L. casei)
Coleção do LBCM
bLBCM680-3 (L. casei)
Coleção do LBCM
A cepa de S. cerevisiae utilizada nesse trabalho é originária da coleção do
Laboratório de Biologia Celular e Molecular/UFOP, selecionada de dorna de fermentação
com características desejáveis para a produção de cachaça. As cepas de Lactobacillus
plantarum e Lactobacillus fermentum foram gentilmente cedidas pelo Dr. Jacques Nicoli
da Universidade Federal de Minas Gerais. As cepas de Bacillus foram gentilmente cedidas
pelo Dra. Flávia Passos da Universidade Federal de Viçosa.
A cepa Lactobacillus casei Shirota foi isolada do Yakult® e utilizada como um
controle industrial. As cepas bLBCM680-2 e bLBCM680-3, foram isoladas de dorna de
fermentação de cachaça pelo doutorando Thiago Moreira dos Santos. Tais bactérias foram
posteriormente submetidas ao processo de identificação molecular e identificadas como
Lactobacillus casei.
Todos os micro-organismos foram mantidos a -80°C em seus meios de cultura
apropriados adicionados de 30% de glicerol. A levedura foi mantida em YPD2%, os
bacilos em PCA/PCB e os lactobacilos em MRS. As fermentações mistas foram realizadas
em meio mínimo.
21
Materiais e Métodos
4.3 Meios de cultura
4.3.1 Meio YPD2%
O meio YPD2% (Yeast Extract Peptone Dextrose 2%) é composto por extrato de
levedura 1% (p/v), peptona 2% (p/v), glicose 2% (p/v) como fonte de carbono, e água
destilada. Para o meio sólido Agar 2% (p/v) foi utilizado.
4.3.2 Meio mínimo (YNB Sac8%)
O meio mínimo é composto de base nitrogenada sem aminoácidos e sem sulfato de
amônio 0,2% (p/v), pH 5,5. A fonte de nitrogênio utilizada foi peptona de carne (Himedia)
na quantidade de 0,3% (p/v). A fonte de carbono utilizada durante a fermentação foi
Sacarose 8% (p/v).
4.3.3 Meio PCB (Plate Count Broth)
O meio PCB é composto por peptona 0,5% (p/v), extrato de levedura 1,0% (p/v),
glicose 0,1% (p/v) como fonte de carbono e água destilada. Para o meio sólido (PCA Plate Count Agar) Agar 1,5% (p/v) foi utilizado.
4.3.4 Meio MRS (de Man, Rogosa and Sharpe)
Meio MRS (Himedia) foi utilizado conforme recomendado pelo fabricante (5,515%
p/v do meio MRS e água destilada). Para o meio sólido Agar 1,5% (p/v) foi utilizado.
Todos os meios de cultura foram autoclavados por 20min a 121°C antes de serem
utilizados e as fontes de carbono e nitrogênio foram autoclavadas separadamente.
4.4 Padronização das cepas de levedura e bactérias para uso na fermentação mista
4.4.1 S. cerevisiae LBCM606c
Padronização da contagem:
A cepa foi crescida em YPD2%, e de tempos em tempos, alíquotas foram retiradas.
De tais alíquotas realizou-se a leitura de absorbância (600nm) e a contagem de células em
Câmara de Neubauer. Os valores de absorbância (D.O. 600nm) foram plotados em gráfico
22
Materiais e Métodos
contra os valores de contagem em Câmara de Neubauer. As contagens foram feitas em
triplicata, e o experimento realizado em dois dias, sendo que as amostras com valores de
absorbância superior a 0,35 a 600nm foram diluídas para a leitura de densidade ótica.
Amostras com contagem superior a 50 células por campo na Câmara de Neubauer também
foram diluídas.
4.4.2 Bactérias
Para a realização dos inóculos de bactérias no meio de fermentação mista de modo
a obter concentrações adequadas de células (10 4, 105 ou 106 UFC/mL), desejou-se
padronizar a suspensão de células de acordo com a absorbância a 600nm. Deste modo,
conhecendo-se a relação referente à quantidade de células presentes em uma suspensão de
determinada D.O. 600nm, é possível a adição da quantidade de bactérias adequadas
variando-se o volume do pré-inoculo. Para a padronização do número de células presentes
na suspensão de micro-organismos, as suspensões tiveram sua absorbância 600nm ajustada
segundo o tubo 2 da Escala de McFarland, correspondendo a 60.107 UFC/mL. A
confirmação da concentração de células foi realizada por contagem em placa das diluições
adequadas, utilizando-se a técnica de “pour plate” ou plaqueamento em microgotas, como
descrito no decorrer desta seção. As padronizações foram realizadas em 3 dias diferentes, e
em cada um deles, foram realizadas 4 replicatas da contagem em placa, totalizando 12
contagens. Para a padronização foram plaqueadas três diluições seriadas: a diluição de
interesse, a imediatamente anterior e a imediatamente posterior. Para a técnica de pour
plate, estas diluições foram: 10-6, 10-7 e 10-8 e para a técnica de microgotas, 10-4, 10-5 e 106
. Tal procedimento foi adotado para a avaliação da proporcionalidade entre as diluições,
que deve ter razão <2. A diluição de interesse é aquela onde o número de colônias
esperado é o ideal para a contagem (entre 20 e 200 colônias por placa).
A) Lactobacilos:
Foram crescidos em placa de MRS-agar, incubados a 30°C por 48h, e colônias
foram dispersas em salina peptonada (0,1% de peptona) até a obtenção de uma suspensão
com absorbância a 600nm igual à solução do tubo dois da Escala de McFarland. Realizouse a diluição seriada em salina. Plaqueou-se, em MRS-agar, 1mL das diluições 10-6, 10-7 e
10-8 em triplicata utilizando-se a técnica de pour plate,, e para a técnica de microgotas
23
Materiais e Métodos
10µL das diluições 10-4, 10-5 e 10-6 em triplicata. Incubou-se a 30°c por 2 a 3 dias. O
resultado foi expresso como unidades formadoras de colônias por mL.
B) Bacilos:
As células foram crescidas em caldo e ajuste de absorbância de acordo com o tubo
2 da escala de McFarland no próprio meio de cultura. Realizou-se a diluição seriada em
salina. Plaqueou-se, em PCA, 1mL das diluições 10-6, 10-7 e 10-8 em triplicata utilizando-se
a técnica de pour plate,, e para a técnica de microgotas 10µL das diluições 10-4, 10-5 e 10-6
em triplicata. Após a secagem das placas, adicionou-se mais 8mL de PCA com o objetivo
de impedir o crescimento de colônias da superfície do agar. Incubou-se a 30°c por 24 a 48
horas. O resultado foi expresso como unidades formadoras de colônias por mL.
Plaqueamento por Microgota
Antes do plaqueamento, as placas foram colocadas em estufa a 80°C por 5 minutos
e posteriormente expostas abertas à luz UV por 10 minutos, propiciando a retirada do
excesso de umidade da superfície da placa, evitando assim o espalhamento da gota.
As culturas, nas diluições de interesse, foram plaqueadas em triplicata. O volume
plaqueado foi de 10µL ou 20 µL, e as gotas foram colocadas na placa de modo
equidistante.
As placas foram incubadas invertidas em estufa a 30ºC por 24h.
4.5 Adaptação das bactérias ao meio de cultivo misto
As cepas de bactérias láticas mantidas sob congelamento (-80°C) foram reativadas
transferindo-se 20µL das suspensões de células para 4mL de caldo de cultivo apropriado
(MRS para lactobacilos e PCB para bacilos), e incubadas a 30°C por 24 horas. Em seguida,
200µL da cultura foram transferidos para o meio YNBSac8% pH 5,5 incubadas a 30°C
para adaptação das bactérias às condições utilizadas no processo de fermentação mista.
24
Materiais e Métodos
4.6 Fermentação Mista de 48h
As fermentações foram realizadas em erlemmeyers contendo 200mL de meio YNB
sem aminoácidos e sem sulfato de amônio adicionado de 8% de sacarose (YNB Sac8%).
Inicialmente, seguiu-se a proporção da literatura: 3,6.109 UFC/mL de leveduras e
3,6.104 UFC/mL de bactérias no pé-de-cuba, que corresponde a 20% do volume útil da
dorna de fermentação. Para os 200mL de fermentação, isto corresponde a um total de
1,44.1011 células de leveduras (7,2.10 8 células/mL) e 1,44.106 células de bactérias (7,2.10 3
células/mL). Posteriormente as quantidades de bactérias foram aumentadas.
As leveduras foram crescidas em YPD2% até a D.O. necessária para obter 1,44.10 11
células (3,6.109 UFC/mL nos 200mL da fermentação mista), que foram então
centrifugadas, lavadas com água destilada estéril, e vertidas no meio da fermentação mista
(YNB Sac8%).
As bactérias foram inoculadas overnight em meio próprio para cultivo (MRS para
lactobacilos e PCB para bacilos) e então inoculadas em YNB Sac8% overnight ou até
alcançarem o valor de absorbância correspondente ao tubo 2 da escala de Mcfarland. Tal
passo foi necessário para adaptação das bactérias ao meio da fermentação mista. Este
inóculo foi então padronizado segundo o tubo 2 da escala de McFarland e então volume
necessário para as concentrações desejadas foi transferido para o meio da fermentação
mista. O momento da adição das células de leveduras e bactérias foi chamado de tempo 0h.
O esquema da fermentação mista é demonstrado na Figura 6.
25
Materiais e Métodos
Figura 5 - Esquema para a fermentação mista, em escala laboratorial.
4.7 Fermentação Mista com reciclo de células
As fermentações foram realizadas em erlenmeyers estéreis de 125mL contendo
30mL de meio mínimo YNB Sac8%. Cada ciclo fermentativo ocorreu em estufa a 30°C e
teve duração de 24 horas.
Para o primeiro ciclo, leveduras e bactérias foram crescidas separadamente.
Volumes adequados, determinados pela padronização descrita acima, foram centrifugados
por 12 minutos a 2885g, e lavados com água destilada estéril, para obter concentrações de
3,6 109 UFC/mL de leveduras e 106 UFC/mL de bactérias. Para os demais ciclos, as células
do ciclo anterior foram centrifugadas por 12 minutos a 2885g, o sobrenadante foi estocado
em freezer (-20°C) para análises químicas posteriores (pH, °Brix, teor de etanol, dosagem
de ácido lático e lactato de etila). As células foram então lavadas com água destilada
estéril, novamente centrifugadas a 2885g por 12 minutos e então resuspensas em 30mL de
YNB Sac8%.
Plaqueamentos em microgota foram realizados no inicio e no fim de cada ciclo para
acompanhamento da população de células e para verificação de perda das mesmas durante
a centrifugação.
26
Materiais e Métodos
Os experimentos foram realizados em triplicatas, em dias diferentes. O esquema da
fermentação mista com reciclo de células é representado na Figura 7.
Figura 6 - Esquema para a fermentação mista com reciclo de células, em escala laboratorial.
4.8 Análises químicas e microbiológicas
Para a análise de ácido lático e lactato de etila, alíquotas foram coletadas e extraídas
com solvente orgânico conforme descrito no item 4.8.1. Os experimentos de fermentação
de 48h tiveram suas alíquotas retiradas nos tempos 8, 24 e 48h, e os experimentos com
reciclo de células, ao final de cada ciclo fermentativo.
Foram feitas coletas de amostras nos tempos 0, 2, 4, 6, 8, 12, 24 e 48 horas para
análises de pH, medido em pHametro (Orion) e consumo de sacarose (°Brix) medido em
refratômetro de bancada tipo ABBE Pró-Análise (BK Equipamentos). Para os
experimentos com reciclo de células, tais análises foram realizadas ao final de cada ciclo
fermentativo.
27
Materiais e Métodos
Para a análise de ácido lático e lactato de etila, alíquotas foram coletadas e extraídas
com solvente orgânico nos tempos 8, 24 e 48h, para os experimentos de fermentação de
48h, e ao final de cada ciclo fermentativo para os experimentos com reciclo de células.
A dinâmica populacional foi analisada nos experimentos de fermentação de 48h nos
tempos 0, 24 e 48h. Já nos experimentos com reciclo de células, tal análise foi realizada ao
início e ao fim de cada ciclo fermentativo para verificação de perda de células durante a
centrifugação. Para a avaliação da dinâmica populacional, foram realizados plaqueamentos
em microgota (10µL) das culturas em diluições adequadas nos seguintes meios de cultura:
A dinâmica populacional foi analisada nos tempos 0, 24 e 48h. Para isto, foram
realizados plaqueamentos em microgota (10µL) das culturas em diluições adequadas nos
seguintes meios de cultura:
- Contagem de leveduras: Meio YPD2% Agar + cloranfenicol 10 mg/L
- Contagem de lactobacilos: Meio MRS Agar + cicloheximida 7mg/L
- Contagem de bacilos: Meio PCA + cicloheximida 7mg/L
4.8.1 Análise de Voláteis
A) Extrações
Alíquotas de 25mL foram coletadas nos tempos de 8h, 24h e 48h dos experimentos
de fermentação de 48h, e ao final de cada ciclo fermentativo nos experimentos com reciclo
de células. Após centrifugação a 2885g por 8 minutos, 20mL do sobrenadante foi coletado
para a extração de ácido acético e lactato de etila para análise cromatográfica.
Os 20mL do sobreandante foram transferidos para tubos de centrífuga de vidro com
capacidade para 50mL, foram adicionados 5g de NaCl e 5mL de acetato de etila e então
agitados em vortex por 1 minuto. As amostras foram então centrifugadas a 2885g por 3
minutos. Para a análise lactato de etila, 1mL da fase orgânica foi coletado e analisado por
CG-MS. Para a análise de ácido lático, 1mL da fase orgânica foi coletado, transferido para
vials de 1,5mL de capacidade, secos sob N2 e então ressuspensos em 1mL de água Milli-Q.
As amostras foram então analisadas por HPLC UV/Vis.
28
Materiais e Métodos
B) Análises Cromatográficas
O solvente utilizado foi o acetato de etila Mallinckrodt grau cromatográfico; os
padrões lactato de etila e ácido lático, 98 e 85% de pureza, respectivamente, ambos da
sigma.
B.1) Lactato de etila
As dosagens de lactato de etila foram realizadas em um cromatógrafo Shimadzu
GCMS – QP2010 plus, equipado com um detector de massas quadrupolo, operando no
modo de impacto eletrônico com 70 eV, escaneamento e monitoramento de íon seletivo
(SIM), A tabela 3 mostra os íons monitorados neste trabalho.
Tabela 3 - Íons monitorados (m/z) para a análise de lactato de etila no modo SIM
Janela
Tempo de
aquisição (min.)
Modo de
Aquisição
Íon (m/z *)
Composto
4,5 – 12,5
SCAN
-
-
12,5-14,0
SIM
45, 56 e 75
Lactato de Etila
14,0-35,0
SCAN
-
-
* m/z: razão massa-carga
A rampa de aquecimento utilizada permite a separação de outros voláteis de
interesse para a cachaça, como ésteres (hexanoato, octanoato e decanoato de etila), alcoóis
superiores (álcool isobutílico e álcool isoamílico) além de ácido acético, compostos não
quantificados neste trabalho.
A coluna cromatográfica empregada foi uma coluna capilar EliteWax (30m x
0,25mm x 0,5µm, fase estacionária de polietilenoglicol). Injetor, detector e interface a
240°C e a seguinte programação de temperatura de forno: temperatura inicial de 35°C,
elevada a 120°C numa taxa de 3°C /min., e então elevada até 240°C a 20°C/min. e mantida
por 15 min.
O volume injetado foi de 1,0µL no modo “splitless” por 0,75 minutos, e então
ativado o modo “split” com taxa de 1:50 utilizando gás hélio como gás de arraste, com
fluxo de 1,24mL/min.
29
Materiais e Métodos
A confirmação dos picos foi realizada por comparação do tempo de retenção e do
espectro de massas obtido para padrão e amostras. Para análise quantitativa empregou-se o
método de calibração externa.
A repetibilidade do método foi verificada através de 7 extrações de uma amostra de
mosto fermentado e 7 extrações da mesma amostra adicionada de lactato de etila. A
precisão foi determinada pelo cálculo do desvio-padrão relativo (DPR). (Ver Anexo)
B.2) Ácido lático
A análise de cromatografia líquida de alta eficiência (HPLC) foi feita em
cromatógrafo Shimadzu utilizando-se coluna de troca iônica Aminex HPX-87H(Bio-Rad).
A fase móvel empregada foi ácido sulfúrico 0,01 mol/L, com uma vazão de 0,6mL/min. A
temperatura da coluna foi mantida a 40°C e o volume de injeção empregado foi de 10 µL.
A detecção foi realizada a 210nm. (MESQUITA, 2009)
C) Teste do melhor solvente para extração simultânea de ácido lático e lactato
de etila.
Testes qualitativos foram realizados em GC-FID na busca de um solvente extrator
para ácido lático e lactato de etila. Para tanto, partiu-se de uma matriz aquosa complexa
(sobrenadante do mosto fermentado de S. cerevisiae após 24h de cultivo em YNB Sac8%)
adicionada de 200 ppm de ácido lático e 7,0 ppm de lactato de etila.
Procedeu-se a extração conforme descrito anteriormente e analisou-se a fase
orgânica em cromatógrafo à gás acoplado a detector de ionização por chama (GC-FID).
Para a determinação da recuperação de lactato de etila, as análises foram feitas em
triplicatas e as amostras quantificadas através de cromatografia gasosa hifenada à
espectrometria de massas.
4.9 Análise estatística
Considerou-se uma replicata a repetição de todo o experimento, ou seja, desde o
crescimento das cepas e adição nas concentrações desejadas, com coletas de amostra nos
tempos desejados para a realização das analises de interesse. Para a contagem de viáveis de
30
Materiais e Métodos
cada
experimento,
considerou-se
a
média
de
3
plaqueamentos
para
cada
tempo/concentração desejada.
O pH e o consumo de sacarose foram analisados pelo teste de Kruskal-Walllis (oneway ANOVA) pelo programa GraphPad Prism. A viabilidade de leveduras e bactérias
foram analisadas quanto à porcentagem de viabilidade em relação ao tempo 0h.
considerou-se como significativa, variações de 5% ou mais.
31
Resultados e Discussão
5. RESULTADOS E DISCUSSÃO
5.1 Padronizações de micro-organismos
Segundo a literatura, o “pé-de-cuba” é composto, em média, por 3,6 x 109 UFC/mL
de leveduras e de 3,6 x 10 4 UFC/mL de bactérias. Para que esta concentração de células
fosse adicionada ao meio fermentativo, fez-se necessária a padronização da contagem de
células, tanto de leveduras, quanto de bactérias. Tal padronização permitiu a correta adição
da concentração de células descrita na literatura, assim como variações propostas no
decorrer do presente trabalho.
5.1.1 Padronização da suspensão de leveduras
A cepa de levedura S. cerevisiae LBCM606c teve sua suspensão padronizada com
relação ao número de células por comparação entre absorbância e contagem de células em
câmara de Neubauer (Figura 7). O experimento foi realizado em três diferentes dias, e a
reta obtida ofereceu um bom coeficiente de correlação (0,9855). Desta forma utilizamos a
equação da reta para o cálculo do número de células presentes em uma suspensão de
absorbância conhecida, assim como foi possível correlacionar que D.O. deveria ser
alcançada para se obter o número de células desejado.
Figura 7: Padronização do número de células de leveduras em suspensão (YPD2%) pela medida da
absorbância 600nm e pela contagem de células em Câmara de Neubauer.
32
Resultados e Discussão
5.1.2 Padronização da suspensão de bactérias
Foi constatada a proporcionalidade entre as diluições seriadas testadas para cada
cepa de micro-organismo, já que a razão entre elas foi < 2, o que valida os resultados
encontrados. As suspensões foram padronizadas, pois segundo o Teste T, os valores de
contagem de uma mesma cepa não diferiram entre si, nos 3 diferentes dias ao nível de
significância de 5%.
Esperava-se obter 60x107 UFC/mL, porém não obtivemos 100% de recuperação da
cultura bacteriana em meio de cultura. Apesar deste fato, o método pode ser utilizado uma
vez que apresentou proporcionalidade entre as diluições, repetibilidade (replicatas em um
mesmo dia) e reprodutibilidade (análise em dias diferentes), mesmo quando sujeito a
variações como diluição em salina peptonada ou não-peptonada, ou quando se partia de
colônias crescidas em placa ou cultura em caldo.
A tabela 4 mostra a concentração de
células em suspensões bacterianas padronizadas para este estudo.
Tabela 4 - Medida da concentração de células em suspensões bacterianas.
Bactéria
Contagem (UFC/mL)*
Lactobacillus plantarum
256x106
Lactobacillus fermentum
299x106
Bacillus. Coagulans
14,6x106
Bacillus stearothermophilus
53,5x106
Lactobacillus casei shirota
265x106
bLBCM680-2 (L. casei)
296x106
bLBCM680-3 (L. casei)
288x106
*Corresponde a média de 12 plaqueamentos
33
Resultados e Discussão
5.2 Avaliação do melhor solvente para extração de lactato de etila.
Foi inicialmente testada a extração de voláteis utilizando-se como solvente extrator
a mistura hexano:éter etílico (1:1) conforme descrito por MAMEDE & PASTORE, (2006).
Os autores descrevem que o solvente utilizado permitiu a detecção de lactato de etila e
ácido lático, não detectados pelo método de Purge and Trap também testado para as
mesmas amostras de mosto fermentado de uva.
Porém, em nossos experimentos tal
mistura de solventes apesar de permitir a detecção de lactato de etila, apresentou uma baixa
recuperação (43%, conforme demonstrado na Tabela 5), e não permitiu a detecção de ácido
lático na condição testada (mosto fermentado de cana adicionado de ácido lático 200 ppm e
lactato de etila 7,0 ppm detectados por HPLC UV/Vis e GC-MS respectivamente).
Variando-se a proporção dos solventes para hexano:éter etílico (1:3), nem ácido lático e
nem lactato de etila foram detectados.
Foram então testados outros solventes e misturas de solventes visando não só a
recuperação do lactato de etila como também do ácido lático. O solvente álcool isoamílico
assim como as misturas éter etílico:álcool isoamílico (1:1); clorofórmio: álcool isoamílico
(1:1); clorofórmio: álcool isoamílico (1:2) clorofórmio: álcool isoamílico (2:1) não
permitiram a detecção de ácido lático e nem lactato de etila nas mesmas condições testadas
(Tabela 5). Em trabalho realizado por PEREIRA, (1991), o álcool isoamílico foi escolhido
como o melhor solvente para a extração de ácido lático obtido por via fermentativa. É
importante ressaltar que o autor buscava um método para purificação de ácido lático com
fins comerciais. Para tanto foram considerados aspectos como seletividade, baixa
solubilidade em água, facilidade de separação entre as fases, viscosidade, densidade,
toxidez, inflamabilidade, custo e disponibilidade. Segundo o autor, o álcool isoamílico
eliminou efetivamente a lactose residual e a maior parte dos ácidos contaminantes. O autor
descreve ainda que a purificação do ácido lático obtido por via fermentativa é complexa,
devido à baixa pressão de vapor, tendência a interesterificação, elevada solubilidade em
água e presença de impurezas de difícil separação.
Conforme demonstrado na Tabela 5, os solventes clorofórmio e acetato de etila e
foram os melhores solventes extratores de lactato de etila, com porcentagem de
recuperação próxima a 100%. Diclorometano também apresenta uma boa recuperação de
lactato de etila, aproximadamente 75%. A análise qualitativa da extração de ácido lático
realizada com estes mesmos solventes revelou o acetato de etila como a melhor opção.
34
Resultados e Discussão
Tabela 5 - Porcentagem de recuperação de ácido lático e lactato de etila por extração com solventes
orgânicos
Solvente
% Recuperação
Éter etílico: Álcool isoamílico (1:1)
ND*
Hexano : Éter Etílico (1:1)
43,29
Hexano : Éter Etílico (1:3)
ND*
Diclorometano
74,81
Clorofórmio
99,45
Clorofórmio : Álcool Isoamílico (1:1)
ND*
Clorofórmio : Álcool Isoamílico (2:1)
ND*
Clorofórmio : Álcool Isoamílico (1:2)
ND*
Álcool Isoamílico
ND*
Acetato de etila
100,41
* ND: não detectado
35
Resultados e Discussão
5.3 Fermentações Mistas
As bactérias são descritas na literatura como contaminantes do processo produtivo
da cachaça porque podem competir por nutrientes e diminuir a viabilidade de leveduras
principalmente por acidificaçao do meio (LUDWIG et al., 2001; NOBRE, 2005; SOUSA,
2005; CARVALHO-NETTO et al., 2008). Portanto é necessário saber até qual
concentração as bactérias podem ser usadas em fermentação mista sem prejuízos ao
processo. Para isso, alíquotas da fermentaçao mista foram coletadas e o pH e a sacarose
(°Brix) foram medidos, e a dinâmica populacional acompanhada por plaqueamento. Como
controle, foram utilizadas fermentações com a cepa de S. cerevisiae LBCM606c
isoladamente.
5.3.1 Fermentação mista utilizando-se 104 UFC/mL das bactérias Bacillus coagulans,
Bacillus stearothermophilus, Lactobacillus plantarum, Lactobacillus fermentum
Utilizou-se inicialmente, a proporção descrita na literatura como sendo a
composição média encontrada no “pé-de-cuba”, de 3,6 x 109 UFC/mL de leveduras e de
3,6 x 104 UFC/mL de bactérias (SCHWAN et al., 2001). Tal proporção foi adotada
utilizando-se inicialmente as bactérias Lactobacillus fermentum, Lactobacillus plantarum,
Bacillus coagulans e Bacillus steaarothermophilus, descritos entre as bactérias mais
comumente associadas à contaminação do mosto (GALLO, 1992 apud NOBRE, 2005;
SOUSA, 2005).
A variação de pH observada de 5,5 para 3,0 está de acordo com o descrito por
BARNES, 1974 (citado por SCHWAN et al., 2001) que cita que quedas de pH de 5,5 para
3,0 são frequentemente observadas em fermentações etanólicas devido à produção de
ácidos pela bactéria e algumas espécies de leveduras assim como pela expulsão de prótons.
Em nossos experimentos, pode-se observar as culturas mistas promovem uma queda de pH
mais acentuada no inicio da fermentação (tempo 4h), porém no tempo 24h não há
diferença entre controle e fermentações mistas. Isto pode ser devido ao fato das bactérias já
não estarem mais viáveis nos tempo finas da fermentação (24 e 48h). Logo, as bactérias
não seriam capazes de alterar o pH, à exceção do L. plantarum, que foi a única bactéria a
sobreviver nesta condição, e apresenta, no tempo 48h, pH semelhante ao controle,
36
Resultados e Discussão
enquanto as demais bactérias apresentam valores aparentemente mais elevados (Figura 8a).
Porém, segundo o teste Kruskal-Wallis, não há diferença estatística entre controle e
fermentações mistas. Este resultado contrasta com aquele obtido por (NOBRE, 2005) que
ao trabalhar com estas mesmas cepas mais a cepa de Bacillus subtilis encontra que L.
fermentum e B. subtilis se destacam na produção de ácidos, apresentando maiores
concentrações de acidez total e volátil e menores valores de pH. Tal diferença pode ser
devido ao tamanho do inóculo utilizado (da ordem de 10 6 – 108 UFC/mL dependendo da
cepa). É possível ainda que tal diferença seja devido à utilização de linhagens diferentes.
Neste experimento realizado por NOBRE, (2005) as cepas de bactéria pouco variaram sua
contagem após 72h de cultivo misto.
Para a análise do consumo de sacarose utilizou-se a medida do teor de sólidos
solúveis totais (°Brix). No caldo de cana, este teor corresponde às concentrações de
açucares, majoritariamente, a sacarose (AQUARONE, 2001 apud SOUSA, 2005).
Observou-se que houve consumo de sacarose até 24h de cultivo, após este período o teor
de sólidos solúveis residuais no meio se manteve estável. Não se pode afirmar se tal fato se
deve aos açucares residuais ou a outros componentes, já que a medida se refere ao teor de
sólidos solúveis totais, e não especificamente sacarose (Figura 8b). Segundo o teste
Kruskal-Wallis, não há diferença estatística entre controle (fermentação tradicional) e
fermentações mistas.
Com relação à viabilidade de leveduras, podemos observar que cocultura com L.
fermentum 104 UFC/mL, apresenta aumento da quantidade de células nos tempo 24 e 48h,
156% e 227%, respectivamente, quando comparado ao tempo 0h da fermentação mista, e
redução no tempo final (72h) com 90% da contagem de células do tempo 0h. Já as
fermentações com B. coagulans e B. sterothermophilus apresentam grande redução de
viabilidade no tempo final, 65,4 e 51,5% da contagem de células no tempo 0h,
respectivamente. (Tabela 6 e Figura 8c). A redução na viabilidade é descrita por
competição por nutrientes e acidificação do meio, porém neste caso, não houve diferença
estatística na acidificação (pH) e consumo de sacarose. Além disso, nesta condição
experimental, somente o Lactobacillus plantarum foi capaz de sobreviver, logo, as demais
bactérias não poderiam consumir sacarose ou acidificar o meio por não estarem viáveis
(dados não demonstrados). É possível então que produtos oriundos das bactérias mortas
tenham causado a redução da viabilidade, porém experimentos realizados NOBRE, 2005
indicam que à exceção da bactéria B. subtilis inativada por radiação, as demais bactérias
37
Resultados e Discussão
tratadas por calor, radiação, ou antimicrobiano não causaram diminuição da população de
leveduras, indicando que a presença isolada dos metabolitos celulares destas bactérias não
foi suficiente para reduzir a contagem de leveduras nas condições testadas.
Na concentração de 10 4 UFC/mL, frente a 109 UFC/mL de leveduras, somente L.
plantarum foi capaz de sobreviver. Portanto, decidiu-se aumentar o inóculo bacteriano,
trabalhando-se inicialmente com o L. plantarum que foi o único sobrevivente do primeiro
experimento.
Tabela 6 – Viabilidade de leveduras (%) ao longo da fermentação, frente a diferentes bactérias na
concentração de 104 UFC/mL, quando comparadas ao tempo 0h.
Lactobacillus
Lactobacillus
Bacillus
Bacillus
plantarum
fermentum
coagulans
stearothermophilus
100,2
102,4
156,2
84,6
106,8
48h
101,6
103,0
227,5
97,1
109,7
72h
99,7
100,6
91,3
65,4
51,5
Tempo
Controle
24h
38
Resultados e Discussão
4
Figura 8 - Avaliação dos parâmetros fermentativos na fermentação mista com 10 UFC/mL de bactérias
láticas. Foram realizadas fermentações mistas com as bactérias láticas Lactobacillus plantarum,
Lactobacillus fermentum, Bacillus coagulans, e Bacillus stearothermophilus na concentração de 104 UFC/mL
e avaliadas com relação aos parâmetros fermentativos nos tempos 0, 24 e 48h. (a) pH, (b) consumo de
sacarose e (c) contagem de leveduras.
39
Resultados e Discussão
5.3.2 Fermentação mista utilizando-se Lactobacillus plantarum nas concentrações de
104, 105 e 106 UFC/mL
Para avaliar o efeito do tamanho do inóculo inicial nos parâmetros fermentativos,
inoculou-se a bactéria L. plantarum nas concentrações de 104, 105 e 106 UFC/mL no
volume total de fermentação mista, e não mais nos 20% do volume de fermentação. As
leveduras continuaram sendo inoculadas na concentração de 3,6.10 9 UFC/mL nos 20% do
volume de fermentação, o que corresponde a 7,2.10 8 UFC/mL quando se avalia o volume
total.
Assim como descrito por NOBRE, (2005) neste experimento também foi observada
a queda nos valores de pH para as primeiras 24h de cultivo, com posterior aumento até o
fim do cultivo (72h). Tal comportamento foi observado tanto para o controle quanto para
os cultivos mistos, e não foram observadas diferenças entre controle e cultivos mistos, ou
seja, não houve acidificação adicional do meio promovida por bactérias. (Figura 9a)
A viabilidade de leveduras apenas sofreu uma pequena redução na quantidade de
células, no tempo final (72h) quando L. plantarum foi inoculado na concentração de 106
UFC/mL, apresentando 88,5% da quantidade de células presentes no tempo 0h. E um
pequeno aumento na quantidade de células de leveduras foi observado no tempo 48h da
fermentação mista com 105 UFC/mL, 114% da contagem de células inicial (tempo 0h).
(Tabela 7 e Figura 9b). Logo, não foram constatadas evidências de que o cultivo misto de
S. cerevisiae e L. plantarum até a concentração de 10 6 UFC/mL de bactérias pudesse afetar
significativamente/negativamente o processo fermentativo.
Quanto à sobrevivência bacteriana, a concentração de células no tempo 72h da
fermentação mista, foi maior para as fermentações com um inóculo inicial de 10 4 e 106
UFC/mL, e permaneceu o mesmo quando o inóculo foi de 10 5 UFC/mL. (Tabela 8 e
Figura 9c).
40
Resultados e Discussão
Tabela 7 - Viabilidade de leveduras (%) ao longo da fermentação, frente a diferentes concentrações de L.
plantarum, quando comparadas ao tempo 0h.
L. plantarum
L. plantarum
L. plantarum
104 UFC/mL
105 UFC/mL
106 UFC/mL
100,2
102,4
91,3
109,2
48
101,6
103,0
114,1
109,2
72
99,7
100,6
96,7
88,5
Tempo
Controle
24
Tabela 8 - Viabilidade de L. plantarum (%) inoculado em diferentes concentrações, ao longo da
fermentação, quando comparado ao tempo 0h.
L. plantarum
L. plantarum
L. plantarum
104 UFC/mL
105 UFC/mL
106 UFC/mL
24
61,3
95,8
95,9
48
101,5
38,2
150,3
72
139,8
92,7
155,8
Tempo
41
Resultados e Discussão
Figura 9 - Avaliação da interferência do tamanho do inóculo bacteriano com relação aos parâmetros
fermentativos. A cepa de L. plantarum foi inoculada nas concentrações de 104, 105 e 106 UFC/mL e a
fermentação mista analisada nos tempos 24, 48 e 72h com relação a (a)pH, (b) viabilidade de leveduras e (c)
viabilidade de bactérias.
42
Resultados e Discussão
5.3.3 Fermentação mista utilizando-se 106 UFC/mL de bactérias.
Como o L. plantarum inoculado até a concentração de 10 6 UFC/mL não afetou o
pH, o consumo de sacarose e nem a viabilidade das leveduras, decidiu -se trabalhar com
esta concentração de células, porém utilizando-se também um controle industrial e
bactérias isoladas de dornas de produção de cachaça.
Isolou-se do Yakult® a bactéria Lactobacillus casei Shirota, que será daqui para
frente chamada apenas de Lactobacillus casei, ou L. casei. Esta cepa foi escolhida para
servir como um controle industrial, pois trata-se de uma bactéria lática empregada
industrialmente em um alimento fermentado. Espera-se então que tal cepa apresente boas
propriedades tecnológicas. Segundo OLIVEIRA et al., (2002) culturas probióticas com
boas propriedades tecnológicas devem apresentar boa multiplicação, e devem promover
propriedades sensoriais adequadas no produto. Porém, como a cepa foi selecionada para
fermentação de produto lácteo, apresenta boa capacidade de multiplicação em leite.
Desejou-se então verificar se a cepa também apresenta bom desempenho nas condições
empregadas para a fermentação com vistas à produção de cachaça.
Em paralelo, trabalhou-se com duas cepas de bactérias isoladas de dornas de
produção de cachaça, as cepas bLBCM680-2 e bLBCM680-3. É importante lembrar, que
as condições de cultivo empregadas são as condições ótimas para leveduras, visando seu
melhor desempenho, e não são as condições mais apropriadas para o cultivo de bactérias.
Isto porque o micro-organismo principal do processo de produção de cachaça é a levedura,
fermentador primário, responsável pela presença do etanol no meio. A mudança destas
condições pode acarretar em prejuízos à produção devido à queda no teor de etanol
produzido. Por terem sido isoladas de dornas, espera-se que sejam cepas mais robustas,
capazes de resistir a este ambiente fermentativo.
Aparentemente nos tempos iniciais (até 8h) as fermentações mistas causaram uma
maior acidificação do meio do que a fermentação de S. cerevisiae isoladamente, sendo que
no tempo de 48h, a fermentação associada a L. casei apresenta mesmo valor de pH que a
fermentação controle, e as demais cepas, apresentam valores aparentemente inferiores
(Figura 10a). Porém a aplicação do teste estatístico ANOVA (teste de Kruskal-Wallis)
revela que não há diferença estatística entre as fermentações mistas e a fermentação
controle com 95% de confiança.
43
Resultados e Discussão
Esta mesma análise estatística revela que não há diferença significativa entre
controle e fermentações mistas com relação ao consumo de sacarose, com 95% de
confiança (Figura 10b).
A presença das bactérias láticas não causou maior redução da população de
bactérias quando comparada com o tempo inicial da fermentação do que aquela
apresentada pelo controle. (Tabela 9 e Figura 10c). Este resultado contrasta com aquele
observado por OLIVEIRA-FREGUGLIA & HORII, (1998) que verificaram uma redução
de 96% na viabilidade de leveduras em 12 horas de cultivo misto com bactérias ativas.
Porém, no experimento citado, bactérias e leveduras foram crescidas separadamente, e
então volumes adequados dos seus meios de cultura foram misturados. Já no presente
trabalho, os micro-organismos foram crescidos separadamente, centrifugados, lavados com
água destilada estéril e então adicionados simultaneamente a um meio de cultivo novo.
Este pode ser o motivo da diferença encontrada, já que no tempo 0h, não havia a presença
dos metabólitos anteriormente secretados no meio pelas culturas de células.
Quanto à sobrevivência das bactérias, L. plantarum e bLBCM680-2 foram as cepas
que melhor mantiveram a população de células inoculada, apresentando uma contagem de
células de quase 90% da quantidade adicionada no tempo 0h. Já as cepas L. casei e
bLBCM680-3 apresentaram forte queda da população bacteriana ao final da fermentação
mista (48h), com contagem de células de 59 e 42% respectivamente, da quantidade
inoculada no tempo 0h. (Tabela 10 e Figura 11).
Tabela 9 - Viabilidade de leveduras (%) ao longo da fermentação, frente a diferentes bactérias na
6
concentração de 10 UFC/mL, quando comparadas ao tempo 0h.
Lactobacillus
Lactobacillus
plantarum
casei
86,9
91,0
79,5
72,5
Tempo
Controle
24
48
bLBCM680-2
bLBCM680-3
107,4
163,7
117,4
111,3
88,2
108,2
44
Resultados e Discussão
Figura 10 - Avaliação dos parâmetros fermentativos com relação à presença das bactérias láticas L.
plantarum, L. casei, bLBCM680-2 e bLBCM680-3 inoculadas na concentração de 106 UFC/mL. (a) pH, (b)
consumo de sacarose e (c) contagem de leveduras.
45
Resultados e Discussão
Figura 11 - Viabilidade das bactérias láticas inoculadas na concentração de 1e6 UFC/ml em cultivo misto
com S. cerevisiae por 48h.
Tabela 10 - Viabilidade das diferentes bactérias (%) quando inoculadas na concentração de 10 6 UFC/mL
ao longo da fermentação, quando comparadas ao tempo 0h.
Lactobacillus
Lactobacillus
plantarum
casei
24
117,73
48
89,9
Tempo
bLBCM680-2
bLBCM680-3
82,4
91,6
65,4
59,1
89,7
42,4
46
Resultados e Discussão
5.3.4 Padronização de uma metodologia cromatográfica (GC-MS) para análise de
lactato de etila e ácido lático.
Apesar do objetivo deste trabalho ser a quantificação apenas de lactato de etila e
ácido lático, optou-se por fazê-lo através de metodologia cromatográfica, para que fosse
possível em um único método quantificar além destes dois componentes os demais
compostos voláteis importantes para o “flavour” da cachaça. Apesar da metodologia
descrita pelo MAPA, utilizando-se CG-FID, não visar à quantificação do lactato de etila,
sua análise é possível, como demonstra NASCIMENTO (2007). Em nossos testes, nem
lactato de etila nem ácido lático foram detectados nas amostras através de GC-FID, embora
soluções padrão de concentração mais elevada (5 mg/L e 15 mg/L respectivamente)
tenham sido detectadas. Porém é importante ressaltar que NASCIMENTO, (2007)
trabalhou com a cachaça, enquanto as análises deste trabalho foram realizadas em mosto
fermentado, antes da etapa de destilação. Como o teor de etanol produzido em cada ciclo
fermentativo fica em torno de 7 a 8%, e a cachaça apresenta teores entre 38 e 48%, o mosto
é então concentrado pelo processo de destilação. SILVA et al., (2009) descrevem que ao
final das fermentações, o mosto fermentado foi destilado, e para cada 10L de alimentação
do alambique, retirou-se 1,6L de destilado total. BOZA & HORII, (1998) citam que a
destilação além de separar e concentrar os componentes do vinho ainda promove algumas
reações químicas induzidas pelo calor. Assim os componentes voláteis podem aumentar,
diminuir e ainda originar novos componentes.
A dosagem de lactato de etila foi realizada por GC-MS, e para a sua quantificação
foi utilizado o fragmento 45, escolhido com base no espectro obtido no modo SCAN
(Figura 12a). O fragmento 45 é o mais intenso do espectro do lactato de etila, e apesar de
apresentar interferência com outros compostos, este fato não foi relevante, dado que os
compostos foram separados, não havendo co-eluição. O fragmento 75 também pode ser
utilizado para a quantificação assim como realizado por NASCIMENTO (2007), porém,
como o íon 45 é o mais intenso, não houve problema de co-eluição de compostos e
apresentou um melhor coeficiente de correlação linear, foi o fragmento escolhido (Figura
12).
47
Resultados e Discussão
Figura 12 - Cromatogramas obtidos por GC-MS. (a) extração com acetato de etila do mosto após 48h de
fermentação de S. cerevisiae isoladamente e análise por CG-MS no modo SCAN, (b) padrão de lactato de
etila 1,5ppm e (c) pico de lactato de etila na amostra após 8h de fermentação mista com L. casei
1e6UFC/mL, extraída com acetato de etila.
48
Resultados e Discussão
5.3.5 Fermentações mistas de 48h com as cepas selecionadas nas concentrações de 10 5
e 106 UFC/mL para dosagem de lactato de etila e ácido lático.
Para a análise de lactato de etila e de ácido lático foram selecionadas as cepas
bLBCM680-2, bLBCM680-3 e L. casei nas concentrações de 10 5 e 106 UFC/mL, com base
nos resultados obtidos anteriormente. Além disso, foi também utilizada a cepa laboratorial
L. plantarum, inoculada na proporção de 10 6 UFC/mL no meio de fermentação.
Novamente, nos tempos finais da fermentação (24 e 48h), aparentemente L. casei
105 e L. casei 106 UFC/mL apresentam valores de pH semelhantes ao grupo controle, e
ligeiramente mais elevados que as demais fermentações mistas. Porém, como ocorrido no
item 5.3.1, Figura 8, a análise estatística revela que não há diferença significativa entre
nenhum dos grupos (Figura 13a).
Do mesmo modo, nenhuma das cepas bacterianas testadas nestas condições alterou
significativamente o consumo de sacarose. Assim sendo, não se espera grandes diferenças
no teor de etanol produzido, uma vez que aparentemente, as leveduras não foram
prejudicadas na captação de sacarose (Figura 13b). E como já descrito por
(NARENDRANATH et al., 1997) cada molécula de sacarose consumida pela bactéria
resulta em perda de duas moléculas de etanol que poderiam ser produzidas pelas leveduras,
já que a fermentação das bactérias láticas é a fermentação lática e não a fermentação
alcoólica.
É importante lembrar que uma ligeira redução do teor alcoólico, pode ser aceitável,
pois apesar de representar uma diminuição do rendimento, não acarretaria em prejuízo
econômico, ao contrário, haveria o aumento do valor agregado do produto devido ao ganho
em qualidade sensorial.
Com relação à viabilidade celular, as cepas bLBCM680-2 e L. casei, quando
inoculadas na concentração de 105 UFC/mL, reduziram a quantidade de leveduras no
tempo 48h da fermentação mista (58,3 e 57,0% respectivamente), mas contrariamente ao
esperado, quando inoculadas na concentração de 10 6 UFC/mL nenhuma redução foi
observada. L. plantarum quando inoculado a 10 6 UFC/mL também causa uma ligeira
redução na contagem de leveduras no tempo final, 72% da concentração de células
inoculadas no tempo 0h. Já as demais cepas não causaram redução da contagem de
leveduras ao longo da fermentação mista. (Tabela 11 e Figura 13c).
49
Resultados e Discussão
Com relação à sobrevivência da bactéria, a cepa bLBCM680-2, quando inoculada
na concentração de 106 UFC/mL, é quem melhor apresenta a manutenção do número de
células inoculados durante a fermentação mista, já quando inoculada na concentração de
105 UFC/mL, apresenta um aumento inicial (135,7%) com posterior queda do número de
células (61,7%) quando comparada à quantidade inoculada no tempo 0h. L. casei apresenta
forte queda da população bacteriana no tempo final (48h) quando inoculado na
concentração de 10 5 UFC/mL (27% da quantidade inicial) mas queda bem menor quando
inoculado na concentração de 10 6 UFC/mL (59% da quantidade inicial).
Já a cepa
bLBCM680-3 apresenta o comportamento mais intrigante, aumentando expressivamente a
população de células quando inoculadas na concentração de 105 UFC/mL (aumento de 517
e 417% nos tempos 24 e 48h respectivamente, quando comparados ao tempo 0h), e queda
no número de células ao longo da fermentação quando um inóculo maior é testado, 10 6
UFC/mL (Figura 14 e Tabela 12).
Tabela 11 - Viabilidade de leveduras (%) ao longo da fermentação, frente a diferentes bactérias na
concentração de105 e 106 UFC/mL, quando comparadas ao tempo 0h.
Cepa
24h
48h
94,3
113,5
91,0
72,5
116,6
91,5
bLBCM680-2 105 UFC/mL
154,3
58,3
bLBCM680-3 105 UFC/mL
167,6
119,6
L. casei 105 UFC/mL
90,7
57,0
L. casei 106 UFC/mL
107,4
111,3
bLBCM680-2 106 UFC/mL
138,0
94,4
bLBCM680-3 106 UFC/mL
117,4
108,2
Controle
L. plantarum 106 UFC/mL
B. coagulans 105 UFC/mL
50
Resultados e Discussão
Figura 13 - Avaliação da presença das bactérias selecionadas com relação aos parâmetros fermentativos.
(a) pH, (b) consumo de sacarose e (c) viabilidade de levedura.
51
Resultados e Discussão
Figura 14 - Avaliação da viabilidade das bactérias selecionadas nos tempos 0, 24 e 48h da fermentação
mista.
Tabela 12 - Viabilidade das diferentes bactérias (%) quando inoculadas na concentração de10 5 e 106
UFC/mL ao longo da fermentação, quando comparadas ao tempo 0h.
Cepa
24h
48h
B. coagulans 105 UFC/mL
11,2
4,7
bLBCM680-2 105 UFC/mL
135,7
61,7
bLBCM680-3 105 UFC/mL
516,6
479,1
L. casei 105 UFC/mL
90,2
27,0
L. casei 106 UFC/mL
82,4
59,1
bLBCm680-2 106 UFC/mL
91,6
89,8
bLBCM680-3 106 UFC/mL
65,4
42,4
52
Resultados e Discussão
5.3.6 Dosagem de lactato de etila e ácido lático.
Os sobrenadantes das fermentações nos tempos de 8, 24 e 48h foram extraídos com
o solvente acetato de etila para a análise de ácido lático e lactato de etila. Esperava-se que a
levedura S. cerevisiae não produzisse lactato de etila, pois como não possui a enzima
lactato desidrogenase (apenas a enzima mitocondrial, envolvida no balanço redox) o
lactato de etila não é produto de sua fermentação (ver Anexo 1). Porém este éster foi
também detectado no experimento controle (fermentação contendo apenas leveduras).
Como lactato de etila não foi detectado como sendo um dos componentes do meio de
cultura é possível que sua presença no mosto fermentado seja devido à existência de outros
compostos metabolizáveis a lactato de etila, e não como produto de fermentação.
Foram observadas variações no teor de lactato de etila presente nos controles
realizados nos diferentes dias. É possível que tal diferença decorra da variação da
quantidade de leveduras adicionadas em cada um deles. Na tentativa de eliminar este
interferente, o teor de lactato de etila presente nas amostras de fermentação mista foi
subtraído da quantidade deste éster detectada no experimento controle de cada dia. Isto
porque, para um mesmo dia, as células de leveduras adicionadas partiram de um mesmo
inóculo, logo, espera-se que a quantidade de células adicionadas, assim como sua
viabilidade e atividade metabólica seja a mesma ou muito próxima. Deste modo, os valores
de lactato de etila plotados em gráfico são referentes ao teor efetivamente produzido
devido à presença das bactérias láticas no meio (Figura 15a e Figura 15b).
Foi constatado o desempenho superior com relação ao aparecimento do éster lactato
de etila no mosto fermentado das cepas de bactérias isoladas de dorna de produção de
cachaça e, principalmente, da cepa de L. casei utilizada industrialmente. Logo, o teor de
lactato de etila no mosto está relacionado ao tipo de bactéria lática e parece estar também
associado à quantidade de bactérias presentes no meio, pois concentrações maiores de uma
mesma cepa de bactéria resultam em teores mais elevados de lactato de etila no mosto
fermentado.
Com relação aos teores de ácido lático, as dosagens foram realizadas por
HPLC/UV-Vis, porém ácido lático não foi encontrado, exceto nas seguintes amostras de L.
casei: 105 UFC/mL no tempo de 8h; 10 6 UFC/mL no tempo de 24h e no ciclo 3 do
experimento com reciclo de células (este último descrito na próxima seção). Nestas
53
Resultados e Discussão
amostras os teores encontrados foram de 136,79 ppm; 56,55 ppm e 59,79 ppm
respectivamente.
A curva padrão foi construída no intervalo de 10 a 400 ppm, porém, ao contrário do
que foi feito para a construção da curva de calibração de lactato de etila, os padrões foram
diretamente adicionados ao solvente orgânico, e não à matriz de mosto fermentado para
serem então extraídos pelo solvente (ver Anexos 2 e 3). Portanto, a não detecção deste
composto pode ser devido à baixa recuperação de ácido lático pelo acetato de etila, apesar
deste ter sido o melhor solvente testado. Logo, ácido lático pode estar presente nas
amostras, mas não ter sido recuperado em concentração suficiente para ser detectado. É
também possível, que o método de detecção não seja o mais adequado. GOMES, (2009)
utiliza metodologia muito semelhante para a dosagem de ácido lático, porém, a detecção é
realizada por detector de índice, e não detector UV-Visível. Deve-se também considerar a
possibilidade do ácido lático produzido pelas bactérias já ter sido captado pelas leveduras e
esterificado a lactato de etila nos momentos das coletas.
54
Resultados e Discussão
Figura 15 - Dosagens de lactato de etila em amostras de mosto fermentado extraídas com acetato de
etila. (a) dosagem do lactato de etila total presente em um grupo de análise, (b) teores de lactato de etila
referentes à presença de bactérias no mesmo grupo de análise anterior, (c) teores de lactato de etila
referentes à presença de bactérias em todas as amostras testadas. Um grupo de análise é constituído por
controle e amostras de fermentação realizados em um mesmo dia a partir de um mesmo pré-inóculo de
leveduras.
55
Resultados e Discussão
5.3.7 Fermentações mistas utilizando-se reciclos de células.
Sabe-se que na produção de cachaça é comum o reaproveitamento do pé-de-cuba
em um processo conhecido como batelada alimentada, descrito na introdução do presente
trabalho. Portanto, é desejável que a proporção de células de leveduras e bactérias se
mantenha estável ao longo dos ciclos fermentativos. A manutenção da proporção é
importante para que se obtenha a padronização do produto final, ou seja, que suas
características sensoriais se mantenham ao longo do processo.
Tal manutenção pode ser difícil de ser alcançada, pois é possível que, as bactérias
devido ao seu tempo de geração mais curto que o das leveduras se multipliquem
rapidamente, alcançando teores elevados. Tal fato, como já mencionado, além de
proporcionar teores muito elevados de acidez na cachaça, fato sensorialmente indesejado,
pode comprometer excessivamente o rendimento alcoólico da fermentação pelo consumo
de açúcares, e em casos mais extremos, comprometer a viabilidade das leveduras devido à
acidez do meio. Porém, a fermentação pode causar uma ação antibacteriana, pela ação
sinérgica de ácidos orgânicos, especialmente ácido succínico e etanol, além da rápida
assimilação de substrato (OLIVA NETO, 1995; SOUSA, 2005; GOMES, 2009).
Para a realização deste teste foram descartadas as cepas bacterianas L. fermentum,
B. stearothermophilus e B. coagulans por não sobreviverem mesmo quando inoculadas na
concentração de 106 UFC/mL e/ou reduzirem a viabilidade das leveduras como
demonstrado nos experimentos anteriores. Foi escolhida a concentração inicial de bactérias
de 106 UFC/mL já que apresentam maior produção de lactato de etila.
O pH, o Brix e a contagem de células foi realizada ao final de cada ciclo
fermentativo. Pode-se observar a presença das bactérias não afetou o pH final da
fermentação quando comparada ao controle segundo o teste de Kruskal-Wallis (Figura
16a). Segundo este mesmo teste, não há diferença entre controle e L. casei com relação ao
Brix final da fermentação, porém bLBCM680-2 e bLBCM680-3 foram capazes de alterar o
Brix residual ao longo dos ciclos (Figura 16b). Assim, é possível que apenas a cepa
bLBCM680-3 tenha provocado redução do teor de etanol produzido.
A presença de todas as bactérias testadas parece contribuir para a viabilidade das
leveduras ao longo dos 10 ciclos fermentativos. Em todos os ciclos, a porcentagem de
leveduras presente quando comparadas aos seus respectivos ciclo 1 é igual ou superior à
56
Resultados e Discussão
porcentagem apresentada pelo controle. Logo estas cepas não foram capazes de prejudicar
o processo fermentativo mesmo quando utilizado o processo de reciclo de células, ao longo
de 10 ciclos (Tabela 13 e Figura 16c).
Importante ressaltar que tanto as contagens de bactérias quanto de leveduras, foram
realizadas ao final de cada ciclo e inicio do próximo para a avaliação de possível perda
devido à centrifugação. Não foram constatadas diferenças entre as duas medições (dados
não representados), não evidenciando erros inerentes ao processo. Foram representados em
gráfico apenas os valores referentes ao final de cada ciclo fermentativo.
Tabela 13 - Viabilidade de leveduras (%) ao longo de 10 ciclos fermentativos, frente a diferentes bactérias
6
na concentração de 10 UFC/mL, quando comparadas à quantidade de células adicionadas no ciclo 1.
Tempo
Controle
Lactobacillus
Casei
bLBCM680-2
bLBCM680-3
2
115,1
98,0
138,7
169,1
3
112,8
117,7
144,3
144,7
4
121,9
125,5
146,4
174,4
5
100,2
153,0
111,0
140,3
6
133,6
162,0
141, 4
193,3
7
133,5
165,3
111,4
149,4
8
59,4
143,4
63, 8
81,6
9
66,5
150,3
110,7
95,5
10
82,5
174,1
79,8
98,3
57
Resultados e Discussão
Figura 16 - Avaliação da interferência das bactérias láticas L. casei, bLBCM680-2 e bLBCM680-3 com
relação aos parâmetros fermentativos ao longo de 10 ciclos fermentativos. (a) pH, (b) consumo de
sacarose e (c) viabilidade de leveduras. As medidas foram realizadas ao final de cada ciclo fermentativo
(24h).
58
Resultados e Discussão
As três cepas testadas só mantiveram a contagem de bactérias inicial ao longo dos 3
primeiros ciclos. No 4º ciclo, as contagens de bactérias para L. casei, bLBCM680-2 e
bLBCM680-3 foram respectivamente 29, 36 e 17% da quantidade de bactérias inoculadas
no tempo 0h do primeiro ciclo fermentativo. No 10º e último ciclo testado, as contagens de
bactérias foram menores do que 0,5% da quantidade inoculada no ciclo 1 para todas as
cepas testadas. (Tabela 14 e Figura 17a). Como a viabilidade das bactérias só se manteve
durante os três primeiros ciclos, era já era de se esperar que a produção de lactato de etila
também sofresse uma forte queda, o que de fato ocorreu ( Figura 18b e Tabela 15).
Na Figura 18b, estão representados os teores de lactato referente apenas à presença
da bactéria, isto é, o incremento do éster lactato de etila possivelmente devido à produção
de ácido lático pelas bactérias. Para isto, os valores de lactato de etila de cada ciclo foram
subtraídos dos valores obtidos para o controle no mesmo ciclo.
A bactéria bLBCM680-2 manteve a produção de lactato de etila até o ciclo 7, sendo
que nos ciclos 2, 3 e 4 a produção foi ainda maior que no ciclo 1 (aumento de 100, 180 e
50% respectivamente quando comparadas ao ciclo1). Já nos ciclos finais (8, 9 e 10), a
produção caiu pela metade quando comparada ao primeiro ciclo. A bactéria bLBCM680-3
apresenta oscilações no teor do éster ao longo dos ciclos. No ciclo 10, a redução do teor de
lactato quando comparada ao primeiro ciclo foi de 63%. A bactéria L. casei só manteve o
teor de lactato no segundo ciclo. No terceiro ciclo o teor foi de apenas 26% quando
comparado ao ciclo 1; o ciclo 9 foi de 8% e o último ciclo apenas 3% do teor obtido no
ciclo 1. (Tabela 15)
Vale ressaltar que o lactato de etila é o objeto de interesse neste trabalho, e não o
ácido lático, já que é o éster que contribui para a qualidade sensorial da bebida devido ao
seu caráter frutado. Assim, a variação de seu teor é de grande importância para este
trabalho. Porém, é importante lembrar que sua variação também pode estar relacionada à
variação da capacidade da levedura em metabolizar o ácido lático à lactato de etila, e não
somente às variações do teor de ácido lático, este sim, diretamente ligado à presença,
quantidade, viabilidade e tipo de bactéria presente.
59
Resultados e Discussão
Figura 17 - Desempenho das bactérias láticas L. casei, bLBCM680-2 e bLBCM680-3 no reciclo fermentativo
com relação a (a) sobrevivência bacteriana e (b) teores de lactato de etila. As medidas foram realizadas ao
final de cada ciclo fermentativo (24h).
60
Resultados e Discussão
Tabela 14 - Viabilidade das diferentes bactérias (%) quando inoculadas na concentração de 10 6 UFC/mL
ao longo de 10 ciclos fermentativos, quando comparadas à quantidade de células adicionadas no ciclo1.
Ciclo
Lactobacillus
Casei
bLBCM680-2
bLBCM680-3
2
342,2
127,6
103,6
3
142,0
74,3
82,2
4
29,3
35, 7
16, 8
5
36,4
55,5
25,3
6
8,8
45,0
9,9
7
5,7
2,0
2,9
8
2,8
2,0
1,7
9
1,8
1,1
0,7
10
0,2
0,5
0,4
61
Resultados e Discussão
Tabela 15 – Porcentagem de produção de lactato de etila em relação às quantidades produzidas no ciclo 1
6
pelas diferentes bactérias quando inoculadas na concentração de 10 UFC/mL .
Ciclo
Lactobacillus
Casei
bLBCM680-2
bLBCM680-3
2
95,5
203,9
177,8
3
10,1
276,3
55,9
4
26,1
146,4
88,9
5
30,3
105,9
38,7
6
14,7
124,4
55,3
7
20,1
93,1
81,1
8
12,5
50,3
104,4
9
8,4
39,3
49,9
10
3,1
51,4
37,4
62
Considerações Adicionais
6. CONSIDERAÇÕES ADICIONAIS
A metodologia de padronização das suspensões de micro-organismos se mostrou
adequada para a adição de células de leveduras e bactérias nas quantidades desejadas para
o processo de fermentação.
Dentre os solventes testados, acetato de etila foi o mais adequado para a extração de
lactato de etila e ácido lático. A metodologia cromatográfica (GC-MS) se mostrou
adequada para a dosagem de lactato de etila em amostras de mosto fermentado, e permite
ainda a detecção de outros compostos voláteis importantes para as características sensoriais
da cachaça, mas que não foram foco deste trabalho.
Algumas cepas apresentaram problemas na viabilidade, como por exemplo, o B.
coagulans. Foi observado em alguns experimentos que a contagem de células viáveis em
placas não correspondeu ao esperado, e anteriormente obtido, pela inoculação de volume
adequado da suspensão padronizada. É possível que a reativação em apenas 1 passagem
pelo caldo MRS de cepas mantidas congeladas a -80°C não seja o suficiente para garantir a
completa reativação das cepas. Uma reativação com mais passagens pelo caldo MRS,
como sugerem alguns autores, pode garantir este fato assim como minimizar a
variabilidade dos teores de lactato produzidos nos experimentos realizados em diferentes
dias.
É necessária a realização de mais experimentos de fermentação mista com o L.
casei, pois os resultados aqui expressos são preliminares (sem replicatas).
As amostras de sobrenadantes dos tempos 0, 2, 4, 6, 8, 24 e 48h das fermentações
sem reciclo de células e as amostras do final de cada ciclo fermentativo estão armazenadas
para dosagens futuras. Estas dosagens serão importantes para a seleção da melhor cepa em
sua melhor concentração e condição ideal de fermentação (duração do ciclo fermentativo, e
número de ciclos em que pode ser usada) para incremento da produção de voláteis e com
baixa redução do rendimento alcoólico.
63
Conclusões
7. CONCLUSÕES
Nenhuma das cepas utilizadas neste trabalho foi capaz de reduzir a viabilidade da
cepa de S. cerevisiae, LBCM606c, nas condições testadas. Não foram constatadas
diferenças quanto ao consumo de sacarose e da viabilidade de células, verificada por
contagem em placa, também não houve acidificação adicional do meio causada pela
presença das bactérias.
As cepas utilizadas como controle industrial (L. casei) e isoladas de dorna
(bLBCM680-2 e bLBCM680-3) apresentaram desempenho superior às linhagens
laboratoriais das cepas descritas como contaminantes comuns da fermentação alcoólica,
apresentando maior sobrevivência e possibilitando aparecimento de teores mais elevados
de lactato de etila no mosto fermentado.
L. casei foi a cepa com maior produção de lactato de etila, porém no experimento
utilizando reciclo de células, apresenta rápida queda de viabilidade e dos teores de lactato
produzidos.
Por possuir uma produção de lactato de etila mais estável ao longo dos ciclos, a
bactéria bLBCM680-2, é uma boa candidata para a utilização de fermentações mistas em
dornas de produção de cachaça. Porém é possível que a quantidade de células inoculadas
não seja a ideal. Outras concentrações devem também ser testadas.
64
8. PERSPECTIVAS
Do mesmo modo que as leveduras isoladas de dorna passam por teste de seleção
das melhores cepas para serem utilizadas na produção de cachaça, é interessante que um
teste seja utilizado também para seleção de bactérias láticas isoladas de dornas e adaptadas
às condições utilizadas. Para isto, a produção de ácido lático e a manutenção da dinâmica
populacional leveduras/bactérias devem ser consideradas.
As diferenças observadas quanto aos teores de lactato de etila não necessariamente
serão perceptíveis ao paladar/olfato humano, logo, testes sensoriais com provadores
treinados devem ainda ser realizados.
65
REFERÊNCIAS BIBLIOGRÁFICAS
BOSCOLO, M., BEZERRA, C.W.B., CARDOSO, D.R., LIMA NETO, B.S. e FRANCO, D.W.
Identification and dosage by HRGC of minor alcohols and esters in Brazilian sugar-cane spirit.
Journal of the Brazilian Chemical Society, v.11, p.86-90. 2000.
BOZA, Y. e HORII, J. Distillation influence on the composition and sensorial quality of sugar cane
distilled beverage. Ciênc. Tecnol. Aliment. [online]. 1998, vol.18, n.4, pp. 391-396., v.18, n.4,
p.391-396. 1998.
BRASIL. Instrução Normativa N° 13, de 29 de Junho de 2005. Regulamento Técnico para fixação
dos padrões de identidade e qualidade para aguardente de cana e para cachaça. Brasília: Diário
Oficial da União. Seção 1: 3-5 p. 2005.
BRITO, N.M., AMARANTE JUNIOR, O.P., POLESE, L. e RIBEIRO, M.L. VALIDAÇÃO DE
MÉTODOS ANALÍTICOS: ESTRATÉGIA E DISCUSSÃO. Revista de Ecotoxicologia e Meio
Ambiente, v.13, jan./dez., p.129-146. 2003.
CARVALHO-NETTO, O.V.D., ROSA, D.D. e CAMARGO, L.E.A. Identificarion of contaminant
bacteria in cachaça yeast by 16s rDNA gene sequencing. Scientia Agricola, v.65, p.508-515. 2008.
CHERUBIN, R.A. Efeitos da viabilidade da levedura e da contaminação bacteriana na fermentação
alcoólica. Microbiologia Agrícola, Escola Superior de Agricultura Luiz de Queiroz (ESALQ),
Piracicaba, 2003.
FLEET, G.H. Yeast interactions and wine flavour. International Journal of Food Microbiology,
v.86, n.1-2, p.11-22. 2003.
FLEET, G.H., LAFON-LAFOURCADE, S. e RIBEREAU-GAYON, D.P. Evolution of Yeasts and
Lactic Acid Bacteria During Fermentation and Storage of Bordeaux Wines. Applied and
Environmental Microbiology, v.48, n.5, p.1034-1038. 1984.
GOMES, F.S. Antagonismo entre leveduras e bactérias láticas na fermentação alcoólica. Ciência e
Tecnologia de Alimentos, Escola Superior de Agricultura Luiz de Queiroz (ESALQ), Piracicaba,
2009.
GOMES, W.O. O perfil da cachaça. Biblioteca Digital SEBRAE-BDS: SEBRAE 2004.
KANDLER, O. Carbohydrate metabolism in lactic acid bacteria. Antonie Van Leeuwenhoek, v.49,
n.3, Sep, p.209-24. 1983.
LAMBRECHTS, M.G. e PRETORIUS, I.S. Yeast and its Importance to Wine Aroma - A Review.
S.Afri.J.Enol.Vitic, v.21, p.97-129. 2000.
LIU, S.Q. A review: malolactic fermentation in wine -- beyond deacidification. In: (Ed.). J Appl
Microbiol. England, v.92, 2002. A review: malolactic fermentation in wine -- beyond
deacidification, p.589-601
LONVAUD-FUNEL, A. Microbiology of the malolactic fermentation: Molecular aspects. FEMS
Microbiology Letters, v.126, n.3, 1995/3/1/, p.209-214. 1995.
66
LONVAUD-FUNEL, A. Lactic acid bacteria in the quality improvement and depreciation of wine.
Antonie Van Leeuwenhoek International Journal of General and Molecular Microbiology, NOV
1999, p.317-331. 1999.
LUDWIG, K.M., OLIVA-NETO, P. e ANGELIS, D.F.D. Quantificação da floculação de
Saccharomyces cerevisiae por bactérias contaminantes da fermentação alcoólica. Ciência e
Tecnologia de Alimentos, v.21, p.63-66. 2001.
MAICAS, S., GIL, J., PARDO, I. e FERRER, S. Improvement of volatile composition of wines by
controlled addition of malolactic bacteria. Food Research International, 1999, p.491-496. 1999.
MAIORELLA, B., BLANCH, H. e WILKE, C. By-product inhibition effects on ethanolic
fermentation by Saccharomyces cerevisiae. Biotechnology and Bioengineering, 1983, p.103-121.
1983.
MAMEDE, M. e PASTORE, G. Study of methods for the extraction of volatile compounds from
fermented grape must
DOI 10.1016/j.foodchem.2005.03.013. Food Chemistry, JUN 2006, p.586-590. 2006.
MESQUITA, P.D.L. Caracterização de produtos microbianos solúveis (SMPs) em reatores aeróbio
e anaeróbio de bancada em diferentes condições operacionais. Universidade Federal de Ouro Preto,
Ouro Preto, 2009.
NARENDRANATH, N., HYNES, S., THOMAS, K. e INGLEDEW, W. Effects of lactobacilli on
yeast-catalyzed ethanol fermentations. Applied and Environmental Microbiology, NOV 1997,
p.4158-4163. 1997.
NASCIMENTO, E.S.P.D. Ésteres em aguardente de cana: seu perfil. Química Analítica, Instituto
de Química de São Carlos (IQSC), São Carlos, 2007.
NIELSEN, J. e RICHELIEU, M. Control of flavor development in wine during and after malolactic
fermentation by Oenococcus oeni. Applied and Environmental Microbiology, FEB 1999, p.740745. 1999.
NOBRE, T.D.P. Viabilidade celular de Saccharomyces cerevisiae cultivada em associação com
bactérias contaminantes da fermentação alcoólica. (Mestrado). Ciência e Tecnologia de Alimentos,
Escola Superior de Agricultura Luiz de Queiroz (ESALQ), Piracicaba, 2005.
NÓBREGA, I.C.D.C. Análise dos compostos voláteis da aguardente de cana por concentração
dinâmica do "headspace" e cromatografia gasosa-espectrometria de massas. Ciência e Tecnologia
de Alimentos, v.23, p.210-216. 2003.
NONATO, E., CARAZZA, F., SILVA, F., CARVALHO, C. e CARDEAL, Z. A headspace solidphase microextraction method for the determination of some secondary compounds of Brazilian
sugar cane spirits by gas chromatography. Journal of Agricultural and Food Chemistry, AUG 2001,
p.3533-3539. 2001.
OLIVA NETO, P.D. Estudo de diferentes fatores que influenciam o crescimento da população
bacteriana contaminante da fermentação alcoolica por leveduras. (Tese). Departamento de Ciência
de Alimentos (DCA) - Faculdade de Engenharia de Alimentos, Universidade Estadual de
Campinas, Campinas, 1995.
OLIVA-NETO, P.D. e YOKOYA, F. Evaluation of bacterial-contamination in a fed-batch
alcoholic fermentation process. World Journal of Microbiology & Biotechnology, NOV 1994,
p.697-699. 1994.
67
OLIVEIRA, E.D.S. Caracteristicas fermentativas, formação de compostos volateis e qualidade da
aguardente de cana obtida por linhagens de leveduras isoladas de destilarias artesanais.
Universidade Estadual de Campinas, Campinas, SP, 2001.
OLIVEIRA, M.N.D., SIVIERI, K., ALEGRO, J.H.A. e SAAD, S.M.I. Aspectos tecnológicos de
alimentos funcionais contendo probióticos. Revista Brasileira de Ciências Farmacêuticas, v.38, p.121. 2002.
OLIVEIRA-FREGUGLIA, R.M. e HORII, J. Viabilidade celular de Saccharomyces cerevisiae em
cultura mista com Lactobacillus fermentum. Scientia Agricola, v.55, p.520-527. 1998.
PEREIRA, A.J.G. Purificação do acido latico atraves de extração liquido-liquido. (Doutorado).
Faculdade de Eng. Alimentos, Universidade Estadual de Campinas, Campinas, 1991.
POZO-BAYON, M., ALEGRIA, E., POLO, M., TENORIO, C., MARTIN-ALVAREZ, P., DE LA
BANDA, M., RUIZ-LARREA, F. e MORENO-ARRIBAS, M. Wine volatile and amino acid
composition after malolactic fermentation: Effect of Oenococcus oeni and Lactobacillus plantarum
starter cultures
DOI 10.1021/jf050739y. Journal of Agricultural and Food Chemistry, NOV 2 2005, p.8729-8735.
2005.
REGODON, J., PEREZ, F., VALDES, M., DEMIGUEL, C. e RAMIREZ, M. A simple and
effective procedure for selection of wine yeast strains. Food Microbiology, JUN 1997, p.247-254.
1997.
RIBANI, M., BOTTOLI, C.B.G., COLLINS, C.H., JARDIM, I.C.S.F. e MELO, L.F.C. Validação
em métodos cromatográficos e eletroforéticos. Química Nova, v.27, p.771-780. 2004.
RUIZ, P., IZQUIERDO, P., SESENA, S. e PALOP, M. Analysis of lactic acid bacteria populations
during spontaneous malolactic fermentation of Tempranillo wines at five wineries during two
consecutive vintages
DOI 10.1016/j.foodcont.2009.04.002. Food Control, JAN 2010, p.70-75. 2010.
SANADA, C.T.M. Produção de alfa-galactosidase a partir de vinhaça de soja. Universidade
Federal do Paraná, Curitiba, 2009.
SCHWAN, R.F., MENDONCA, A.T., DA SILVA JR, J.J., RODRIGUES, V. e WHEALS, A.E.
Microbiology and physiology of Cachaca (Aguardente) fermentations. Antonie Van Leeuwenhoek,
v.79, n.1, Jan, p.89-96. 2001.
SEBRAE. Diagnóstico da cachaça de Minas Gerais. Belo Horizonte: 241 p. 2001.
SEBRAE/NA. Estudo de viabilidade econômica: simulação da produção de 60 mil litros de
cachaça / safra. Biblioteca online SEBRAE: 70 p. 2005.
SEBRAE/NA. Cachaça artesanal: estudos de mercado SEBRAE, ESPM 2008: relatório completo:
Série Mercado: 152 p. 2008.
SILVA, P.H.A.D., SANTOS, J.D.O., ARAÚJO, L.D., FARIA, F.C., PEREIRA, A.F., OLIVEIRA,
V.A.D., VICENTE, M.D.A. e BRANDÃO, R.L. Avaliação cromatográfica de compostos voláteis
de cachaças produzidas com leveduras de diferentes procedências. Ciência e Tecnologia de
Alimentos, v.29, n.1, p.100-106. 2009.
68
SOUSA, M.V.F. Interação de Saccharomyces cerevisiae e Lactobacillus fermentum na produção de
cachaça artesanal. Ciência e Tecnologia de Alimentos, Universidade Federal de Lavras, Lavras,
2005.
THOMAS, K., HYNES, S. e INGLEDEW, W. Effect of lactobacilli on yeast growth, viability and
batch and semi-continuous alcoholic fermentation of corn mash. Journal of Applied Microbiology,
MAY 2001, p.819-828. 2001.
VAILIANT, H., FORMISYN, P. e GERBAUX, V. Malolactic fermentation of wine: study of the
influence of some physico-chemical factors by experimental design assays. Journal of Applied
Microbiology, v.79, n.6, p.640-650. 1995.
VERDI, A. Dinâmicas e perspectivas do mercado da cachaça. Informações Econômicas, São Paulo,
v.36, n.2, p.93-98. 2006.
VICENTE, M.D.A. Caracterização Molecular e Bioquímica de Cepas de Saccharomyces cerevisiae
Utilizadas na Fabricação de Cachaça de Alambique. NUPEB, UFOP, Ouro Preto, 2007.
VICENTE, M.D.A., COUTRIM, M.X., FIETTO, L.G., CASTRO, I.D.M. e BRANDÃO, R.L.
Methodology for the isolation of Saccharomyces cerevisiae strains with more adequate
characteristics to the production of „„cachaça‟‟. Brasil 2003.
VICENTE, M.D.A., FIETTO, L.G., DE MIRANDA CASTRO, I., GONÇALVES DOS SANTOS,
A.N., COUTRIM, M.X. e BRANDÃO, R.L. Isolation of Saccharomyces cerevisiae strains
producing higher levels of flavoring compounds for production of "cachaça" the Brazilian
sugarcane spirit. International Journal of Food Microbiology, v.108, n.1, 2006/4/15/, p.51-59. 2006.
VILANOVA, M. e SIEIRO, C. Contribution by Saccharomyces cerevisiae yeast to fermentative
flavour compounds in wines from cv. Albarino. J Ind Microbiol Biotechnol, v.33, n.11, Nov,
p.929-33. 2006.
69
ANEXO 1 - Resultado da busca no banco de dados SGD por lactate
dehydrogenase
Molecular Function
GO terms
GO synonyms
(R)-4hydroxyphenyllactate
dehydrogenase
activity
(R)-aromatic lactate dehydrogenase activity ;
(R)-3-(4-hydroxyphenyl)lactate:NAD(P)+ 2-oxidoreductase
activity ;
D-hydrogenase, D-aryllactate
3-(imidazol-5yl)lactate
dehydrogenase
activity
(S)-3-(imidazol-5-yl)lactate:NAD(P)+ oxidoreductase
activity ;
imidazol-5-yl lactate dehydrogenase activity
L-lactate
dehydrogenase
(cytochrome) activity
lactic acid dehydrogenase activity ;
cytochrome b2 ;
L-lactate ferricytochrome c oxidoreductase activity ;
(S)-lactate:ferricytochrome-c 2-oxidoreductase activity ;
cytochrome b2 (flavin-free derivative of flavocytochrome b2)
;
dehydrogenase, lactate (cytochrome) ;
flavocytochrome b2 ;
L(+)-lactate:cytochrome c oxidoreductase activity ;
L-lactate cytochrome c oxidoreductase activity ;
L-lactate cytochrome c reductase activity ;
lactate dehydrogenase (cytochrome) ;
lactic cytochrome c reductase activity
Associate
d Gene(s)
CYB2
lactate
dehydrogenase
activity
Tabela 16 - Resultado da busca no banco de dados Saccharomyces Genome Database por lactate
dehydrogenase.
http://www.yeastgenome.org/
70
ANEXO 2 – Validação do método de dosagem de lactato de etila
Linearidade
“A linearidade corresponde à capacidade do método em fornecer resultados
diretamente proporcionais à concentração da substância em exame, dentro de uma
determinada faixa de aplicação.” (RIBANI et al., 2004)
“É a resposta obtida em função da concentração do analito, a qual deve ser
estudada em um intervalo de concentração apropriado. Na prática, a linearidade é
determinada por intermédio de gráficos de calibração, seguidos de um tratamento
estatístico, o qual deve envolver, no mínimo, a equação da função, a análise da regressão e
dados de correlação.” (LANÇAS, 2004 apud (MESQUITA, 2009).
Para a determinação da linearidade, foram injetados 7 concentrações de padrão para
cada um dos compostos de interesse: lactato de etila (0,03; 0,150; 0,300; 0,750; 1,500;
3,000 e 7,500 mg/L).
Area(x1,000,000)
7
7.5
5.0
6
2.5
5
4
23
0.01
0.0
2.5
5.0
Conc.
Figura 18 – Curva de calibração de lactato de etila obtida. Curva obtida pela extração por acetato de etila
de amostras de mosto fermentado pela S. cerevisiae LBCM606c adicionadas de 0,030; 0,150; 0,300; 0,750;
1,500; 3,000 e 7,500 mg/L de padrão de lactato de etila. Análises realizadas em GC-MS. Gráfico gerado pelo
programa GCMSsolutions.
71
A curva de calibração foi realizada adicionando-se padrão de lactato de etila a um
pool de sobrenadante da fermentação controle (realizada apenas com leveduras). Esperavase que esta matriz fosse isenta do analito, o que não ocorreu. Preparou-se em balões
volumétricos soluções nas concentrações de 0,03; 0,15; 0,30; 0,75 e 1,50 ppm de lactato de
etila. tais soluções foram então extraídas com acetato de etila, utilizando-se o mesmo
protocolo estabelecido para as amostras. Os extratos orgânicos foram então injetados no
cromatógrafo (GC-MS). Para a construção da curva de calibração, os valores de área
obtidos foram subtraídos do valor de área encontrado para a matriz sem adição do padrão.
Deste modo, a curva obtida é referente aos teores de lactato presente no mosto, e não no
extrato orgânico. Sendo assim, não há a necessidade de correção dos valores pela
eficiência de extração do solvente.
Figura 19 – Linearidade e análise de regressão obtidos para o lactato de etila.
Precisão
“A repetibilidade expressa a fidelidade ao resultado quando as condições são mantidas
constantes, com o mesmo analista, reagentes, equipamentos e instrumentos, e aplicadas em
um curto intervalo de tempo. Usualmente, refere-se ao desvio padrão de replicatas.”
AOAC
72
Para a análise da precisão da metodologia de extração, foram realizadas 7 extrações de
uma mesma matriz.
Tabela 17 - Valores aceitáveis de desvio padrão relativo (DPR) em função da concentração do analito.
Concentração
DPR
100%
1%
10%
1,5%
1%
2%
0,1%
3%
0,01%
4%
10ppm
6%
1ppm
8%
10ppb
15%
Precisão do método de extração
1- Matriz isenta de adição de padrão
Tabela 18 - Dados de concentração de lactato de etila para a matriz isenta de padrão de lactato de etila
para avaliação da precisão do método de extração.
Replicata
Lactato de Etila
1
0,9083
2
0,8602
3
0,8471
4
0,8763
5
0,9203
6
0,8490
7
0,8524
DP
0,02980
Média
0,8734
CV
3.41%
*Valores calculados pelo programa GraphPad Prisma (ANOVA)
73
2- Matriz adicionada de padrão
Tabela 19 - Dados de concentração de lactato de etila para a matriz adicionada de 7,0 ppm de padrão de
lactato de etila para avaliação da precisão do método de extração.
Replicata
Lactato de Etila
1
7,509827
2
7,05842
3
7,09929
4
7,12944
5
6,998766
6
7,333383
7
7,114705
DP
0,1795
Média
7,178
CV
2.50%
Exatidão (Fortificação)
Segundo o INMETRO, a exatidão refere-se ao grau de concordância entre o
resultado de uma medição e um valor verdadeiro do analito. Exatidão em procedimentos
analíticos refere-se à concordância entre o valor real (valor de referencia) da concentração
de um analito em uma amostra e o estimado pelo processo analítico. Uma baixa exatidão
resulta em erros sistemáticos que contribuem para desvios ou tendências (bias) nos
resultados.
A exatidão representa o grau de concordância entre os resultados individuais
encontrados em um determinado ensaio e um valor de referencia aceito como verdadeiro.
Valor obtido: 7,178 – 0,8734 = 6,3046
Valor real: 7,0 ppm (0,007%)
Matriz isenta de adição de padrão: 0,8734 ppm (0,000087%)
Podemos observar que as amostras se encontram dentro do intervalo de recuperação
aceito para a sua concentração, segundo a Tabela 11.
74
Tabela 20 – Recuperação do analito em função da concentração
Concentração do analito (%) Intervalo de Recuperação Aceito (%)
> 10 %
98 - 102
>1%
97 - 103
> 0,1 %
95 – 105
> 0,01 %
90 – 107
> 0,001 - > 0,00001 %
80 - 110
> 0,000001 %
60 – 115
> 0,0000001 %
40 - 120
Fonte: (BRITO et al., 2003)
Precisão de injeção / Controle de injeção
É aceitável um limite de variação de 1 a 2% para alturas ou áreas de pico em
resposta a repetidas injeções do analito. Tais controles são eficientes para verificar a
estabilidade do aparelho. (AOAC)
Tabela 21 - Dados de concentração de lactato de etila de uma mesma amostra injetada 7 vezes.
Replicata
Lactato de Etila
1
0,3817
2
0,3881
3
0,3935
4
0,3955
5
0,3966
6
0,3980
7
0,3819
DP
0,02980
Média
0,8734
CV
3.41%
75
Seletividade
A seletividade é a capacidade com que um método consegue quantificar um analito
em presença de outros analitos, matriz ou materiais potencialmente interferentes. É
usualmente obtida por extração com solventes seletivos, separação de fase cromatográfica
ou outra, ou por aplicação de técnicas analito-específicas como reações bioquímicas
(enzimas, anticorpos) ou instrumental (NMR, infravermelho, espectrometria de massas).
AOAC.
A Figura 12 demonstra a seletividade do método.
76
ANEXO 3 – Dosagens de ácido lático
A curva analítica foi realizada com o padrão de ácido lático da Sigma, 85% de
pureza na faixa de concentração de 10 a 400 ppm.
Para a construção da curva de calibração, foram preparadas soluções padrão de
ácido lático em acetato de etila nas concentrações de 10; 25; 50; 100; 200 e 400 ppm. Os
padrões foram então submetidos às mesmas condições sofridas pelas amostras. Foram
coletados 1 mL de cada uma destas soluções e passados para vial de 1,5 mL, que foram
então submetidos à secagem por N2 . Depois de alcançada a secura, os padrões foram
ressuspensos em água MilliQ. Deste modo espera-se corrigir erros inerentes ao processo,
como, por exemplo, a perda de ácido lático no processo de secagem. Vale ressaltar que
ácido lático tem baixa volatilidade, por isso este processo de secagem foi possível.
Figura 20 - Linearidade e análise de regressão obtidos para o ácido lático.
77
mAU
1.75 210nm,4nm (1.00)
1.50
1.25
1.00
0.75
0.50
0.25
0.00
-0.25
0.0
5.0
10.0
15.0
20.0
25.0
30.0
35.0
min
Figura 21 – Pico do ácido lático obtido por HPLC (UV-Vis).
78