COMPOSTOS DE
COORDENAÇÃO de
Metais de Transição
1
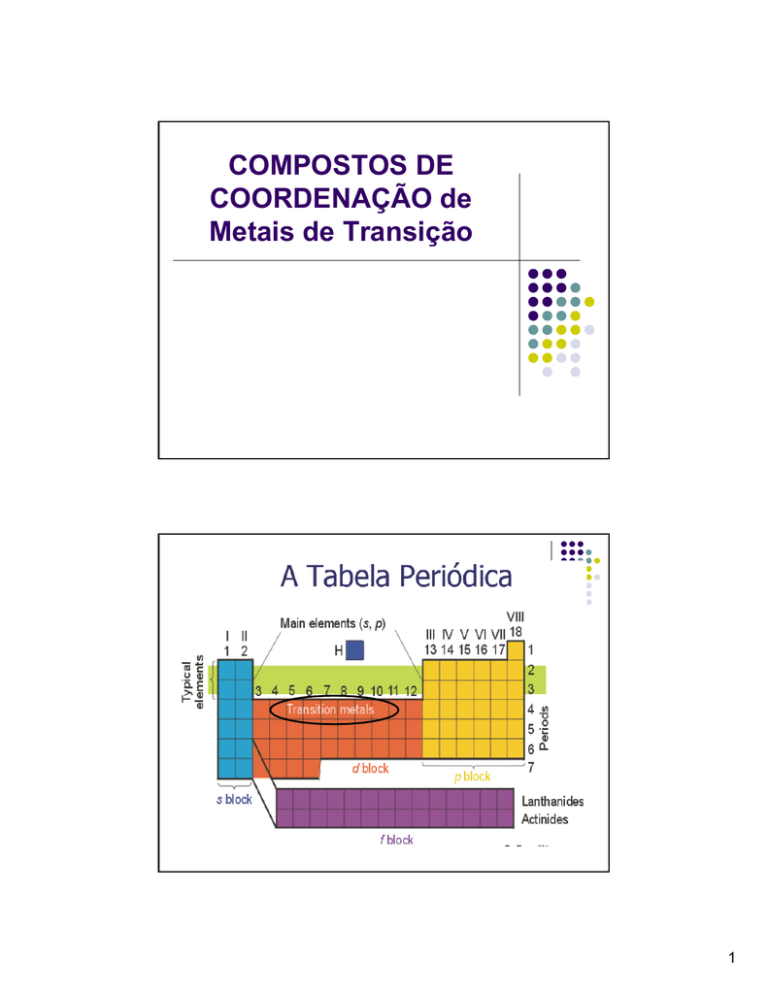
Metais de transição na
Tabela Periódica
Configuração electrónica e outras propriedades dos metais da 1ª série de transição
Sc
Ti
V
Cr
Mn
Fe
Co
Ni
Cu
M
4s23d1
4s23d2
4s23d3
4s13d5
4s23d5
4s23d6
4s23d7
4s23d8
4s13d10
M2+
-
3d2
3d3
3d4
3d5
3d6
3d7
3d8
3d9
M3+
[Ar]
3d1
3d2
3d3
3d4
3d5
3d6
3d7
3d8
Electronegatividade
1,3
1,5
1,6
1,6
1,5
1,8
1,9
1,9
1,9
1ª
631
658
650
652
717
759
760
736
745
2ª
1235
1309
1413
1591
1509
1561
1645
1751
1958
3ª
2389
2650
2828
2986
3250
2956
3231
3393
3578
M
162
147
134
130
135
126
125
124
128
M2+
-
90
88
85
80
77
75
69
72
M3+
81
77
74
64
66
60
64
-
-
Potencial de redução
padrão (V)*
-2,08
-1,63
-1,2
-0,74
-1,18
-0,44
-0,28
-0,25
0,34
Configuração electrónica
Energia de ionização
Raio atómico (pm)
* A semi-reacção para a qual foram calculados os valores é M2+(aq) + 2e- → M(s), à excepção de Sc e Cr, para os quais a reacção
considerada é M3+(aq) + 3e- → M(s).
2
Estados de Oxidação de
Metais de Transição
1ª série de transição
Sc
Ti
V
Cr
Mn
Fe
Co
Ni
Cu
Zn
3
3,4
2, 3,
4, 5
2, 3,
4, 6
2, 3,
4, 6,
7
2, 3
2, 3
2
1, 2
2
Y
Zr
Nb
Mo
Tc
Ru
Rh
Pd
Ag
Cd
3
4
3,4, 5
2,3,4,
5, 6
2,3,4,
5,6,7
2,3,4,
5,6,7,
8
1, 3
2, 4
1
2
La
Hf
Ta
W
Re
Os
Ir
Pt
Au
Hg
4
3, 4,
5
2,3,4,
2,3,4,
3,4,5,
1, 3
2, 4
1, 3
1, 2
5, 6
5,6,7
6,7,8
3
Escândio
Titânio
Vanádio
Crómio
Manganês
Ferro
Cobalto
Níquel
Cobre
3
Importância dos complexos de
metais de transição
z
z
Os complexos de
metais de transição
apresentam
propriedades químicas,
ópticas e magnéticas
variadas.
Os complexos de
metais de transição são
importantes em
catálise, síntese de
materiais, fotoquímica e
em sistemas biológicos.
Cores de complexos de metais
de transição
[Fe(H2O)6]3+
[Ni(H2O)6]2+
[Co(H2O)6]2+
[Zn(H2O)6]2+
[Cu(H2O)6]2+
4
COMPLEXOS
Compostos de coordenação
Um composto de coordenação contém pelo menos um
complexo.
Um complexo contém um catião metálico central ligado a uma
ou mais moléculas ou iões.
As moléculas ou iões que rodeiam o metal
num complexo são denominados
ligandos.
Um ligando tem pelo menos um par de
electrões de valência não compartilhado
H
H
H H H
-
C
O
••
••
Cl
••
••
••
N
••
••
•O• •
5
EXEMPLO de um complexo
Número de coordenação = 4
Complexo tetradentado
Cores variadas de complexos
de pentamino cobalto
6
O átomo do ligando que se encontra directamente ligado ao
centro metálico denomina-se átomo dador.
••
•O• •
N
H
H
H H H
O número de átomos dadores que circundam o centro metálico
é o número de coordenação.
Ligandos com:
Um átomo dador
Dois átomos dadores
monodentado H2O, NH3, ClEtilenodiamina
bidentado
NH2-CH2-CH2-NH2
Três ou mais átomos dadores polidentado
EDTA
[(OOCCH2)2-N-CH2-CH2-N(CH2COO)2]4-
Ligandos
Monodentados/Polidentados
z
LIGANDO MONODENTADO
z Ligando que se coordena por apenas um átomo ao elemento
central
z
LIGANDO BIDENTADO, TRIDENTADO, ...
z Ligando que se coordena por dois, três, .... átomos ao elemento
central
z
LIGANDO POLIDENTADO ou QUELANTE
z Ligando que se pode coordenar por mais que um átomo ao
elemento central.
z
ANÉIS DE QUELAÇÃO
z Ciclos constituídos pelo elemento central e pela cadeia do
ligando entre os átomos coordenantes
7
Tris(etilenodiamina) níquel(II)
[Ni(en)3]2+
Ligando bidentado
••
H2N
CH2
CH2
••
NH2
Ligando polidentado
(EDTA)
Os ligandos bidentados e polidentados denominam-se agentes
quelantes
8
Ligando polidentado (hexadentado)
Ácido EtilenoDiaminoTetrAcético (EDTA)
9
Diferença entre Ligando e
Contra-ião
Diferença entre Ligando e
Contra-ião
Laranja
Rosa
10
Composto de coordenação
Ião complexo
Contra
-iões
Ligandos
Catião
metálico
Número de
Coordenação
(1 + 5 = 6)
Complexos em Sistemas
Biológicos: a Hemoglobina
11
Complexos em Sistemas
Biológicos: a Hemoglobina
z
Ligandos:
z
z
z
z
Fe
Grupo hemo da
hemoglobina:
z
z
Porfirina no plano (átomos
coordenantes = N)
Aminoácido axial (His:
coordenação N)
Sexta posição livre para
aceitar O2
Metal central = Fe
Coordenação octaédrica
Complexos em Sistemas
Biológicos: a Hemoglobina
12
Cálculo de números de oxidação
de metais em complexos
Quais são os números de oxidação dos metais em
K[Au(OH)4] e [Cr(NH3)6](NO3)3 ?
OH- tem uma carga -1
K+ tem uma carga +1
n.o (Au) + 1 + 4x(-1) = 0
n.o.(Au) = +3
NO3- tem uma carga -1
NH3 tem carga 0
n.o(Cr) + 6x(0) + 3x(-1) = 0
n.o(Cr) = +3
13
Preencher a tabela
Composto de
coordenação
Na2[Zn(CN)4]
Ião
metálico
central
Ligandos
Átomos
doadores
dos
ligandos
Contra Número de
-ião
coordenação
do metal
Zn2+
CN-
C
Na+
4
[CoCl2(en)2]Cl
Co3+
Cl-, en
Cl, N
Cl-
6
[Cu(H2O)4]SO4.H2O
Cu2+
H2O
O
SO42-
4
[NiBr2(PEt3)2]
Ni2+
Br-, PEt3
Br, P
-
4
K2[NiEDTA]
Ni2+
EDTA
N, O
K+
6
14