Metabolismo e Endocrinologia
“Interacções Proteicas Com Ligandos”
Mestrado Integrado em Engenharia Biomédica
2007/2008
Grupo 7
Tiago Robalo, 58481
Carlos Lúcio, 58511
Carlos Santiago, 58445
RELATÓRIO
Nos meios biológicos, um ligando é uma substância extra celular capaz de se ligar a receptores
de biomoléculas (“proteínas-alvo”). Podem ser específicos para determinados tipos de
receptores ou menos selectivos, podendo formar ligações com diferentes tipos de receptores.
Ao ligar-se a esses receptores libertam energia que pode ser aproveitada para alterar a
conformação da molécula, determinando a sua acção biológica.
Entre o receptor e o ligando podem ser formadas ligações iónicas, ligações de hidrogénio ou
ainda ligações de Van Der Waals. Menos frequentemente, podem também ser formadas
ligações covalentes, que, dada a sua estabilidade, tornam a ligação irreversível.
O local de união entre o ligando e as moléculas receptores é designado por sítio de ligação,
que é complementar do ligando no tamanho, na forma, na carga e no carácter hidrofóbico e
hidrofílico. É esta complementaridade que confere ao ligando alguma especificidade de
ligação. Contudo, a estrutura tridimensional da proteína não é estática e os ligeiros
movimentos vibratórios desta facilitam a formação das ligações do ligando ao sítio de ligação.
Uma proteína pode ter vários sítios de ligação para diferentes tipos de ligandos.
É a força da ligação intermolecular que define a constante de equilíbrio da reacção
ligando+proteína; esta, por sua vez, define a afinidade entre ligando e receptor e vai
caracterizar a reversibilidade ou irreversibilidade da reacção:
Tal como acontece para todas as reacções químicas, a constante de equilíbrio apenas depende
da temperatura a que a reacção se dá. Esta constante de associação, tal como a de equilíbrio,
estabelece a relação entre a concentração de complexo ligando-receptor no final da reacção
com a concentração de ligando e de receptores no início da reacção, através da expressão
abaixo. Por sua vez, o inverso da constante de associação dar-nos-á precisamente a constante
de dissociação (trata-se do cálculo da constante de equilíbrio da reacção inversa – a separação
do complexo):
Estas duas constantes são frequentemente utilizadas como indicador da apetência para a
união do ligando com o receptor, ao que se dá o nome de afinidade. Quanto maior for a
afinidade, maior será a constante de associação (e, por sua vez, menor será a constante de
dissociação).
Outro resultado que se pode tirar da afinidade é a “durabilidade” da união. Nos meios
biológicos torna-se extremamente relevante pensar quando é que um ligando se deverá
associar ao receptor, assim como quando é que se deverá separar dele, isto é, se a reacção é
reversível ou não. De referir que a reversibilidade ou irreversibilidade é também definida por
factores presentes no Princípio de Chatelier, tais como a concentração, pressão e temperatura.
Numa proteína com n sítios de ligação, temos:
No equilíbrio, considerando a razão:
=>
e como
Sabendo ainda que
:
A que se dá o nome de Equação de Hill - analisada
pela primeira vez por Archibald Hill em 1910,
descrevendo a curva de ligação de O2 com a
hemoglobina.
Quando
:
Verifica-se assim que a constante de dissociação kd não é mais do que a concentração molar
de ligandos para a qual metade dos sítios de ligação do receptor estão ocupados.
O Vector de Hill, obtido através da equação de Hill, é uma
curva na qual a percentagem de sítios de ligação ocupados
está em função da concentração ou pressão de ligandos.
Apresenta um crescimento sigmóide, ou seja, quanto
maior for a concentração de ligandos maior o número de
complexos PL formados, com uma assímptota horizontal
em
. Quanto menor for Kd, maior a afinidade entre a
proteína e o ligando.
O gráfico de Hill pode ser obtido através da
seguinte relação:
Verificou-se experimentalmente que o declive,
n, não reflecte o nº de sítios de ligação mas sim
um grau de interacção (cooperatividade) entre
estes – o coeficiente de Hill, nH.
nH = 1 – não cooperativa – ligações completamente independentes
nH > 1 – cooperatividade positiva – afinidade a ligandos aumenta
nH < 1 – cooperatividade negativa – afinidade a ligandos diminui
Existem dois modelos de mecanismos de cooperatividade entre ligandos. No primeiro,
Concerted model, considera-se que a ligação do primeiro ligando pode ou não induzir uma
alteração da estrutura da proteína. Se induzir, estamos perante um fenómeno de
cooperatividade e este modelo defende que a alteração da estrutura da proteína será global.
No segundo, Sequential model, a alteração pode ser causada em subunidades
individualmente. Admite-se que haja, contudo, um meio-termo entre estes dois modelos.
Os principais mediadores de oxigénio do nosso organismo são a hemoglobina e mioglobina.
A hemoglobina está contida nos eritrócitos e, para além de transportar oxigénio, também
exerce um papel vital no transporte de dióxido de carbono e iões hidrogénio. É uma
metaloproteína composta por quatro cadeias proteicas e possui quatro grupos heme. É uma
proteína alostérica, pois a ligação com o oxigénio é regulada por alterações na sua estrutura
provocadas por diferenças de concentrações. A forma mais comum de hemoglobina é a A1
(cerca de 95%) em adultos, mas na fase fetal predomina o tipo F.
A mioglobina é uma proteína de cadeia simples que contém apenas um grupo heme e é
responsável pelo armanezamento de oxigénio nos músculos. Ao contrário do que acontece
com a hemoglobina, como só há um local de ligação ao oxigénio, não há cooperatividade entre
ligandos.
O grupo heme é um grupo prostético (ligando de natureza não
proteica) que consiste num tetrâmero, chamado protoporfirina,
que contém no centro um ião Fe2+. Este ião tem de capacidade
de se ligar a alguns gases existentes no organismo,
nomeadamente O2 e CO.
No que diz respeito à afinidade entre o grupo heme e os gases,
verifica-se que esta é influenciada pela estrutura proteica na
qual o grupo está inserido, bem como o gás que se está a
considerar.
O CO tem cerca de 200 vezes mais
afinidade que o O2 (tem maior número de
ligações covalentes). Como consequência,
a hemoglobina pode combinar-se com
monóxido de carbono bloqueando o
transporte de oxigénio.
Aplicando os conceitos anteriores às moléculas de mioglobina e hemoglobina A1 e F, obteve-se:
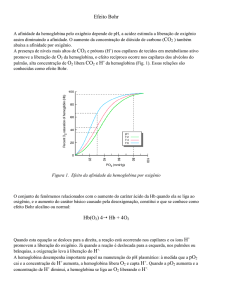
Comparando os três traçados,
conclui-se que Kd-Mioglobina < Kd-HgF
< Kd-HgA1 , logo, a afinidade
aumenta no sentido inverso.
Repare-se também que o aumento
da percentagem de ligações O2hemoglobina não é tão acentuado a
pressões baixas como a pressões
próximas de Kd, que se deve ao
aumento da afinidade para com o
O2 provocado por cooperatividade
positiva. Ou seja, presença de
oxigénios ligados à hemoglobina
facilita a união de outros.
Como se trata de um gás,
passa para
Nestes gráficos de Hill, verifica-se o que foi
dito acima quanto à cooperatividade
presente na hemoglobina (vermelho):
existe um intervalo para o qual o nH=3 –
cooperatividade positiva. Como resultado,
haverá maior afinidade ao oxigénio. Isto
sucede até o grupo heme possuir três O2
ligados.
Pode constatar-se, também, que o declive
do gráfico da mioglobina (azul) é linear,
com declive nH=1, o que significa que não
há cooperatividade, como já foi referido
anteriormente.