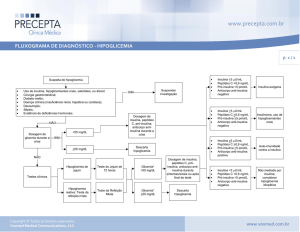
NASCER E CRESCER
revista do hospital de crianças maria pia
ano 2008, vol XVII, n.º 3
Hiperinsulinismo Congénito
Revisão Teórica e Série de Casos
Anabela Bandeira1, Cátia Cardoso2, José Sizenando3, Elisa Proença4, Esmeralda Martins5
RESUMO
O hiperinsulinismo congénito constitui a causa mais frequente de hipoglicemia persistente no recém-nascido e
lactente e engloba um grupo heterógeneo de defeitos genéticos que afectam o
metabolismo da secreção de insulina.
Os autores apresentam três casos
clínicos de hiperinsulinismo congénito.
Os três casos ilustram a diversidade na
apresentação clínica, desde a iritabilidade, a um quadro clínico de sepsis ou
convulsões neonatais. A necessidade de
grandes aportes de glicose para corrigir
e manter a normoglicemia pode levantar
a suspeita do diagnóstico, assim como a
resposta clínica ao glucagon. Num dos
casos foi realizado cateterismo pancreático por imagem suspeita na ecografia
abdominal e noutro caso foi realizado cintilograma (PET com 18F-fluoro-L-Dopa). A
distinção entre as duas formas: focal e
difusa é muito importante uma vez que o
tratamento é diferente. O tratamento com
diazóxido permite o controlo glicémico
em alguns casos.
O diagnóstico precoce e a correcção imediata das hipoglicemias previne
a lesão cerebral e melhora o prognóstico
neurológico destas crianças.
Palavras-chave: hiperinsulinismo
congénito, diazóxido, hipoglicemia.
INTRODUÇÃO
O hiperinsulinismo congénito é a
causa mais frequente de hipoglicemia
persistente na infância(1). A secreção inapropriada de insulina causa hipoglicemia
que necessita de correcção precoce para
evitar sequelas neurológicas. A incidência estimada é de 1/30.000 a 1/50.000
nados vivos(2). O hiperinsulinismo transitório está associado a diabetes materna,
asfixia neonatal, policitemia e incompatibilidade Rh.
Os critérios de diagnóstico(1) (Quadro I) incluem hipoglicemia (<54 mg/
dl) em jejum e pós-prandial com concomitante hiperinsulinemia (> 3 mU/L)
e necessidade de perfusão de glicose
superior a 10 mg/kg/minuto para manter valores de glicemia acima de 54 mg/
dl, resposta positiva à administração de
glucagon e persistência da hipoglicemia
ao longo do primeiro mês de vida. Na
ausência de níveis anormais de insulina
concomitantes com a hipoglicemia pode
ser realizado um teste de jejum de 4 a
6 horas, com o doseamento dos corpos
cetónicos, ácidos gordos livres e aminoácidos de cadeia ramificada no plasma,
que se encontram baixos.
O hiperinsulinismo pode ser classificado, de acordo com o início da hipoglicemia, como neonatal ou tardio (aparecimento na infância). Existem duas formas histológicas distintas: a lesão focal
por hiperplasia adenomatosa das ilhotas
de Langerhans, medindo cerca de 2,5 a
7,5 mm de diâmetro ou lesão difusa que
consiste no alargamento anormal nuclear
das células β em todo o pâncreas. Estas
lesões histológicas são clinicamente indistinguíveis.
CLÍNICA
A hipoglicemia pode ser grave, com
risco de convulsões e lesão cerebral.
Cerca de 60% dos doentes apresentam
sintomas nas primeiras 72 horas de vida.
As manifestações no período neonatal
podem ser convulsões em 50% dos casos, sintomas não específicos em 30% e
hipoglicemia assintomática em 20% dos
casos3. Outros sintomas: tremores, hipotonia, cianose, hipotermia ou ALTE. A
hipoglicemia é persistente e ocorre tanto
em jejum como no período pós-prandial.
A maioria dos recém-nascidos são macrossómicos ao nascimento e podem
apresentar hepatomegalia ligeira. A apre-
Quadro I - Critérios de diagnóstico de hipoglicemia hiperinsulinémica persistente
Nascer e Crescer 2008; 17(3): 133-138
__________
1
2
3
4
5
Interna Complementar de Pediatria do
HGSA-CHP
Interna Complementar de Pediatria, Hospital
do Funchal
Assistente Hospitalar de Pediatria do HMPCHP
Assistente Hospitalar de Pediatria, CHPovoa
de Varzim/Vila do Conde
Assistente Hospitalar Graduada de Pediatria
do HMP-CHP
- Hipoglicemia em jejum e pós-prandial (< 54 mg/dl ou 3 mmol/L) com concomitante
hiperinsulinemia (> 3 m U/L)
- Necessidade de perfusões altas de glucose (> 10 mg/kg/minuto no período neonatal) para
manter glicemias superiores a 54 mg/dl
- Resposta positiva à administração subcutânea ou intramuscular de glucagon (aumento da
glicemia em 36 a 54 mg/dl após 0,5 mg de glucagon)
- Hipoglicemia persistente no primeiro mês de vida
casos clínicos
133
NASCER E CRESCER
revista do hospital de crianças maria pia
ano 2008, vol XVII, n.º 3
sentação clínica não depende da forma
histológica ou genética4.
O hiperinsulinismo pode associar-se
a hiperamoniémia moderada (Sindrome
hiperinsulinismo hipoglicémico / hiperamoniemia) respondendo bem, nestes casos, ao diazóxido e à restrição proteica.
Está associado também aos síndromes
de Usher tipo Ic ou distúrbios congénitos
da glicosilação tipo Ia e Ib, síndrome de
Beckwith-Widemann, Perlman, SimpsonGolabi-Behmel ou Sotos5.
A taxa de glucose intravenosa necessária para prevenir a hipoglicemia é
elevada (geralmente 17 mg/kg/minuto)
no período neonatal. Quando o diagnóstico é feito no lactente as necessidades
de glicose são mais baixas (12-13 mg/kg/
minuto). Nestes, a hipoglicemia é melhor
tolerada pelo que o diagnóstico pode ser
atrasado.
Os níveis de glucose aumentam 3654 mg/dl em resposta à administração
SC ou IM de glucagon (0,5 mg).
Os múltiplos diagnósticos diferenciais da hipoglicemia no período neonatal implicam uma história clínica e fami-
liar exaustiva, exame físico completo e
pedido de alguns exames complementares de diagnóstico, nomeadamente:
doseamento da amónia, lactato e piruvato séricos, cromatografia dos aminoácidos séricos e urinários, cromatografia
dos ácidos orgânicos urinários, perfil de
acilcarnitinas e pesquisa de substâncias
redutoras na urina. Doseamento do cortisol e hormona do crescimento também
fazem parte dos exames na hipoglicemia
persistente6.
FISIOLOGIA
No hiperinsulinismo congénito existe uma hipersecreção de insulina pelas
ilhotas de Langerhans. A insulina inibe
a libertação do glicogénio hepático, a
gluconeogénese e aumenta a captação
de glicose pelas células musculares diminuindo o nível sérico de glicose. Isto
explica a necessidade elevada de glicose
para corrigir a hipoglicemia e a resposta
ao glucagon7.
A glucocinase é a enzima que inicia
o metabolismo da glicose na célula β.
Níveis elevados de glicose aumentam a
taxa de fosforilação da glicose pela glucocinase e o nível ATP/ADP resultante da
glicólise. Níveis aumentados de ATP activam o receptor da sulfonilureia (SUR1)
e fecham o canal de potássio ATP dependente. Isto conduz a uma despolarização
da membrana, com influxo de cálcio e
libertação de insulina (Figura 1).
A leucina estimula a secreção de
insulina através da glutamato desidrogenase, aumentado a taxa de oxidação
do glutamato. Isto conduz a hiperamoniémia, aumento do alfa cetoglutarato e
aumento da actividade do ciclo de Krebs
e da relação ATP/ADP, com aumento da
secreção de insulina.
O diazóxido inibe a secreção de insulina por ligação a SUR1.
GENÉTICA
A transmissão genética pode ser
esporádica, autossómica recessiva ou
dominante. A lesão focal é geralmente
de ocorrência esporádica, a lesão difusa
pode ser recessiva (a maioria das vezes)
ou dominante (raro). Foram encontradas
mutações genéticas em cerca de 50%
Figura 1: Sequência funcional da célula β e possíveis alterações genéticas.
134
casos clínicos
NASCER E CRESCER
revista do hospital de crianças maria pia
ano 2008, vol XVII, n.º 3
dos doentes, podendo existir muitos outros genes envolvidos (Quadro II)8.
A hiperplasia focal das ilhotas está
associada a uma mutação paterna, herdada em hemizigotia ou homozigotia,
nos genes do receptor da sulfonilureia
(SUR1) ou canal de potássio (kir6.2) no
cromossoma 11p15. A perda do alelo materno conduz a uma expressão aumentada de imprinting genes, que incluem o
gene do factor de crescimento ou supressores tumorais.
O hiperinsulinismo difuso envolve vários mecanismos e genes: as canalopatias
(envolvem genes que codificam o receptor
da sulfonilureia ou canal de potássio), o
distúrbio metabólico envolvendo a enzima
glucokinase (gene GGK) ou a enzima glutamato desidrogenase (gene GLUD 1) e
situações em que a hiperamoniémia está
associada a hipoglicemia. Pode ocorrer
uma forma dominante de hiperinsulinismo
ligada ao exercício por um defeito metabólico na enzima SCHAD ou um defeito no
receptor da insulina humana.
CASOS CLÍNICOS
1º caso clínico: lactente do sexo
feminino, com 10 meses de idade, fruto
de uma gravidez vigiada, sem intercorrências. Pais jovens, saudáveis, não consanguíneos. Parto distócico por fórceps
às 40 semanas com Apgar 9/10. Peso
3160 g (P 25-50), comprimento 48.5 cm
(P 25) e perímetro cefálico 35 cm (P 75).
Internada aos 4 dias de vida por recusa alimentar, hipotonia e hipoglicemia.
Rastreio séptico negativo. Fez bólus de
glicose a 10% e perfusão de glicose a
11,5% durante 48 horas. Teve alta com o
diagnóstico de hipogalactia materna com
leite adaptado suplementado com maltrodextrina.
Reinternada aos 23 dias de vida por
choro forte e irritabilidade (hipoglicemia
6 mg/dl) necessitando aporte de glicose
de 22 mg/kg/minuto para normoglicemia.
Doseamento de insulina 23 μU/ml em
hipoglicemia (14 mg/dl) sendo o valor
normal de insulina no plasma <5 μU/ml
em hipoglicemia. Restante estudo endócrino (cortisol e hormona de crescimento)
e metabólico (amónia, lactato e piruvato,
aminoácidos séricos e perfil de acilcarnitinas, ácidos orgânicos na urina) sem alte-
rações. Realizou TAC abdominal que foi
normal. Iniciou tratamento com diazóxido
10 mg/kg/dia com boa resposta clínica.
Teve alta orientada para consulta externa
de doenças do metabolismo. Internamento de curta duração aos 4 meses de idade por hipoglicemia em contexto de otite
média aguda e aos 4 meses e meio por
recusa alimentar e hipoglicemia aumentando a dose de diazóxido para 15mg/kg/
dia. Novo internamento aos 5 meses por
vómitos alimentares com necessidade de
um aporte de glicose ev de 8 mg/kg/minuto e alimentação contínua nocturna por
falta de resposta ao diazóxido. Efectuou
3 tomas de octreótido de acção prolongada (5 mg intramuscular) sem resposta clínica e posteriormente iniciou tratamento
com nifedipina sem resultados favoráveis.
Realizou ressonância magnética nuclear
abdominal que foi relatada como normal.
O PET com 18F-L-Dopa revelou imagem
de hipercaptação na cabeça do pâncreas
(Figura 2).Nesta altura, foi orientada para
Centro de Referência de Doenças do Metabolismo (Hospital Necker em Paris) devido à ausência de resposta ao tratamento médico. Após realização de novo PET
com 18F-L-Dopa foi submetida a pancre-
atectomia parcial com excelente resposta
clínica. Actualmente com 10 meses de
idade apresenta boa evolução estaturoponderal e desenvolvimento psico-motor
adequado à idade, sem necessidade de
qualquer tratamento. O estudo molecular
efectuado não foi conclusivo.
2º caso clínico: criança do sexo
feminino, com 18 meses de idade, fruto
de uma gravidez gemelar, sem intercorrências. Parto por cesariana às 36 semanas com Apgar 9/10. Peso 2660 g (P 50),
comprimento 48 cm (P 50), perímetro cefálico 31,5 cm (P 10-25). Aos 2 dias de
vida iniciou gemido, choro fácil, hipotonia
com pouca reactividade a estímulos e reflexo de sucção débil com glicemia de 30
mg/dl. Fez perfusão de soro glicosado a
10% mas manteve hipoglicemias (37 mg/
dl), sem acidose metabólica. Necessidade de perfusão de glicose 9 mg/kg/minuto. Realizou estudo metabólico (amónia,
lactato, piruvato, aminoácidos séricos,
perfil de acilcarnitinas, ácidos orgânicos
urinários) e pesquisa de substâncias redutoras na urina que foram normais. A
insulina doseada em hipoglicemia revelou nível de 13,4 μU/ml pelo que iniciou
Quadro II – Genes implicados na patogénese do hiperinsulinismo congénito
Proteína
Fisiologia
Gene /Locus
Receptor da sulfonilureia 1
(SUR 1)
Defeito no canal K-ATP com despolarização
da membrana e libertação de insulina
mesmo com glicemias baixas.
ABCC8
11p15.1
Autossómica recessiva ou dominante
Subunidade
Kir 6.1
Defeito no canal K-ATP
KCNJ11
11p15.1
Autossómica recessiva ou dominante
Síndrome hiperamoniémia / hiperinsulinismo
Enzima glutamato
desidrogenase
Resposta intensa da insulina após bolus
intravenoso de leucina
GLUD 1
10q23.3
Enzima glucocinase
Mutações activadoras da glucocinase
Hipoglicemia sensível ao diazóxido
GCK
7p15-p13
Enzima L-3 hidroxiacil Co
A desidrogenase de
cadeia curta (SCHAD)
Autossómica recessiva
HADHSC
4q24-q25
casos clínicos
135
NASCER E CRESCER
revista do hospital de crianças maria pia
ano 2008, vol XVII, n.º 3
tratamento com diazóxido 10 mg/kg/dia.
A ecografia transfontanelar revelou área
focal hiperecogenica a nível da charneira
entre o tálamo e núcleo caudado, com 5
mm de diâmetro, provável foco hemorrágico. Por apresentar algumas dismorfias
faciais minor e hipotonia axial colheu cariótipo do sangue periférico: del (9)(pter
p 23) 46 XX. Realizou ecocardiograma
pela presença de sopro sistólico que revelou comunicação intra-auricular tipo
osteum secundum. Aos 11 meses de idade apresenta peso no P10, comprimento no P 50 e microcefalia com perímetro
cefálico abaixo do P5. Apresenta hipotonia axial com restante desenvolvimento
normal. Suspendeu o tratamento com
diazóxido mantendo valores glicémicos
normais. Aos 14 meses apresentou episódio de recusa alimentar e convulsão
tónico-clonica por hipoglicemia (glicemia
38 mg/dl, insulinémia 4.8 μU/ml) tendo
necessitado de perfusão de glicose a 8
mg/kg/minuto, pelo que reiniciou tratamento com diazóxido (10 mg/kg/dia). A
ressonância magnética cerebral realizada aos 17 meses revelou focos de hipersinal nas regiões peritrigonais, sem
outras alterações relevantes. As lesões
observadas não são características das
lesões de hipoglicemia.
3º caso clínico: rapaz com 7 anos
de idade, fruto de uma gravidez vigiada,
sem intercorrências. Pais jovens, saudáveis e não consanguíneos. Parto por cesariana às 38 semanas com Apgar 9/10.
Peso 3500 g (P 25), comprimento 50
cm (P 25) e perímetro cefálico 35 cm (P
50). Ao mês e meio de vida iniciou movimentos rápidos dos olhos, no sentido
horizontal, com duração de cerca de 4
minutos. Aos 2 meses apresentou duas
crises tónico-clónicos generalizadas
antes da mamada da manhã que não
foram valorizadas. Aos 2 meses e meio
agravamento com movimentos oculares
anormais, postura do membro superior
esquerdo em extensão e movimentos tónico-clónicos. Realizou rastreio séptico
que foi negativo (não fez glicemia). Realizou TAC cerebral que foi normal e EEG
sem alterações. Três dias depois, crises
múltiplas, sonolência e hiporeactividade.
Ao exame físico apresentava-se hipotónico. O estudo analítico revelou uma glicemia de 16 mg/dl e nível de insulina 23
μU/ml. Doseamento do cortisol e hormona de crescimento e estudo metabólico
(amónia, lactato, piruvato, aminoácidos
séricos, perfil de acilcarnitinas, ácidos
orgânicos urinários) foram normais. Iniciou tratamento com hidrocortisona e octreótido que posteriormente foram substituídos pelo diazóxido (15 mg/kg/dia).
Necessitou de aporte de glicose máximo
de 20 mg/kg/minuto. A ecografia abdominal revelou imagem local complexa
na cauda do pâncreas com 11 mm de
diâmetro pelo que realizou angiografía
pancreática que foi normal. Teve alta do
internamento aos três meses e meio medicado com diazóxido 10 mg/kg/dia. Actualmente com 7 anos de idade apresenta boa evolução ponderal, hirsutismo e
Figura 2 - PET com 18F-fluoro-L-Dopa com visualização de hipercaptação na cabeça do pâncreas.
136
casos clínicos
NASCER E CRESCER
revista do hospital de crianças maria pia
ano 2008, vol XVII, n.º 3
dificuldades na aprendizagem. Mantém
terapêutica com diazóxido 7 mg/kg/dia
com bom controlo metabólico.
DISCUSSÃO
Os três casos clínicos ilustram a
diversidade da apresentação clínica do
hiperinsulinismo congénito, desde a irritabilidade, ao quadro clínico de sepsis ou a
convulsões neonatais. A necessidade de
grandes aportes de glicose para corrigir e
manter a glicemia em níveis normais, podendo ser necessário um cateter venoso
central para administração de glicose associado a alimentação entérica contínua,
levanta a suspeita do diagnóstico, assim
como a resposta clínica à perfusão de
glucagon (1-10 μg/kg/hora). O objectivo é
manter a glicemia entre 54-108 mg/dl 9.
No primeiro caso clínico, o doseamento de insulina em hipoglicemia permitiu o estabelecimento do diagnóstico. O
desenvolvimento psicomotor da lactente
é excelente, uma vez que o tratamento
foi instituído rapidamente prevenindo a
lesão cerebral irreversível. A evolução clínica permitiu verificar a resistência ao tratamento com diazóxido pela necessidade
de perfusão endovenosa de glicose para
manter os níveis de glicemia. A maioria
das formas neonatais (84 %) é resistente
ao diazóxido. Este é usado, por via oral,
numa dose que varia de 5 a 25 mg/kg/
dia, dividido em 3 tomas. Dois valores de
glicemia (< 54 mg/dl) em 24 horas com
alimentação oral e sem aporte de glicose endovenosa, faz com o doente seja
considerado não responsivo ao diazóxido. Os efeitos adversos mais frequentes
deste fármaco são: hirsutismo, efeitos
hematológicos e retenção de fluidos. O
hirsutismo secundário ao tratamento era
bastante notório nesta lactente.
Os análogos da somastotatina (octreótido) podem ser usados isoladamente
ou em associação com o glucagon e podem ser tentados antes da cirurgia nos
casos não responsivos ao diazóxido. As
doses variam de 15 μg/kg/dia a 60 μg/dia,
usualmente o tratamento é iniciado com
uma dose de 40 μg/kg/dia, dividido em
3-4 doses SC ou perfusão endovenosa
(1 a 4,5 μg/kg/hora) ou intramuscular nas
formas de libertação prolongada. Alguns
doentes apresentam vómitos e/ou diar-
reia e distensão abdominal que resolvem
espontaneamente em 7 a 10 dias.
Os bloqueadores dos canais de cálcio, nifedipina, 0,5 a 2 mg/kg/dia, são por
vezes eficazes. No primeiro caso clínico
verificou-se uma resposta positiva inicial
mas que não foi duradoura.
Os glucocorticoides não estão indicados no tratamento do hiperinsulinismo.
Não existe nenhuma característica
clínica que distinga entre as duas formas
histológicas: focal e difusa10. A ecografia,
a TAC ou a RMN não conseguem localizar
as formas focais. A cateterização venosa
pancreática e a arteriografia pancreática
são utilizadas para localizar o local de secreção de insulina. Os doentes com uma
lesão focal têm indicação cirúrgica, uma
vez que as lesões focais tratadas cirurgicamente conduzem à cura mas, antes de
qualquer cirurgia uma forma transitória (<
1 mês) tem que ser excluída. Os doentes
com lesão difusa podem ser submetidos
a pancreatectomia parcial, se o tratamento médico falha. Os riscos após esta intervenção são a hipoglicemia numa fase
inicial (2-3 anos) e a longo prazo a diabetes mellitus que ocorre em cerca de 90%
dos doentes antes dos 15 anos de idade.
A insuficiência pancreática exócrina pode
necessitar de enzimas pancreáticas. A
vigilância anual é realizada através de
glucose em jejum e pós prandial, insulina, hemoglobina glicosilada e teste de
tolerância oral à glicose.
O uso recente do PET (18 F fluoro-Ldopa positron emission tomography) permite detectar o hiperfuncionamento das
ilhotas de tecido pancreático sem necessidade de técnicas invasivas11. Uma captação anormal focal de 18 F fluoro-L dopa
permite localizar lesões focais. Este exame não está a ser realizado no nosso país
pelo elevado custo e dificuldades de transporte do radiofármaco. No 1º caso clínico,
a sua realização permitiu a identificação
de uma lesão focal com posterior excisão
cirúrgica por pancreactectomia lesional. O
follow-up, embora pequeno, permite verificar uma evolução muito favorável.
No 2º caso clínico a prematuridade
e o doseamento do nível de insulina sem
hipoglicemia poderá ter atrasado o diagnóstico. Para além disso esta lactente
apresenta algumas dismorfias faciais e
hipotonia axial. O cariótipo revelou delecção do braço curto do cromossoma 9,
que está associado a trigonocefalia, hipoplasia do corpo caloso que esta criança
não apresenta.
A maioria dos doentes tratados
medicamente são fármaco dependentes, embora existam alguns casos de
remissão. Isto justifica a paragem do tratamento médico uma vez por ano, sob
supervisão médica, para avaliar a possível recuperação espontânea. No 2º caso
clínico verificou-se descompensação em
situação de doença com recusa alimentar
pelo que houve necessidade de reinstituir
terapêutica com diazóxido.
O 3º caso clínico apresentou um
quadro mais exuberante com convulsões
neonatais mas com boa resposta ao diazóxido. O aparecimento de uma imagem
suspeita na ecografia abdominal conduziu à realização de angiografia pancreátrica para excluir um lesão focal com necessidade de tratamento cirúrgico.
A cateterização pancreática percutânea é realizada sob anestesia geral.
O diazóxido e qualquer outro fármaco é
interrompido 5 dias antes da intervenção,
sendo administrada uma perfusão de glicose para manter a glicemia entre 54-108
mg/dl. Amostras de sangue venoso são
recolhidas da cabeça, do corpo e da cauda do pâncreas para medição da insulina,
glucose e peptideo C. Os doentes com lesão focal apresentam elevação da insulina e peptideo C num local do pâncreas.
O seguimento clínico e analítico
posterior deste caso clínico permitiu verificar um bom controlo metabólico com
doses baixas de diazóxido permitindo a
vigilância com tratamento médico. Mas
o atraso no diagnóstico e as sucessivas
convulsões tónico-clónicas generalizadas
no período neonatal podem justificar as
dificuldades na aprendizagem. O prognóstico mental e neurológico está relacionado com a duração e a severidade do
episódio inicial de hipoglicemia. Existem
muito poucos dados acerca da evolução
a longo prazo destas crianças. Em algumas séries de doentes 44% apresentam
atraso do desenvolvimento psicomotor.
Os autores pretendem alertar para
os episódios recorrentes e persistentes
de hipoglicemia no período neonatal que
casos clínicos
137
NASCER E CRESCER
revista do hospital de crianças maria pia
ano 2008, vol XVII, n.º 3
podem ser devidos a hiperinsulinismo
congénito. O diagnóstico atempado permite evitar a lesão cerebral e um melhor
prognóstico neurológico nestas crianças.
permits a better neurological prognostic
for these children.
Keywords: congenital hyperinsulinism, diazoxide, hypoglycaemia
Nascer e Crescer 2008; 17(3): 133-138
CONGENITAL HYPERINSULINISM –
CLINICAL REVIEW AND CASE
REPORT
BIBLIOGRAFIA
ABSTRACT
Congenital hyperinsulinism is the
most important cause of persistent hypoglycaemia in early infancy. Mutations in
at least five genes have been associated
with dysregulated insulin secretion.
The authors present three clinical cases of congenital hyperinsulism.
This clinical cases show the diversity in
clinical presentation: from asymptomatic
hypoglycaemia, to neonatal sepsis-like
or seizures. The need of high glucose
perfusions to obtain the normalization of
blood glucose levels often leads to the diagnosis. The clinical response to glucagon
also helps in diagnosis. In one of the clinical cases it was realized a trans-hepatic
portal venous insulin sampling and in another a PET scan with 18F-fluoro-L-Dopa.
The distinction between the focal and
diffuse forms is very important because
the treatment differs. The treatment with
diazoxide permits the metabolic control in
some cases.
A precocious diagnosis and immediate correction of glycaemia avoids the
neurodevelopment complications and
1. Lonlay P, Touati G, Robert J-J, Saudubray J-M. Persistent hyperinsulinaemic hypoglicaemia. Semin Neonatol
2002; 7: 95-100
2. Lonlay P, Giurgea I, Sempoux G, Joaubert F, Rahier J, Ribeiro M-J et al.
Dominantly inherited hyperinsulinaemin hypoglycaemia. J Inherit Metab
dis 2005; 28:267-76
3. Guerrero-Fernández J, González C,
Colindres LE, Bouthelier RG. Hiperinsulinismo congénito. Revisión de
22 casos. An Pediatr (Barc), 2006;
65:22-3
4. Giurgea I, Ribeiro M-J, Boddaert N,
Touati G, Robert J-J, Saudubray J-M,
Jaubert F et al. L’hyperinsulinisme
congenital du nouveau-né et du
nourrisson. Archives de pédiatrie
2005;12:1628-1632
5. De León DD, Stanley CA. Mechanisms of disease: advances in diagnosis
and treatment of hyperinsulinism in
neonates. Endocrinology & Metabolism. 2007; 3: 57-67
6. Lindley KJ, Dunne MJ. Contemporary strategies in the diagnosis and
138
casos clínicos
management of neonatal hyperinsulinaemic hypoglycaemia. Early Human
Developmemt 2005;81:61-72
7. Hussain K. Congenital hyperinsulisms. Sem Fetal & Neonatal medicine
2005;10: 369-76
8. Giurgea I, Bellanné-Chantelot C, Ribeiro M, Hubert L, Sempoux C, Robert J et al. Molecular mechanisms of
neonatal hyperinsulinism. Horm Res
2006; 66:289-296
9. Hussain K, Blankenstein O, De Lonlay P, Christesen HT. Hyperinsulinaemic hypoglycaemia: biochemical nbasis and the importance of maintaining
nornoglycemia during management.
Arch Dis Child 2007; 92:568-570
10. Hardy OT, Hernandez-Pampaloni
M, Saffer JR, Suchi M, Ruchelli E,
Zhuang H et al. Diagnosis and localization of focal congenital hyperinsulinism by 18F-Fluorodopa PET Scan. J
Pediatr 2007;150:140-5
11. Bakker B, Oostdijk W. Diagnosis and
management of congenital hyperinsulinism: a xase report. European
Journal of Endocrinology 2006;155 e
S153-S155
CORRESPONDÊNCIA
Anabela Bandeira
Serviço de Pediatria – HGSA-CHP
Largo do Prof. Abel Salazar
4099-001 Porto
Telef: 222 077 500