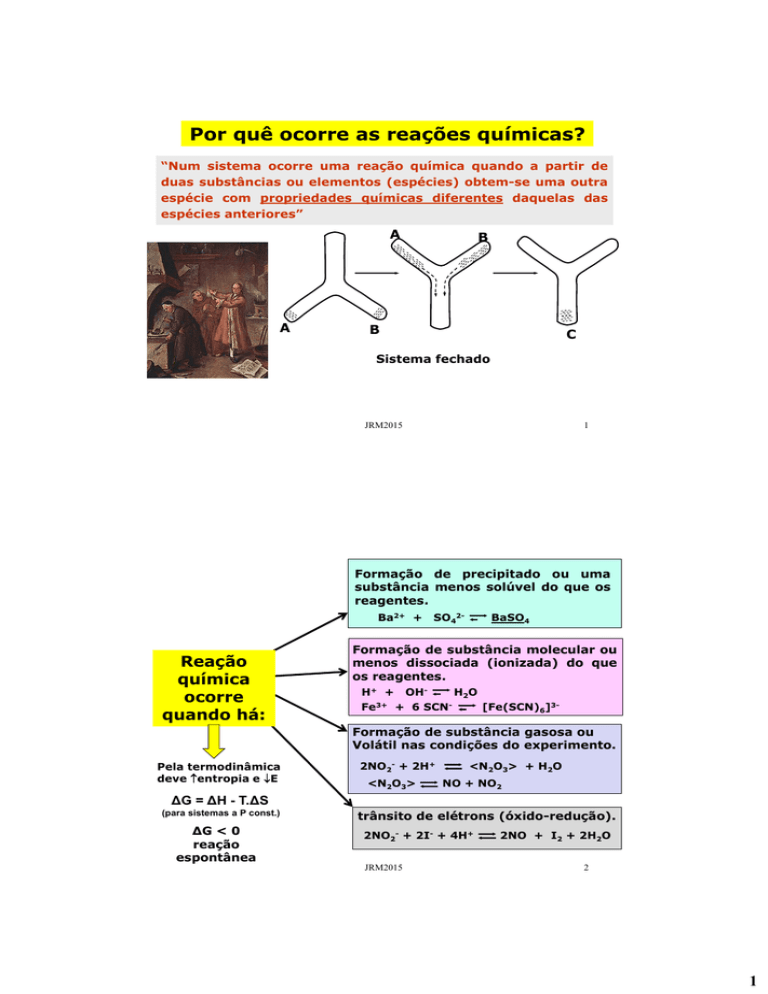
Por quê ocorre as reações químicas?
“Num sistema ocorre uma reação química quando a partir de
duas substâncias ou elementos (espécies) obtem-se uma outra
espécie com propriedades químicas diferentes daquelas das
espécies anteriores”
A
A
B
B
C
Sistema fechado
JRM2015
1
Formação de precipitado ou uma
substância menos solúvel do que os
reagentes.
Ba2+ +
Reação
química
ocorre
quando há:
SO42-
BaSO4
Formação de substância molecular ou
menos dissociada (ionizada) do que
os reagentes.
H+ +
Fe3+
OH-
H2O
+ 6 SCN-
[Fe(SCN)6]3-
Formação de substância gasosa ou
Volátil nas condições do experimento.
Pela termodinâmica
deve entropia e E
2NO2- + 2H+
<N2O3>
<N2O3> + H2O
NO + NO2
ΔG = ΔH - T.ΔS
(para sistemas a P const.)
ΔG < 0
reação
espontânea
trânsito de elétrons (óxido-redução).
2NO2- + 2I- + 4H+
JRM2015
2NO + I2 + 2H2O
2
1
Equilíbrio Químico
Ácido-Base
Solubilidade e precipitação
Complexação
Óxido-redução
JRM2015
3
LEI DA AÇÃO DAS MASSAS (Equílibrio Químico)
Todas as reações químicas são reversíveis:
A + B
1
C+ D
2
Após um t atinge-se o
dinâmico, ou seja, no mesmo t(min) o
número de moléculas de A e B que reagem é = ao número delas que
se formam. As condições de
podem ser facilmente derivadas da
L.A.M. (1879 – Guldberg e Waage).
*CO2 (g)
CO2 (g)
CaCO3(s)
Tcte
t
CaCO3 (s) /CaO(s)
Tcte
CO2 (g)
*CO2 (g)
CaCO3 (s)
Ca*CO3 (s)
CaO(s)
“A veloc. de rç. quim. (v) é massas ativas das subst. reagentes”
4
JRM2015
2
“A velocidade de rç. quim. (v) é massas
ativas das substâncias reagentes”
Termodinamicamente: massas ativas
Atividades (a) {Potencial químico}
Difícil de se determinar experimentalmente ou calcular
teoricamente. Uma boa aproximação está baseado
no estado físico de cada espécie.
a = 1,00 para líquidos puros ou sólidos puros
a = P, isto é, pressão do gás em atmosfera
a = [ ], concentração molar, para solutos em solução muito diluídas.
JRM2015
5
Para a reação:
A + B
C+ D
1
v as atividades de A e B
Matematicamente: Proporcionalidade
igualdade
Então:
v = k aA.aB
cte de proporcionalidade
2
Cte da velocidade de reação
Se a rç é reversível:
A + B
1
C+ D
2
v1 = k1.aA.aB
e
3
v2 = k2.aC.aD
JRM2015
4
6
3
Graficaticamente, tem-se as seguintes situações:
i)
a
a
ii)
v1 = v 2
Produto
Reagente
v1 = v 2
Produto
Reagente
t(seg)
t(seg)
a
iii)
Reagente
v1 = v2 sistema
está em
v1 = v 2
Então:
Produto
k1.aA.aB = k2.aC.aD
5
t(seg)
JRM2015
7
Ou melhor
k1
k2
=
aC.aD
= Keq
aA.aB
6
Cte de
A uma dada T, a cte
terá o mesmo valor númerico
independente das ainiciais dos componentes A, B, C e D e,
também, independe se o
for alcançado a partir de A e B
ou C e D.
Na direção contrária:
C + D
K’eq =
k2
k1
=
aA.aB
aC.aD
A + B
Keq =
JRM2015
1
K’eq
7
8
4
Para a rç:
2A+ B
C
aC
Keq =
2
v1 = k.aA.aA.aB = k.aA .aB
a2 .a
A
B
Generalizando:
mA + nB
r C + sD
r
s
m
n
aC . aD
Keq =
8
9
aA . aB
JRM2015
9
Para solutos em solução a atividade (a) se define por:
a = C.f
concentração
10
a=
Coeficiente de atividade,
normalmente < 1.
No puro
Levando-se em conta a definição de a ,
a equação 9 pode ser escrita como:
Keq
= estado padrão
11
C = 1 mol/L
(CA.fA) . (CB.fB)
Aumentando a diluição: f
Então:
1
r
Keq =
(Cc) . (CD)s
m
m = 1 mol/kg
atividade
s
(Cc.fC)r. (CD.fD)
=
m
n
n
(CA) . (CB)
=
m
xf
m
e
a~
=c
r
s
m
n
[C] . [D]
[ ] expressa o valor
numérico da
concentração
12
[A] . [B]
JRM2015
10
5
As equações 9, 11 e 12
São expressões matemáticas da Lei do
Químico, ou seja, aplicação da Lei da
Ação das Massas a uma reação química.
“Para uma reação química em
, o produto das
concentrações molares (atividades) das substâncias
que se formam, dividido pelo produto das
concentrações molares (atividades) das substâncias
que reagem é constante, desde que cada
concentração (atividade) esteja elevado a um
expoente que corresponda ao coeficiente que
aparece na equação química representativa”.
mA + nB
rC + sD
Keq =
r
s
m
n
[C] . [D]
[A] . [B]
JRM2015
11
Que tipo de informação a Keq nos fornece?
Uma Keq muito alta indica que a rç praticamente ocorre
completamente (da esquerda para a direita), ou seja, a
quantidade de produtos formada é grande.
a
Relação qualitativa entre
a G e a Keq para uma
dada reação.
i)
Produto
v1 = v2
Reagente
∆Gº=∆Hº - T∆Sº
t(seg)
O valor da Keq não fornece nenhuma informação sobre o
tempo necessário para que o seja alcançado, somente indica
a extensão em que a reação ocorre.
Keq = 1,1x105 formação do
CaSO4 , porém a rç é lenta.
Keq = Ka = 1,75x10-5 ionização do Hac.
JRM2015
12
6
Tipos de Equilíbrio
Equilíbrio
Dissociação
ácido-base
Equação
Constante de Equilíbrio
HA + H2O
HAc + H2O
XOH
Complexação
Oxidaçãoredução
+
Ac-
+
Ag+
Mn+ + a Lb-
+
Ks, Produto de solubilidade
Ks = [Ag+] [Cl-] = 1,6x10-10
Kf, Constante de formacão
ou constante de estabilidade
MLa(n-ab)+
[Fe(CN)6]4-
XRED + YOX
Xox + Yred
I2 (H2O)
[NH4+] [OH-]
= 1,75x10-5
[NH4OH]
Kb =
Cl-
Fe2+ + 6 CN-
AH2O
[H3O+] [Ac-]
= 1,74x10-5
[HAc]
Kb, Constante da base
OH-
Mx+ + Ay-
5Fe2++MnO4- + 8H+
Distribuição
de fase
Ka =
NH4+
M y Ax
AgCl
Ka, Constante do ácido
H3O+
OH- + X+
NH4OH
Solubilidade
H3O+ + A-
Kf =
[Fe(CN)64-]
= 1x1037
[Fe2+] [CN-]6
Keq, Constante de equilíbrio
da reação
Mn2++ 5Fe3++4H2O
Asolvente org.
I2 (CHCl )
Keq=
[Fe3+]5 [Mn2-]
=
[Fe2+]5[MnO4-][H+]8
Kd, Coeficiente
de distribuição
3
JRM2015
13
Formação de precipitado ou uma
substância menos solúvel do que os
reagentes.
Ba2+ +
Reação
química
ocorre
quando há:
SO42-
BaSO4
Formação de substância molecular ou
menos dissociada (ionizada) do que
os reagentes.
H+ +
Fe3+
OH-
H2O
+ 6 SCN-
[Fe(SCN)6]3-
Formação de substância gasosa ou
Volátil nas condições do experimento.
Pela termodinâmica
deve entropia e E
2NO2- + 2H+
<N2O3>
<N2O3> + H2O
NO + NO2
ΔG = ΔH - T.ΔS
(para sistemas a P const.)
ΔG < 0
reação
espontânea
trânsito de elétrons (óxido-redução).
2NO2- + 2I- + 4H+
JRM2015
2NO + I2 + 2H2O
14
7
EQUILÍBRIO DE SOLUBILIDADE E EQUÍLÍBRIO HETEROGÊNEOS
1) Uma reação química se processa se for possível a formação de um
precipitado ou uma substância menos solúvel que os reagentes.
É uma susbtância insolúvel no meio.
MxAy
x
... ..
...
MxAy
Keq =
xxxx
xxxx
[My+] [Ax-]
xMy+ + yAxy
[MxAy]
Keq . [MxAy]
cte. = Ks (produto
Sólido
cte.
sem se
dissolver
H2 O
MxAy
Alguns íons
My+ Ax-
Sal pouco
solúvel
de solubilidade)
x
É uma susbtância que atingiu o
PRODUTO DE SOLUBILIDADE .
y
KsM A = [My+] [Ax-]
x y
Num determinado meio e
a uma dada temperatura
Ks ou Kps
É o produto da [ ] de cátions pela de ânions afetadas de
expoentes que são iguais aos coeficientes dos respectivos
JRM2015
íons da equação química representativa.
Então:
15
“Uma susbtância precipita quando o Ks é alcaçado. A
precipitação é tanto mais fácil quanto menor for o Ks”.
Só tem sentido falar em Ks para sais pouco solúveis.
Alguns íons
My+ Ax-
... ..
.
xxxx
xxxx
NaCl
Sal
insolúvel
H2O
grande
qtidade. de
íons Na+ Cl-
Totalmente
solúvel em H2O
SOLUBILIDADE (S): É a máxima qtidade de
soluto que pode ser dissolvida numa
qtidade pré-fixada de solvente numa
dada temperatura.
Pode ser expressa em g/L, mol/L
ou msoluto/100 g solvente.
Ex.
(25oC
em H2O)
NaCl
360 g/L
solúveis.
KClO3
80 g/L
AgCl
0,0018 g/L
Ag2CrO4 0,0430 g/L
Insolúveis ou
pouco solúveis
SOLUBILIDADE , DE MANEIRA GERAL COM O T
JRM2015
16
8
3- Determinação e significado numérico do Ks
1
AgCl
Filtração, secagem e pesagem
da massa não dissolvida
(10,0000 g)
9,9982 g
Logo: 0,0018 g/L foram disssolvidos
1 L H2 O
Então:
Solubilidade
[AgCl]dissolvida = S =
0,0018 g/L
-5
SAgCl = 1,26 x 10 mols/L
143,3 g/mol
mdissolvida/L
Massa molar
Sobrenadante
(solução saturada)
0,0018 g de AgCl em solução
na forma de Ag+ e Cl-
AgCl(s)
(9,9982 g)
17
JRM2015
Na equação do equilíbrio da dissociação tem-se:
1
AgCl
S
1
Logo em solução:
1
Ag+ + ClS
[Ag+] = [Cl-] = S = 1,26 x 10-5 mols/L
S
Então: Ks = [Ag+][Cl-] = (1,26 x 10-5) (1,26 x 10-5) = 1,56 x 10-10
Observe que o Ks tem uma relação direta com a solubilidade (S).
[AgCl]solução = S = [Ag+]= [Cl-]
Então para o AgCl:
Ks = [Ag+][Cl-] = S
x
S = S2 SAgCl =
JRM2015
Ks
18
9
Ex.
2
Pesagem = 10,0000 g de Ag2CrO4
Dissolução = 1 L de H2O
Filtração, secagem e pesagem = 9,9570 g (sólido retido no filtro)
m Ag
2CrO4
= 10,0000 g - 9,9570 g = 0,0430 g
solução
Como 0,0430 g foram dissolvidos em 1 L de H2O, tem-se:
0,0430 g/L
331,8 g/mol
[Ag2CrO4]solução =
-4
SAg2CrO4 = 1,3 x 10 mols/L
Na equação do equilíbrio da dissociação tem-se:
1
2
Ag2CrO4
S
2
Ag+
Logo em solução:
1
+ CrO4
2S
[Ag+] = 2S = 2 x 1,3 x 10-4 mols/L
2-
S
[CrO42-] = S = 1,3 x 10-4 mols/L
Então: Ks = [Ag+]2[CrO42-] = (2,6 x 10-4)2 (1,3 x 10-4) = 8,8 x 10-12
Ks = [Ag+]2[CrO42-] = (2S)2
x
(S) = 4S3 S =
3
Ks/4
19
JRM2015
Uma substância será tanto mais insolúvel quanto menor for o Ks.
Pergunta-se: Qual sal é mais insolúvel Ag2CrO4 ou AgCl?
Composto
KS
Solubilidade (mol/L)
Ag2CrO4
8,8 x 10-12
1,3 x 10-4
AgCl
1,56 x 10-10
1,26 x 10-5
Apesar do Ks Ag
2CrO4
ser < do que o Ks AgCl
o Ag2CrO4 é mais solúvel, ou seja,
Quanto menor a solubilidade menor será o Ks.
Conclusão: Só se pode comparar Ks de espécies de
mesmas fórmulas estequiométricas.
20
JRM2015
10
Qual é o limite para um sal ser considerado
solúvel ou insolúvel?
Não há um limite muito bem definido.
Alguns autores sugerem que sais cuja [íons] em uma
solução saturada for < 0,02 mol L-1, sejam considerados
insolúveis.
sais
Cátions....... Mx+
Ânions........ Ax-
proporção 1:1
MxAx = MA
[Mx+] = [Ax-] = 0,02 mol/L
Kps = [Mx+] [Ax-] = 0,02x0,02 = 4x10-4
(da ordem de 10-4 para baixo)
JRM2015
21
Para saber qual sal é mais solúvel ou insolúvel
deve-se determinar a sua solubilidade (S)
QUAL A RELAÇÃO S
KS?
Alguns tipos comuns de expressões de produto de solubilidade
FÓRMULA
EQUILÍBRIO DE SOLUBILIDADE
EXPRESSÃO PARA
Kps
s, a solubilidade molar, é a concentração molar na solução saturada do soluto dissolvido
na forma dos íons que são os produtos da reação do equilíbrio de solubilidade.
OBS.: Ks é um número muito pequeno, não tem sentido falar
em Ks para substâncias solúveis.
Ks Aspecto
quantitativo
JRM2015
22
11
VALORES DAS CONSTANTES DOS PRODUTOS DE SOLUBILIDADE À 25oC
Equilíbrio de solubilidade
BaCO3
Ba2+ + CO32-
Ks
Equilíbrio de solubilidade
Ks
5,1X10-9
SrCO3
CaCO3
Ca2+ + CO32-
Sr2+ + CO32-
1,1X10-10
2,8X10-9
MgCO3
Mg2+ + CO32-
Mg (OH)2
RELAÇÃO S
Ks
Equilíbrio de solubilidade
Mg2+ + 2OH-
5
3,5X10-5
1,8X10-11
Em alguns casos pode ocorre pptação simultânea. Por quê a
reação entre Mg2+ e CO32- conduz à pptação do Mg(OH)2CO3?
KS
JRM2015
23
Tipos de Equilíbrio
Equilíbrio
Equação
Solubilidade
M y Ax
AgCl
Mx+ + Ay-
Constante de Equilíbrio
Ks, Produto de solubilidade
AgCl
Ag+ + Cl-
Ks = [Ag+] [Cl-] = 1,6x10-10
AgBr
Ag+ + Br-
Ks = [Ag+] [Br-] = 5,0x10-13
AgI
Ag+ + I-
Ks = [Ag+] [I-] = 8,5x10-17
AgBr
JRM2015
AgI
24
12
Constante de Formação dos Complexos a 25oC:
AgCl2-........1,62x105
5
AgCl32-........1,26x10
Precipitação
AgBr2-........3,02x107
8
AgBr32-........7,24x10
consecutiva
AgI2-..........3,47x1011
AgI
Ag+
Ag+ + 3 IAgI
+
2
AgI32-.........2,29x1013dos AgX
+ I-
Ks = 8,5x10-17
[AgI32-]
I-
[AgI3
Kf =
2-]
Numa mistura
de Cl-, Br- e I-os íons
2,29x1013
Ag+ devem ser
Keq = KsxKf
AgCl
adicionados em
excesso para garantir
Considerando 0,1 mol/L de AgI a ser dissolvido. Logo,
se formará
a precipitação
0,1 mol/L do complexo, então:
-10
quantitativa de
Ks ~ 10
[AgI
AgBr
K =
eq
3
2-]
[I ]
Ks ~ 10-13
- 2
[I-]2 =
= 1,95x10-3
todos os íons.
0,1 mol/L
= 51,28
1,95x10-3
[I-] = 7,16 mol/L
AgI
Ks ~ 10-16
(Foto cedida pela aluna Cynthia Fernandes (Disciplina QFL 230 – Curso de Farmácia Noturno – IQ-USP 2013)
2) Uma reação química se processa quando ocorre a
formação de uma substância molecular ou menos
dissociada (ionizada) do que os reagentes.
Ex. a) Ácido/Base: H3PO4 + NH4OH
(NH4)3PO4 + 3 H2O
Qualquer H+ ou/e qualquer OH- reagem entre si porque forma
água (substância Molecular)
Portanto, ÁCIDO + BASE
..................................
Outros exemplos:___________________________________________________
H+ + OH-
H2O
JRM2015
26
13
Reação de Neutralização
Um composto iônico constituído por um cátion
diferente do H+ e um ânion diferente do OH- ou O2-.
ácido + base
sal + água
Equação molecular
HCl (aq) + NaOH (aq)
H+ + Cl- + Na+ + OHÁcido
H+
Íons espectadores
NaCl (aq) + H2O
Na+ + Cl- + H2O
base
+ OHEquação líquida
JRM2015
H2O
27
ÁCIDOS E BASES
HCl(g) + H2O(l)
H3O+(aq) + Cl-(aq)
FORTE
Considere 1 L de Solução:
HCl Solução
concentrada
a) Calcule a massa dessa 1 L de solução.
d=
%p = 36 – 37%
d = 1, 19 g/cm3
Como é obtida?
m
V
m = 1,19 g/cm3x1000 cm3
m = 1190 g
b) Calcule a massa de HCl nessa
quantidade de solução.
1190 g
mHCl
100%
37%
mHCl = 440,3 g
28
JRM2015
14
ÁCIDOS E BASES
H3O+(aq) + Cl-(aq)
HCl(g) + H2O(l)
FORTE
Considere 1 L de Solução:
HCl Solução
concentrada
c) Calcule a concentração do HCl em
mols/L nessa solução.
M=
m (g)
MM (g/mol)xV(L)
%p = 36 – 37%
d = 1, 19 g/cm3
=
440,3
36,5x1
mol/L
M = 12,06 mol/L
Como é obtida?
29
JRM2015
Número de mols
=
HCl Solução
concentrada
m (g)
MM (g/mol)
ou
= M (mol/L)xV(L)
Considere 1 L de Solução:
d) Qual a concentração molar em íons H+
quando 1 gota (0,05 mL) dessa solução é
adicionada a 1 L de H2O destilada?
DILUIÇÃO
%p = 36 – 37%
d = 1, 19 g/cm3
Como é obtida?
antes = após
0,05 mLx12,06 mol/L = 1000 mLx Mapós
Mapós = 6,03x10-4 mols/L
e) Qual o pH dessa solução diluída?
pH = 3,22
30
JRM2015
15
ÁCIDOS E BASES
HCl(g) +
H3O+(aq) + Cl-(aq)
H2O(l)
O no de moléculas ionizadas é
grande comparada ao no de
moléculas iniciais. A relação
entre eles expressa o grau de
ionização
(),
que
permite
encontrar o a const. de ionização
do ácido (Ka).
H3O+, Cl-
ctes
=
HCl
tempo
no moléculas
ionizadas
no moléculas
iniciais
=
Cionizado
x100
Cinicial
Em soluções diluídas HCl = totalmente ionizado.
Logo, não tem sentido falar em Ka para ácidos fortes.
31
JRM2015
HCN(aq )
+
ácido
FRACO
H2O(l)
CN–(aq)
base
base
EQUILÍBRIO
+
H3O+(aq)
ácido
DINÂMICO
Mesmo em soluções diluídas HCN = muito pouco
ionizado
HCN
é
baixo
Um ácido fraco é melhor
definido em termos da Ka .
ctes
H3O+, CN
–
Ka =
[H3O+] [CN-]
[HCN]
= 4,93x10-10
tempo
JRM2015
32
16
Ácido fraco: HAc
Ácido forte: HCl
Antes da
Dissociação
ou ionização
Antes da
Dissociação
No
equilíbrio
HCl
H+
HAc
HAc
Cl-
H+
Ac-
A concentração molar da
forma não ionizada { [Ac-]
e [H+] }, no equilíbrio, é
. O é .
A concentração molar da forma
não ionizada { [Cl-] e [H+] }, no
equilíbrio, é muito ,
praticamente, ocorre
No
equilíbrio
100%
[Ac-] [H+]
Ka =
de ionização
[HAc]
= 1,75x10-5
Qual a % de ionização ou
grau de ionização () da
solução 1 mol/L de HAc?
JRM2015
Ácido fraco: HAc
Antes da
Dissociação
33
Solução 1 mol/L de HAc
No
equilíbrio
HAc
HAc
HAc
99,582%
100%
0,418%
H+
Ac-
+
H+
início
1
0
0
Dissoc. e
forma
x
x
x
1-x
x
x
Ac-
1 – x ~ 1 e x = [Ac-] = [H+]
A concentração molar da
forma não ionizada { [Ac-]
e [H+] }, no equilíbrio, é
. O é .
Ka =
x.x
1
= 1,75x10-5
x2 = 1,75x10-5
Ka =
[Ac-] [H+]
[HAc]
x = [Ac-] = [H+] = 4,18x10-3 mol/L
= 1,75x10-5
Qual a % de ionização ou
grau de ionização () da
solução 1 mol/L de HAc?
=
JRM2015
4,18x10-3
1
100 = 0,418%
34
17
Base fraca : NH4OH
Base forte: NaOH
Antes da
Dissociação
Antes da
Dissociação
No
equilíbrio
NaOH
Na+
No
equilíbrio
NH4OH
NH4OH
OHNH4+ OH-
A concentração molar da
forma não ionizada
{ [OH-] e [NH4+] }, no
equilíbrio, é . O é .
A concentração molar da forma
não ionizada { [OH-] e [Na+] },
no equilíbrio, é muito ,
praticamente, ocorre 100% de
ionização
Kb =
[OH-] [NH4+]
[NH4OH]
= 1,75x10-5
JRM2015
35
Ácidos Fortes do ponto de vista prático estão
completamente ionizados em.
HNO3
H 2O
H+ +
NO3-
H+
Bases Fortes do ponto de vista prático estão
completamente ionizadas em H2O.
NaOH
H 2O
Na+
+
OH-
OH-
Ácidos Fracos ionizam de forma limitada em H2O.
CH3COOH
H 2O
CH3COO- + H+
HAc
Bases Fracas ionizam de forma limitada em H2O.
NH3
+
H2O
NH4+
JRM2015
+
OH-
NH4OH
36
18
Como deduzir que água
pura tem pH=7?
IONIZAÇÃO DA AGUA
Considere um litro de ÁGUA que na temperatura
de 25oC apresenta d = 0,997 g/cm3
No equilíbrio tem-se:
H2 O
H+ + OH-
997 g
m
[H2O] =
=
= 55,4 mol/L
18 g/mol
M*
Keq =
Cte.
[H+] [OH-]
Keq x [H2O] = [H+] [OH-]=
[H2O]
= 1,81x10-16
Cte. do produto
iônico da H2O
Kw
Keq x [H2O] = 1,81x10-16 x 55,4 = 1,00x10-14 = Kw = [H+] [OH-]
JRM2015
37
Keq x [H2O] = 1,81x10-16 x 55,4 = 1,00x10-14 = Kw = [H+] [OH-]
mas no equilíbrio a proporção é 1:1, ou seja, [H+] = [OH-]
Então, Kw = [H+]2
ou
Kw varia com a Temperatura
Kw = [OH-]2 = 10-14 (25oC)
Para soluções muito diluida
utiliza-se a notação: p = -log
[H+] = Kw = 10-7
[OH-] =
[Sorensen (1909) ]
ou
Kw = 10-7
-log[H+] = pH e –log[OH-] = pOH
pH= pOH = 7
Adição de 10-8 mols de HCl
em 1 L de água. Qual o pH?
X2 - 2,1.10-7x + 10-15 = 0
JRM2015
38
19
Relação entre pH e pOH
[H3O+]
[OH-]
pOH
14
10-14
1
0
7
10-7
10-7
7
0
1
pH
Solução
Alcalina
Neutra
(H2O sem CO2)
Ácida
pH
[H3O+]
10-14
[OH-]
14
pOH
pH + pOH = pKw
a 25oC
pH + pOH = 14
JRM2015
39
Cálculo de pH
Para calcular o pH de qualquer solução, a 1a
etapa é encontrar a [H+] ou [OH-]. Para:
Ácidos fortes o H+ está totalmente ionizado.
De maneira geral a [H+] [ácido].
Bases fortes a OH- está totalmente dissociada.
De maneira geral [OH-] [base].
Ácidos fracos e bases fracas, além da [ácido] ou
da [base], deve-se levar em conta a Ka ou a Kb.
JRM2015
40
20
a) Calcular o pH de uma solução de HCl 0,1 mol/L?
HCl é ácido forte, está praticamente 100% ionizado
Logo [H+] = [HCl] = 0,1 mol/L. Então:
pH = -log [H+] pH = -log 0,1 = 1
b) Calcular o pH de uma solução de NaOH 0,1 mol/L?
NaOH é base forte, está praticamente 100% dissociada
Logo [OH-] = [NaOH] = 0,1 mol/L. Então:
pOH = -log [OH-] pOH = -log 0,1 = 1, logo pH = 13
c) Como calcular o pH de uma solução de HAc 0,1 mol/L:
Ka = 1,75x10-5
d) Como Calcular o pH de uma solução de NH4OH 0,1 mol/L:
Kb = 1,76x10-5
JRM2015
Solução 0,1 mol/L de NH4OH
Solução 0,1 mol/L de HAc
HAc
Ac-
+
41
NH4OH
H+
NH4+ +
OH-
início
0,1
0
0
início
0,1
0
0
Diss. e
forma
x
x
x
Diss. e
forma
x
x
x
0,1-x
x
x
0,1-x
x
x
0,1 – x ~ 0,1 e x = [NH4+] = [OH-]
0,1 – x ~ 0,1 e x = [Ac-] = [H+]
Ka =
x.x
0,1
Kb =
= 1,75x10-5
x.x
0,1
= 1,76x10-5
x2 = 1,75x10-6
x2 = 1,76x10-6
x = [Ac-] = [H+] = 1,32x10-3 mol/L
x = [NH4+] = [OH-] = 1,33x10-3 mol/L
pOH = 2,88 pH = 11,12
pH = 2,88
JRM2015
42
21
Hidrólise
JRM2015
43
pH EM SOLUÇÕES DE CÁTIONS OU ÂNIONS
QUE PROVOCAM HIDRÓLISE
Interação entre os íons do sal
dissolvido e os íons H+ e OH- da H2O.
Esses íons deslocam o equílibrio iônico da H2O.
H2O
H+
+
OH-
Kw
INTERAGEM
ÂNIONS
CÁTIONS
Derivados de
ácidos fracos
Derivados de
bases fracas
formando o ácido não
dissociado correspondente
e [OH-] no meio
>7
formando a base não
dissociada correspondente
e [H+] no meio
pH da
solução
<7
JRM2015
44
22
Qual o pH de uma solução de H3CCOONa (NaAc) 0,1 mol/L?
(Ka = 1,75x10-5)
O NaAc é um sal totalmente dissociável e portanto é um eletrólito
forte. Sua dissolução em água pode ser representada por :
NaAc
H 2O
AcAcKeq =
Ac- +
H+
H+
+
=
OH-
HAc
+ H2 O
Kw
Ka
+
[H2O][Ac-]
Portanto, Kh =
Kw
Ka
pOH = 5,1
=
Kw
1/Ka
HAc +
[HAc] [OH-]
Derivado de base forte,
não provoca hidrólise
Na+
Keq =
OH-
keqx[H2O] = kh
10-14
1,75x10-5
=
[OH-]2
0,1
Kw
Ka
, mas no
,
[HAc] = [OH-]
[OH-] = 7,5x10-6
Sais derivados de ácido fraco provocam
hidrólise dando soluções alcalinas
pH = 8,9
45
JRM2015
Qual o pH de uma solução de NH4Cl 0,1 mol/L? (Kb = 1,76x10-5)
O NH4Cl é um sal totalmente dissociável e portanto é um eletrólito forte.
Sua dissolução em água pode ser representada por :
NH4Cl
H 2O
NH4
+
NH4+ +
H+
+
+
OH-
Keq =
Kw
Kb
=
pOH = 8,9
Kw
1/Kb
Keq =
NH4OH + H+
[NH4OH] [H+]
Portanto, Kh =
pH = 5,1
OHNH4OH
NH4+ + H2O
Derivado de ácido forte,
não provoca hidrólise
Cl-
, mas no
,
[NH4OH] = [H+]
[NH4+]
Kw
Kb
=
10-14
1,76x10-5
Kw
Kb
=
[H+]2
0,1
[H+] = 7,5x10-6
Sais derivados de base fraca provocam
hidrólise dando soluções ácidas
46
JRM2015
23
Tampão
JRM2015
47
Solução Tampão
São aquelas soluções “insensíveis” à adição
de ácido ou base (variam relativamente
pouco o pH pela adição de um ácido ou uma
base). As substâncias que constituem os
tampões agem aos pares ou, menos
comumente, em grupos, constituindo um
sistema protetor.
JRM2015
48
24
Uma solução tampão é aquela formada por:
1. Um ácido fraco ou uma base fraca e
2. O sal do ácido fraco ou base fraca
Ambos devem estar presentes!
Uma solução tampão tem a capacidade de resistir a
pequenas variações de pH sob pequenas adições de
quantidades de ácidos ou bases.
Considere uma mistura equimolar de CH3COOH e CH3COONa
1
CH3COOH (aq)
H+ (aq) + CH3COO- (aq)
2
Adição de: a) ácido: H+ reage com Ac- deslocamento para 2
b) base: OH- reage com HAc deslocamento para 1
O pH permanece praticamente constante.
HCl 0,1 mol/L
JRM2015
0
50
Considere:
49
HCl
H+ + Cl-
HCl + CH3COOHCl
add
CH3COOH + ClKa=
= 0,1 mols/L x Vtotal(L)
HAc = NaAc = 0,2 mols x 50x10-3 L = 0,01 mols
[H+] =1,75x10-5 x
50 mL solução Tampão
0,2 mol/L em HAc/NaAc
ou 50 mL H2O destilada
HCl add
(x10-3)
HAc
(x10-3)
Acetato
(x10-3)
0
0
10
10
1
20
2
[HAc]
[Ac-]
pH = -log [H+]
8
pH
H2O
Solução
Tampão
10
7
4,74
11
9
1,78
4,67
12
8
1,54
4,58
30
3
13
7
1,43
4,49
40
4
14
6
1,35
4,39
50
5
15
5
1,30
4,28
7,07
6
pH
VHCl add
(mL)
[Ac-] [H+]
= 1,75x10-5
[HAc]
4
Série1
3,03
Série2
H 2O
2
1,01
0
JRM2015
Solução tampão
5,05
0
1
3
4
5
12
3
4
5
6
2
Mols de HCl add x 10-3
50
25
Ex.: Na preparação da solução tampão de HAc/NaAc 0,1 mol/L
pode-se misturar HAc 0,1 mol/L com NaAc 0,1 mol/L.
A solução de HAc 0,1 mol/L apresenta pH 2,87, isto é:
HAc
H+
+
no
HAc
(Ka = 1,75x10-5 );
[H+] = [Ac-]
[Ac-] [H+]
Ka=
1 L de HAc
(0,1 mol/L)
pH = 2,87
Ac-
[H+]2 = Ka . Ca
pH = 2,87
= 1,75x10-5
[HAc]
Ca
(Conc. inicial
do ácido)
Ka=
[Ac-] [H+]
pH = pKa - log
[HAc]
[H+] = Ka x
[HAc]
[Ac-]
Equação de Henderson-Hasselbalch
[HAc]
NÃO DECORE FÓRMULAS
[Ac-]
JRM2015
51
pH de uma solução de H3CCOONa (NaAc) 0,1 mol/L = 8,9
(Ka = 1,75x10-5)
NaAc
H 2O
Ac-
Ac- +
H+
+
H+
Kw
Ka
=
OH-
HAc
Ac- + H2O
Keq =
+
Derivado de base forte,
não provoca hidrólise
Na+
Kw
1/Ka
Keq =
HAc + OH-
[HAc] [OH-]
[H2O][Ac-]
Portanto, Kh =
Kw
Ka
=
keqx[H2O] = kh
10-14
1,76x10-5
=
[OH-]2
0,1
Kw
Ka
, mas no
,
[HAc] = [OH-]
[OH-] = 7,5x10-6
pOH = 5,1
pH = 8,9
52
JRM2015
26
A mistura HAc/Ac- 0,1 mol/L apresenta pH 4,74, porque,
Na mistura de HAc e Ac- em solução temos:
[Ac-] e, portanto, [H+] e [HAc], então o
pH deve . Independente do que ocorra o
HAc/Ac-
é restabelecido, porém, o valor de Ka não se
altera.
1 L de HAc/NaAc
Ambos 0,1 mol/L
HAc
H+
+ Ac-
NaAc
Na+
+
Então: Ka=
Ac-
[Ac- + Ac-] [H+]
[HAc]
0,1 mol/L
= 1,75x10-5
0,1 mol/L
pH = 4,74
Logo, [H+] = Ka = 1,75x10-5
Como varia o pH dessa solução tampão quando se
adiciona 0,01 mol/L de HCl ou 0,01 mol/L de NaOH?
JRM2015
53
53
adição de 0,01 mol de HCl ou NaOH
a) adição de HCl:
(reage com
1 L de
HAc/NaAc
Ambos
0,1 mol/L
pH = 4,74
Ac-)
HAc
H+
NaAc
Na+
+ Ac+ Ac-
[Ac-] em 0,01 mol
[HAc] em 0,01 mol
No equílibrio : [HAc] = 0,1 + 0,01 = 0,11
[Ac-] = 0,1 - 0,01 = 0,09
pH = pKa – log
b) adição de OH-: HAc
(reage com HAc) NaAc
[HAc]
= 4,74 - log
[Ac-]
0,11
= 4,74
0,09
H+ + Ac-
[Ac-] em 0,01mol
Na+
[HAc] em 0,01mol
+
Ac-
=
4,66
pH=0,12
No equílibrio : [HAc] = 0,1 - 0,01 = 0,09
[Ac-] = 0,1 + 0,01 = 0,11
pH = pKa – log
[HAc]
[Ac-]
= 4,74 - log
JRM2015
0,09
= 4,74
0,11
=
4,84
54
27
Aplicação:
2 CrO42- + 2 H+
2 HCrO4-
Existe em meio
básico [CrO42-]
Cr2O72- + H2O
Existe em meio
ácido [CrO42-]
H+
[Cr2O72-]
OH-
[CrO42-]
pH 5
Ba2+ +
Cr2O72-
BaCrO4
HAc/Ac-
Os Cr2O72- são solúveis, portanto, se ocorrer
pptação só pode ser cromato CrO42-.
BaCrO4
Ks
10-10
SrCrO4
10-5
O BaCrO4 para pptar. precisa de uma [CrO42-] < do que
aquela existente em pH 5, enquanto o SrCrO4 não
ppta. nessas condições. Então em meio HAc/Ac- é
possível separar quantitativamente o Ba2+ do Sr2+.
JRM2015
55
2) Uma reação química se processa quando ocorre a
formação de uma substância molecular ou menos
dissociada (ionizada) do que os reagentes.
b) Complexação: AgCl + NH4OH
AgCl
+
NH3HOH
Ag+ + NH3HOH
OCORRE?
Ag(NH3)2+Cl-
(S.L.T. incolor, cloreto de diamin prata)
Ag(NH3)2+
(COMPLEXO, subst.
muito pouco dissociada)
Complexo ou composto de coordenação
é uma substância muito estável.
Ag(NH3)2+
Ag+ + NH3
COMPLEXO OU COMPOSTO DE COORDENAÇÃO
JRM2015
56
28
DEFINIÇÕES
Complexo: Espécie em que um íon central, geralmente,
um cátion é rodeado por um certo número de ligantes, que
podem ser moléculas (neutras) ou ânions.
são compostos formados por
interações ácido-base de Lewis.
Íons Metálicos
são ácidos de
Lewis (espécies
receptoras de
pares elétrons).
Ligantes são bases
de Lewis (espécies
doadoras de pares
de elétrons).
[Cu(H2O)4]2+
O No de ligantes é denominado No de coordenação (NC) e é
função do raio e carga, tanto do íon central como do ligante.
Cu2+(aq)
Representação
mais precisa
[Cu(H2O)4]2+
Um íon metálico central (Cu2+) é rodeado de moléculas
de água.
As moléculas de água orientam-se de acordo com a
atração eletrostática entre a carga do cátion e os pares
de elétrons não partilhados da molécula de água que é o
ligante.
JRM2015
58
29
Nos íons complexos :
Designa-se por ligante as moléculas ou íons que
possuem pares de elétrons não ligados.
O átomo central é um íon do metal (aceita elétrons ).
A ligação coordenada envolve pares de elétrons
não ligados dos ligantes.
Designa-se por no de coordenação (NC) o no de
pares eletrônicos aceitos pelo átomo central.
JRM2015
59
[Cu(H2O)4]2+
Íon central – Cu2+
Ligante – H2O
NC – 4
Nome - Tetraaquo cobre (II)
JRM2015
60
30
[Zn(OH)4]2-
Íon central – Zn2+
Ligante – OH- (hidróxi)
NC – 4
Nome - Tetrahidroxi de zincato
JRM2015
61
[CoCl(NH3)5]2+
Íon central – Co3+
Ligantes – Cl- (cloro) e NH3 (amin)
NC – 6
Nome -Monocloro, pentaamin cobalto (III)
JRM2015
62
31
Alguns ligantes comuns
Ligante
Nome nos
complexos
ligante
Nome nos
complexos
Brometo, Br-
Bromo
Oxalato, C2O42-
Oxalato
Cloreto, Cr-
Cloro
Óxido, O2-
Oxo
Cianeto,
CN-
Ciano
Amônia, NH3
Amin
Fluoreto,
F-
Fluoro
Monóxido de carbono, CO
carboxi
Hidroxi
Água, H2O
aquo
Tiociano
Etilenodiamina, en
Etilenodiamino
Hidróxido, OHTiocianato,
SCN-
• Os NC mais comuns são 4 e 6.
NC = 4 (tetracoordenados) ; NC = 6 (hexacoordenados)
JRM2015
63
b.1) Quando o ligante é um ânion a carga do complexo
dependerá do no de coordenação.
Ex. Fe3+ + 1 SCN-
[Fe(SCN)]2+ (monotiociano ferro III)
solução límpida transparente
vermelho-claro
Fe3+ + 3 SCN-
[Fe(SCN)3]
(tritiociano ferro III)
Vermelho
Fe3+ + 6 SCN-
[Fe(SCN)6]3- (hexatiociano ferrato III)
Vermelho-sangue
b.2) Quando o ligante é uma molécula (neutra) a carga
do complexo é a mesma do cátion central.
Ex. Fe2+ + NO
[Fe(NO)]2+ (ferro nitrosilo)
JRM2015
64
32
Complexos formados com OH- (hidroxi complexos)
e NH4OH (amin complexos). Exemplos:
Íon central:Sn4+; NC = 6; carga do complexo = 2-
[Sn(OH)6
]2-
Ligante: HO- (hidroxi);
Nome: Hexahidroxi estanato
Íon central:Cu2+; NC = 4; carga do complexo = 2+
[Cu(NH3)4]2+
Ligante: NH3 (amin);
Nome: Tetra-amin cobre (II)
JRM2015
hidroxi
complexos:
65
Zn2+ + OH-
Zn2+ + NH4OH
amin
complexos:
REAÇÕES DE CÁTIONS COM BASE FORTE (OH-) E BASE FRACA (NH4OH)
PRECIPITAÇÃO E
EVENTUAL REDISSOLUÇÃO COM FORMAÇÃO DE
COMPLEXOS (ver Tabela a seguir). Escreva as equações de reação e
observe que é possível montar esquemas de separação de cátions em
misturas.
JRM2015
66
33
Reações de cátions usuais
com base forte (OH-) e
base fraca (NH4OH)
precipitação e eventual
redissolução com
formação de complexos
De acordo com os
produtos formados em
cada caso, como
equacionar corretamente
as equações de reação?
I.E. = Insolúvel no excesso
S.L.T.I. = solução límpida, transparente e incolor
67
JRM2015
Na+OH- gotas
Antes da adição de NaOH
NH4OH gotas
Após adição de algumas
gotas de NaOH
Ponto final
NH4OH excesso
JRM2015
68
34
Reações de cátions usuais com base forte (OH-) e base
fraca (NH4OH) precipitação e eventual redissolução
com formação de complexos
Aplicação: Uma liga de bronze via de regra é constituída por
Cu0 e Sn0. Como separar os elementos presentes nessa liga?
Cu0
Cu2+
Cu(NH3)42+
Sn0
HNO3 dil (brando)
Sn2+
NH4OH exc.
Sn(OH)2
H+
H+
Cu2+
Sn2+
Filtração
JRM2015
69
Aplicação: O latão (utilizado em armas e torneiras) é uma liga
constituída por Cu0 e Zn0. Como separar os elementos
presentes nessa liga?
Cu0
Cu2+
Cu(OH)2
H+
Cu2+
Zn0
HNO3 dil (brando)
Zn2+
OH- exc.
[Zn(OH)4]2H+
2+
Zn
Filtração
JRM2015
70
35
Aplicação: Separação de misturas cátions metálicos. Após
retirada da Ag+, usando com base fraca
Ag+ Cu2+ Fe3+ Zn2+ Al3+ NO3- H+
ClAgCl
Cu2+ Fe3+ Zn2+ Al3+
NH4OHEXC.
JRM2015
71
Reações de cátions usuais com base forte (OH-) e base
fraca (NH4OH) precipitação e eventual redissolução
com formação de complexos
Aplicação: Separação de misturas cátions metálicos. Após
retirada dos íons Ag+ e usando com base forte
Ag+ Cu2+ Fe3+ Zn2+ Al3+ NO3- H+
ClAgCl
Cu2+ Fe3+ Zn2+ Al3+
OH-EXC.
JRM2015
72
36
3) Uma reação química se processa quando houver
possibilidades de formação de uma substância gasosa
ou volátil nas condições do experimento.
NH4+
(sólido)
+
OH-
O aquecimento deve ser
feito de cima para baixo.
NH3
brando
0,5 cm abaixo
da rolha
H2 O
Abertura na rolha
(válvula de segurança)
brando
2
OH-
0,5 cm acima
da solução
1
NH4
Amostra sólida
+
Antes de iniciar o
aquecimento verifique se o
sistema está montado
corretamente.
+
NH3 + 2HgI42- + 3OH-
Gera resíduo de Hg,
descarte corretamente.
Reagente
de Nessler
[Hg
O
Hg]+I- + 7I- + 2H2O
NH2
JRM2015
CO32- +
2 H+
(sólido)
+
brando
0,5 cm abaixo
da rolha
H2 O
Abertura na rolha
(válvula de segurança)
brando
2
HAc dil.
Antes de iniciar o aquecimento
verifique se o sistema está
montado corretamente.
CO2
Após adição do HAc dil. fechar
rapidamente. O aquecimento deve
ser feito de cima para baixo.
73
1
CO32-
Amostra
sólida
JRM2015
0,5 cm acima
da solução
água de barita
[Ba(OH)2]
74
37
PROVA DO CrO2Cl2 Prova de identificação de Cl(SPsólida)
O aquecimento deve ser feito de cima
para baixo, ou seja, aqueça primeiro
o tubo em J e emseguida o tubo 1
brando
Antes de iniciar o aquecimento
verifique se o sistema está
montado corretamente.
0,5 cm abaixo
da rolha
Após adição do H2SO4 conc.
fechar rapidamente o sistema.
brando
2
H2SO4 conc.
1 parte:
Abertura na rolha
(válvula de segurança)
0,5 cm acima
da solução
1
(Cl-
) SPsólida
3 partes: K2Cr2O7(S)
[Na+OH-]
Equações
das reações:
Após absorção do volátil no tubo 2, deve-se fazer a identificação do CrO42JRM2015
75
PROVA DO Borato de Etila Identificação de BO33- (SPsólida)
Substância volátil nas
condições experimentais
brando
brando
Fogo
brando
EtOH
(SP) Na3BO3 +
H2SO4 conc.
Equações
das
reações:
Se o volátil liberado queimar produzindo uma chama de coloração verde esmeralda,
confirma que se trata do borato de etila, logo a amostra contem BO33-.
JRM2015
76
38
4) Uma reação química se processa se for possível ocorrer
trânsito de elétrons (Reação de oxidação-redução).
redução
Oxidante
MnO4- + I- + H+
Mn2+ + I2 + H2O
oxidação
Redutor
Quais os Agentes participantes?
Oxidantes: Recebem ou capturam elétrons. Quando reagem ox,
sofre redução e, portanto,
Oxid
+ e-
red
redutor conjugado.
Ex. MnO4- + 8 H+ + 5 e-
Mn2+ + 4H2O
Redutores: Perdem ou cedem elétrons. Quando reagem ox,
sofre oxidação e, portanto,
Red
oxid + e-
Pares conjugados
oxidante conjugado.
Ex. SO32- + H2O
SO42- + 2 H+ + 2e-
Oxidante/Redutor (MnO4-/Mn2+ e SO42-/SO32-)
JRM2015
77
EQUILÍBRIO DE ÓXIDO-REDUÇÃO
MnO4-
OH-
1
(gotas)
MnO42-
alcalino
SO32- + MnO4- + OH-
SO42- + MnO42- + H2O
MnO4-
H2O
(gotas)
2
MnO2
neutro ou
levemente H+
SO32- + MnO4- + H+
SO32-
MnO4-
H+
3
SO42- + MnO2 + H2O
(gotas)
Mn2+
ácido
SO32- + MnO4- + H+
JRM2015
SO42- + Mn2+ + H2O
78
39
DEFINIÇÃO DE OXIDAÇÃO-REDUÇÃO POR NÚMERO DE OXIDAÇÃO
Implica ox
Implica ox
2I-
ox
I2 + 2e-
OXIDAÇÃO
PERDA de elétrons
ox = ...-5, -4, -3, -2, -1, 0, +1, +2, +3, +4, +5, ...
REDUÇÃO
GANHO de elétrons
MnO4- + 8H+ + 5e-
Mn2+ + 4H2O
JRM2015
79
SÃO OXIDANTES TÍPICOS:
a) As espécies que possuem pelo menos um E.Q. ox.
Ex. MnO4-; MnO42-; Cr2O72-; CrO42-; S2O82-; ClO3-; BrO3-; ClO-;
BiO3-; NO3-; NO2b) As subst. Simples não metálicas
Ex. F2; Cl2; Br2; I2; O2; O3 (S)
c) Os cátions (ico)
Ex. Sb5+; As5+; Sn4+; Cu2+; Hg2+; Fe3+; Co3+
b) Os cátions dos metais nobres
Ex. Ag+; Hg22+; Hg2+ Bi3+; Cu2+; Pt2+; Au3+
JRM2015
80
40
SÃO REDUTORES TÍPICOS:
a) As espécies que possuem pelo menos um E.Q. ox
Ex. S2-; S2O32-; SO32-; CN-; C2O42-; H2PO2-; I-; Br-; Cl-; SCN-; CNSb) As subst. Simples metálicas
Ex. Cs Rb K Na Ba Li Sr Ca Mg Be Zn Cr Fe Cd Ti Co
H Sb Bi As Cu Ag Pd Pt Au
menos reativos
Metais mais reativos que o hidrogênio
menos nobre
mais nobre
REDUTORES
FORTES
Meo
+
REDUTORES
FRACOS
H+
-nobre
+nobre
Mex+
+
H2
c) Os cátions (oso)
Ex. Sb3+; As3+; Sn2+; Hg22+; Fe2+; Co2+; Cu+
JRM2015
81
Exemplos de reação óxido-redução
III-
III+
NH4+ + NO2-
(sólido)
NO2- + MnO4- + H+
N2 + 2H2O (Eliminação de NO2-)
NO3- + Mn2+ + H2O
(verificação se a eliminação foi total).
Faça o balanceamento pelo método do íon-elétron
JRM2015
82
41
Balanceamento de Equações de
Oxidação-Redução pelo método do íon-elétron
Este processo envolve o tratamento (apenas no papel), da
oxidação e da redução como dois processos separados,
equilibrando estas semi-reações e, em seguida, combiná-las
para atingir o equilíbrio da equação para a reação global.
Etapas do Balanceamento:
1) Atribuir em cada espécie os números de oxidação para
determinar qual é oxidada e qual é reduzida.
2) Escrever as semi-reações de oxidação e de redução.
JRM2015
83
Balanceamento pelo Método do íon-elétron
3.
Em cada semi-reação balncear:
a.
os elementos diferentes de H e O.
b.
o O adicionando H2O no membro contrário.
c.
o H adicionando H+ no membro contrário.
d.
as cargas somando elétrons ao membro onde há excesso
de cargas positivas.
4.
Multiplique cada semi-reação por números inteiros tal que o
número de elétrons seja o mesmo em ambas semi-reações.
5.
Some as semi-reações, subtraindo as mesmas espécies que
aparecem em ambos os lados da equação.
6.
Confira se o número cargas é o mesmo em ambos os lados.
Se forem iguais a equação está devidamente balanceada.
JRM2015
84
42
C2O42−
MnO4−
Balanceamento pelo Método do íon-elétron, exemplo:
Considere a reação entre MnO4− e C2O42− :
MnO4−(aq) + C2O42−(aq)
Mn2+(aq) + CO2(aq)
JRM2015
85
Balanceamento pelo Método do íon-elétron
Primeiro deve-se atribuir os números oxidação.
+7
+2
+3
MnO4− + C2O42-
+4
Mn2+ + CO2
O manganês vai de +7 para +2, então é reduzido.
O carbono vai de +3 para +4, então é oxidado.
JRM2015
86
43
Semi-Reação de Oxidação:
C2O42− CO2
Para balancear o carbono, adiciona-se um coeficiente 2:
C2O42− 2 CO2
Ao balancear o carbono o oxigênio resulta balanceado.
Para balancear as cargas, deve-se somar 2 elétrons do
lado direito.
C2O42− 2 CO2 + 2 e−
JRM2015
87
Semi-Reação de Redução:
MnO4− Mn2+
O manganês está balanceado; para balancear o oxigênio,
deve-se somar 4 moléculas de H2O no lado direito.
MnO4− Mn2+ + 4 H2O
Para balancear o hidrogênio, deve-se somar 8 H+ no
lado esquerdo.
8 H+ + MnO4− Mn2+ + 4 H2O
Para balancear as cargas, deve-se somar 5 e− no lado
esquerdo.
5 e− + 8 H+ + MnO4− Mn2+ + 4 H2O
JRM2015
88
44
Combinação das Semi-Reações:
Deve-se avaliar as duas semi-reações juntas:
C2O42− 2 CO2 + 2 e−
5 e− + 8 H+ + MnO4− Mn2+ + 4 H2O
• Para atingir o mesmo número de elétrons em cada lado,
multiplica-se a primeira reação por 5 e a segunda por 2
5 C2O42− 10 CO2 + 10 e−
10 e− + 16 H+ + 2 MnO4− 2 Mn2+ + 8 H2O
O somatório de ambas as semi-reações resulta em:
10e− + 16H+ + 2MnO4− + 5C2O42−
2 Mn2+ + 8H2O + 10CO2 +10e−
JRM2015
89
Resultado:
5 C2O42− 10 CO2 + 10 e−
10 e− + 16 H+ + 2 MnO4− 2 Mn2+ + 8 H2O
O somatório de ambas as semi-reações resulta em:
10 e− + 16H+ + 2MnO4− + 5C2O42−
2 MnO4− + 5 C2O42− + 16 H+
2Mn2+ + 8H2O + 10CO2 +10 e−
2 Mn2+ + 10 CO2 + 8 H2O
Essa reação ocorre em meio ácido
JRM2015
90
45
REAÇÕES QUE OCORREM EM MEIO ALCALINO
Se o balanceamento terminar com íons H+ no 2o membro significa que
a reação ocorre em meio básico. Para o ajuste final deve-se adicionar
OH- em ambos os membros e em igual número aquele do H+ presente.
A presença de OH- e H+ no mesmo membro resulta em H2O. Se ocorre
a presença de H2O em lados contrários deve-se realizar a diminuição.
Faça o balanceamento por íon-elétron corretamente:
SO32- + MnO4- + ...
SO42- + MnO42- + ...
JRM2015
NO2- + I- + ...
91
I2 + NO + H2O
(verificação se a eliminação foi total).
Faça o balanceamento pelo método do íon-elétron
Dados os valores de potenciais de redução: E0 (CrO42-/Cr3+ = -0,13 V;
E0 (H2O2/ H2O = 1,77 V. Escreva a equação da reação que ocorre
espontaneamente e faça o balanceamento pelo método do íon
elétron.
Cr3+ + MnO4- + ...
CrO42- + Mn2+ + H2O
Faça o balanceamento pelo método do íon-elétron
Como verificar no laboratório se uma
substância é oxidante, redutora ou
indiferente?
JRM2015
92
46
NOS PROCESSOS DE ÓXIDO-REDUÇÃO observa-se: Enquanto
um agente oxidante facilmente oxida uma dada substância ou
íon, um outro não consegue efetuar a reação.
Cl2 + BrFe3+ + Br-
Br2 + 2 ClNADA
agentes oxidantes e redutores
diferem entre si quanto a força.
Mas,
Fe3+ + I-
Isso mostra que diferentes
Fe2+ + I2
Conclusão:
JRM2015
93
Conclusão:
1) I- é um redutor mais forte do que o Br-.
Br- não consegue reduzir Fe3+ a Fe2+ enquanto o I- consegue.
2) Cl2 é um oxidante mais forte do que o Fe3+.
Cl2 consegue oxidar Br- a Br2 enquanto o Fe3+ não consegue.
Estas diferenças nas forças dos vários agentes
oxidantes ou redutores estão associadas com as
tendências desiguais de certas espécies (átomos
ou íons) em perder ou capturar elétrons.
JRM2015
94
47
a) Quanto > a tendência que uma espécie apresenta em
perder elétrons, tanto + forte será o seu caráter redutor.
b) Quanto > a tendência que uma espécie apresenta em
capturar elétrons, tanto + forte será o seu caráter oxidante.
SEMPRE A SUBSTÂNCIA ATUARÁ COMO OXIDANTE ou REDUTOR?
DEPENDERÁ:
1) Do parceiro de reação:
NO2- + I- + H+
NO + I2 + H2O
OXID
NO2- + MnO4- + H+
Mn2+ + NO3- + H2O
RED
JRM2015
2) Do meio:
H2O2 + Mn2+ + OH-
95
MnO(OH)2 + H2O
OXID
2H2O2 + MnO2 + H+
Mn2+ + O2 + 3 H2O
RED
“Numa reação química espontânea, é dito que as
substâncias mais energéticas produzem outras menos
energéticas, ou seja, os AGENTES FORTES originam os
AGENTES FRACOS”.
AGENTES FORTES
agentes fracos
OXIDFORTE + eJRM2015
redfraco
96
48
Por analogia a Teoria de Ácido-Base de Bronsted e
Lowry associamos a cada agente (oxidante ou
redutor) FORTE o seu conjugado que será FRACO.
perdem e-
Capturam e-
OXIDANTES FORTES
redutores fracos
REDUTORES FORTES
oxidantes fracos
Doam e-
Ganham ou recebem e-
A REAÇÃO SERÁ ESPONTÂNEA PORQUE
QUEM REAGEM SÃO OS AGENTES FORTES:
OxidF + RedF
redf + oxidf
JRM2015
97
Equação de oxidação e de redução:
REDUÇÃO: OxidF + eOXIDAÇÃO: RedF
redf
Tensão ou
potencial
envolvido
oxidf + e-
Dado em
volt (V)
Essas equações são denominadas:
1) semi-reações;
2) semi-pilhas; ou,
3) ELETRODO (E)
a cada uma delas existe uma
tensão (potencial elétrico)
envolvida, dada em Volts (V).
1V=1
JRM2015
J
C
J = joules
C = coulombs
98
49
OBSERVAÇÕES:
• Não existem métodos que permitam medir, diretamente, a
tensão produzida por uma semi-pilha ou eletrodo.
•
Contorna-se o problema empregando o eletrodo de referência.
•
O
eletrodo
de
referência
tem
uma
tensão
ou
potencial
conhecido.
•
A partir daí, pode-se atribuir o potencial de qualquer outro
eletrodo.
•
Para isso, mede-se a tensão produzida por uma pilha (célula)
composta pelo eletrodo em questão e o referência.
JRM2015
99
O ELETRODO DE REFERÊNCIA
ELETRODO PADRÃO
(NORMAL) DE HIDROGÊNIO
semi-reações
1 ) 2H++ 2e2 ) H2
2H+/H2 (2H+ + 2eH2 (E = 0,0 V)
2H+ + 2e- (E = 0,0 V)
H2
Espécies que
reagem com:
1) H+ são redutores
fortes. Potencial
padrão de redução
< 0,00 V.
Puro, seco
25oC
constante
1 atm
2H+/H2 este é o par padrão, a
tensão foi convencionada como
sendo zero Volt. E0
=0,00 V
2H+/H2
~~~~
2) H2 são oxidantes
fortes. Potencial
padrão de redução
> 0,00 V.
H 2)
~~~~
~~~
H+
~~~
~~~~
~
~ ~ ~ ~ ~ ~~
~~~
Pt (em
pó) inerte
Negro de Pt,
finamente dividida
Adsorve H2
H2SO4 [H+] = 1 mol/L
(constante)
JRM2015
100
50
POTENCIAL PADRÃO DE REDUÇÃO
E0Forma
=
oxidada
Forma
Reduzida
V
Forma oxidada
é oxidante forte
E0ox/red > 0 V
E0
2H+/H2
Exemplo: cátion
de metal nobre
= 0,00 V
Forma reduzida
é redutor forte
E0ox/red < 0 V
Exemplo: metal
não nobre
JRM2015
101
MEDIDAS DE POTENCIAIS PADRÃO DE ELETRODO
Para medir potencial de um
eletrodo ou uma semi-pilha deve0
se combiná-lo ao E2H+/H2 para a
formação de uma pilha ou célula
voltaica. A partir da força
eletromotriz (f.e.m.) ou potencial
total da pilha medido pode-se
determinar o valor desse novo E0.
=0,00 V
2H+/H2
T = 25oC ;
P = 1 atm
H2
[H+] = 1 M (1 íon-g/L)
f.e.m.
H2
Contém gelatina
ou agar-agar
E0 x+
=?V
Me /Me0
JRM2015
E0
Potenciômetro
Eletrodo a ser medido
Gelatina ou agar-agar
ao esfriar se
gelatinizam impedindo
o escorrimento da
solução. Não interferem
no movimento dos íons
Eletrodo de
Referência
K+ Cl~~~~
~~~~
~~
Me0
Mex+
~~~
~~~~
~
~ ~ ~ ~ ~ ~~
~~~
~~~~
~~~
~~~~
~ ~ ~ H2
~~~~
~~~
2H~+ ~
Ponte salina: solução de um eletrólito (KCl), os
íons se difundem de um recipiente a outro,
fechando o circuito interior
102
51
MEDIDAS DE POTENCIAIS PADRÃO DE ELETRODO
Eletrodo de
Referência
E0
T = 25oC ;
=0,00 V
2H+/H
[H+] = 1 M (1 íon-g/L)
2
Eletrodo a ser medido E0
=?V
Mex+/Me0
catodo
Dependendo do Me que está
como eletrodo a ser medido
pode ocorrer:
f.e.m.
+
+
(anodo)
(elétrons fluem do eletrodo de
referência para barra a metálica)
H2
eK+ Cl-
K+
Cl~~~~
~~~~
2e-
-
Potenciômetro
Me0 (catodo)
e consumo de H2
H2
e-
e-
a) deposição de Me0 sobre a
barra metálica:
2H+
ocorre a
oxidação
anodo
ocorre a
redução
EXEMPLO 1:
Mex++ xe-
P = 1 atm
H2
~~~~
Me0
Mex+
~~
~~~
~~~~
~
~ ~ ~ ~ ~ ~~
~~~
~~~~
~~~
~~~~
~ ~ ~ H2
~~~
2H~+ ~
JRM2015
103
MEDIDAS DE POTENCIAIS PADRÃO DE ELETRODO
Eletrodo de
Referência
E0
T = 25oC ;
=0,00 V
2H+/H2
Eletrodo a ser medido E0
Mex+/Me0
(elétrons fluem da barra metálica
para o eletrodo de referência)
Mex+
ocorre a
redução
-
+
(anodo)
Polo – (anodo) para
onde migram os
ânions da ponte)
e-
e-
eCl-
~~~~ ~~~~
Me0
Mex+
~~
~~~
~~~~
~
~ ~ ~~ ~ ~
~~~~
JRM2015
H2
+
Potenciômetro
H2 (catodo)
xe-
f.e.m.
e-
catodo
anodo
b) corrosão da barra metálica
com [Mex+] na solução:
Me0
=?V
ocorre a
oxidação
EXEMPLO 2:
2H+ + 2e-
P = 1 atm
H2
[H+] = 1 M (1 íon-g/L)
K+ ClK+
~~~~
~~~
~~~~
~ ~ ~ H2
~~~~
~~~
2H~+ ~
104
52
Analisando os seguintes casos:
a) Deposição de Me0 sobre a barra metálica
Nesse caso o voltímetro indica
uma voltagem de 0,34 V
Me0 = Cu0 e Mex+ = Cu2+
Reações que ocorrem:
1) No polo – (Anodo) é onde ocorre a oxidação:
H2
2H+ + 2e-
E0 = 0,00 V
2) No polo + (Catodo) é onde ocorre a Redução:
Cu2+ + 2eReação
da Pilha
Cu0
E0 = 0,34 V
Cu2+ + H2
H2 é consumido
Cu0 + 2H+
Anodo
H2
Polo – (anodo, para
onde migram os
ânions da ponte)
E0
e-
- e-
(oxidação)
E0T = 0,34 V
Catodo
+
Cu2+/Cu0
= 0,34 V
ocorre deposição de Cu0
(redução)
2H+
+
2e-
Cu2+
+
2e-
Cu0
H2
Cu2+ + 2eCu2+
+ H2
+
2e-
0,00 V
Cu0
Cu0
+
catodo
E0
2H+
105
anodo
JRM2015
-
+
?V
2H+
0,337 V
Figura - Célula (Pilha) padrão : Pt|H2(g)|H+(aq) ||Cu2+(aq)|Cu(S)
Anodo
Catodo
53
A f.e.m padrão da pilha é calculada a partir das f.e.m
padrão de redução das semi-pilhas, sendo o potencial
padrão de referência dado pela reação:
Eletrodo de referência: 2H+(aq) + 2e
H2(g)
Eº(H+/H ) = 0 V
2
A f.e.m padrão de uma pilha é dada por:
E0pilha = E0cátodo - E0anodo
Não decore, escreva as semi-reações
e some membro a membro.
JRM2015
107
Analisando os seguintes casos:
b) Corrosão da barra metálica com formação de Mex+
Me0 = Zn0 e Mex+ = Zn2+. Nesse caso o desvio da agulha tem sentido oposto e o
valor é = a 0,76 V. Este desvio no sentido oposto indica que os átomos de Zn0, no lugar
das espécies H2, cedem elétrons. Deste modo o Zn0 está atuando como eletrodo - .
Reações que ocorrem:
1) No polo - (Anodo) é onde ocorre a Oxidação:
Zn0
Zn2+ + 2e
E0
Zn2+/Zn0
=?
2) No polo + (Catodo) é onde ocorre a Redução:
2H+ + 2eReação
da Pilha
H2
Zn0 + 2 H+
E0 = 0,00 V
Anodo
T
e-
- e-
Logo,
E0
E0 = 0,76 V
Zn2+ + H2
= -0,76 V
0
Zn2+/Zn
JRM2015
Zn0
Zn2+ + 2e-
Catodo
+
2 H+ + 2e-
Pilha: Zn(S)|Zn2+(aq)||Pt|H+(aq)|H2(g)
Anodo
Catodo
H2
108
54
E
0
Zn2+ + 2e-
2H+ + 2eZn0 + 2H+
0,763 V
H2
catodo
Zn0
0,00 V
Zn2+ + H2
e-
0,763 V
e-
+
Voltímetro
anodo
-
Zn0
Cl-
H2(g)
K+
Ponte salina
Zn2+
HCl(aq)
ZnCl2(aq)
Zn0
negro
de Pt
H+
2H+ + 2e-
Zn2+ + 2e-
H2
Figura - Célula padrão: Zn(S)|Zn2+(aq)||Pt | H+(aq)|H2(g)
Anodo
Catodo
Representação da célula voltaica
Espécies (e concentrações) em
contato com a superfícies do eletrodo
Ponte
salina
Zn(S)|Zn2+ (1.0 M) || Cu2+(1.0 M)|Cu(s)
superfícies
do eletrodo
Anodo
Zn0 + Cu2+
Catodo
Cu0 + Zn2+
55
Comumente se representa POTENCIAL DE REDUÇÃO, isto:
para
FORMA OXIDADA
Portanto, representa-se
para o eletrodo padrão
forma reduzida
E0
FORMA FORMA
OXIDADA REDUZIDA
Pode-se falar em potenciais de redução
Com valor < ou > que zero.
JRM2015
111
POTENCIAL PADRÃO DE REDUÇÃO
E0Forma
=
oxidada
Forma
Reduzida
V
E0ox/red >0 V
Reage com H2
(oxida H2 a H+).
A forma reduzida
é redutor fraco.
Forma oxidada
é oxidante forte
0
E2H
= 0,00 V
+/H
2
E0ox/red <0 V
JRM2015
Forma reduzida
é redutor forte
112
Reage com H+
(reduz H+ a H2).
A forma oxidada
é oxidante fraco.
56
Conhecendo os valores de potencial de redução é
possível prever: a espontaneidade de uma reação de
oxidação-redução;
escrever
a
equação
da
reação
devidamente balanceada (pelo método do íon elétron);
e calcular a f.e.m. de uma reação (pilha).
JRM2015
113
Para encontrar a espontaneidade de uma reação redoxi
basta adotar a seguinte regra:
“Dados dois pares de potenciais de redução, ao par de >
potencial, significa dizer que a sua forma oxidada é um
OXIDANTE FORTE e ao par de < potencial a forma
reduzida é um REDUTOR FORTE. Num par conjugado, um
OXIDANTE FORTE corresponde a um redutor fraco e um
REDUTOR FORTE corresponde a um oxidante fraco. A
reação ocorre entre os fortes para formar os fracos”
A partir dos valores de potenciais de redução da
Tabela seguinte escreva equações de reações.
JRM2015
114
57
Qual reação química espontânea ocorre?
E0
Zn2+/Zn0
E0
Zn0
= -0,79 V
Cu2+/Cu0
= 0,34 V
Cu2+
JRM2015
115
Exemplo:
E0
= -0.79 V
0
E0
= 0.34 V
Zn0
Zn2+ + 2e-
E0 = 0,76 V
Zn2+/Zn
Cu2+/Cu0
Cu2+ + 2eCu2+ + Zn0
E0 = 0,34V V
Cu0
Cu0 +Zn2+ E0 = 1,10V V
T
Reação espontânea E0
T
E0
= -0.49 V
E0
= 1.51 V
>0
CO2/C2O42-
MnO4-/Mn2+
JRM2015
116
58
Tabela – Alguns potenciais de redução (eletrodo padrão)
Semi-reação
E 0, V
Solução ácida
117
JRM2015
JRM2015
118
59
Solução alcalina
JRM2015
119
Direção das reações de óxido-redução
Explique porque é possível identificar Br- e I- , juntos,
num mesmo tubo de ensaio.
E0
= 1,36 V
E0
= 1,06 V
Cl2/Cl-
Br2/Br-
E0
I2/I-
= 0,54 V
JRM2015
120
60