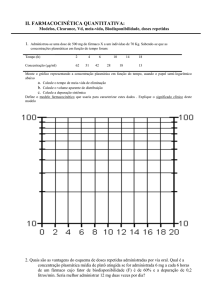
Nº 156, quarta-feira, 14 de agosto de 2002
1
SOLUBILIDADE
A solubilidade é definida como alta ou baixa e é calculada com base na menor concentração do fármaco em miligramas por mililitro (mg/ml),
utilizando a apresentação que contém a maior dosagem, determinada em pH fisiológico (1 a 8) e à temperatura de 37 ± 0,5°C.
Fármacos de alta solubilidade são aqueles para os quais se obtém um valor de volume igual ou menor a 250ml quando se divide a dose pela
solubilidade.
Ex: Fármaco cuja solubilidade é igual a 1,0 mg/ml (37 ± 0,5°C) e que está disponível em formas farmacêuticas nas dosagens de 100, 200, 400
mg:
400 mg ÷ 1,0 mg/ml = 400 ml (fármaco classificado como de baixa solubilidade).
PERMEABILIDADE
A permeabilidade é definida como a permeabilidade efetiva do fármaco na parede do jejuno humano e inclui resistência aparente ao transporte
de massa na membrana intestinal. Fármacos de alta permeabilidade são, geralmente, aqueles estáveis nas condições do trato gastrintestinal e
que apresentam biodisponibilidade absoluta maior que 90%, ou aqueles para os quais essa propriedade foi determinada experimentalmente.
Caso A: alta solubilidade (AS) e alta permeabilidade (AP)
A documentação exigida deverá incluir a realização do relatório técnico e avaliação dos resultados do teste de dissolução, realizado conforme
descrito na Farmacopéia Brasileira e, na ausência desta, outros códigos autorizados pela legislação vigente. Deve haver dissolução de, no
mínimo, 85% do fármaco em até 15 minutos, utilizando-se 900ml de HCl 0,1 M. Em caso de não cumprimento deste critério deve-se realizar
os ensaios descritos para os Casos B ou C.
Caso B: alta solubilidade (AS) e baixa permeabilidade (BP)
A documentação exigida deverá incluir a realização do relatório técnico e avaliação dos resultados do perfil de dissolução empregando
condições Farmacopéicas e retirando alíquotas do meio em tempos adequados até o platô ser alcançado. O perfil de dissolução obtido deverá
ser semelhante ao perfil proveniente da formulação não alterada (a semelhança deverá ser avaliada conforme descrito no GUIA PARA ENSAIOS
DE DISSOLUÇÃO DE FORMAS FARMACÊUTICAS SÓLIDAS ORAIS DE LIBERAÇÃO IMEDIATA).
Caso C: baixa solubilidade (BS) e alta permeabilidade (AP)
A documentação exigida deverá incluir a realização do relatório técnico e avaliação dos resultados do perfil de dissolução em cinco condições
diferentes: água destilada, HCl 0,1M e tampões fosfato pH 4,5, 6,5 e 7,5 para a formulação proposta e a formulação anterior, sem modificação.
Alíquotas do meio de dissolução devem ser retiradas em tempos adequados até que 90% do fármaco se dissolva ou o platô seja alcançado. Um
tensoativo pode ser utilizado apenas quando justificado adequadamente. O perfil obtido deverá ser semelhante ao perfil da formulação não
alterada (a semelhança deverá ser avaliada conforme descrito no GUIA PARA ENSAIOS DE DISSOLUÇÃO DE FORMAS FARMACÊUTICAS SÓLIDAS ORAIS
DE LIBERAÇÃO).
3.3.2.4.2.3. Alterações de Nível 3
São alterações que, geralmente, causam um impacto significativo
sobre a qualidade e o desempenho do medicamento e que se exige
prova de biodisponibilidade relativa.
A documentação a ser apresentada varia na dependência de três fatores: faixa terapêutica, solubilidade e permeabilidade do fármaco.
São alterações de Nível 3:
a) As alterações qualitativas e quantitativas relativas aos excipientes
de uma formulação que contém um fármaco de baixo índice terapêutico que ultrapassam as porcentagens descritas para o Nível 1;
b) Todos os fármacos que não cumprem com os critérios descritos no
Nível 2;
c) Alterações nos excipientes de uma formulação que contém um
fármaco de baixa solubilidade e baixa permeabilidade, que ultrapassam as porcentagens descritas para o Nível 1;
d) Alterações nos excipientes de uma formulação que contém qualquer tipo de fármaco, que ultrapassem as porcentagens descritas para
o Nível 2.
A documentação técnica exigida será a seguinte:
a) Relatórios completos de produção e controle de qualidade de acordo com a legislação vigente para registro, para cada concentração do
produto e forma farmacêutica.
b) Relatório técnico contendo os resultados e avaliação do teste de
estabilidade acelerada e de longa duração relatado anualmente, para
cada concentração do produto;
c) Comprovação da equivalência farmacêutica de acordo com a legislação vigente.
d) Apresentar relatório técnico contendo os resultados e avaliação do
novo estudo de bioequivalência e/ou biodisponibilidade relativa, conforme legislação vigente a menos que uma correlação in vitro/in vivo
(CIVIV) tenha sido adequadamente estabelecida.
3.4. ALTERAÇÃO NO PROCESSO DE FABRICAÇÃO DO MEDICAMENTO
São alterações no tipo de processo empregado na fabricação do medicamento, tais como o uso da compressão direta ou via seca ao invés
da granulação por via úmida.
3.4.1 Aspectos Legais
a) Comprovante de pagamento de Taxa de Fiscalização de Vigilância
Sanitária;
b) Cópia do Certificado de Registro ou cópia do D.O.U. do Registro
ou comprovante da última revalidação;
c) Certificado de Boas Práticas de Fabricação e Controle (BPFC)
emitido pela ANVISA, para a linha de produção na qual o produto
será fabricado, ou ainda, cópia do protocolo de solicitação de inspeção para fins de emissão do certificado de BPFC. Este protocolo
será válido desde que a empresa não apresente restrições para a linha
de produção pretendida na última inspeção realizada.
3.4.2. Aspectos Técnicos
3.4.2.1.FP1 e FP2 devidamente preenchidos;
3.4.2.2Justificativa Técnica referente à solicitação;
3.4.2.3.Relatório técnico
3.4.2.3.1. Produtos isentos de bioequivalência e/ou biodisponibilidade
relativa e Suspensões
a) Relatórios completos de produção e controle de qualidade de acordo com a legislação vigente para registro, para cada concentração do
produto.
b) Reprodutibilidade dos resultados analíticos entre um lote registrado
e três com proposta de alteração, para cada concentração do produto;
c) Relatório técnico contendo os resultados e avaliação do teste de
estabilidade acelerada e de longa duração relatado anualmente, para
cada concentração do produto;
d) Comprovação da equivalência farmacêutica de acordo com a legislação vigente.
e) Relatório de validação do método de fabricação proposto;
3.4.2.3.2. Produtos não isentos de bioequivalência e/ou biodisponibilidade relativa
A documentação exigida neste caso deverá incluir:
a) Relatórios completos de produção e controle de qualidade de acordo com a legislação vigente para registro, para cada concentração do
produto.
b) Relatório técnico contendo os resultados e avaliação do teste de
estabilidade acelerada e de longa duração relatado anualmente, para
cada concentração do produto;
c) Comprovação da equivalência farmacêutica de acordo com a legislação vigente.
e) Relatório de validação do método de fabricação proposto;
f) Relatório técnico contendo os resultados e avaliação do novo estudo de bioequivalência, conforme legislação vigente a menos que
uma correlação in vitro/in vivo (CIVIV) tenha sido adequadamente
estabelecida.
3.5. ALTERAÇÃO NO TAMANHO DO LOTE
Refere-se ao aumento do tamanho de um lote já registrado, utilizando
os mesmos equipamentos.
A documentação legal exigida será a mesma para todos os casos.
3.5.1. Aspectos Legais
a) Comprovante de pagamento de Taxa de Fiscalização de Vigilância
Sanitária;
b) Certificado de Boas Práticas de Fabricação e Controle (BPFC)
emitido pela ANVISA, para a linha de produção na qual o produto
será fabricado, ou ainda, cópia do protocolo de solicitação de inspeção para fins de emissão do certificado de BPFC. Este protocolo
será válido desde que a empresa não apresente restrições para a linha
de produção pretendida na última inspeção realizada.
3.5.2. Aspectos Técnicos
A documentação exigida nestes casos deverá incluir:
3.5.2.1. FP1 e FP2 devidamente preenchidos;
3.5.2.2. Justificativa Técnica referente à solicitação;
3.5.2.3. Relatório técnico:
3.5.2.3.1. Produtos isentos de bioequivalência e/ou biodisponibilidade
relativa e Suspensões
a) Relatórios completos de produção e controle de qualidade de acordo com a legislação vigente para registro, para cada concentração do
produto.
b) Reprodutibilidade dos resultados analíticos entre um lote registrado
e três com proposta de alteração, para cada concentração do produto;
ISSN 1676-2339
59
c) Relatório técnico contendo os resultados e avaliação do teste de
estabilidade acelerada e de longa duração relatado anualmente, para
cada concentração do produto;
d) Comprovação da equivalência farmacêutica de acordo com a legislação vigente se a alteração no tamanho do lote for acima de 10
vezes o registrado.
e) Apresentar testes de dissolução que comprovem correlação com o
lote registrado se a alteração no tamanho de lote for igual ou inferior
a 10 vezes o registrado.
3.5.2.3.2. Produtos não isentos de bioequivalência e/ou biodisponibilidade relativa
a) Cumprir com o descrito no item 3.5.2.3.1;
b) Relatório técnico contendo os resultados e avaliação do novo
estudo de bioequivalência, conforme legislação vigente se a alteração
no tamanho do lote for acima de 10 vezes o registrado, a menos que
uma correlação in vitro/in vivo (CIVIV) tenha sido adequadamente
estabelecida;
3.6. MUDANÇA DE EQUIPAMENTOS UTILIZADOS
Refere-se às mudanças nos equipamentos empregados na fabricação
do produto.
A documentação legal exigida será a mesma para todos os casos.
3.6.1. Aspectos Legais
a) Comprovante de pagamento de Taxa de Fiscalização de Vigilância
Sanitária;
b) Certificado de Boas Práticas de Fabricação e Controle (BPFC)
emitido pela ANVISA, para a linha de produção na qual o produto
será fabricado, ou ainda, cópia do protocolo de solicitação de inspeção para fins de emissão do certificado de BPFC. Este protocolo
será válido desde que a empresa não apresente restrições para a linha
de produção pretendida na última inspeção realizada.
3.6.2. Aspectos Técnicos
Neste caso a documentação exigida será a seguinte:
3.6.2.1.FP1 e FP2 devidamente preenchidos;
3.6.2.2.Justificativa Técnica referente à solicitação;
3.6.2.3.Relatório Técnico:
3.6.2.3.1. Produtos isentos de bioequivalência e/ou biodisponibilidade
relativa e Suspensões
a) Relatórios completos de produção e controle de qualidade de acordo com a legislação vigente para registro, para cada concentração do
produto.
b) Reprodutibilidade dos resultados analíticos entre um lote registrado
e três com proposta de alteração, para cada concentração do produto;
c) Validação do processo de fabricação do medicamento, contemplando também a validação de limpeza dos equipamentos. Para a
comprovação, a empresa deverá apresentar protocolo de validação e
relatório conclusivo.
d) Relatório técnico contendo os resultados e avaliação do teste de
estabilidade acelerada e de longa duração relatado anualmente, para
cada concentração do produto;
e) Comprovação da equivalência farmacêutica de acordo com a legislação vigente.
3.6.2.3.2. Produtos não isentos de bioequivalência e/ou biodisponibilidade relativa - Formas farmacêuticas sólidas orais
a) Cumprir com o descrito no item 3.6.2.3.1.;
b) Relatório técnico contendo os resultados e avaliação do novo
estudo de bioequivalência, conforme legislação vigente, a menos que
uma correlação in vitro/in vivo (CIVIV) tenha sido adequadamente
estabelecida;
3.7. ALTERAÇÃO DE REGISTRO POR MODIFICAÇÃO DE
PRINCÍPIO ATIVO PARA ASSOCIAÇÕES QUE RESULTEM EM
ASSOCIAÇÃO OU MONODROGA JÁ APROVADAS NO PAÍS
3.7.1. Aspectos Legais
a) Comprovante de pagamento de Taxa de Fiscalização de Vigilância
Sanitária;
b) Cópia do Certificado de Registro ou cópia do D.O.U. do Registro
ou comprovante da última revalidação;
c) Certificado de Boas Práticas de Fabricação e Controle (BPFC)
emitido pela ANVISA, para a linha de produção na qual o produto
será fabricado, ou ainda, cópia do protocolo de solicitação de inspeção para fins de emissão do certificado de BPFC. Este protocolo
será válido desde que a empresa não apresente restrições para a linha
de produção pretendida na última inspeção realizada.
3.7.2. Aspectos Técnicos
Neste caso a documentação exigida será a seguinte:
3.7.2.1.FP1 e FP2 devidamente preenchidos;
3.7.2.2.Justificativa Técnica referente à solicitação;
3.7.2.3.Relatório Técnico:
3.7.2.3.1. Produtos isentos de bioequivalência e/ou biodisponibilidade
relativa e Suspensões
a) Relatórios completos de produção e controle de qualidade de acordo com a legislação vigente para registro;
b) Reprodutibilidade dos resultados analíticos entre um lote registrado
e três com proposta de alteração, para cada concentração do produto;
c) Validação do processo de fabricação do medicamento, contemplando também a validação de limpeza dos equipamentos. Para a
comprovação, a empresa deverá apresentar protocolo de validação e
relatório conclusivo.
d) Relatório técnico contendo os resultados e avaliação do teste de
estabilidade acelerada e de longa duração relatado anualmente;
e) Comprovação da equivalência farmacêutica de acordo com a legislação vigente.
3.7.2.3.2. Produtos não isentos de bioequivalência e/ou biodisponibilidade relativa - Formas farmacêuticas sólidas orais