Seminário de Bioequivalência
Introdução aos conceitos gerais sobre
Farmacologia, Bioequivalência e
Biodisponibilidade
Eunice Kazue Kano
10 de Setembro de 2011
1. Introdução
1. Introdução
Medicamento
Organismo
Fase biofarmacêutica
Liberação do fármaco de
sua forma farmacêutica
Fase Farmacodinâmica
Interação do fármaco
com o receptor
Fase farmacocinética
-Absorção
-Distribuição
-Biotransformação
-Excreção
Efeito Farmacológico
1. Introdução
Liberação
Dissolução
Membranas
Absorção
Fármaco
no TGI
Administração do
medicamento
Intravenosa
DiPiro, J.T., 2002
Fármaco
ligado às
proteínas
plasmáticas
Fármaco
ligado aos
receptores
nos tecidos
Fármaco livre
no plasma
Fármaco livre
nos tecidos
Distribuição
Órgão de
eliminação
do fármaco
Biotransformação
e/ou excreção
1. Introdução
1. Introdução
1. Introdução
Eficácia e Segurança
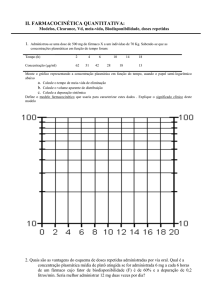
Cp
FT
1. Introdução
Histórico da qualidade de produtos farmacêuticos
Análise
física
30
FDA / BE para
medicamentos
genéricos
Estudos
biofarmacêuticos
40
Análise
química
50
60
70
Início
BD e BE
80
90
Diretrizes FDA
2. Biodisponibilidade
EMEA
A biodisponibilidade indica a velocidade e a extensão pelas quais
um fármaco é absorvido a partir da forma farmacêutica e tornase disponível no local de ação.
A biodisponibilidade refere-se à extensão e à velocidade pelas
quais um fármaco é liberado da forma farmacêutica e atinge a
circulação sistêmica.
FDA
O FDA define a biodisponibilidade como a velocidade e
extensão pelas quais um fármaco é absorvido a partir de um
produto farmacêutico e torna-se disponível no local de ação
2. Biodisponibilidade
ANVISA
A biodisponibilidade indica a velocidade e a extensão de
absorção de um princípio ativo em uma forma de dosagem, a
partir de sua curva concentração versus tempo na circulação
sistêmica ou sua excreção na urina
2. Biodisponibilidade
fármaco
biodisponibilidade oral
quantidade
“nominal”
quantidade
“real”
cefalexina
90 %
250 mg
225 mg
diclofenaco
50-60%
50 mg
25–30 mg
alendronato
0,75%
40 mg
0,3 mg
2. Biodisponibilidade
Cp
ASCT × DR
F=
×100
ASCR × DT
t
F= fração absorvida
T=teste (oral)
R=referência (IV)
D=dose
2. Biodisponibilidade
Parâmetros Farmacocinéticos
Cp
Conc.
CMT
Cmax
Cmax
FT
CME
t(1/2)el
ASC
ASC
tmax
Tempo
Tmax
2. Biodisponibilidade
Parâmetros farmacocinéticos relacionados à biodisponibilidade:
– ASC: área sob a curva “concentração x tempo”; relaciona-se
à extensão da absorção.
– Cmax: concentração plasmática máxima que o fármaco
atinge após a administração; relaciona-se à velocidade de
absorção.
– Tmax: tempo para Cmax; relaciona-se à velocidade da
absorção.
Concentração plasmática
2. Biodisponibilidade
Mesmo fármaco
Mesma dose
Tempo
3. Fatores que afetam a Biodisponibilidade
Forma farmacêutica
• solução, suspensão, comprimido, cápsula, injetável
3. Fatores que afetam a Biodisponibilidade
3. Fatores que afetam a Biodisponibilidade
Forma farmacêutica
• solução, suspensão, comprimido, cápsula, injetável
Via de administração
• oral, retal, sublingual, transdérmica, inalatória, ocular
Fatores físico-químicos
• tamanho de partícula, polimorfos, diferentes sal, éster, grau
de hidratação
3. Fatores que afetam a Biodisponibilidade
3. Fatores que afetam a Biodisponibilidade
3. Fatores que afetam a Biodisponibilidade
3. Fatores que afetam a Biodisponibilidade
Processo de fabricação
• força de compressão, temperatura e tempo de mistura e secagem
Excipientes
• lubrificante, desintegrante, aglutinante
3. Fatores que afetam a Biodisponibilidade
A
B
Cp
%D
100
0,5%
0,5%
1,0%
1,0%
5,0%
5,0%
t
t
A
Influência do estearato de magnésio sobre a dissolução
B
Influência do estearato de magnésio sobre a absorção
3. Fatores que afetam a Biodisponibilidade
3. Fatores que afetam a Biodisponibilidade
Processo de fabricação
• força de compressão, temperatura e tempo de mistura e secagem
Excipientes
• lubrificante, desintegrante, aglutinante
Fatores fisiológicos
• superfície de absorção, motilidade, pH dos fluidos, presença de
alimentos, idade, comorbidade, raça, sexo
3. Fatores que afetam a Biodisponibilidade
3. Fatores que afetam a Biodisponibilidade
3. Fatores que afetam a Biodisponibilidade
Estudos de Biodisponibilidade
avaliação da biodisponibilidade oral de um produto
linearidade farmacocinética
proporcionalidade de dose
estudo da forma farmacêutica
estudos de interações medicamentosas farmacocinéticas
estudos de biodisponibilidade relativa para medicamentos
genéricos e similares
4. Bioequivalência
Bioequivalência
Medicamentos BIOEQUIVALENTES são equivalentes farmacêuticos
que, ao serem administrados na mesma dose molar, nas
mesmas condições experimentais,
experimentais não apresentam diferenças
estatisticamente significativas em relação à
BIODISPONIBILIDADE
4. Bioequivalência
Equivalência Farmacêutica
Equivalência Terapêutica
Após administração na
mesma dose molar, a eficácia
e segurança são
essencialmente os mesmos
4. Bioequivalência
Equivalência Terapêutica
Estudos clínicos
Duração
Recursos financeiros
Considerações éticas
Estudos de Bioequivalência
Provas in vitro
- [ ] plasma fármaco,
metabólito
- Efeito farmacológico agudo
4. Bioequivalência
Medicamento inovador
Medicamento genérico/similar
Comprovação da qualidade:
Mesma eficácia e segurança
Equivalentes terapêuticos
4. Bioequivalência
Cp
CMT
Cmax
FT
CME
ASC
Tmax
EF + BE = ET
EF = equivalência farmacêutica (in vitro)
BE = bioequivalëncia (in vivo)
ET = Equivalência terapêutica
4. Bioequivalência
4. Bioequivalência
UV-VIS (230nm)
Cefadroxil
Ppt_Acetonitrila 230 nm_branco
UV-VIS (230nm)
Cefadroxil
Branco+PI
UV-VIS (230nm)
Cefadroxil
Cc4
UV-VIS (230nm)
Cefadroxil
Cc5
UV-VIS (230nm)
Cefadroxil
Cc6
400
UV-VIS (230nm)
Cefadroxil
Cc7
300
300
200
200
100
100
0
0,0
0
0,5
1,0
1,5
2,0
2,5
3,0
3,5
Minutes
4,0
4,5
5,0
5,5
6,0
6,5
7,0
mAU
mAU
400
Concentração plasmática (ng/mL)
4. Bioequivalência
15
12
Referência
9
Teste
6
3
0
0
30
60
90
12 0
150
Tem po (hora s)
[ ]
C2
80% ≤
ASC teste
80% ≤
≥ 125%
ASC referência
C3
T2
C1
C4
C5
T3
T4
T1
0
t1
t2
t3
T5
t4
C max teste
≥ 125%
C max referência
t5
tempo
4. Bioequivalência
Objetivo do estudo de Bioequivalência
avaliação da qualidade do produto – velocidade e extensão
de absorção
Padronização do estudo
qualquer diferença observada é em função da formulação
Fatores que afetam a biodisponibilidade
forma farmacêutica
via de administração
fatores físico-químicos
excipientes
processo de fabricação
fatores fisiológicos
4. Bioequivalência
TGI
Circulação sistêmica
Absorção
Dissolução
(solubilização do fármaco)
Interação
fármaco-receptor
Fatores relacionados à formulação
Efeito farmacológico
4. Bioequivalência
Maior desafio das indústrias farmacêuticas
Avaliação das características biofarmacêuticas
Solubilidade
Parâmetros básicos que
controlam a absorção dos
fármacos
Permeabilidade
4. Bioequivalência
Liberação
Quantidade / Velocidade
Dissolução
Absorção
Quantidade / Velocidade
Permeação
Eficácia e Segurança
Biodisponibilidade
5. Sistema de Classificação Biofarmacêutica
Solubilidade
Classe I:
Classe II:
Solubilidade
Solubilidade
Permeabilidade
Permeabilidade
Classe III:
Classe IV:
Solubilidade
Solubilidade
Permeabilidade
Permeabilidade
5. Sistema de Classificação Biofarmacêutica
Avaliação da solubilidade
Teste de solubilidade com a maior dose
dissolução completa em 250 mL de soluções em pHs fisiológicos (1,2 a
6,8) a 37º C
Avaliação da estabilidade do fármaco durante o teste, utilizar método
validado para quantificações
Avaliação do perfil de dissolução do produto, comprovando rápida
dissolução (85% em até 30 min)
5. Sistema de Classificação Biofarmacêutica
Metodologias utilizadas para avaliação da permeabilidade:
Métodos in vivo
estudos de farmacocinética em animais
Métodos in situ
ensaios de perfusão
Métodos in silico
métodos computacionais
5. Sistema de Classificação Biofarmacêutica
Metodologias utilizadas para avaliação da permeabilidade:
Avaliação físicofísico-química
peso molecular, pKa, lipofilicidade, solubilidade
Métodos in vitro
tecido animal
ensaios de permeabilidade sobre membranas artificiais
modelos de culturas celulares
5. Sistema de Classificação Biofarmacêutica
5. Sistema de Classificação Biofarmacêutica