GABARITO
Química A – Extensivo – V. 5
Exercícios
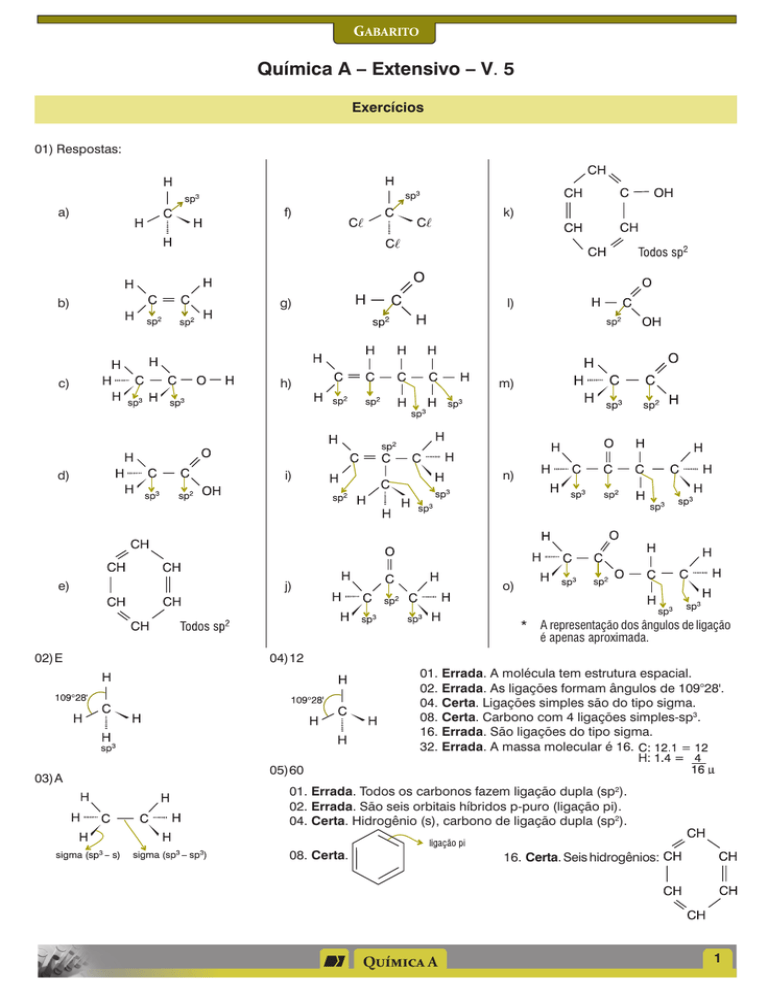
01)Respostas:
a)
f)
k)
b)
g)
l)
c)
h)
m)
d)
i)
n)
e)
j)
o)
* A representação dos ângulos de ligação
é apenas aproximada.
02)E
04)12
01.Errada. A molécula tem estrutura espacial.
02.Errada. As ligações formam ângulos de 109°28'.
04.Certa. Ligações simples são do tipo sigma.
08.Certa. Carbono com 4 ligações simples-sp3.
16.Errada. São ligações do tipo sigma.
32.Errada. A massa molecular é 16.
03)A
05)60
01.Errada. Todos os carbonos fazem ligação dupla (sp2).
02.Errada. São seis orbitais híbridos p-puro (ligação pi).
04.Certa. Hidrogênio (s), carbono de ligação dupla (sp2).
08.Certa.
16.Certa. Seis hidrogênios:
Química A
1
GABARITO
32.Certa. Carbono de ligação dupla.
64.Errada. Todos os carbonos são insaturados.
11)88
01.Errada.
06)13
02.Errada.
04.Errada.
07)B
O O é p e o carbono é sp(duas ligações duplas)
A ligação sigma é do tipo sp-sp.
As outras duas são π (p-p).
08.Certa.
08)27
O Cl é p e o carbono é sp3 (somente ligação simples).
16.Certa.
32.Errada.
Existem 3 ligações sigma.
64.Certa.
01.Certa. A molécula pode ser representada no plano
(2 dimensões).
02.Certa. Carbonos sp2 (dupla ligação) com ângulos
de ligação de 120°.
04.Errada. São as ligações p que entram em ressonância.
08.Certa. Carbonos com dupla ligação.
16.Certa. As ligações p ocorrem em eixos paralelos.
Os orbitais são chamados p.
32.Errada. As linhas que unem os carbonos são do
tipo sigma.
12)A
Todos os carbonos fazem uma dupla ligação (sp2).
13)38
09)C
01.Errada. Somente carbonos sp e sp2.
02.Certa. Os carbonos sp2.
04.Certa. O carbono sp.
08.Errada. Apenas 2 ligações π.
16.Errada. São dois carbonos sp2 e um carbono sp.
32.Certa. O carbono do centro da molécula.
Hibridação sp: carbono de tripla ou duas duplas ligações.
10)53
01.Certa.
02.Errada.
04.Certa. A ligação do meio é sigma e as outras duas
são pi.
08.Errada. São duas ligações pi.
16.Certa. São carbonos que fazem tripla ligação.
32.Certa. Os ângulos de ligação são de 180°, geometria linear.
14)C
15)B
64.Errada.
2
Química A
GABARITO
16)C
23)E
Os 2 elétrons do P que não participam da ligação fazem
com que a molécula adquira ângulos, assumindo forma
de pirâmide.
I. Certa. Carbonos sp3 adquirem ângulo de ligação de
aproximadamente 109°.
II. Certa. A ligação simples é "mais comprida" que a
ligação dupla ou tripla, pois ocorre no mesmo eixo.
III.Certa. Por ter carbono com hibridação sp3, a molécula é espacial.
24)D
17)E
25)C
18)C
O = C = O
Linear
19)
26)E
20)
22)C
fazem uma dupla
ligação, cada uma tendo hibridação sp2.
Os elétrons do N estão deslocalizados, passando para
um ou outro oxigênio, nos híbridos de ressonância.
21)E
Os carbonos da carbonila
O nitrogênio faz 3 ligações simples (sp3).
27)
1 – Ligação covalente simples.
2 – Ligação covalente tripla.
Hibridação do H : s
C : sp (tripla)
N : sp (tripla)
28)B
→ C
C ←
- Be Momento dipolar: ← → se anulam = 0
29)B
a)Certa. I – I Apolar Ligações intermoleculares:
Van der Waals (fraca).
b)Errada.
Química A
3
GABARITO
c)Certa. Ligações covalentes entre hidrogênio e oxigênio (intramoleculares) e ligações (pontes) de hidrogênio entre moléculas de água (intermoleculares).
d)Certa. Cs – C → Cs+C–
Metal Ametal Ligação iônica
30)D
37)D
Para ter pontes de hidrogênio, é preciso do hidrogênio
ligado a algum elemento bastante eletronegativo: flúor,
oxigênio ou nitrogênio. No item I, o oxigênio liga-se a
2 carbonos e não a hidrogênio.
38)C
a)Linear e Polar
b)Angular e Polar
c)Linear e Apolar
d)Certa.
Metal alcalino + halogênio
(metal) (ametal)
Ligação iônica
39)B
31)B
Carbono como elemento central, sem elétrons não
ligantes, com os ligantes iguais, molécula apolar.
O bastão eletrizado atrai as moléculas de água pois
estas são polares. O polo negativo da água é atraído
pelo bastão eletrizado (polarizado positivamente).
40)D
32)A
Em moléculas apolares, a
interação é do tipo dipolo
induzido (instantâneo).
33)05
41)a)Quanto menor o ponto de ebulição, mais volátil é a
substância. Logo, a mais volátil é H2S.
b)A geometria angular e a alta polaridade das ligações
(devido à grande diferença de eletronegatividade
entre oxigênio e hidrogênio) fazem com que a molécula de H2O possa realizar pontes de hidrogênio,
que são interações fortes. Dessa forma, as moléculas
de H2O ficam mais "unidas" entre si, dificultando a
evaporação (ebulição).
01. Certa. CaC2 – iônica – sólido
Metal Ametal
02. Errada. NaC2 – iônica – sólido
Metal Ametal
04.Certa. C – C – covalente – gás
Ametal Ametal
08.Errada. Na2O – iônica – sólido
Metal Ametal
16.Errada. O = O – covalente – gás
Ametal Ametal
34)D
Entre moléculas apolares, a interação é do tipo dipolo
induzido ou instantâneo, ou ainda, forças de London.
35)D
As interações são intermoleculares (entre moléculas
dos pés e das paredes), genericamente definidas como
forças de Van der Waals.
36)C
O oxigênio pode fazer duas pontes de cada hidrogênio, e mais
uma, totalizando 4 por molécula.
42)Fase mais densa: tetracloreto de carbono (CC4) – mais
no fundo do recipiente.
Fase menos densa: tolueno (C7H8) – mais na fase superior do recipiente.
43)I2 é apolar, logo irá se dissolver em A (CC4 – apolar) e
C (C7H8 – apolar).
A fase B (água) é polar e não dissolve I2.
44)3 fases. permanecem as fases A, B e C, porém com
iodo dissolvido em A e C (cada uma como mistura
homogênea)
45)5 elementos.
C7H8, H2O, CC4, I2
Elementos: C, H, O, C, I.
4
Química A
GABARITO
46)Gasolina e graxa são hidrocarbonetos (apolares). Como
"semelhante dissolve semelhante", a gasolina interage
com a graxa podendo dissolvê-la.
b) Benzina e gordura são apolares.
↓
↓
Hidrocarboneto
Ácido carboxílico de cadeia carbônica longa.
O nome dipolo induzido tem o mesmo significado de
forças de London, sendo, porém, mais atual. Van der
Waals não diferenciava dipolo permanente de dipolo
induzido. Sendo assim, a ligação que ocorre por forças
de London pode também ser considerada interação por
Van der Waals. O contrário nem sempre é verdadeiro.
Água é polar e por isso não remove a gordura.
48)C
47)Para moléculas apolares, forças de dipolo induzido (instantâneo), forças de dispersão de London ou atração
de Van der Waals.
O = C = O Apolar
Moléculas estão unidas por dipolo induzido (Van der
Waals).
49)A
2)
(C4H10 – apolar – MM = 58)
dipolo induzido.
1)
(C4H10 – apolar – MM = 58)
dipolo induzido.
3)
(C4H8O – polar – MM = 72)
dipolo permanente.
4)
(C4H10O – polar – MM = 74)
pode fazer ligação de hidrogênio.
5)
(C4H8O2 – polar – MM = 88)
pode fazer ligação de hidrogênio.
50)a)Iônicos: NaC e NaCO
Metal Metal
Moleculares: HC e C2 (covalentes)
b)Nos compostos iônicos, ligações iônicas. No HC,
dipolo permanente (polar) e no C2 dipolo induzido
(apolar).
c)Iônicos: temperaturas de fusão e ebulição altas,
estado físico sólido;
Covalentes: temperaturas de fusão e ebulição baixas,
estado físico líquido ou gasoso, em geral.
52)B
51)D
53)C
Quanto mais forte a ligação intermolecular → maior ponto de
ebulição.
Quanto maior a massa molecular
→ maior o ponto de ebulição.
* Entre 1 e 2 (mesma MM e
mesma forma de interação), terá
maior PE a molécula 1, pois, por
ter a cadeia mais alongada, tem
mais pontos de interação com
moléculas adjacentes (vizinhas).
A molécula 2 tem menos pontos
de contato, sendo menos atraída
por outras moléculas.
A pequena diferença de eletronegatividade (0,8) dá
ideia de que X e Y são ametais. Pela fórmula XY2, ficam
como opções:
Como o enunciado informa que é apolar, segue:
Y=X=Y
Ligações polares
Pode formar pontes de H, solubilizando
substâncias polares.
Química A
5
GABARITO
54)07
57)A
Ordem decrescente: da maior para a menor polaridade.
H20: polar, H2S: polar; CO2: apolar
01.Certa.
H20 é mais polar que H2S, pois o oxigênio é mais eletronegativo que o enxofre. Assim, o oxigênio atrai mais o elétron
na molécula H20, tornando-a mais polar.
02.Certa.
58)D
04.Certa.
08.Errada. BF3 é apolar, pois µℜ = 0.
16.Errada. NH3 é polar.
Ponte de hidrogênio torna a substância menos volátil
(evapora ou ferve mais dificilmente). No gráfico, percebe-se
que H20 e HF têm maiores temperaturas de ebulição. Isso
ocorre, porque podem fazer pontes de hidrogênio, sendo
portanto menos voláteis.
59)08
55)27
CO2 é apolar. Suas moléculas são apolares e interagem
por forças de Van der Waals.
60)31
01.Certa.
56)B
Ligações covalentes (ametal-ametal) polares (átomos
diferentes).
A molécula é apolar, pois o somatório das forças é
igual a zero (anulação de vetores).
6
02.Certa. H20 e HF têm, entre moléculas semelhantes,
ligações de hidrogênio (maior ponto de ebulição).
04.Certa. Ligações de hidrogênio.
08.Certa. Todas (com exceção da água) possuem ponto
de ebulição menor que 25 °C.
16.Certa. A –37,5 °C H2Se passa de líquido para gasoso.
A –50 °C estará no estado líquido.
Química A












