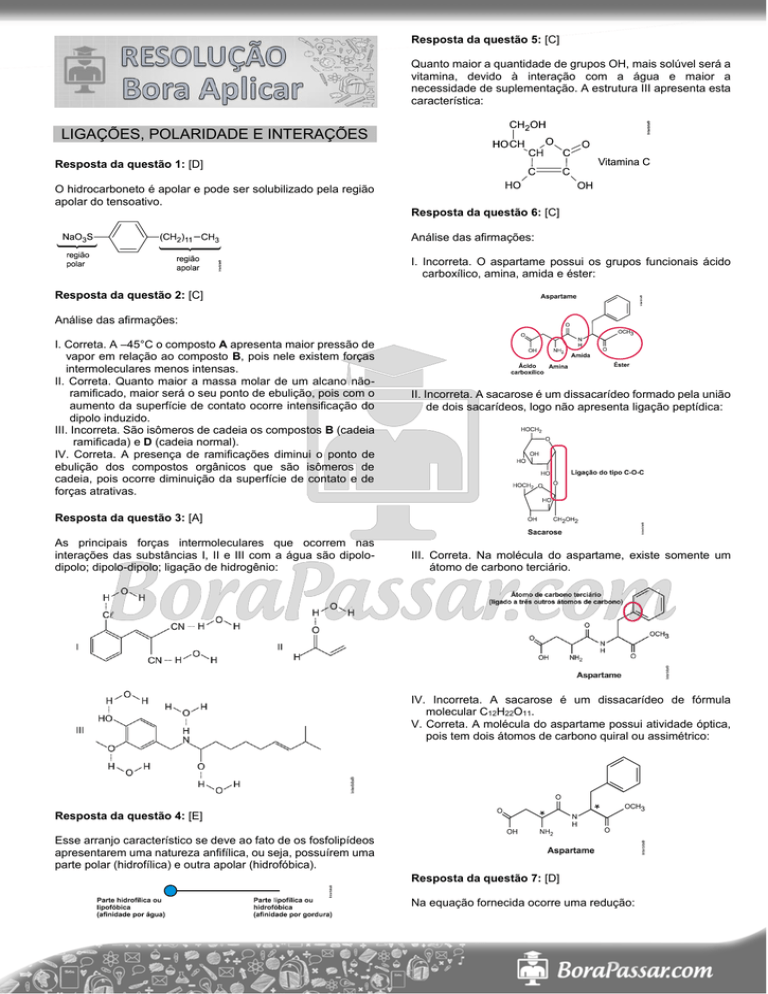
Resposta da questão 5: [C]
Quanto maior a quantidade de grupos OH, mais solúvel será a
vitamina, devido à interação com a água e maior a
necessidade de suplementação. A estrutura III apresenta esta
característica:
LIGAÇÕES, POLARIDADE E INTERAÇÕES
Resposta da questão 1: [D]
O hidrocarboneto é apolar e pode ser solubilizado pela região
apolar do tensoativo.
Resposta da questão 6: [C]
Análise das afirmações:
I. Incorreta. O aspartame possui os grupos funcionais ácido
carboxílico, amina, amida e éster:
Resposta da questão 2: [C]
Análise das afirmações:
I. Correta. A –45°C o composto A apresenta maior pressão de
vapor em relação ao composto B, pois nele existem forças
intermoleculares menos intensas.
II. Correta. Quanto maior a massa molar de um alcano nãoramificado, maior será o seu ponto de ebulição, pois com o
aumento da superfície de contato ocorre intensificação do
dipolo induzido.
III. Incorreta. São isômeros de cadeia os compostos B (cadeia
ramificada) e D (cadeia normal).
IV. Correta. A presença de ramificações diminui o ponto de
ebulição dos compostos orgânicos que são isômeros de
cadeia, pois ocorre diminuição da superfície de contato e de
forças atrativas.
II. Incorreta. A sacarose é um dissacarídeo formado pela união
de dois sacarídeos, logo não apresenta ligação peptídica:
Resposta da questão 3: [A]
As principais forças intermoleculares que ocorrem nas
interações das substâncias I, II e III com a água são dipolodipolo; dipolo-dipolo; ligação de hidrogênio:
III. Correta. Na molécula do aspartame, existe somente um
átomo de carbono terciário.
IV. Incorreta. A sacarose é um dissacarídeo de fórmula
molecular C12H22O11.
V. Correta. A molécula do aspartame possui atividade óptica,
pois tem dois átomos de carbono quiral ou assimétrico:
Resposta da questão 4: [E]
Esse arranjo característico se deve ao fato de os fosfolipídeos
apresentarem uma natureza anfifílica, ou seja, possuírem uma
parte polar (hidrofílica) e outra apolar (hidrofóbica).
Resposta da questão 7: [D]
Na equação fornecida ocorre uma redução:
Resposta da questão 14: [C]
Resposta da questão 8: [C]
Teremos:
Forças intermoleculares do tipo ligações de hidrogênio podem
ocorrer na interação das substâncias água e etanol, pois
apresentam o grupo OH.
Resposta da questão 15: [D]
Resposta da questão 9: [C]
O átomo de nitrogênio presente na molécula do gás amônia
apresenta um par de elétrons livres:
Resposta da questão 10: [E]
A ligação de hidrogênio é uma atração intermolecular mais
forte do que a média. Nela os átomos de hidrogênio formam
ligações indiretas, “ligações em pontes”, entre átomos muito
eletronegativos de moléculas vizinhas.
Este tipo de ligação ocorre em moléculas nas quais o átomo
de hidrogênio está ligado a átomos que possuem alta
eletronegatividade como o nitrogênio, o oxigênio e o flúor. Por
exemplo: NH3, H2O e HF.
A ligação de hidrogênio é uma força de atração mais fraca do
que a ligação covalente ou iônica. Mas, é mais forte do que as
forças de London e a atração dipolo-dipolo.
Resposta da questão 11: [B]
A característica presente nas substâncias tóxicas e
alergênicas, que inviabiliza sua solubilização no óleo de
mamona, é a hidrofilia, ou seja, a capacidade de atrair
compostos polares (hidro = água; filia = afinidade). Como o
óleo de mamona é predominantemente apolar, os compostos
alergênicos polares não se misturam ao óleo.
Resposta da questão 12: [E]
Tiamina, ácido pantotênico, ácido fólico, ácido ascórbico e
biotina podem fazer mais ligações de hidrogênio com a água
do que o retinol, pois apresentam maior quantidade de grupos
OH e NH.
Resposta da questão 13: [C]
Teremos:












